
焓变与反应热(高三一轮复习)
设计说明:
本节基本内容位于选修四第一章第一节《化学反应与能量变化》,在必修二第二章第一节《化学能与热能》中也有体现。本节课在学生已有化学能与热能相互转变知识的基础上,进一步体现知识点在习题中的应用。教学中通过“知识梳理”进行知识点的复习与重现,通过“深度思考”加强对基础知识的理解与体会,通过“练一练”进行知识点的初步应用,通过“走进高考”实现理论与解题的突破和飞跃,通过“作业”进一步熟悉和熟练,从而达到从本质上解决问题的目的,提高复习效率,收到较好的复习效果。
教学设计:
【教学目标】
1、知识与技能
(1)了解化学反应中能量转化的原因,能说出常见的能量转化形式。
(2)了解化学能与热能的相互转化,了解吸热反应、放热反应、反应热等概念。
2、过程与方法
学会有关反应热的图形分析及反应热的计算方法。
3、情感态度价值观
培养学生辩证分析化学反应与能量的关系,培养实事求是的科学态度。
【教学重点】
反应热的图形分析及反应热的计算方法。
教学过程教师活动学生活动设计意图一、高考题引入
肼(H
2NNH
2
)是一种高能燃料,有关
化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O==O为500、N—N为154,则断裂1 mol N—H 键所需的能量(kJ)是( )
A.194 B.391 C.516 D.658 【引入】同学
们分析此题考
到的知识点有
哪些?
【思考】
【回答】
键能与反应热的关
系、
ΔH的相关计算
从高考题
引入,分
析基础知
识在考题
中的实际
应用,使
后续的复
习更有针
对性
二、知识梳理
1.化学反应中的能量变化
(1)化学反应中的两大变化:变化和变化。
(2)化学反应中的两大守恒:
守恒和守恒。
(3)化学反应中的能量转化形式:、光能、电能等。通常主要表现为的变化。【布置任务】
快速完成基础
填空
【思考、回答】
(1)物质、能量
(2)质量、能量
(3)热能、热量
熟记基
础,为后
续解题做
好铺垫
2.焓变(反应热)
(1)定义:在条件下进行的反应的。
(2)符号:。
(3)单位:。【布置任务】
快速完成基础
填空
【思考、回答】
(1)恒压、热效应
(2)ΔH
(3)kJ/mol
熟记基
础,为后
续解题做
好铺垫
3.吸热反应和放热反应
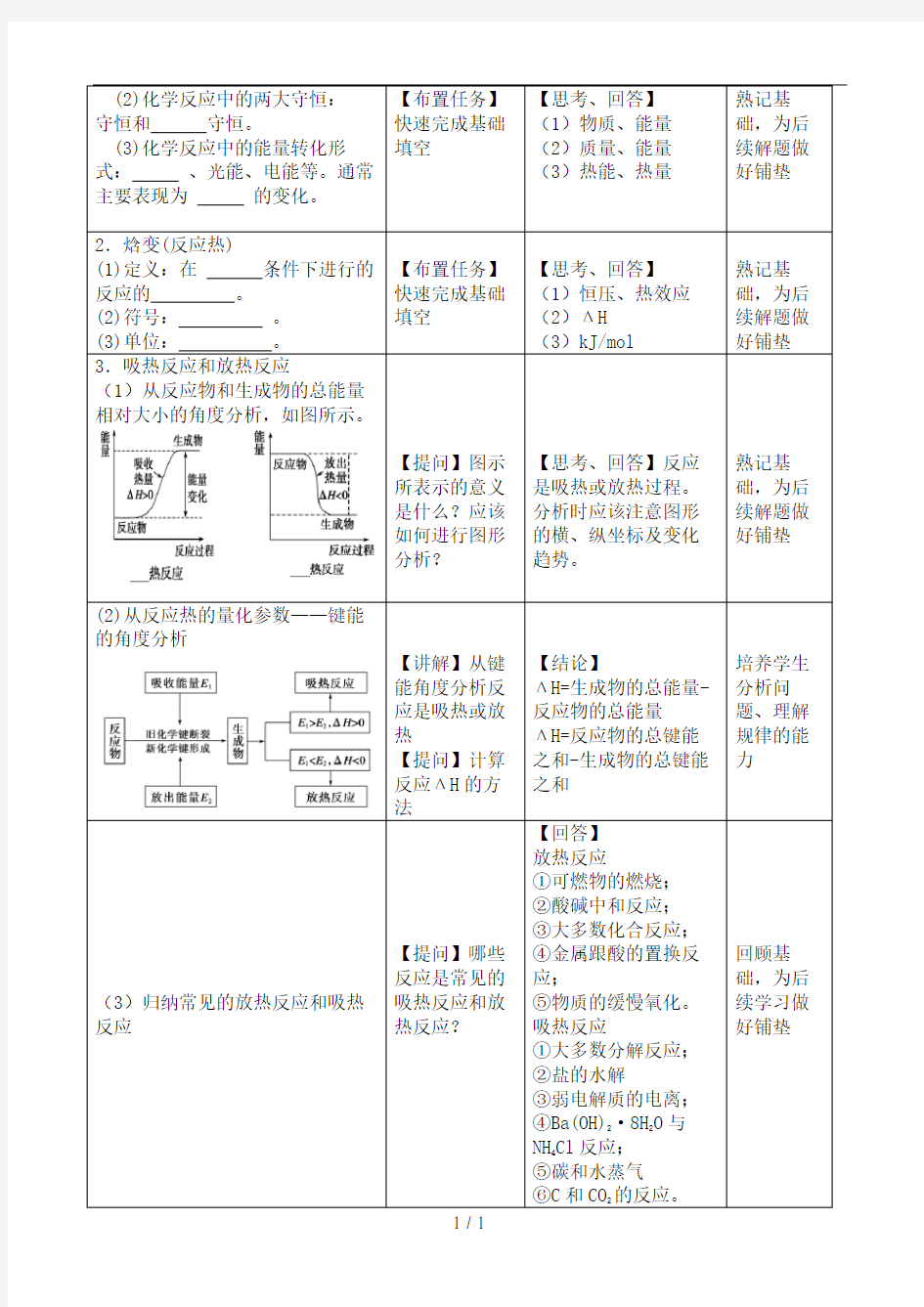
(1)从反应物和生成物的总能量相对大小的角度分析,如图所示。
【提问】图示所表示的意义是什么?应该如何进行图形分析?【思考、回答】反应
是吸热或放热过程。
分析时应该注意图形
的横、纵坐标及变化
趋势。
熟记基
础,为后
续解题做
好铺垫
(2)从反应热的量化参数——键能的角度分析
【讲解】从键能角度分析反应是吸热或放热
【提问】计算反应ΔH的方法【结论】
ΔH=生成物的总能量-
反应物的总能量
ΔH=反应物的总键能
之和-生成物的总键能
之和
培养学生
分析问
题、理解
规律的能
力
(3)归纳常见的放热反应和吸热反应【提问】哪些
反应是常见的
吸热反应和放
热反应?
【回答】
放热反应
①可燃物的燃烧;
②酸碱中和反应;
③大多数化合反应;
④金属跟酸的置换反
应;
⑤物质的缓慢氧化。
吸热反应
①大多数分解反应;
②盐的水解
③弱电解质的电离;
④Ba(OH)
2
·8H
2
O与
NH
4
Cl反应;
⑤碳和水蒸气
⑥C和CO
2
的反应。
回顾基
础,为后
续学习做
好铺垫
三、深度思考
判断正误,正确的划“√”,错误的划“×”
(1)放热反应不需要加热就能反应,吸热反应不加热就不能反应
( )
(2)物质发生化学变化都伴有能量的变化( )
(3)伴有能量变化的物质变化都是化学变化( )
(4)吸热反应在任何条件都不能发生( )
(5)水蒸气变为液态水时放出的能量就是该变化的反应热( ) 【提出要求】
判断正误并说
明原因
【思考、回答】
(1)×、加热是引发
反应的外界条件,反
应的吸、放热由反应
物、生成物的总能量
或总键能决定。
(2)√
(3)×、物质三态的
变化伴随了能量的变
化,但属于物理变
化。
(4)×、ΔH>0,Δ
S>0时,高温下反应能
发生
(5)×、该变化是物
理变化。
基础知识
考查,进
一步熟
悉、熟
练。
四、练一练
1.某反应过程中体系的能量变化如图所示,下列说法错误的是( )
A.反应过程可表示为
B.E
1
为反应物的平均能量与过渡态的能量差,称为正反应的活化能
C.正反应的热效应为ΔH=E
1
-
E
2
<0,所以正反应为放热反应
D.此图中逆反应的热效应ΔH=E
1-E
2
<0,所以逆反应为放热反应2.通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强
弱,也可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下面列举了一些化学键的键能【布置任务】
分析问题并解
决
【思考、讨论、回
答】
D、
该图表示的正反应放
热,逆反应吸热。
ΔH=4×360+2×436-2
×176-4×431
基础知识
的简单应
用,为后
续解决高
考原题做
好铺垫
数据,供计算使用。Si—O:460kJ/mol,Si—Cl:
360kJ/mol,H—H:
436kJ/mol,H—Cl:
431kJ/mol,Si—Si:
176kJ/mol,Si—C:347kJ/mol。工业上的高纯硅可通过下列反应制
取:SiCl
4(g)+2H
2
(g)===Si(s)+
4HCl(g),该反应的反应热(ΔH)为__________。
3.断开1 mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A—B键的键能。下表列出了一些化学键的键能E,回答问题:
(1)如图表示某反应的能量变化关系,则此反应为____(填“吸热”或“放热”)反应,其中ΔH=
________
(用含有a、b的关系式表示)。(2)若图示中表示反应
H 2(g)+ O
2
(g)==H
2
O(g)
ΔH=-241.8 kJ·mol-1,则b =________kJ·mol-1,x=
______。=+236kJ/mol
(1)放热、
反应物总能量大于生成物总能量
ΔH=-(b-a)
kJ/mol放热反应,ΔH 为负值
(2)926、
b为逆反应的活化能。496.4、
键能计算反应热
五、走进高考
1、(2012·大纲全国卷,9)反应 A +B―→C(ΔH<0)分两步进行:①A+B―→X (ΔH >0),②X―→C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是( )
【布置任务】分析、思考【思考、讨论、回
答】
D、
根据两步反应的ΔH的
大小
用高考原
题,检验
学生在解
决实际问
题时应用
知识的能
力,举一
反三。
2、(2012·重庆理综,12)肼
(H
2NNH
2
)是一种高能燃料,有关化
学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O==O为500、
N—N为154,则断裂1 mol N—H 键所需的能量(kJ)是( ) A.194 B.391
C.516 D.658 【布置任务】
分析、思考
【思考、讨论、回
答】
B、
ΔH
3
=4(N—H)+(N—
N)+(O==O)
=+2218kJ/mol
用高考原
题,检验
学生在解
决实际问
题时应用
知识的能
力,举一
反三。
六、作业
乌鲁木齐市“高效课堂教学设计与展示”
课题:焓变与反应热(高三一轮复习)学校:乌鲁木齐市实验学校
姓名:吴未希