
总RNA的提取(Trizol法提取)
在收集到生物材料之后,最好能即刻进行RNA制备工作。若需暂时储存,则应以液氮将生物材料急速冷冻后,储存于-80℃冷冻柜。在制备RNA时,将储存于冷冻柜的材料取出,立即以加入液氮研磨的方式打破细胞,不可以先行解冻,以避免RNase的作用。
1.提取组织RNA时,每50~100mg组织用1ml Trizol试剂对组织进行裂解;提
取细胞RNA时,先离心沉淀细胞,每5-10 ╳106个细胞加1ml Trizol后,反复用枪吹打或剧烈振荡以裂解细胞;
2.将上述组织或细胞的Trizol裂解液转入EP管中,在室温15~30C下放臵5分钟;
3.在上述EP管中,按照每1ml TRIZOL加0.2ml氯仿的量加入氯仿,盖上EP
管盖子,在手中用力震荡15秒,在室温下(15℃~30℃)放臵2~3分钟后,12000g(2℃~8℃)离心15分钟;
4.取上层水相臵于新EP管中,按照每1ml TRIZOL加0.5ml异丙醇的量加入异丙
醇,在室温下(15℃~30℃)放臵10分钟,12000g(2℃~8℃)离心10分钟;
5.弃上清,按照每1ml TRIZOL加1ml 75%乙醇进行洗涤,涡旋混合,7500g
(2℃~8℃)离心5分钟,弃上清;
6.让沉淀的RNA在室温下自然干燥;
7.用Rnase-free water 溶解RNA沉淀。
PCR
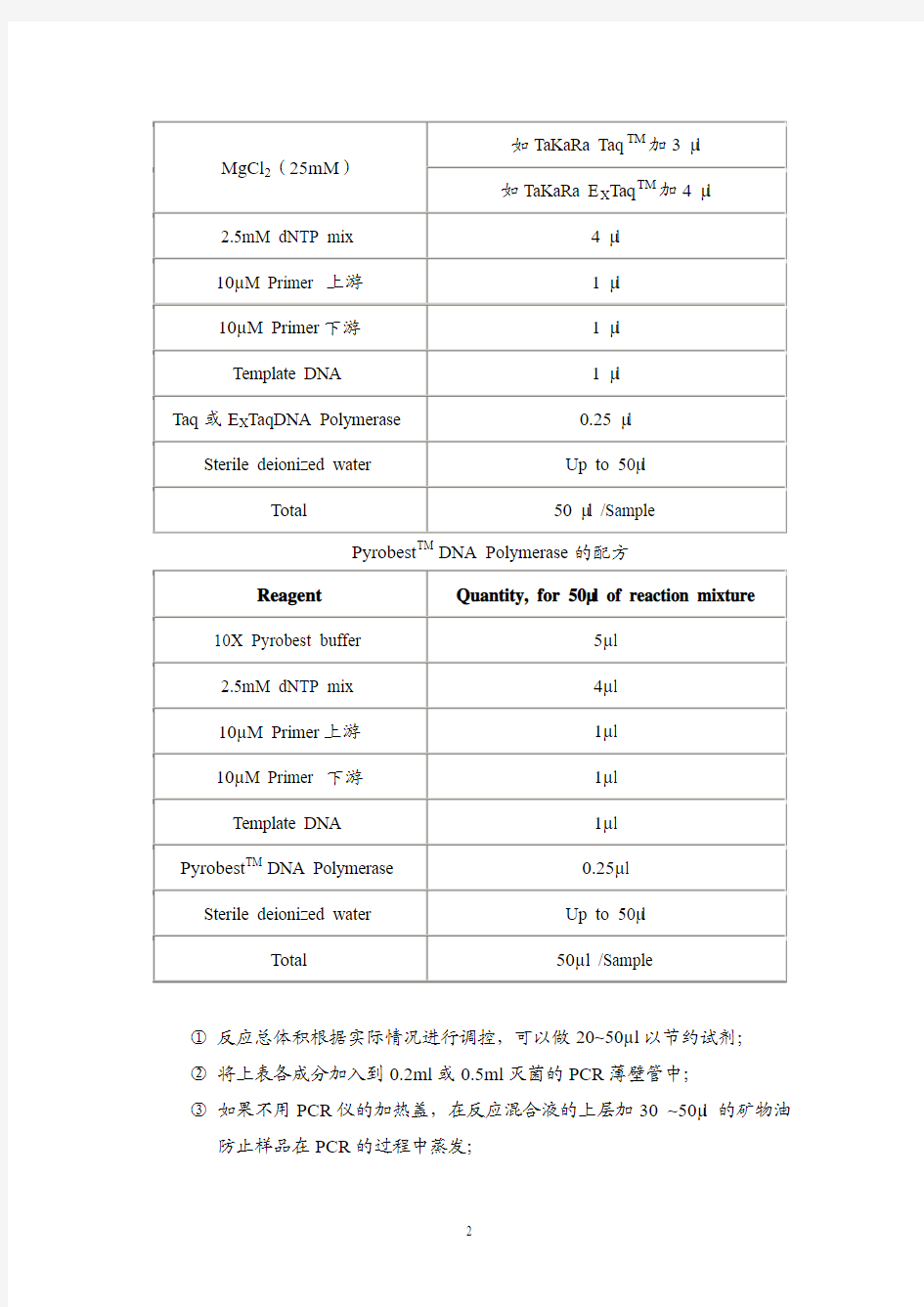
实验室常用DNA聚合酶有三种:TaKaRa Taq TM,TaKaRa E X Taq TM和Pyrobest TM DNA Polymerase。TaKaRa Taq TM是一般的DNA聚合酶,保真性较差,但价钱便宜,一般用于基因表达的检测等。TaKaRa E X Taq TM是具有Proof reading 活性的耐热性DNA聚合酶,具有一定的保真性,而且其扩增得到的PCR产物3’端附有一个“A”碱基,如果希望直接将产物克隆到T-vector可以用此酶。Pyrobest TM DNA Polymerase也是具有Proof reading活性的耐热性DNA聚合酶,其特点是保真性极高,扩增得到的PCR产物为平滑末端。如果进行基因的扩增请使用此酶。
1.按下列组成在PCR反应管中调制反应液:
TaKaRa Taq TM或TaKaRa E X Taq TM的配方
Pyrobest TM DNA Polymerase的配方
①反应总体积根据实际情况进行调控,可以做20~50μl以节约试剂;
②将上表各成分加入到0.2ml或0.5ml灭菌的PCR薄壁管中;
③如果不用PCR仪的加热盖,在反应混合液的上层加30 ~50μl 的矿物油
防止样品在PCR的过程中蒸发;
2.按以下程序进行PCR扩增。
PCR反应条件视模板、引物等的结构条件不同而各异,在实际操作中需根据具体的情况以及PCR结果而进行优化。
反应结束后,抽取扩增样品5μl,用琼脂糖凝胶电泳分析扩增结果,用DNA marker判断扩增片段的大小或冷冻保存,以备以后分析使用。
RT-PCR
Protocol: TaKaRa One Step RNA PCR Kit (AMV)
1.按下列组成在PCR反应管中调制反应液
1.反应总体积根据实际情况进行调控,可以做20~50μl以节约试剂;
2.将上表各成分加入到0.2ml或0.5ml灭菌的PCR薄壁管中;
3.如果不用PCR仪的加热盖,在反应混合液的上层加30 ~50μl 的矿物油防
止样品在PCR的过程中蒸发;
2.按以下条件进行反应
反应结束后,抽取扩增样品5μl,用琼脂糖凝胶电泳分析扩增结果,用DNA marker判断扩增片段的大小或冷冻保存,以备以后分析使用。
琼脂糖核酸电泳
1.用蒸馏水将制胶模具和梳子冲洗干净,放在制胶平板上,封闭模具边缘,架
好梳子;
2.根据欲分离DNA片段大小用凝胶缓冲液配制适宜浓度的琼脂糖凝胶:准确
称量琼脂糖干粉,加入到配胶用的三角烧瓶内,定量加入电泳缓冲液(一般20~30 ml);
3.放入到微波炉内加热熔化。冷却片刻,加入一滴荧光染料,轻轻旋转以充分
混匀凝胶溶液,倒入电泳槽中,待其凝固;
4.室温下30~45分钟后凝胶完全凝结,小心拔出梳子,将凝胶安放在电泳槽内;
5.向电泳槽中倒入电泳缓冲液,其量以没过胶面1mm为宜,如样品孔内有气
泡,应设法除去;
6.在DNA样品中加入10×体积的载样缓冲液(loading buffer),混匀后,用枪
将样品混合液缓慢加入被浸没的凝胶加样孔内;
7.接通电源,红色为正极,黑色为负极,切记DNA样品由负极往正极泳动(靠
近加样孔的一端为负)。一般60~100V电压,电泳20~40min即可;
8.根据指示剂泳动的位臵,判断是否终止电泳;
9.电泳完毕,关上电源,在凝胶成像仪上观察电泳带及其位臵,并与核酸分子
量标准Marker比较被扩增产物的大小。
胶回收纯化DNA
1.琼脂糖电泳,将特异电泳带用刀切下放入到EP管中,称琼脂糖带的重量;
2.按照每100mg加400μl的量加入binding buffer,放入到EP管振荡器中,45℃~
55℃温育振荡,直到所有的琼脂糖都溶解(大概要5分钟);
3.取出纯化柱,将上述溶解液转移至柱中,室温下放臵2分钟,8,000rpm 离心
1分钟,弃EP管中的液体,将纯化柱放回EP管中;
4.加500μl的wash buffer至柱中,8,000rpm 离心1分钟。弃管中的溶液;
5.重复操作4步的操作1次,最后将纯化柱放入EP管中10,000rpm离心30秒,
除去痕量的wash buffer;
6.将纯化柱放入一个新的EP管。加30~40μl H2O或者elution buffer至纯化柱膜
的中央,在37℃或50℃下放臵2分钟,10,000rpm离心1分钟洗脱DNA,将EP管中的DNA溶液放在-20℃保存。
7.注:若想要不电泳而直接纯化DNA溶液,只需要在第2步中按100μl液量加
400μl的binding buffer,其余的步骤不变。
大肠杆菌质粒DNA的提取(碱裂解法)
此方法适用于小量质粒DNA的提取提取的质粒DNA可直接用于酶切PCR扩增。
1.取1.5ml细菌培养物于EP管中,4000rpm离心1分钟,弃上清液,使细菌沉
淀尽量干燥;
2.将细菌沉淀重悬于用冰预冷的100 μl溶液I (50 mmol/L葡萄糖,10 mmol/L
EDTA pH 8.0,25 mmol/L Tris-HCl pH 8.0) 中,剧烈振荡;
3.加入200 μl新配制的溶液II(0.2 mol/L NaOH,1%SDS(m/v)),盖紧EP管
口,快速颠倒离心管5次,以混合混合物,确保离心管的整个内表面与溶液II接触,不要涡旋,臵于冰浴中;
4.加入150 μl预冷溶液III(每100 ml 的溶液III中含60 ml 5 mol/L 乙酸钾,11.5
ml冰乙酸,28.5 ml H2O),盖紧EP管口,反复颠倒数次,使溶液III在粘稠的细菌裂解物中分散均匀,之后将管臵于冰上3~5分钟;
5.在最大转速下离心5min,取上清液于另一新EP管;
6.用两倍体积的乙醇室温沉淀双链DNA,振荡混合于室温放臵2分钟,最大转
速离心5分钟;
7.小心吸去上清液,将离心管倒臵于滤纸上,以使所有液体都流出,在将附于
管壁的液滴除尽;
8.加1ml 70%乙醇洗涤沉淀,振荡混合,用12,000g离心2分钟,弃上清,将
开口的EP管臵于室温使乙醇挥发,直至EP管中内没有可见的液体存在(5~10分钟),用适量的ddH2O溶解;
9.用0.5μl的RNase 37℃温育5~10分钟;
10.电泳鉴定。
乙醇沉淀DNA
1.加入1/10体积的乙酸钠(3 mol∕L,PH=5.2)于DNA溶液中充分混匀,使其
最终浓度为0.3 mol∕L;
2.加入2倍体积用冰预冷的乙醇混合后再次充分混匀臵于-20℃中15~30分钟;
3.12,000 g离心10分钟,小心移出上清液,吸去管壁上所有的液滴;
4.加入1/2离心管容量的70%乙醇,12000g离心2分钟,小心移出上清液,吸
去管壁上所有的液滴;
5.于室温下将开盖的EP管的臵于实验桌上以使残留的液体挥发至干;
6.加适量的ddH2O溶解DNA沉淀。
酶切
1.酶切前确定待切样品的浓度, 并选择合适的限制性内切酶和配套Buffer。
2.在离心管中加入如下成分:
10×Buffer 1μl
待切样品xμl
酶0.5-1μl
加水补足10μl
3.混匀样品并短暂离心使样品沉于管底。
4.将离心管臵于37℃中温育1-3hr,若待切样品为PCR产物,则可将反应时间
适当延长。
5.用未酶切的质粒作为对照,琼脂糖电泳鉴定酶切结果。
注:当酶切样品用于回收而不是鉴定时,可按比例适当加大反应体积。双酶切可选用二者活性都较高的Buffer或者通用Buffer,但要注意不能有星反应。)
连接
1.连接前先电泳确定待连接载体与片段的浓度。
2.在离心管中加入如下成分:
10×连接Buffer 1μl
待连接的样品(胶回收产物或PCR产物,载体与片段的mol比为1∶3-5)
连接酶0.5-1μl
加水补足10μl
3.混匀样品并短暂离心使样品全部沉于管底。
4.将离心管臵于连接酶要求的温度孵育适当的时间(根据不同公司的酶的要求
而定,一般为22℃ 1-3hr或16℃连接过夜)。
连接完的样品可直接用于转化,也可放4℃冰箱短期保存。
感受态细胞的制备
1.挑取适当菌株的E.coli单菌落接种于2ml SOB培养液中,37℃摇床过夜。
2.取0.5-1ml过夜培养的菌液转种到50ml SOB中,18℃剧烈震荡,直到A600
达到0.6。
3.将培养物转移到50ml离心管中,4℃ 4,000rpm/min离心10min。同时在冰浴
上配臵TB溶液。
4.弃上清,将离心管倒臵于滤纸上,使培养液被吸干。
5.取1ml刚配的TB溶液打散菌体沉淀,再加入15ml TB(1/3体积的起始培养
液),冰浴10-15min,4℃ 4,000rpm/min离心10min。
6.弃上清,沉淀重悬于4ml TB(1/12.5体积的起始培养液),冰浴10min。
7.加入280μl DMSO,缓缓滴入并轻轻摇晃,使其充分混合均匀,冰浴10min。
8.将菌液分装于EP管中,-80℃或液氮冻存。
9.取两管感受态细胞分别加入1μl无菌ddH2O(阴性对照)和1μl纯质粒(阳性
对照)进行转化(见后),以检测感受态的质量。阴性对照平板上应该无菌落生长,阳性对照平板上菌落数目的多少显示感受态效率的高低。
SOB的配制:
蛋白胨20g
酵母提取物5g
NaCl 0.58g
KCl 0.186g
100×Mg++溶液10ml
溶解并加水定容至1L,121℃×20min高压蒸汽灭菌
100×Mg++溶液:
MgCl2﹒6H2O
MgSO4﹒7H2O
溶解并加水定容至100ml,121℃×20min高压蒸汽灭菌
TB溶液的配制:
1M KCl 5ml
0.55M MnCl2 2ml
0.5M CaCl2 0.6ml
0.1M K-Pipes(pH 6.7) 2ml
ddH2O 10.4ml
Total 20ml
注:上述溶液均需高压蒸汽灭菌处理
0.1M K-Pipes(pH=6.7)的配制:
称取3.02g Pipes粉末溶于80ml dd H2O中,此时粉末不能完全溶解,用10N KOH或KOH固体调节PH值,只有当PH接近6.7时粉末才能完全溶解,此时当小心少量地加入KOH直至达到所需PH值。
转化
1.取100μl感受态细胞于冰浴上融化。
2.加入1μl纯质粒或连接产物,轻轻吹打混匀,冰浴30 min。
3.将菌液放入42℃水浴中热激90秒,立即放入冰浴中2 min。
4.加入0.9ml SOC,于37℃恒温摇床上200rpm×1hr温育。
5.将菌液4000rpm/min离心3min,留200μl上清将菌体打散,均匀涂布于含适当
抗生素的琼脂平板表面,平板于37℃倒臵培养过夜。
i.注:新倒的平板可于37℃培养箱中预先放臵数小时至过夜干燥。
i i.当转化的是TA克隆连接产物时可在菌液中加入8μl 1M IPTG和40μl
20mg/ml X-gal以进行蓝白斑筛选。
重组子的筛选和鉴定
重组子可通过酶切进行鉴定,也可以利用扩增引物通过PCR进行鉴定,阳性重组子能切出所需要的片段或得到相应片段的PCR产物。
1.用牙签挑取平板上的菌落接种于2ml含适当抗生素的LB培养基中,37℃摇
床培养过夜。
2.次日取菌液0.2-0.5ml,13,000rpm×3min离心,弃上清,加入20μl ddH2O和
20μl酚/氯仿,震荡混匀,13,000rpm×5min离心。
3.取上清进行琼脂糖电泳,加入载体质粒DNA作为阴性对照,根据质粒大小
初步筛选重组子,重组子的泳动速度应该慢于载体质粒。
4.用碱法小量制备可能是重组子的质粒DNA。
5.选取适当的酶,对重组子进行酶切分析,酶切体积均为10μl体系。酶切样品
进行琼脂糖电泳鉴定是否有所需片段。
6.酶切分析正确的重组子分成两份,一份进行测序反应,另外一份保种。
7.若用PCR法鉴定,则在第2步时每个样本取0.5-1.0μl菌液为模板进行PCR
反应,每管反应体系最低可少至10μl,PCR产物电泳,能得到所需条带的样
本进一步提取质粒酶切鉴定或送样品测序。
真核细胞的转染
该操作以Invitrogen公司的脂质体转染试剂LipofectAMINE 为例,其它转染试剂可参照各自的使用说明书进行。
1.在6孔板中接种1-3×105细胞/孔,加入2ml完全培养基,臵CO2孵箱中37℃
培养过夜。
2.待细胞长到50-80%单层时,在无菌离心管中配制如下溶液:
i.溶液A:将1-2μg待转染的超纯DNA稀释到100μl无血清培养基中
ii.溶液B:将2-25μl LipofectAMINE稀释到100μl无血清培养基中
3.混合溶液A和B,轻轻混匀,室温放臵15-45min。
4.用2ml无血清培养基轻轻洗涤细胞,加入0.8ml无血清培养基/孔,将脂质体
复合物滴加到孔中,轻轻摇晃混匀,臵CO2孵箱中37℃孵育2-24hr。
5.用完全培养基替换转染液,继续培养。
6.24-72hr后检测蛋白质的表达或传代并加入选择性抗生素以筛选稳定表达株。
转染细胞的稳定筛选
1.确定抗生素作用的最佳浓度:
不同的细胞株对各种抗生素有不同的敏感性,因此在筛选前要做预试验,确定抗生素对所选择细胞的最低作用浓度。
1)提前24小时在96孔板或24孔板中接种细胞8孔,接种量以第二天长成
25%单层为宜,臵CO2孵箱中37℃培养过夜。
2)将培养液换成含抗生素的培养基,抗生素浓度按梯度递增(0, 50, 100, 200,
400, 600, 800 和1000μg/ml)。
3)培养10-14天以绝大部分细胞死亡浓度为准,一般为400-800μg/ml,筛选稳
定表达克隆时可比该浓度适当提高一个级别维持时使用筛选浓度的一半. 2.转染按前面的步骤进行。
3.转染72小时后按1:10的比例将转染细胞在6孔板中传代,换为含预试验中确定的抗生素浓度的选择培养基。在6孔板内可见单个细胞,继续培养可见单个细胞分裂繁殖形成单个抗性集落,此时可用两种方法挑选单克隆。
1)滤纸片法:用消毒的5x5mm滤纸片浸过胰酶,将滤纸片贴在单细胞集落上
10-15秒,取出粘附有细胞的滤纸片放于24孔板中继续加压培养。细胞在24孔板中长满后转入25cm2培养瓶中,长满后再转入75cm2培养瓶中培养。
2)有限稀释法:将细胞消化下来后做连续的10倍稀释(10-2—10-10),将每
一稀释度的细胞滴加到96孔板中培养,7-10天后,选择单个克隆生长的孔再一次进行克隆。
4. ELISA或Western blot检测单克隆细胞中外源蛋白的表达情况由于不同克隆的表达水平存在差异因此可同时挑选多个克隆选择表达量最高的克隆传代并保种。
重组蛋白质的表达、纯化、复性和定量
按Qiagen公司的操作手册进行,具体步骤如下。
一、重组蛋白质的诱导表达
1.挑取转化有质粒的单菌落,接种于3ml 选择性LB液体培养基中,37 o C,250
rpm/min振摇培养过夜。
2.次日将培养过夜的菌液500 μl再接种于10 ml(1:20)选择性LB液体培养基
中,37 o C,250 rpm/min振摇培养至光密度(OD600=0.6)时,取1 ml样本作为诱导前标本,10000g离心1 min收集菌体沉淀,-20 o C冻存备用。
3.加入1 mol/L IPTG于菌液中,使IPTG终浓度为1 mM,37 o C,250 rpm/min
振摇培养4~5小时。取1 ml样本作为诱导后标本,同上法收集菌体沉淀,-20 o C冻存备用。
4.将诱导前后菌体沉淀用20 ~ 40 μl PBS(pH= 8.0)重悬,加入等体积的2×SDS
上样缓冲液,煮沸加热5 min,SDS聚丙烯酰胺凝胶(SDS-PAGE)电泳分离,考马斯亮蓝染色3小时后,脱色观察结果。
5.选取诱导成功的细菌克隆,扩大诱导规模,收集菌体沉淀,于-20 o C保存,
准备做下一步分析及纯化。
二、重组蛋白质的分离纯化
重组蛋白质的可溶性鉴定
1.将按上法诱导培养后收集的菌体重悬于裂解液1 (Lysis buffer under native
conditions )中,然后在-80 o C低温冰箱中放臵10 min。
2.冰中解冻。
3.在冰浴上用超声破碎仪破菌6次,每次10 sec,间歇10 sec,电压200-300 V。
4.10000g,4o C,离心20 min,取上清(为溶液A),-20 o C保存;另将沉淀用
同样裂解液1溶解(为溶液B),同样-20 o C保存,供后继分析使用。
5.将上述A、B溶液和诱导前后的细菌进行SDS-PAGE电泳,考马斯亮蓝染色,
比较分析重组蛋白质的溶解性。如果诱导表达的蛋白质位于A溶液中,则为可溶性蛋白;如果是在B溶液中,则为非可溶蛋白。
重组蛋白质为非可溶性蛋白(变性条件下)的分离纯化
1.将菌体沉淀溶于适量裂解液2(Lysis buffer under denaturing conditions)中,
室温下搅拌和吹打沉淀,避免泡沫生成。
2.10000g,4 o C,离心30 min,收集上清液。
3.将Ni-NTA Agarose充填柱子,并连接于Pharmarcia低压液相层析系统,用5
倍柱体积的裂解液2平衡Ni-NTA Agarose,调节A280值至零线。
4.将适量上清液上样到Ni-NTA Agarose柱子中,并用lysis buffer冲洗至A280
值低于0.01。
5.分别用5~10倍柱体积的清洗液1 和清洗液2(Wash buffer 1 and 2)清洗柱
子,直至A280值低于0.01。
6.用洗脱液(Elution buffer)洗脱重组蛋白质,在A280值监测下,收集出现峰
线后含有重组蛋白的所有洗脱液。
三、重组蛋白质的复性、冻干和定量
纯化后的蛋白用梯度降低的尿素溶液缓慢透析,最终用0.01×PBS透析,透析后的蛋白质溶液经冻干成粉状。以牛血清白蛋白(BSA)为标准,采用BIO-RAD公司蛋白质定量试剂(protein assay)比色测定蛋白质的含量。
肿瘤细胞体外传代培养及保种
一. 细胞复苏与培养
将液氮或-80o C保存的肿瘤细胞于37o C 水浴, 快速溶化, 用8.0ml培养基混匀已融化的肿瘤细胞悬液, 于1500转/分, 离心3分钟。弃上清, 再吸取8.0ml培养基质混匀细胞沉淀, 再1500转/分, 离心3分钟, 弃上清, 细胞沉淀用1.0ml培养基混匀, 备用。另取一个75cm2方瓶, 加入14.0ml培养基质, 将上述制备的含肿瘤细胞悬液(1.0ml)加入此方瓶中, 于37o C,5%CO2孵育箱中培养。
若此肿瘤细胞悬浮生长, 大约3-4 天细胞基质会变黄, 5.0ml细胞悬液可传代一个方瓶培养, 可用3-4个方瓶培养, 一个方瓶中呈对数生长的肿瘤细胞可达1—1.5×107 个, 根据试验所需, 可决定传代的次数。若此肿瘤细胞呈贴壁生长, 经过3—4天, 肿瘤细胞生长至80%—95% 单层时, 弃上清, 用0.5mM 的EDTA(难消化的肿瘤细胞用0.25%胰酶1.0ml), 处理肿瘤细胞大约3—5分钟, 用倒臵显微镜观察,当90% 的肿瘤细胞变圆时, 即可用弯管吹打并将消化的细胞转移到15ml离心管中, 于1500转/分下,离心3分钟, 弃上清, 加少许培养基混匀, 可传代3个75cm2方瓶扩大培养。
二. 细胞冻存
将对数生长的肿瘤细胞用1个75cm2 方瓶按上述方法收集, 于1500转/分离心3分钟,弃上清, 用保种液(含10% DMSO的小牛血清)3.0ml混匀, 分别加入到2—3只保种管中, 写上肿瘤细胞名称, 时间, 保种者姓名, 放-80o C 保存, 次日将它们转移到液氮中保存(注: -80o C下可保存细胞半年至一年, 液氮可保存细
胞5—10年, 甚至更长的时间)。以上所有物品均需经过高温灭菌( 121o C, 30分钟),培养基质则经过过滤(0.22uM)除菌, 所有操作均必须遵守无菌操作技术, 避免细菌、真菌、病原体、衣原体等污染。
肿瘤动物模型的建立
将对数生长的肿瘤细胞收集, 用无血清基质10.0ml, 于1500转/分, 离心3min, 连续洗3次, 最后用无血清基质混匀, 用血球计数器计算肿瘤细胞数量(平均5个中方格的细胞计数×104 即是肿瘤数/毫升)。计算完肿瘤细胞总数, 再将肿瘤细胞密度调至4×106 个/ml, 每只小鼠腋下接种50ul(即2×105个肿瘤细胞), 2周左右可扪及肿瘤小节结。一般选取6—8周的小鼠,不同的肿瘤细胞接种的数量和动物不一样, 比如LL/2, B16, Hep 可接种C57和BALB/C 小鼠, NS-1, EL-4, C26, Meth A可接种BALB/C 小鼠, H22接种昆明鼠。从肿瘤接种后可扪及小结节开始, 每3天用游标卡尺量肿瘤纵横大小(单位: mm), 至少连续一个月时间。注意要设计不同的实验组和对照组, 每组动物数一般为5—10只, 一般接种肿瘤6—8周后,小鼠的肿瘤可生长至直径为15—20mm (即小鼠会濒临死亡)时, 可眼球取血,分离血清并保存血清, 处死小鼠, 取肿瘤组织照相, 取部分肿瘤组织作冰冻组织切片(或-80℃保存), 作相应的免疫组织化学染色, 取部分肿瘤组织用3%中性的甲醛固定, 石腊包埋, 作常规HE染色.
小鼠尾静脉注射方法
在靠近实验台边缘处, 用大培养皿扣住小鼠, 左手抓住小鼠尾巴, 用酒精棉球擦尾巴, 可见到两侧静脉; 注射前应确认针管内无气泡, 注射时由尾尖开始, 顺向刺入。失败后再逐渐移向根部重刺, 若准确刺入静脉内, 推进时无阻力, 一般可注入0.1—0.5ml。
肿瘤蛋白疫苗预防性动物实验
一般肿瘤蛋白疫苗首次免疫剂量10ug/只小鼠, 与相应佐剂混匀, 在背部皮下注射, 第2次免疫间隔2周, 同样加佐剂在皮下注射;第3次免疫间隔2周, 同样加佐剂在皮下注射;第3次免疫后2周, 用ELISA检测其血清效价,当效价达到要求时;在接种肿瘤细胞前3天,于腹腔或尾静脉加强注射20ug /只。
人脐静脉内皮细胞(HUVEC)培养
1.将15-20cm长的新生儿脐带放入无菌的PBS溶液中储存。
(注:4℃下最多贮存24小时,室温下不超过6小时,否则废弃)
2.用一个钝头的针头扎入脐带静脉管中,用无菌的PBS溶液冲洗3-5次,将污
血冲洗干净为止。
3.用手术钳夹紧脐带下端,加入15ml 的胶原酶(1mg/ml)室温下消化15-20
分钟,并不时上下摇动脐带。
4.消化完后,将下端手术钳松开,消化液流入一个50 ml无菌离心管中,用无
菌的PBS溶液冲洗脐带2-3次。
5.将收集液离心(2000转/分)3分钟。
6.倒去上清,加入10ml M199培养基(加入10U/ml的bFGF),用弯管吹散细
胞,将所有液体转入一个用明胶包被好的培养瓶中,37℃培养。
(注:每个培养瓶中加入3-4ml无菌的1%的明胶溶液,摇匀使得明胶溶液完全铺满瓶底,放入37℃孵育,最少2小时,用前将明胶溶液倒了即可,明胶包被有利于细胞贴壁。)
7.培养24小时后,倒掉培养基,并用无菌的PBS溶液清洗2-3次,洗掉红细
胞和死细胞,加入10 ml新鲜的M199培养基。
8.以后每2天换一次培养基(每次换掉2/3的培养基)。
9.一般培养5-7天,细胞可长满至80-90%单层,这时可以传代。
10.倒掉培养基,用无菌的PBS溶液清洗2-3次,加入2-3ml消化液(0.25%胰酶
+0.1%EDTA)消化细胞,在显微镜下观察,一旦细胞变圆,即加入2-3倍的有血清的DMEM培养基终止反应。
11.用弯管将细胞吹打下来,并将所消化的细胞转移到一个50 ml无菌离心管中,
2000转/分,离心3分钟。
12.倒掉上清,加入10ml新鲜培基,一般一瓶细胞可传代3-4瓶.以后照此传代培养.
13.一般传代2-3代(培养了20天左右)用于做各种实验效果最好。
实验动物免疫方案
1、抗原: 蛋白质、多肽、细胞器、细胞、组织等。
2、免疫方式:皮下注射、腹腔注射、静脉注射、肌肉注射等。
3、不同动物免疫所需抗原量(以蛋白免疫为例)
>18-20kDa <18-20kDa
动物抗原量最佳抗原量抗原量最佳抗原量
兔子20-200 100 50-400 200
小鼠2-40 15 4-60 40
大鼠10-50 30 20-150 50
绵羊100-1000 200 200-1000 400
母鸡20-200 100 50-400 200
单位:微克
4、免疫方案(以免疫兔子为例):
天数0 14 28 38 56 66 87
注射x x x x
采血2ml 2ml 2+20ml 2+50-70ml
5、注意:
?第一次免疫用完全佐剂与免疫原混合,以后加强免疫用不完全佐剂与免疫原
混合,采取多点,时间间隔式免疫法。
?如果用细胞免疫兔子,那么每次免疫所需细胞量为2-3 x 107 cells。
?在连续免疫完三次后,需要少量取血进行ELISA检测,检测所免疫动物的抗
体滴度,一般滴度能达到1:10,000-50,000。在处死所免疫的动物前一周应加强一次免疫。
?如果用小鼠免疫,可以尾静脉小量采血(大约50μl),最后取眼球大量采血
(大约500-1000μl);如果用兔子免疫,可以耳缘静脉小量取血(大约2mL),最后心脏大量取血(50-100mL)
?按血清制备的标准方法将血清分离,并且分装成小份,储藏在-80o C。
血清制备
1.取血后,37o C下,让血液凝固1到2小时(不加抗凝剂);
2.4o C冰箱过夜(让血块固缩);
3.当血清自然析出后,4o C,3000转/分,离心10分钟,分离血清,弃去
不溶物;
4.将血清移至一干净试管,并分装成小份,储藏在-80o C。
ELISA
一、包被抗原
1.用50mM的碳酸盐包被缓冲液(pH 9.6)溶解抗原,使抗原浓度为10-20 μg/ml,
加100 μl/孔到96孔酶标板,4 o C放臵过夜。
2.第二天弃去包被液后,用PBST洗涤3次,每孔加入150 μl 1%BSA 37 o C
封闭1小时。
3.PBST洗涤3次后,每孔加入100 μl不同倍比稀释度的血清,并加入对照样
品,37 o C孵育2小时。
4.PBST洗涤5次后,加入100μl稀释后的HRP标记的二抗,37 o C孵育1小时。
5.PBST洗涤5次后,显色剂显色20 min后,酶标仪上读取A405吸收值。
二、包被细胞
1.在96孔培养板上接种细胞数为1 x 104 cells/well,37℃过夜培养。
2.第二天用PBS洗涤培养板2-3次。
3.加入125 μl/well 10% Formalin(1:10稀释), 室温下固定15 min。
4.用ddH2O洗涤培养板3次,并晾干,储藏在2-8o C备用。
5.用PBST洗涤3次,每孔加入150 μl 1%BSA 37 o C封闭1小时。
6.PBST洗涤3次后,每孔加入100 μl不同倍比稀释度的血清,并加入对照样
品,37 o C孵育2小时。
7.PBST洗涤5次后,加入100 μl稀释后的HRP标记的二抗,37 o C孵育1小时。
8.PBST洗涤5次后,显色剂显色20 min后,酶标仪上读取A405吸收值。
50mM的碳酸盐包被缓冲液:0.05mol/L pH9.6碳酸缓冲液,4℃,保存,
Na2CO3 0.15克, NaHCO3 0.293克,蒸馏水稀释至100 ml。
ABTS作为底物进行显色反应(10ml):
?0.2M Na2HPO4 2.4ml
?0.1M 柠檬酸2.6ml
?ddH2O 5ml
?ABTS 5mg
?H2O2(30%) 4 ul(用前加入)
注意:
?一般做倍比稀释进行检测,需要有相应的对照血清。
?不同的显色系统对应不同的光吸收值。
血清学筛选克隆新抗原/新基因
一、E.coli/ phage 裂解液预吸附血清
1.将E.coli /phage lysate以1:10-20稀释在TBST溶液中。
2.将4张82mm的nitrocellulose membranes(NC)浸入稀释后的E.coli/ phage
lysate中,室温下水平摇动30分钟,取出NC并使膜沥干。
3.用50ml TBST溶液洗膜3次,每次10分钟。
4.用滤纸轻轻吸去膜上的液体。
5.将膜放入50ml封闭液中,室温下水平摇动最少30分钟。
6.将膜从封闭液中取出,用50ml TBST溶液洗膜3次,每次10分钟。
7.将血清按1:5稀释在TBST溶液中,将一张膜放入溶液中,37℃下轻轻水平
摇动10分钟。
8.从血清稀释液中取出膜并丢弃,加入另外一张新膜,37℃下轻水平摇10分钟.
9.重复步骤8,直至所有4张膜都处理完。
10.除去最后一张膜,收集血清(primary antibody),分装成小份储存于-80℃冰
箱中待用。
注意:
?该步处理过程是为了去除血清中能与细菌和噬菌体裂解蛋白进行免疫反
应的抗体,这样可以减少假阳性率;
?一抗不能反复冻融,化冻后不要再次冰冻,可放于4℃作短暂保存;
?可以是病人血清,也可以是免疫血清,如果是病人血清,则需要至少10
个病人血清进行混合;
二、噬菌体筛选
1.准备NZY agar plates(至少用前24小时倒好),用前在37℃培养箱中烘烤1-2
小时以去除水滴。
2.将过夜培养的XL1-blue MRF’细菌2000转/分,离心10分钟,将细菌溶解在
10mM MgSO4中,调整细菌浓度为OD600=0.5。
3.融化NZY top,并将NZY top放在50℃水浴中。
4.将适量的XL1-blue MRF’细菌溶液与一定稀释度的phage文库混合,37℃下
共同作用15分钟。
?直径90mm平板:200μl XL1-blue 细菌+适量的phage文库
?直径150mm平板:600μl XL1-blue 细菌+适量的phag文库
(噬菌斑数量一般保持在3000pfu/90mm; 12000pfu/150mm)
5.将步骤4中的混合液与NZY top溶液混合(200μl混合液+3-4mlNZY top溶
液;600μl混合液+8-10 ml NZY top溶液),倒入到NZY agar plates中,室温下放10分钟左右,然后倒臵放于37℃下培养。
6.当噬菌斑刚好可看到时(大约5-8小时),从培养箱中拿出平板。
7.将NC放入10mM IPTG溶液中完全浸湿,在空中使膜沥干,并做好3个不
对称的标记。
8.将IPTG处理好的NC贴在平板上,不留气泡,然后倒臵放于37℃下培养。
9.过夜培养后,第二天早上取出平板,用镊子将膜轻轻掀起,注意不要将培养
基粘在膜上。
10.将膜放于50ml TBST溶液中,水平脱色摇床上震荡洗膜3次,每次10分钟。
11.将膜放入50ml封闭液中,水平摇动,封闭4-6小时。
12.在封闭液中加入适当滴度的一抗,水平摇动处理过夜。
13.将膜放于50ml TBST溶液中,洗膜3次,每次10分钟。
14.在封闭液中加入适当滴度的二抗(各个公司的二抗使用滴度不同),室温水
平摇动1-2小时。
15.将膜放于50ml TBST溶液中,洗膜3次,每次10分钟,最后用50ml TBS
溶液洗膜15-20分钟,取出膜空气中沥干。
16.将膜放入BCIP-NBT显色液中避光显色,水平摇动直到阳性斑点可见为止。
17.从显色液中取出膜放在TBS溶液中,空气中使膜干燥。
18.根据所做的标记,将膜与平板对齐,将平板上对应的阳性克隆区域的培养基挖
出放入500μl SM buffer中,并加入25 ml chloroform,4℃贮存(最多可贮6月)。
19.第一轮筛选得到阳性克隆需要进行第二轮筛选以去除假阳性并获得阳性单
克隆噬菌体。过程如第一轮筛选,只不过用直径90mm平板;具体过程见步骤4,这时所加入的噬菌体溶液是第一轮筛选得到的噬菌体上清(见步骤18),在用前要滴定好噬菌体的滴度,噬菌斑的数量以可区分出单个克隆,同时密度不能太稀为标准(一般100-200 pfu/90mm)。
20.按第一轮相似的过程进行实验,最后显色,确定真正的阳性克隆,并将阳性
单克隆所在的培养基挖出放入500μl SM buffer中,并加入25 ml chloroform,4℃贮存(最多可贮存6月)。
注意:
?封闭液一般可用:5%的脱脂牛奶或1%的BSA溶解在TBST溶液中。
?第一轮筛选用150mm的平板;第二轮筛选用90mm的平板,一般需要筛选
至少1 x 106 pfu。
?认真做好三个不对称的标记,特别在第二轮挑选阳性克隆时要仔细将膜与平
板吻合好,不能挑错。
三、单克隆剪切
1.取第二轮筛选得到的阳性克隆贮存液上清。
2.将过夜培养的XL1-blue MRF’细菌2000转/分离心10分钟,将细菌溶解在
10mM MgSO4中,调整细菌溶度到OD600=1.0。
3.在一个EP管中加入:200μl XL1-blue MRF’细菌+250ul phage stock(步骤1)
+1 ul ExAssist helper phage。
4.将以上三种样品混合,37℃下共同保温15分钟。
5.将样品混合物加入到3 ml LB培养基中,37℃震荡培养3-4小时。
6.将试管放于65-70℃水浴20分钟,3000转/分,离心15分钟。
7.将上清转入新的离心管中,已发生剪切的phage particles在上清中(上清可
在4℃下储存1-2月)。
8.将100ul phage 上清+200ul SOLR cells(OD600=1.0)混合,37℃保温15分钟。
9.取步骤8中溶液5-10 ul涂于LB-amp agar plates(amp=50ug/ml),过夜培养。
10.第二天细菌长出,随机挑取单克隆接种到LB-amp培养基中培养过夜。
11.过夜培养细菌分为三部分:(1)提取质粒做双酶切,鉴定外源基因的大小;
(2)送样品进行DNA测序(3)加入30-40%的甘油进行保种,分装成小份储存于-80℃备用。
附录:
1、SM buffer (1L):
(5.8 g NaCl+2.0 g magnesium sulfate+50 ml 1M Tris (pH=7,5)+0.1 g gelatin)
2、AP-buffer:
(100 mM Tris HCI (pH 9.5) ; 100 mM NaCl ; 5 mM MgCl2)
3、10xTBS(1L):
(0.1 M Tris-HCl (pH 8.0);1.5 M NaCl)
4、LB Broth(1L):
(10 g NaCl+10 g of tryptone+5 g of yeast extract)
ELISPOT
1.PBS溶解抗原为30 μg/ml,加100 μl/孔于PVDF膜铺底的96孔灭菌板过夜;
2.第二天吸去包被液后,加5%FCS的PRMI 1640培养基100 μl封闭1小时,
37 o C;
3.准备脾细胞悬液(用氯化铵去除红细胞,制备成单个脾淋巴细胞悬液);
4.从1 × 106/孔开始,按1:3的稀释度开始逐孔稀释做不同浓度梯度,并做3个
复孔,37 o C静臵培养5小时;
5.PBS洗3~5次,生物素化的抗鼠IgG二抗孵育30 min;
6.PBS洗3~5次,链亲和素标记的碱性磷酸酶孵育30 min;
7.PBS洗3~5次,用底物BCIP/NBT显色,显微镜下观察显色反应,显色后及
时终止反应;
8.计数每孔中的斑点数目,计算每106个脾细胞中抗体分泌细胞数量。
藻酸盐包裹实验
1.将藻酸钠溶于无菌生理盐水,终浓度为1.5%;
2.收集培养的肿瘤细胞,用无血清的培养基洗涤1次,将细胞沉淀重悬于1.5%
藻酸钠溶液中;
3.将上述肿瘤细胞悬浮液用1 ml加样枪缓慢滴入磁力搅拌的250 mM CaCl2溶
液中,形成乳白色的藻酸盐小珠。继续静臵于250 mM CaCl2中30 min即可使用。以上操作步骤均在无菌条件下进行;
4.将第4次免疫后7天的小鼠用苯巴比妥钠0.1ml (按100 mg/kg计) 腹腔注射
麻醉,小鼠麻醉后臵于解剖台上,切开背部皮肤,皮下植入4粒藻酸盐包裹颗粒,缝合皮肤,外敷手术胶膜;
5.天以后,小鼠经尾静脉注入100 μl (按100 mg/kg计) FITC标记的葡聚糖
(FITC-Dextran);
6.20 min后处死动物,取出藻酸盐颗粒,常温下加入1 ml的生理盐水,剪碎研
磨颗粒,再加入1 ml的生理盐水,混匀标本,放臵1小时,1500 rpm离心5 min。
取上清液用荧光酶标仪测定;
7.用不同浓度的FITC-Dextran制备标准曲线。
重组腺病毒构建,扩增及纯化基本技术操作
(细菌内同源重组AdEasy System)
一、疾病预防控制中心实验室仪器设备清单 1 气相色谱仪:定性定量分析 2 阿贝折射仪:测透明半透明液体或固体的折射率和平均色散 3 氨气分析仪:测样品中氨的含量 4 测汞仪:测固、体液体样品中汞含量 5 电导率仪:测电解质溶液电导率值 6 二氧化硫测定仪:大气环镜中二氧化硫浓度的自动监测 7 二氧化碳测定仪:大气环镜中二氧化碳浓度的自动监测 8 离子交换纯水器:使用离子交换法制纯水 9 粉层采样器:该采样器适用于煤矿及其它粉层作业环镜中进行粉层采样 10 光电浊度仪:测量浊度 11 光照度计:测定光照强度 12 火焰光度计:监床化验用病理研究 13 激光粉层仪:检测粉层浓度 14 紫外可见分光光度计:测量物质对不同波长单色辐射的吸收程度、定量分析 15 紫外辐射照度计:紫外辐射照度测量 16 自动量程照度计:测定光照强度 17 自动旋光仪:测物质旋光度,分析物质的浓度、纯度、含糖量 18 酶标仪:定性定量 19 冷原子荧光测汞仪:专用测贡仪器,测痕量贡 20 离子计:测离子浓度 21 CO分析仪:测大气环镜中一氧化碳含量 22 双道原子荧光光度计:固、液体中汞、砷、硒、锑、锗、锡含量测定析 23 手持糖量计:测体的含糖量 24 生化分析仪:测定样品的浓度,酶反映速率和酶的活性等数十种生化参数 25 洗板机:与酶标仪配套使用 26 微量可调移液器:移微量液体 27 显微镜:观察微小物质 28 荧光分光光度计:分析和测试各类微生物,氨基酸、蛋白质、核酸及多种监床药物 29 医用净化工作台:提供无尘无菌高洁净工作环镜 30 便携式红外线人析器:测定公共场所中的CO2浓度 31 电子微风仪:适用于工厂企业通风空调,镜污染览测动压平衡自动跟踪等速烟尘采样器的采样 32 放射性污染计量仪:测试放射性污染是否超标 33 热敏电阻(测辐射热计):用于辐射探测 34 紫外光功力计:测试检测紫外光功率 35 热球式电风速仪:测定室内外或模型的气流速度时,是一种测量低风速的基本仪器 36 红血蛋白仪:检测血红蛋白
常用分子克隆实验方法I 一、植物总DNA的小量提取 方法1:提取吸附法。无须巯基乙醇、氯仿等有毒物质,产物无须Rnase处理。 (1)充分研磨。称取约0.2克植物组织,加入液氮充分研磨3-5min,稍后加约1ml溶液 A,继续研磨至略粘稠的组织匀浆,用大口1ml吸头将所有溶液移至1.5ml离心管 中,55℃水浴30min; (2) 高速离心去杂质。10,000rpm离心5min,取约600ul上清至新1.5ml离心管; (3) 核酸吸附。往上清液中加入1倍的异丙醇,轻轻混匀,再加入总体积1/4已混匀的 溶液B,静置3min; (4) 低速离心沉淀。5000rpm离心1min,轻轻倒掉上清,并用吸水纸轻吸离心管口, 再用移液枪吸走大部分残余液体; (5) 75%乙醇清洗。加入1ml75%乙醇,5000rpm离心30s,轻轻倒掉上清,用吸水纸稍 吸离心管口。重复该步骤一次,再5000rpm离心30s,然后用移液枪吸走管底的残 液,晾干5min; (6) 核酸洗脱。加入约55ul TE(PH8.0)至管底,轻轻重悬硅土,静置3min,10,000rpm 离心1min,用小枪头轻轻吸取出50ul管底溶液,冷藏。 方法2:CTAB法,此为在经典方法基础上,经过摸索改进,提高了得率,减少了污染。 (1)充分研磨。称取约0.2克植物组织,加入液氮充分研磨3-5min,稍后加约1ml CTAB 提取液,继续研磨至略粘稠的组织匀浆,用大口1ml吸头移至1.5ml离心管,65℃ 水浴30-60min。 (2) 氯仿抽提。10,000rpm离心3min,取约600ul上清。加入1倍的氯仿,轻轻混匀, 10,000rpm离心3min,取上清再抽提1遍。 (3) 核酸沉淀。加入预冷的1倍异丙醇或2倍乙醇,轻混匀,6000rpm离心3min,弃 上清。 (4) 清洗沉淀。轻加入1ml 75%乙醇,再吸掉上清,重复一次,倒置于吸水纸或横放于 离心管架上晾干5min。 (5) 溶解DNA。加50ul含Rnase A(约10ug/ml)的TE,常温下放置30min。取约3-5ul 电泳检测后,低温冷藏。
●针刺伤事件有处理登记 ●传染病、特殊感染病例报告登记 ●再生医疗器械消毒流程正确: 1.医疗垃圾需分类放置。 2.污染敷料(血液、体液)与使用后的一次性换药包 需用黄色袋。 3.非污染物(使用后的输液袋、注射器)需用兰色袋。 4.使用后的针头需锐器桶盛放,玻璃安瓿需用黄色袋。 ●中心静脉穿刺处无红肿和渗液 ●无菌物品及器械: 使用方法正确,消毒灭菌达标,标识清楚。 ●屏障隔离: 1.符合要求,隔离标识正确,物品单独使用。 2.隔离患者的物品消毒符合规范。 3.沾染了放射性、化疗药物的废弃物处理符合规范。 4.血液制品袋用后按医疗垃圾单独放置,保存24小时 备查。 ●体温表消毒方法: 1.每周浸泡用肥皂水清洗两次(周一、周四),用75%酒精浸泡,不填加,每周更换两次。 2.遇有传染病人用过的体温表,需用0.05%有效氯消毒半小时,然后用清水洗净晾干,放入酒精浸泡。
3.病人处不可放置体温表,随用随取,及时消毒。 4.每月监测体温表检测,并登记。方法如下:将体温表中的汞柱甩至35℃以下,放入36℃以上、42℃以 下水温中浸泡3分钟,取出后体温表中汞柱误差在 0.2之间为合格。 ●血压计终末消毒方法: 1.污染的血压计袖带使用0.05%有效氯即刻消毒,消毒半小时后用清水洗净晾干备用。污染的血压计用 0.05%有效氯擦拭消毒。 2.无法撤掉的要关闭阀门后,再进行消毒。 3.传染病人固定专用血压计,定时每周消毒一次。 4.血压计袖带每周清洁消毒一次,方法如下:用清水或肥皂水清洗后晾干,再用紫外线双面消毒半小时。 ●简易呼吸器消毒: 1.接口与面罩用酒精擦拭,球囊污染用肥皂水清洗。 2.人工呼吸器使用后消毒,避污保存。 3.气管插管导丝使用后灭菌保存。 ●呼吸机冷凝水终末消毒: 1.配制0.1%有效氯装在密闭容器中,积水器中冷凝水达1/2满时倾倒,将冷凝水倒入容器中,半小时后 倒入卫生间污水系统。 2.呼吸机管路积水瓶处于直立状态,避免冷凝水倒灌
总RNA的提取(Trizol法提取) 在收集到生物材料之后,最好能即刻进行RNA制备工作。若需暂时储存,则应以液氮将生物材料急速冷冻后,储存于-80℃冷冻柜。在制备RNA时,将储存于冷冻柜的材料取出,立即以加入液氮研磨的方式打破细胞,不可以先行解冻,以避免RNase的作用。 1.提取组织RNA时,每50~100mg组织用1ml Trizol试剂对组织进行裂解;提取细胞RNA时,先离心沉 淀细胞,每5-10 ╳106个细胞加1ml Trizol后,反复用枪吹打或剧烈振荡以裂解细胞; 2.将上述组织或细胞的Trizol裂解液转入EP管中,在室温15~30C下放置5分钟; 3.在上述EP管中,按照每1ml TRIZOL加0.2ml氯仿的量加入氯仿,盖上EP管盖子,在手中用力震荡 15秒,在室温下(15℃~30℃)放置2~3分钟后,12000g(2℃~8℃)离心15分钟; 4.取上层水相置于新EP管中,按照每1ml TRIZOL加0.5ml异丙醇的量加入异丙醇,在室温下(15℃~30℃) 放置10分钟,12000g(2℃~8℃)离心10分钟; 5.弃上清,按照每1ml TRIZOL加1ml 75%乙醇进行洗涤,涡旋混合,7500g(2℃~8℃)离心5分钟, 弃上清; 6.让沉淀的RNA在室温下自然干燥; 7.用Rnase-free water 溶解RNA沉淀。 PCR 实验室常用DNA聚合酶有三种:TaKaRa Taq TM,TaKaRa E X Taq TM和Pyrobest TM DNA Polymerase。TaKaRa Taq TM 是一般的DNA聚合酶,保真性较差,但价钱便宜,一般用于基因表达的检测等。TaKaRa E X Taq TM是具有Proof reading活性的耐热性DNA聚合酶,具有一定的保真性,而且其扩增得到的PCR产物3’端附有一个“A”碱基,如果希望直接将产物克隆到T-vector可以用此酶。Pyrobest TM DNA Polymerase也是具有Proof reading 活性的耐热性DNA聚合酶,其特点是保真性极高,扩增得到的PCR产物为平滑末端。如果进行基因的扩增请使用此酶。 1.按下列组成在PCR反应管中调制反应液: TaKaRa Taq TM或TaKaRa E X Taq TM的配方
分子克隆技术 一、填空题 1.PCR反应中加入矿物油的作用是___________________________。 2.分子克隆实验中外源DNA和载体片段连接之前,要对载体进行去磷酸化处理,我 们在本次试验中去磷酸化使用的碱性磷酸酶是___________________________。它 的目的是___________________________。 3.用α互补筛选转化子是,带有外源片段的菌落显___________________________色。 4.Southern杂交中进行与杂交的目的是___________________________。 5.凝胶糖凝胶电泳时加入loading buffer作用是___________________________和 ___________________________。 6.影响琼脂糖凝胶电泳的因素主要有___________________________、 ___________________________、___________________________、 ___________________________、___________________________。 二、简答题 1.简述PCR反应体系中都有哪些成分及各成分的作用。 2.为得到质量较好的水稻RNA,抽提前应做如何准备?RNA抽提过程中、RNA的 保存及以后对RNA的操作过程中应特别注意什么? 3.简述为防止放射性同位素外照射及内照射对人体造成伤害,在操作放射性同位素 时,我们可以采取哪些措施进行防护? 4.简述影响电转化感受态细胞转化效率的因素有哪些? 5.质粒抽提时用到的SolutionI,SolutionII,SolutionIII及异丙醇分别起什么作用?操 作时应注意什么? 三、分析问答题 1.描述并图示pUC19载体DNA及其在HindIII位点克隆了外源DNA片段的质粒DNA 和水稻总DNA及它们的HindIII和BamH1酶切产物在琼脂糖凝胶电泳时的带型。 2.利用质粒载体克隆外源DNA片段主要包括哪些步骤?涉及到哪些工具酶?要获得 理想的结果,各步骤操作中应主要注意哪些事项? 3.在Southern杂交实验中,同一根杂交管内的膜曝光的····(原卷此处不清晰)冲 洗后,有些组X光片信号很强,有些组信号很弱,有的样品点样孔附近有较强的 信号,但是有的地方信号较弱,请分析造成这种结果的可能原因。 4.下面是本次课生物技术班某组β-active基因RT-PCR(反转录前没有对总RNA进 行去除DNA 的处理)试验的琼脂糖凝胶电泳图,凝胶上共点了6个样,PCR使用 的模板从左至右分别是:该组提取的水稻总DNA,该组提取的水稻总RNA,该组 的4个反转录产物。(原卷本题图不清晰) 请问: 提取的RNA的质量如何? RT-PCR是否成功?为什么会出现这样的结果? 有哪些地方需要改进?
常用的消毒方法 目前常用的消毒方法主要有:热力消毒和灭菌(湿热)、化学药物消毒和灭菌(含氯消毒剂、环氧乙烷、过氧乙酸、戍二醛、甲醛、乙醇等),以及紫外线消毒和电放辐射灭菌。现分述如下: 一、湿热消毒和灭菌 湿热灭菌原理主要是通过凝固菌体蛋白质而杀死微生物。湿热杀死微生物的能力比干热强,因为湿热消毒可以使菌体蛋白质含水量增加,从而易于被热力所凝固,加速了微生物的死亡。 (一)煮沸消毒 煮沸消毒是最早使用的方法之一,其优点是方法简单,应用方便,不需要特殊设施,花费不多而效果可靠。缺点是消毒物品被浸湿,而且处理后再污染的可能性增多。 煮沸消毒适用于消毒食具、食物、棉织品、金属及玻璃制品等。当水温达到100℃时细菌繁殖体几乎立刻死亡,通常在水沸腾后再煮5-15分钟即可达到消毒目的。细菌芽胞抗热能力较强,有些芽胞煮沸数小时才能将其杀灭,因此煮沸消毒一般不能达到灭菌的效果。 煮沸消毒时应注意:
1.消毒时间应从水煮沸后算起; 2.煮沸过程中不要加入新的消毒物品; 3.被消毒物品应全部浸入水中; 4.碗盘等不透水物品应垂直放置,以利对流; 5.消费物品不应放置过多,一般不应超过容器高的四分之三; 6.消毒导热不良的物品时应适当延长煮沸时间。 (二)压力蒸汽灭菌 压力蒸汽灭菌是热力灭菌中使用最普遍、效果最可靠的一种方法。其优点是穿透力强、灭菌效果可靠,能灭杀所有微生物。穿透力强的原因主要是蒸汽凝结时释放出的潜热和凝聚收缩后产生的负压加速了蒸气对物品的穿透,使物品的深部也能很快达到灭菌所需的温度。 压力蒸汽灭菌的持续时间应从灭菌器内达到要求温度时算起,至灭菌完成时为止。总时间包括: 1.热力穿透时间;2.消毒维持时间,即杀灭微生物所需时间,一般用杀灭嗜热脂肠杆菌芽胞所需时间来表示(在121℃里需12分钟、132℃时需2分钟、115℃需30分钟);3.安全时间(一般为消毒维持时间的一半)。其中热力穿透时间是指灭菌柜内达到灭菌温度至消毒物品中心部位亦达到灭菌温度所需时间,该时间长短取决于消毒物品的性质、包装大小、安放情
实验室常用器材使用方法及注意事项
实验室常见仪器使用方法及注意事项 一、常见的仪器 (一)初中化学实验常见仪器 反应容器可直接受热的:试管、蒸发皿、燃烧匙、坩埚等能间接受热的:烧杯、烧瓶、锥形瓶(加热时,需加石棉网) 常存放药品的仪器:广口瓶(固体)、细口瓶(液体)、滴瓶 (少量液体)、集气瓶(气体) 用加热仪器:酒精灯 计量仪器:托盘天平(称固体质量)、量筒(量液体体积) 仪分离仪器:漏斗 取用仪器:药匙(粉末或小晶粒状)、镊子(块状或较大颗粒)、胶头滴管(少量液体) 器夹持仪器:试管夹、铁架台(带铁夹、铁圈)、坩埚钳其它仪器:长颈漏斗、石棉网、玻璃棒、试管刷、水槽 不能加热:量筒、集气瓶、漏斗、温度计、滴瓶、表面皿、广口瓶、细口瓶等 1、试管 (1)、用途: a、在常温或加热时,用作少量试剂的反应容器。 b、溶解少量固体。 c、收集少量气体的容器 d、用于装置成小型气体的发生
器。 (2)、注意事项: a、加热时外壁必须干燥,不能骤热骤冷,一般要先均匀受热,然后才能集中受热, 防止试管受热不均而破裂。 b、加热时,试管要先用铁夹夹持固定在铁架台上(短时间加热也可用试管夹夹持)。 试管夹应夹在的中上部(或铁夹应夹在离试管口的1/3处)。c、加热固体时,试管口要略向下倾斜,且未冷前试管不能直立,避免管口冷凝水倒流 使试管炸裂。 d、加热液体时,盛液量一般不超过试管容积的1/3(防止液体受热溢出),使试管与桌面 约成45°的角度(增大受热面积,防止暴沸),管口不能对着自己或别人(防止液体喷出伤人)。反应时试管内的液体不超过试管容积的1/2。 2、烧杯用途:①溶解固体物质、配制溶液,以及溶液的稀释、浓缩 ②也可用做较大量的物质间的反应 注意事项:受热时外壁要干燥,并放在石棉网上使其受热均匀(防止受热不均使烧杯炸裂), 加液量一般不超过容积的1/3(防止加热沸腾使液体外溢)。
各种消毒方法及注意事项 日常消毒方式方法,应避免过度消毒,受到污染时应随时进行清洁消毒,并加强通风。消毒方法如下: 1、表面(如楼梯扶手、门把手、课桌椅、体育器材等人体常接触的物体或位置):可使用含氯消毒剂(有效氯浓度250 mg/L~500 mg/L)擦拭,消毒作用30 分钟,再用清水擦净。 2、地面:可使用含氯消毒剂(有效氯浓度250 mg/L~500mg/L)用喷洒或拖布湿式拖拭,消毒作用30 分钟,再用清水洗净。 (三)、常见消毒剂及配制使用 1、有效氯浓度500 mg/L 的含氯消毒剂配制方法: (1)、84 消毒液(有效氯含量5%):按消毒液比水为1:100 比例稀释。(2)、次氯酸钠原液(有效氯含量5-10%):按消毒液比水为1:200 的比例稀释。 配置的溶液需要搅拌混匀后使用。 2、75%酒精消毒液:直接使用。 3、其他消毒剂按产品说明书进行配制和使用。 (四)、注意事项 1、含氯消毒剂(含84 消毒液) (1)、含氯消毒剂有很强的刺激性与腐蚀性,必须按照说明书要求,严格按比例加水稀释后方能使用。 (2)、含氯消毒剂配置和使用时必须佩戴口罩、手套、护目镜、工作服或一次性防护服,严禁儿童触碰。 (3)、含氯消毒剂不能和酒精、碱性活洗剂(洗衣粉)、洁厕剂等混存混用。(4)、含氯消毒剂有漂白作用,不可用于丝绸、毛、尼龙、皮革表面以及彩色织物的浸泡,对金属表面也有腐蚀,消毒后要擦拭干净。其中84 消毒液的漂白作用与腐蚀性较强,最好不要用于衣物的消毒,必须使用时浓度要低,浸泡的时间不要太长。 (5)、含氯消毒剂需加盖保持容器密闭,并存放在避光阴凉处,否则会造成氯
1.GB21549-2008实验室玻璃仪器玻璃烧器的安全要求; 2.GB/T21784.2-2008实验室玻璃器皿通用型密度计第2部分:试验方法和使用; 3.GB/T21298-2007实验室玻璃仪器试管; 4.GB/T21297-2007实验室玻璃仪器互换锥形磨砂接头; 5.GB/T11414-2007实验室玻璃仪器瓶; 6.GB/T12804-2011实验室玻璃仪器量筒; 7.GB/T12805-2011实验室玻璃仪器滴定管; 8.GB/T12806-2011实验室玻璃仪器单标线容量瓶; 9.GB/T28211-2011实验室玻璃仪器过滤漏斗; 10.GB/T28212-2011实验室玻璃仪器冷凝管; 11.GB/T28213-2011实验室玻璃仪器培养皿; 12.GB/T22362-2008实验室玻璃仪器烧瓶; 13.GB/T22067-2008实验室玻璃仪器广口烧瓶; 14.GB/T11165-2005实验室pH计; 15.GB/T30431-2013实验室气相色谱仪; 16.GB4793.7-2008测量、控制和实验室用电气设备的安全要求第7部分:实验室用离心机的特殊要求; 17.GB12803-1991实验室玻璃仪器:量杯; 18.GB12807-1991实验室玻璃仪器:分度吸量管; 19.GB12808-1991实验室玻璃仪器:单标线吸量管; 20.GB21549-2008实验室玻璃仪器:玻璃烧器的安全要求; 21.GBT11414-2007实验室玻璃仪器瓶;
22.GBT12804-2011实验室玻璃仪器:量筒; 23.GBT12805-2011实验室玻璃仪器:滴定管; 24.GBT12806-2011实验室玻璃仪器:单标线容量瓶; 25.GB/T12807-1991实验室玻璃仪器:分度吸量管; 26GB/T12808-1991 实验室玻璃仪器:单标线吸量管; 27.GBT12809-1991实验室玻璃仪器:玻璃量器的设计和结构原则; 28.GBT12810-1991实验室玻璃仪器:玻璃量器的容量校准和使用方法; 29.GBT14149-1993实验室玻璃仪器:互换球形磨砂接头; 30.GBT15723-1995实验室玻璃仪器:干燥器; 31.GBT15724-2008实验室玻璃仪器:烧杯; 32.GBT15725.4-1995实验室玻璃仪器:双口、三口球形圆底烧瓶; 33.GBT15725.6-1995实验室玻璃仪器:磨口烧瓶; 34.GBT21297-2007实验室玻璃仪器:互换锥形磨砂接头; 35.GBT21298-2007实验室玻璃仪器:试管; 理化仪器类 1.GBT1914-2007化学分析滤纸; 2.GB24789-2009用水单位水计量器具配备和管理通则; 3.GBT11007-2008电导率仪试验方法;
实验室样品前处理常用方法 【样品前处理要求】 1.样品是否要预处理,如何进行预处理,采样何种方法,应根据样品的性状、检验的要求和所用分析仪器的性能第方面加以考虑。 2.应尽量不用或少使用预处理,以便减少操作步骤,加快分析速度,也可减少预处理过程中带来的不利影响,如引入污染、待测物损失等。 3.分解法处理样品时,分解必须完全,不能造成被测组分的损失,待测组分的回收率应足够高。 4.样品不能被污染,不能引入待测组分和干扰测定的物质。 5.试剂的消耗应尽可能少,方法简便易行,速度快,对环境和人员污染少。 1 高温灰化法 高温灰化法是利用热能分解有机试样,使待测元素成可溶状态的处理方法。其处理过程是准确是准确称取0.5~1.0g(有些试样要经过预处理),置于适宜的器皿中,zui常用的是适宜的坩锅,如铂坩锅、石英坩锅、瓷坩锅、热解石墨坩锅等,然后置于电炉进行低温碳化,直至冒烟近尽。再放入马弗炉中,由低温升至375~600℃左右(视样品而定),使试样完全灰化。试样不同,灰化的温度和时间也不相同,冷却后,灰分用无机酸洗出,用去离子水稀释定容后,即可进行待测元素原子吸收法测定。 灰化法是有机试样zui常用的方法之一,其优点:操作比较简单,适宜于大量试样的测定,处理过程中不需要加入其它试剂,可避免污染试样,但灰化法也存在明显的缺点:在灰化过程中,引起易挥发待测元素的挥发损失,待测元素沾壁及滞留在酸不溶性灰粒上的损失。汞和硒等易挥发元素,灰化处理中挥发损失严重,不易采用。As、B、Cd、Cr、Fe、Pb、P、V、Zn等元素在灰化过程中有一定程度的挥发损失。Cu、Ni等形成某些有机复合物,在温度相对较低时,也会挥发。非金属元素能形成多种多样化合物,易于挥发。 应特别指出的是,为克服灰化法的不足,在灰化前加入适量的助灰化剂,可减少挥发损失和粘壁损失。常见的灰化剂有:MgO、Mg(NO3)2、HNO3、H2SO4等。其中HNO3起氧化作用,加速有机物的破坏,因而可适当降低灰化温度,减少挥发损失。加入H2SO4能使挥发性较大的氯酸盐转化为挥发性较小的硫酸盐,起到象基体改良剂的作用,硫酸可是使灰化温度升高到980℃,镉、铅未发现明显的损失。Mg(NO3)2有双重作用,其分解为NO2和MgO,前者促进氧化,后者可稀释灰分,减少灰分与坩锅壁的总接触面积,从而减少沾留。例如:As、Cu、Ag等在常规灰化时会有严重损失,如果加入Mg(NO3)2后,则能得到满意的结果。 2 湿法消化法 湿法消化法亦称湿灰化法,其实质是用强氧化性酸或强氧化剂的氧化作用破坏有机试样,使待测元素以可溶形式存在。其基本方法是:称取预处理过的试样于玻璃烧杯中(或石英烧杯、聚四氟乙烯烧杯),加入适量消化剂,通常应在100~200℃下加热以促进消化,待消化液清亮后,蒸发剩余的少量液体,用纯水洗出,定容后即可进行原子吸收法测定。 湿法消化法中zui常用的试剂是HNO3、HClO4、H2SO4等强氧化性酸,以及H2O2、KMnO4 等氧化性试剂。实际上多用以一定比例配制的混合酸。在消化过程中避免产生易挥发性的物质,避免有新的沉淀形成。例如,HNO3:HClO4:H2SO4=3:1:1的混合酸适于大多数的生物试样的消化,但样品含钙高,则可不用H2SO4,以避免CaSO4沉淀形成。某些硫酸盐(如Pb2+、Ag+、Ba2+)和氯酸盐(Pb2+、Ag+如等)呈不溶性,因此测定这类样品时不宜使用HClO4或H2SO4。其它氧化剂如H2O2、高锰酸盐等也可用于消化试样,钼盐则能作催化剂加速氧化反应。
分子克隆实验标准步骤 一、 常规分子克隆实验流程: 二、 分子克隆实验标准步骤(含实验编号): 1. PCR 扩增目的基因(编号Clone SOP-1) 以本实验室常用酶KOD-Plus-Neo (TOYOBO )为例 体系(50ul ): 10×KOD buf 5ul dNTP(2mM) 5ul Mg 2+ 3ul Primer1 1ul Primer2 1ul Template50-200ng KOD0.5ul ddH 2O up to 50ul 程序: 95℃2min 98℃10s 58℃30s 35cycle 68℃2kb/min 68℃7min 12℃∞
2.PCR产物的琼脂糖凝胶电泳琼脂糖凝胶的制备(编号Clone SOP-2) 琼脂糖溶液的制备:称取琼脂糖,置于三角瓶中,按1%-1.5%的浓度加入相应体积的TBE或TAE缓液,将该三角瓶置于微波炉加热至琼脂糖溶解。 胶板的制备:①取有机玻璃内槽,洗净、晾干;②将有机玻璃内槽置于一水平位置模具上,安好挡板,放好梳子。在距离底板上放置梳子,以便加入琼脂糖后可以形成完好的加样孔。 ③将温热琼脂糖溶液倒入胶膜中,使胶液缓慢地展开,直到在整个有机玻璃板表面形成均匀 的胶层。④室温下静置30min左右,待凝固完全后,轻轻拔出梳子,在胶板上即形成相互隔开的上样孔。制好胶后将铺胶的有机玻璃内槽放在含有0.5~1×TAE(Tris-乙酸)或TBE(Tris-硼酸)工作液的电泳槽中使用,没过胶面1mm以上。 3.试剂盒回收DNA片段(编号Clone SOP-3) 以本实验室常用DNA凝胶回收试剂盒(天根)为例 使用前请先在漂洗液PW中加入无水乙醇,加入体积请参照瓶上的标签。 ①柱平衡步骤:向吸附柱CA2中(吸附柱放入收集管中)加入500μl平衡液BL, 12,000rpm(~13,400×g)离心1min,倒掉收集管中的废液,将吸附柱重新放回收集管中。(请使用当天处理过的柱子) ②将单一的目的DNA条带从琼脂糖凝胶中切下(尽量切除多余部分)放入干净的离心管中, 称取重量。 ③向胶块中加入等倍体积溶液PN(如果凝胶重为0.1g,其体积可视为100μl,则加入100μlPN 溶液),60℃水浴放置,其间不断温和地上下翻转离心管,以确保胶块充分溶解。如果还有未溶的胶块,可继续放置几分钟或再补加一些溶胶液,直至胶块完全溶解(若胶块的体积过大,可事先将胶块切成碎块)。 注意:对于回收<300bp的小片段可在加入PN完全溶胶后再加入1/2胶块体积的异丙醇以提高回收率;胶块完全溶解后最好将溶液温度降至室温再上柱,因为吸附柱在室温时结合DNA 的能力较强。 ④将上一步所得溶液加入一个吸附柱CA2中(吸附柱放入收集管中),室温放置2min, 12,000rpm(~13,400×g)离心30-60sec,倒掉收集管中的废液,将吸附柱CA2放入收集管中。 ⑤向吸附柱CA2中加入600μl漂洗液PW(使用前请先检查是否已加入无水乙醇), 12,000rpm(~13,400×g)离心30-60sec,倒掉收集管中的废液,将吸附柱CA2放入收集管中。 ⑥重复操作步骤⑤。 ⑦将吸附柱CA2放回收集管中,12,000rpm(~13,400×g)离心2min,尽量除尽漂洗液。将吸附 柱CA2置于室温放置数分钟,彻底地晾干,以防止残留的漂洗液影响下一步的实验。 ⑧将吸附柱CA2放到一个干净离心管中,向吸附膜中间位置悬空滴加适量洗脱缓冲液EB或 ddH2O,室温放置2min。12,000rpm(~13,400×g)离心2min收集DNA溶液。 4.酶切反应(编号Clone SOP-4) 以本实验室常用酶FastDigest restriction enzymes(Thermo)为例 双酶切体系(若是单酶切则只用加一种酶): 10×FastDigest? buffer or 10×FastDigest? Green buffer 5ul FastDigest restriction enzyme 1 0.5-1ul FastDigest restriction enzyme 2 0.5-1ul DNAN ddH2Oupto50ul 酶切体系混合均匀后置于37℃条件下反应,反应时间应大于30min,若是载体(2-3ug)至少酶切2小时。 5.酶切产物的回收(编号Clone SOP-5) 以本实验室常用Axygen?AxyPrep?PCRClean-UpKit(Axygen)为例 ①在PCR、酶切、酶标、或测序反应液中,加入3个体积的BufferPCR-A(若BufferPCR-A
八种消毒方法的对比 之前,有网友一起讨论,空气消毒用什么方法比较好,其实没有 所谓的最好,只是看看哪种最适合您。为此,我整理了8 种空气消毒方法,主要从消毒原理已经消毒效率进行评价,供各位朋友参考选择:常见应用方法: 1、臭氧消毒法:臭氧是一种淡蓝色气体,具有很强的氧化能力,分解产生的氧原子可以氧化并穿透细菌细胞壁而杀死细菌。但不能除尘,室 内必须没有人,并容易损坏一些易氧化的物品,对表面微生物作用较小。臭氧对人的呼吸道有一定的影响。尽管应用广泛,但越来越多的报导不 主张使用臭氧消毒方法。消毒效率在91~92%之间。 2、紫外照射法:如果应用在空调系统中效果非常差,因为空气流速高,细菌受照的剂量非常小,不能除尘。WHO 和欧盟GMP 都已经宣布其 为通常不被接受的方法,更不能作为最终灭菌。消毒效率在 82~84%。 3、甲醛熏蒸法:甲醛是一种化学试剂,已经宣布致癌,消毒效率大 概在77~78%。 4、超低阻高中效过滤器:这是一种物理阻隔的方法,常规风口上的 阻力是粗效的三分之一,但效率很高,对于大于0.5 微米的效率可达
80%,重量轻,安装方便。消毒效率在92~98%(一次通过的除菌效率) 5、高效过滤器:也是物理阻隔,没有副作用,卫生部消毒规范指出洁净室空气灭菌只用空气净化过滤方式。这种消毒效率可达99.9% 甚至更高(一次的效率) 由于细菌不会单独存在,都需要附着在粒子上,因此,高效其实是最好的消毒,控制好人员的规范其实才是最重要的,其他消毒只是一种辅助。 除此之外,再汇总几个消毒方法,供参考吧: 6、等离子法:这种方法是在气体在加热或者强电磁场作用下产生高度电离的电子云,其中的活性自由基和射线对微生物有一定的杀菌作用,但效率很低70%以下。 7、电子灭菌灯:一种物理方法,没什么破坏,消毒效率平均85%。 8、负离子法:在电场、紫外、射线和水的撞击下使空气电离而产生,可吸附尘埃粒子变成重离子而沉降,缺点是有二次扬尘,在空调系统中不会使用。消毒效率73%左右
高中14种常见物质实验室制法 1、实验室制取氢气(H2) ⑴反应原理:Zn+H2SO4 === ZnSO4+H2↑ ⑵发生装置:固+液?→气(启普发生器) ⑶净化方法:浓硫酸(除水蒸气) ⑷收集方法:排水集气法/向下排空气法 ⑸尾气处理:无 ⑹检验方法:①点燃,淡蓝色火焰,在容器壁上有水珠 ②能使灼烧的CuO由黑色变为红色,气体产物使白色的CuSO4粉末变蓝 2、实验室制取一氧化碳(CO) ⑴反应原理:HCOOH?浓硫酸/?→CO↑+H2O ⑵发生装置:固+液??→气(分液漏斗、圆底烧瓶) ⑶净化方法:浓硫酸(除水蒸气) ⑷收集方法:排水法 ⑸尾气处理:点燃法/收集法(塑料袋) ⑹检验方法:①点燃,淡蓝色火焰,无水珠,产生的气体能使澄清石灰水变浑浊。 3、实验室制取二氧化碳(CO2) ⑴反应原理:CaCO3+2HCl===CaCl2+CO2↑+2H2O ⑵发生装置:固+液?→气(启普发生器) ⑶净化方法:饱和NaHCO3 溶液(除HCl)、浓硫酸(除水蒸气) ⑷收集方法:向上排空气法/排饱和NaHCO3 溶液法 ⑸尾气处理:无 ⑹检验方法:①通入澄清石灰水变浑浊,继续通又变澄清 ②能使燃烧的木条熄灭 4、实验室制取甲烷(CH4) ⑴反应原理:CH3COONa+NaOH ?CaO/?→CH4↑+Na2CO3 ⑵发生装置:固+固??→气 ⑶净化方法:浓硫酸(除水蒸气) ⑷收集方法:排水集气法/向下排空气法 ⑸尾气处理:无 ⑹检验方法:①点燃,淡蓝色火焰,燃烧产物是H2O和CO2 5、实验室制取乙烯(C2H4) ⑴反应原理:CH3CH2OH ?浓硫酸/170℃→CH2=CH2↑+H2O ⑵发生装置:液+液??→气(分液漏斗、圆底烧瓶) ⑶净化方法:NaOH溶液(除SO2、SO3)、浓硫酸(除水蒸气) ⑷收集方法:排水集气法 ⑸尾气处理:无 ⑹检验方法:①点燃,明亮的火焰,冒黑烟,燃烧产物是H2O和CO2
实验室常用生化试剂配方 1.常用抗生素配制以及使用说明(参考链霉菌室操作手册2019版) 抗生素 英文名称及缩写 抗性基因 贮藏液浓度(mg/ml) 100 25(无水乙醇配) 50 25 50 50 25(DMSO配) 100 50 35 25(0.15M NaOH配) 50(DMSO配) 50 50 MM 使用终浓度(μg/ml)链霉菌 2CM YEME 大肠杆菌 LA或LB 氨苄青霉素氯霉素潮霉素卡那霉素壮观霉素链霉素硫链丝菌素红霉素阿泊拉霉素紫霉素萘锭酮酸 TMP Ampicillin, Amp bla Chloramphenicol, Cml Hygromycin, Hyg Kanamycin, Km Spectinomycin, Spc Streptomycin, Str Thiostrepton, Thio Erythomycin, Ery Apramycin, Am Viomycin,Vio Nalidixic acid Trimethoprim cat hyg aac/aph aadA str tsr ermE aac(3)IV vph -* 10 10 2 5 10 5 100 10 -- 25 25 20 25 10 - 50 ------ 2.5 - 5 50-100 25 - 25 50 25 25 20 10-30
注意事项: (1) –表示无记录或不能使用,贮存液除特别说明外均用无菌水配制,配制过程请 确保抗生素粉末充分溶解混匀后再分装; (2)Km 和Am有交叉抗性,同时具有这两种抗性基因时应适当提高抗生素的量,并 设置阴性对照; (3)Hyg、Vio易见光分解,配制好后应用锡箔纸包好,使用过程中建议避光操作。有些抗生素需要在低盐的环境(如DNA培养基)下筛选效率较高,如Hyg, Km, Vio (4)用无菌水配制的抗生素需在超净工作台内用0.22 μm一次性过滤器过滤除菌并 分装;氯霉素、TMP、硫链丝菌素可以在超净工作台外配制分装,无需过滤除菌,但需确 保配制贮存液所用溶剂(无水乙醇、DMSO)未遭受污染,建议配制氯霉素时使用新的无水 乙醇,不要使用抽提质粒或总DNA时用的无水乙醇,以防止污染;DMSO,即二甲亚砜,易 挥发,有剧毒; (5)长期不用的抗生素请置于-20℃保存,抗生素粉末按照使用说明一般置于4℃保存,经常使用时可以暂置于4℃保存; (6)抗生素的实际使用浓度请结合实验经验进行适当调整; (7)配制抗生素时应尽量一次性称取抗生素粉末,配制过程中建议穿工作服,戴一次 性橡胶手套及口罩,及时清理称量配制抗生素时使用的台面及器具,以避免抗生素及溶剂 对自身的损伤及对工作环境的污染。 注意事项: (1)表中所列酶均可以用无菌水配制,也可以用相应的缓冲液配制,缓冲液配制方法 参考《分子克隆实验指南(第3版)》: 蛋白酶 K缓冲液:50 mM Tris(pH 8.0),1.5 mM 乙酸钙; RNase A缓冲液:TE (pH 7.6):10 mM Tris-HCl,1 mM EDTA;溶菌酶缓冲液:10 mM Tris-HCl(pH 8.0); (2) RNase A配制好后沸水浴处理5 min,取出贮存RNase A后首次使用时也需沸水 浴处理5 min后再使用; (3)制备原生质体时使用的溶菌酶配制时需过滤除菌,其他情况一般无需过滤除菌; (4)所有酶均应在-20℃保存,使用过程中避免反复冻融,配制过程中尽量避免外界 污染。 (1)IPTG用无菌水配制,0.22μm一次性滤膜过滤除菌,分装保存于-20℃;
几种常用的消毒方法 一、普通喷雾消毒法 指用普通喷雾器喷洒消毒液进行表面消毒的处理方法,各种农用和医用喷雾器均可应用。 1.适用范围普通喷雾消毒法适用于对物体(品)表面、室内墙面和地面、室外建筑物和帐篷表面、地面、车辆外表面、装备及植被等实施消毒。 2.使用要求先从足下喷洒,开辟无害化通道至操作端点,而后按先上后下、先左后右的顺序依次喷洒。 3.注意事项 (1)喷洒有刺激性或腐蚀性消毒剂时,消毒人员应配戴防护口罩、眼镜,穿防护服。 (2)室内喷雾时,喷前将食品、衣被及其他不需消毒的物品收叠放好,或用塑料膜覆盖防湿。 (3)室外喷雾时,消毒人员应站在上风向。 二、气溶胶喷雾消毒法
指用气溶胶喷雾器喷雾消毒液进行空气或物体表面消毒的处理方法,雾粒直径20μm以下者占90%以上。由于所喷雾粒小,浮于空气中易蒸发,可兼收喷雾和熏蒸之效。喷雾时,可使用QPQ-1型喷雾器及产生直径在20μm以下雾粒的其他喷雾器。 1.适用范围适用于对室内、坑道、车辆、帐篷内空气和物体表面实施消毒。 2.使用要求消毒前关好门窗,喷雾时,按自上而下、由左向右顺序喷雾。喷雾量以消毒剂溶液可均匀覆盖在物品表面或消毒液的雾团充满空间为度。作用30~60min 后,打开门窗通风,驱除空气中残留的消毒液的雾粒及气味。 3.注意事项同普通喷雾消毒法,特别注意防止消毒剂气溶胶进入呼吸道。 三、擦拭消毒法 指用布或其他擦拭物浸以消毒剂溶液,擦拭物体表面进行消毒的处理方法。 1.适用范围适用于对家具、办公用具、生活用具、玩具、器械、车辆和装备等物体表面,以及医院和实验室环境表面实施消毒处理。
2.使用要求消毒时,用干净的布或其他物品浸消毒剂溶液,依次往复擦拭拟消毒物品表面,作用至所用消毒剂要求的时间后,再用清水擦洗,去除残留消毒剂,以减轻可能引起的腐蚀、漂白等损坏作用。 3.注意事项 (1)不耐湿物品表面不能应用该方法实施消毒处理; (2)擦拭时应防止遗漏; (3)污物可导致消毒剂有效浓度下降,因此表面污物较多时,应适时更新消毒液,防止污物中的病原体对消毒剂溶液的污染。 四、浸泡消毒法 指将待消毒物品全部浸没于消毒剂溶液内进行消毒的处理方法。 1.适用范围用于对耐湿器械、玻璃器皿、餐(饮)具、生活用具及衣物等实施消毒与灭菌。 2.使用要求对导管类物品应使管腔内同时充满消毒剂溶液。消毒或灭菌至要求的作用时间,应及时取出消毒物品用清水或无菌水清洗,去除残留消毒剂。
分子克隆技术实验讲义 黑龙江大学生命科学学院 2016年3月 甜菜M14品系BvM14-glyI基因的克隆与鉴定 一、实验目的 1、熟悉和了解目的基因克隆与鉴定的过程和方法。 2、学习和掌握质粒、T载体的特点。 3、学习和掌握TA克隆的连接体系及操作要点。 4、学习和掌握XcmⅠ酶切制备T载体的过程及方法。 5、学习和掌握CaCl2法制备大肠杆菌感受态细胞的原理和方法。 6、学习并掌握热激法转化技术的原理和操作步骤。 7、学习并掌握重组子鉴定和筛选的原理及蓝白筛选的原理和方法。 8、学习并掌握碱法小量制备质粒DNA的原理及操作步骤。 二、相关知识
(一)T载体的制备 pMD18-T Vector是一种高效克隆PCR产物(T-A Cloning)的商业化专用载体,由pΜC 18载体改建而成。在pΜC 18多克隆位点处的XbaⅠ和SalⅠ识别位点之间插入了EcoRⅤ识别位点,用EcoRⅤ进行酶切反应后,再左两侧的3′端添加“T”而成,可以大大提高PCR产物的连接、克隆效率。 相关知识点:(1)质粒的提取;(2)酶切;(3)PCR等。 (二)DNA的重组与连接(PCR产物的克隆) 把DNA片段从某一类型的载体无性繁殖到另一类型载体中,例如从某种质粒克隆到另一种质粒, 这个过程称为亚克隆。所谓重组,就是把外源目的基因“装进”载体的过程,即DNA的重新组合。为了将目的基因重组于载体分子中,需要将载体DNA和目的基因分别进行适当处理,一般采用内切酶法将载体DNA分子切割成可与外源基因连接的线性分子,使其与相同酶切过的载体分子相互连接,彼此成为配伍 末端(compatible end),以产生末端连接。现在一些生物公司也开发了针对不同插入DNA片段的专用载体,如专门用于克隆PCR产物的载体,大大方便了实验操作。 相关知识点:(1)克隆与亚克隆;(2)DNA重组;(3)内切酶;(4)粘性末端与平末端;(5)连接酶;(6)连接酶的分类及功能等。 (三)大肠杆菌感受态细胞的制备 外源基因与载体在体外连接成重组体DNA分子后,需将其导入受体细胞进行扩增和筛选,得到大 量、单一的重组体分子,这就是外源基因的无性繁殖,或称为克隆。受体细胞也叫宿主细胞,大肠杆菌 宿主菌是目前基因工程最常用的受体细胞。感受态细胞(competent cell)是经过一定方法处理后,具有 接受外源DNA能力的大肠杆菌,只有发展了感受态的细胞才能稳定地摄取外来的DNA分子。 相关知识点:(1)克隆;(2)宿主细胞的定义及分类;(3)感受态细胞定义及其功能;(4)转化定义及方法(DMSO、MnCl2、TB aq、PEG)等。 (四)重组DNA的转化及重组子的鉴定 将外源DNA分子导入某一宿主细胞的过程称为转化。把重组DNA分子导入到细菌中产生克隆有两 个目的,一是大量产生重组DNA分子,在完成连接反应后,重组DNA分子往往只有纳克级的量,不易 操作和进行下一步的分析,若把重组DNA分子导入到细菌细胞中,细菌细胞可分裂多次产生克隆,克隆 中每一个细胞都含有很多个拷贝的重组DNA分子,这样重组DNA分子的量就多了;二是对重组DNA 分子进行纯化,在构建重组DNA分子的过程中很难保证体系中不污染其他的DNA分子,连接过程完成以后体系中有多种分子存在,除了需要的重组DNA分子以外,还含有没有连接上的载体分子、没有连接 上的DNA片段、自身环化的DNA分子和连接上污染DNA片段的重组DNA分子,未连接上的载体和DNA片段对实验影响不大,因为它们即使导入细菌细胞,因为不能复制,很快就要被细菌细胞中的酶降 解掉;对克隆工作带来影响的是后两种分子,因为它们都为环状,在细菌细胞中都能复制,因而都能产 生克隆,但是每个细胞中只能导入一个质粒DNA分子,每个单克隆都是由一个细胞形成的,因此在每个
健康教育资料 家庭常用消毒知识 随着生活水平的提高,人们健康意识逐步增强,越来越多的人们开始注重家庭的消毒卫生,消毒剂也逐渐走进人们的日常生活。然而由于一些人对消毒剂的性能和危害不甚了解,在实际应用过程中,达不到真正的消毒效果,甚至出现个别人误服误用消毒剂而出现意外伤害事例的发生。因此,开展家用消毒剂的宣传教育十分必要。 一、家庭消毒原则 1、一般情况下,家庭只需要清洁卫生,无须进行消毒; 当家中出现病人时,尤其是传染病病人时,或者外人来访后,才有必要进行消毒。 2、对于一般家庭,在选择消毒方法时应尽量选用物理消毒的方法,如蒸煮、暴晒。餐具消毒宜首选煮沸消毒,或者消毒柜。衣物、被褥主要采用在阳光下曝晒的方法。室内空气消毒主要采取定期开窗通风。洗手时,如果没有接触患者,使用普通肥皂和流动水即可。 3、对经常接触的物体表面,如门把手、楼梯扶手、脚垫、水龙头等重点部位进行消毒,不要全房大面积喷洒消毒剂。 4、对于洗脸面盆和座便器,只需要对表面适量喷洒消毒,消毒后用大量自来水冲洗,否则会腐蚀管网;地漏及下水道,不
要专门加消毒剂消毒,因为对地漏或下水道消毒通常起不到消毒防病的目的,还会腐蚀管网,带来后患。 5、不要遗漏重点物品的消毒,如洗碗布,由于使用频繁,经常处于湿润状态,而且接触饭菜等有机物比较多,十分有利于细菌的滋生,因此应经常暴晒、煮沸消毒。 6.宠物的窝巢应经常进行消毒。 二、家庭用消毒剂选用原则 1、选择合适的消毒剂。根据消毒剂杀灭微生物的能力,我国把消毒剂分为灭菌剂、高水平消毒剂、中水平消毒剂和低水平消毒剂。消毒剂杀菌能力越强,相应对人体的危害也越强;一般家庭中没有病人时,也就没有很明显的致病微生物,选用中水平或低水平消毒剂就可以了,如75%酒精,0.5%碘伏等。84消毒液为高水平消毒剂,由于浓度相对较低,为家庭常用消毒剂。 2.选择安全的消毒剂。“安全”至少包括三个含义:对人体健康安全,对消毒对象安全,对环境安全。绝大多数消毒剂对人体的皮肤、眼睛、呼吸道均有程度不同的刺激性和腐蚀性,还可以引起过敏反应,甚至造成急性中毒;有些消毒剂的氧化能力很强,会使金属腐蚀、橡胶老化、织物褪色,购买时应详细阅读说明书,重点了解注意事项的内容,根据需要消毒对象的特性选择消毒剂。为安全起见,甲醛、戊二醛、漂白粉、漂白粉精、优氯净、过氧乙酸、高浓度的过氧化氢不适宜家用。 3.选择有效的消毒剂。很多消毒剂不稳定,存放一定时期后,