
第三章均相理想反应器
反应器的开发主要有两个任务:
1.优化设计—反应器选型、定尺寸、确定操作条件。
2.优化操作—根据实际操作情况,修正反应器的数学模型参
数,优化操作条件。
最根本任务—最高的经济和社会效益。
3.1 反应器设计基础
3.1.1反应器中流体的流动与混合
理想反应器的分类
对理想反应器(ideal reactor),主要讨论三种类型:
1.间歇反应器(Batch Reactor—BR);
2.平推流反应器(Plug /Piston Flow Reactor—PFR);
3.全混流反应器(Continuously Stirred Tank Reactor—CSTR)。
返混(back mixing)—不同停留时间的粒子之间的混合;
混合(mixing)—不同空间位置的粒子之间的混合。
注意:返混≠混合!
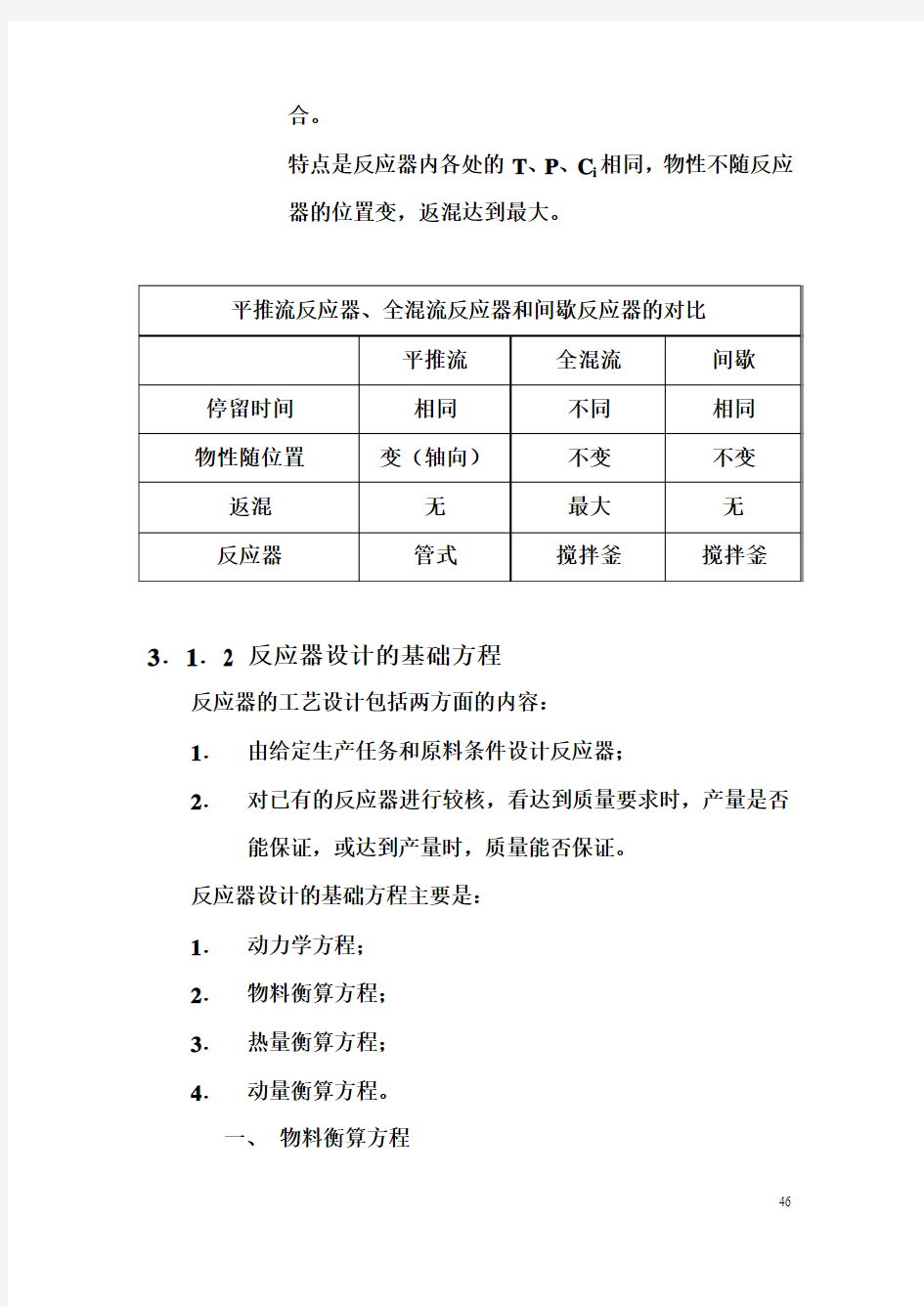
平推流—物料以均一流速向前推进。
特点是粒子在反应器中的停留时间相同,不存在返混。
T、P、C i随轴向位置变(齐头并进无返混,变化随轴
不随径)。
全混流(理想混合)—物料进入反应器后能够达到瞬间的完全混
合。
特点是反应器内各处的T、P、C i相同,物性不随反应
器的位置变,返混达到最大。
3.1.2 反应器设计的基础方程
反应器的工艺设计包括两方面的内容:
1.由给定生产任务和原料条件设计反应器;
2.对已有的反应器进行较核,看达到质量要求时,产量是否能保证,或达到产量时,质量能否保证。
反应器设计的基础方程主要是:
1.动力学方程;
2.物料衡算方程;
3.热量衡算方程;
4.动量衡算方程。
一、物料衡算方程
对反应器内选取的一个微元,在单位时间内,对物质A有:进入量=排出量+反应消耗量+积累量(3.1-1)
用符号表示:F in F out F r F b
即:F in=F out+F r+F b(3.1-2) 1.对间操作,反应过程无进料和出料,即:
F in=F out=0
则:-F r=F b(3.1-4) 反应量等于负积累量。
2.对连续稳定操作,积累量为零,即:F b=0
则F in=F out+F r(3.1-6)
二、热量衡算方程
对反应器内选定的微元,单位时间内的热量变化有:
随物料流-随物料流+与边界交+反应热=积累热量
入的热量出的热量换的热量
符号:Q in Q out Q u Q r Q b
入为正放热为正
即:Q in-Q out+Q u+Q r=Q b(3.1-8) 1.对于稳定操作的反应器,热的积累为零,即:
Q b=0
Q in-Q out+Q u+Q r=0(3.1-9) 2.对稳态操作的绝热反应器,Q u=Q b=0,即:
Q in-Q out+Q r=0(3.1-10) 反应热全部用来升高或降低物料的温度。
3.1.3 几个时间概念
一、反应持续时间t r
简称反应时间,主要用于间歇反应器,是指物料开始反应达到所要求转化率所需的时间。它不包括装料、卸料、升温、降温等非反应的辅助时间。
二、停留时间t 和平均停留时间t
停留时间又称接触时间,主要用于连续流动反应器,是指流体微元体从反应器入口流到出口经历的时间。它不是过程的自变量。
在反应器中,由于反应器的类型不同,流体流动状况不同,以及化学反应的不同,物料微元体在反应器中的停留时间是个不相同的,有一个分布,称为停留时间分布。各流体微元从反应器入口到出口所经历的平均时间称为平均停留时间。
三、空间时间τ
定义:反应器有效容积V R 与流体特征体积流率V 0之比值为空间时间。即:
R V V =
τ (3.1-11)
式中,V 0为特征体积流率,是反应器入口温度、压力和转化率为零时的体积流率。
τ是一个人为规定的参数,可作为过程的自变量,用空间时间可以方便地表示连续流动反应器的基本设计方程。此量反映了连续流动反应器的生产强度。
四、空间速度S V
定义:单位时间内投入单位有效反应器物料的标准体积为空间时间。即:
R
ON V V V S
(3.1-12)
式中,ON V 为进口流体在标准状态下的体积流率。对气体为0℃,1atm ;对液体为25℃。
注意:空间速度不一定为相应的空间时间的倒数。 对空间时间,采用进口条件下的体积流率; 对空间速度,采用标准状态下的体积流率。
对于气相催化反应,空间速度的定义稍有不同,定义为单位时间内通过单位催化剂体积(或质量)的物料标准体积流率。
例 3-1 乙醛气相常压分解,在518℃下进行
CH 3CHO=CH 4+CO
是在一直径3.3cm 长为80cm 的平推流反应器中进行的,原料气的空间速度S V =8.0h -1,达到的转化率为35%,其反应速率常数为0.33L/(mol ·s),反应速率对甲醛为2级。
求:(1)确定空间时间;
(2)确定停留时间,并将两者加以比较。
解:(1)空间时间
s
155h 043.0)
518273(273
81T T V V 1T T p p V V V V 0
N
R
N 0N
00N N
0R 0
R ==+=
=
==
τ (2)停留时间 t
dV dt R =
平推流反应器的物料衡算示意图
进入量=排出量+反应量+积累量
故 R A A A A dV )r (dF F F -++= 由于 )x 1(F F A 0A A -=
A 0A A dx F dF -=
所以 R A A
0A dV )r (dx
F -=
)r /(dx F dV A A
0A R -=
)x y 1(V V A 0A A 0δ+=
11
12=-=
δ, 1y 0A =
所以 )x 1(V V A 0+= 由式(2.2-50)得:
A A A
0A A
A 0A A x 1x C C C ε+αα-=
A
A 0A x 1)x 1(C +-=
则 2
A 2
A 2
A 2A
A )x 1/()x 1(kC
kC
r +-==- 将以上各关系式代入停留时间公式,得:
2
A 0A A A A 02
A 2A 2
A A
0A )
x 1(kC dx
)x 1()
x 1(V )
x 1()x 1(kC dx F dt -+=
++-=
A 2A A dx )
x 1()x 1(kp RT -+=
所以
A 2
A A dx )
x 1()x 1(kp
RT t -+=
?
??
??
??--+-?+?=???
?
??-+-=2)35.01ln(35.01233.01)518273(314.8)x 1ln(x 12kp RT 35
.00
A
A
=127s
停留时间127s 小于空间时间155s ,这是反应后分子数增加造成的。
3.2 等温条件下理想反应器的设计分析总之,反应器设计计算所涉及的基本方程就是:动力学、物料衡算、热量衡算和动量衡算四个方程的结合。
对等温、等压过程,一般只需动力学方程结合物料衡算方程。
一般来说,动力学方程是物料衡算方程中所必需的。
这里结合物料衡算,讨论三种比较简单的理想反应器(间歇、平推流、全混流)的计算。
3.2.1 间歇操作的完全混合反应器(Batch Reactor—BR) 间歇操作完全混合反应器是指一次全部投料,直到反应达到转化率要求后将料液全部排出。
一、适用范围:
1.液相反应、液-固反应、气-液反应;
2.产值高、批量小的产品(如医药及精细化工产品);
3.过程复杂、反应时间长的生产过程;
4.开发新产品、初期阶段还不太成熟的生产过程。
二、缺点
1.间歇操作;
2.非生产时间长;
3.产物损失大;
4.操作费用高。
三、特点
1.不稳定性。浓度随时间变;
2. 无返混。物料充分混合(C I 不随空间位置变);
3. 周期性。生产按一定的周期反复进行(加料、升温、反应、
放料、清洗等),操作周期包括反应和辅助时间; 4. 灵活性。根据生产需要,控制不同的操作条件,即用同一
设备可以生产出不同规格、不同品种的产品。 5. 小规模生产时,投资省见效快(与连续的相比)。 四、间歇反应器设计方程
由于反应体系内的物料、温度、浓度都相同,故选择整个有效容积R 'V 作为衡算体系。在单位时间内,对组分A 作物料衡算:
进入量=排出量+反应量+积累量
0 = 0+R A 'V )r (-+
dt
dn A
(3.2-1)
(或直接用式(3.1-2) F in =F out +F r +F b ) 由于 )x 1(n n A 0A A -= 所以 A
0A A
dx
n dn
-= (2.2-2)
故 dt /dx n 'V )r (A
0A R A =- (3.2-3)
分离变量积分得:
?
?-==
A
r
x 0
R
A A
0A t 0
r 'V )r (dx
n dt t (3.2-4)
恒容时(利用)x 1(C C A 0A A -=,A
0A A
dx
C dC -=)
?
?
?--=-=-=
A
A A
A
C C A A
X 0
A A
x 0
0A A A R
0A r )
r (dC
)
r (dx
C )
r (dx 'V n t (3.2-5)
对一级反应 P A → 恒容时 )x 1(kC kC
)r (A 0A A
A -==-
?
?-=-=A
A
x 0
A 0A A
0A x 0
A A
0A r )
x 1(kC dx
C )
r (dx
C t
A
x 11ln
k
1-=
或
kt
A A e C C -=
对二级反应 P A → 恒容时 ?
?
-=-=A
A
x 0
2
A 2
0A A
0A x 0
A A
0A r )
x 1(kC dx
C )r (dx
C t
)x 1(x kC 1
A A
0A -=
或
r
0A 0
A A t kC 11C C +=
对一级反应,t r 与x A 有关,与C A0无关; 对二级反应,t r 不仅与x A 有关,还与C A0有关。
五、图解积分求反应时间t r
?
?
?--=-=-=
A
A A
A
C C A A
X 0
A A
x 0
0A A A R
0A r )
r (dC
)
r (dx
C )
r (dx 'V n t
图 3-2 间歇反应器的图解计算 图 3-3 恒容情况间歇反应器的图解计算
六、设计计算过程 F A (kmol/h)—生产任务; C A0(kmol/m 3)—原料; V 0(m 3/h)—原料体积流量; x Af —产品要求;
't (h)—辅助生产时间。
求间歇反应器的体积,其步骤为: 1.由?
-=A
X 0
A A
0A r )
r (dx
C t 计算t r
2. 计算一个周期所需时间 t t
't t t r t += (3.2-6)
3. 每批料投放量 A 'F
t A A t F 'F = (3.2-7)
4. 反应器有效容积 R 'V
0A A R C /'F 'V =或t 0r 0R t V )'t t (V 'V =+= (3.2-8)
5. 反应器总体积 V R
反应器体积应包括有效容积、分离空间、辅助部件占有体积。通常有效容积占总容积体积分率为60~85%,称为反应器装填系数?,由生产实践确定。因此
?=/'V V R R (3.2-9) 七、较核计算过程(对已有反应器) (一)已知?,'t ,r ,C ,C ,V A Af 0A R
求 A F ,看是否能满足处理量或产量的要求 1. 求Af x 恒容 )x 1(C C Af 0A A -=
变容 Af
A Af 0A A x 1)x 1(C C ε+-=
2. 求t r ?-=Af
x 0
A A
0A r )
r (dx
C t
3. 求 t t
't t t r t +=
4. 求处理量F A 0A t
R A C t V F ?=
看是否满足要求
(二)已知?,'t ,r ,F ,C ,V A A 0A R 求C Af ,看出口组成是否满足要求
1.求单位时间处理得体积V 0
V 0=F A /C A0
2.求 t t
t t =V R ?/V 0
3.求 t r 't t t t r -= 5. 求 C Af 由?--=Af
A C C A A
r )
r (dC
t 求出C Af
作业:p105, 6, 7
补充:间歇操作的最优反应时间 一、使反应器平均产量最大的反应时间
目标函数:单位操作时间的产品产量最大。 求:最优反应时间。
对反应R A →,若产物的浓度为C R ,则单位操作时间的产品产量为:
't t C 'V F R R R +=
为使F R 最大,应有
0dt
dF R =(利用2
v
udv
vdu )v
u (d -=
)
即
0)
't t ()
C )'t t (dt
dC
(
'V 't t C 'V dt d dt
dF 2
R R
R R R R =+-+=??
? ??+=
则有:
'
t t C dt
dC R R
+=
(a )
取OA='t ,过A 作曲线C R
AM ,则M 点的横坐标OD 最优反应时间t *。
纵坐标MD 为最优反应时间 对应的产物浓度C *R 。
切线的斜率为:dt
dC '
t t C AD
MD R
*
*
R =
+=
正好满足(a)式。
二、使生产费用最低的反应时间
目标函数:单位生产量(产物)的总费用A t 最低,元/单位产量。 求:最优反应时间。
设:a —单位时间内反应操作费用,元/小时; a 0—辅助操作费用,元/小时;
a f —固定(设备折旧、每批原料等)费用,元。
则,单位生产量的总费用为:
R
R f
0t C 'V a 't a at A ++=
为使A t 最小,应有0dt
dA t
=
即
0dt dC 'V )a 't a at (C 'aV )C 'V (1
dt
dA R R f 0R R 2R R t
=??????++-= 则,
a
a 't a t C dt
dC f
0R R
++
=
取a
a 't a OB f
0+=
,过B 作
曲线C R 的切线BN ,则切点N
标即为所求。
B 点的横坐标OE 为最优反
应时间t *
,相应的纵坐标NE 为产物浓度*
R C 。
3.2.2 理想置换反应器(平推流(活塞流)反应器)
(Piston(Plug) Flow Reactor —PFR)
一、理想置换反应器的特性
特性:(对定常态)物料粒子齐头并进无返混,变化随轴不随径。 适用情况:管径小、流速大的管式反应器,列管固定床反应器
等。
二、等温理想置换反应器的设计方程
进入量=排出量+反应量+积累量 (3.2-17)
故 0dV )r ()dF F (F R A A A A +-++= (3.2-18) 由于 )x 1(F F A 0A A -= (3.2-19)
A 0A A dx F dF -= (3.2-20)
所以 R A A
0A dV )r (dx
F -= (3.2-21)
上式就是PFR 物料平衡方程的微分式。
积分式(3.2-21)得:
??-=
A
R
x 0
A A
A V 0
R
)
r (dx
F dV (3.2-22)
积分上式左端,并利用0R V /V =τ, 00A 0A V C F =得:
?-=
τ=
A
x 0
A A
A 0
A R )
r (dx
C F V (3.2-23)
即 ?
-==
τA
x 0
A A
0A 0R )r (dx
C V V (3.2-24)
一般地 ?
-==
τ2A 1
A x x A A
0A 0
R )
r (dx
C V V (3.2-25)
对恒容过程:)x 1(C C A 0A A -=
A 0A A
dx C dC
-=
??
-=
--==
τ1
A 2
A 2
A 1
A C C
A A
C C A A
R )
r (dC
)
r (dC
V V (3.2-26)
以上设计方程关联了四个量:R A A A A V ,F ),C (x ,r 。应注意:
1. 可根据给定的三量求另一个;
2. 具体计算时,r 要代入具体的动力学方程;
3. 动力学方程简单时,可解析积分。动力学式复杂时只能数
值或图解积分。
图 3-6 平推流反应器图解计算示意图
三、PFR 的平均停留时间
PFR 中所有流体粒子的停留时间都相等,等于其平均停留时间。 ?=
R
V 0
R
V
dv t
由式(3.2-21)得)r (dx
F dV A A
0A R -=
,又知)x 1(V V A 0ε+=
则 ?ε+-=
Af
x 0
A A A
0A V )x 1)(r (dx
F t
即 ?ε+-=Af
x 0
A A A
0A )
x 1)(r (dx
C t
对恒容体系,V=V 0 0
R V V t =
3.2.3 全混流反应器(Continuously Stirred T ank Reactor
—CSTR)
一、特性
1.返混程度最大;
2.物料参数均一,不随时间变化;
3.出口与反应器器内组成相同;
4.连续稳定流动,是一个定态过程(无时间变量)。
二、基本设计方程
进入量= 排出量+ 反应量+ 积累量(3.2-17)
F A0 = F A+ (-r A)f V R + 0
由于F A=F A0(1-x A)
所以F A0=F A0(1-x A)+ (-r A)f V R
故F A0x A=(-r A)f V R(对PFR,F A0dx A=(-r A)dV R)
f
A 1A Af f
A A 0A R )r (x x )r (X F V --=
-?=
(3.2-29)
恒容时
f A 0A Af 1A 0
A R )r (C C C F V --==
(3.2-30)
用空间时间(0A 00A 0
R C V F ,V V ==
τ)表示则 f
A 1A Af 0
A 0
R )r (x x C V V --==
τ (3.1-31)
恒容时 f
A Af
1A )r (C C --=
τ (3.2-32)
注意:CSTR 的基础设计方程是代数方程,也关联了四个量
R 0A A A A V ,F ),C (x ,r 。可根据给定的三量求另一个。
其图解计算如图3-8所示。 图3-8 全混釜反应器图解计算示意图
讨论:PFR 与CSTR 面积的不同。
第一章习题 1 化学反应式与化学计量方程有何异同?化学反应式中计量系数与化学计量方程中的计量系数有何关系? 答:化学反应式中计量系数恒为正值,化学计量方程中反应物的计量系数与化学反应式中数值相同,符号相反,对于产物二者相同。 2 何谓基元反应?基元反应的动力学方程中活化能与反应级数的含义是什么? 何谓非基元反应?非基元反应的动力学方程中活化能与反应级数含义是什么? 答:如果反应物严格按照化学反应式一步直接转化生成产物,该反应是基元反应。基元反应符合质量作用定律。基元反应的活化能指1摩尔活化分子的平均能量比普通分子的平均能量的高出值。基元反应的反应级数是该反应的反应分子数。一切不符合质量作用定律的反应都是非基元反应。非基元反应的活化能没有明确的物理意义,仅决定了反应速率对温度的敏感程度。非基元反应的反应级数是经验数值,决定了反应速率对反应物浓度的敏感程度。 3 若将反应速率写成t c r d d A A - =-,有什么条件? 答:化学反应的进行不引起物系体积的变化,即恒容。 4 为什么均相液相反应过程的动力学方程实验测定采用间歇反应器? 答:在间歇反应器中可以直接得到反应时间和反应程度的关系,而这种关系仅是动力学方程的直接积分,与反应器大小和投料量无关。 5 现有如下基元反应过程,请写出各组分生成速率与浓度之间关系。 (1)A+2B ?C A+C ? D (2)A+2B ?C B+C ?D C+D →E (3)2A+2B ?C
A+C ?D 解 (1) D 4C A 3D D 4C A 3C 22 B A 1C C 22B A 1B D 4C A 3C 22 B A 1A 22c k c c k r c k c c k c k c c k r c k c c k r c k c c k c k c c k r -=+--=+-=+-+-= (2) E 6D C 5D 4C B 3D E 6D C 5D 4C B 3C 22 B A 1C D 4C B 3C 22 B A 1B C 22B A 1A 22c k c c k c k c c k r c k c c k c k c c k c k c c k r c k c c k c k c c k r c k c c k r +--=+-+--=+-+-=+-= (3) D 4C A 3D D 4C A 3C 22B 2A 1C C 22B 2A 1B D 4C A 3C 22B 2A 1A 2222c k c c k r c k c c k c k c c k r c k c c k r c k c c k c k c c k r -=+--=+-=+-+-= 6 气相基元反应A+2B →2P 在30℃和常压下的反应速率常数k c =2.65× 104m 6kmol -2s -1。现以气相分压来表示速率方程,即(?r A )=k P p A p B 2 ,求k P =?(假定气体为理想气体) 解 () 3 -1-363 111 2643c P 2 B A p A 2 B A c 2 B A c A 1264c kPa s m kmol 10655.1K 303K kmol kJ 314.8s kmol m 1065.2)(s kmol m 1065.2K 30330273--------??=???= ==-? ? ? ??==-= ?==+=RT k k p p k r RT p RT p k c c k r RT p c k T
化学反应工程知识点 —郭锴主编 1、化学反应工程学不仅研究化学反应速率与反应条件之间的关系,即化学反应动力学,而且着重研究传递过程对宏观化学反应速率的影响,研究不同类型反应器的特点及其与化学反应结果之间的关系。 2、任何化工生产,从原料到产品都可以概括为原料的预处理、化学反应过程和产物的后处理这三个部分,而化学反应过程是整个化工生产的核心。 3.化学反应工程的基本研究方法是数学模型法。数学模型法是对复杂的、难以用数学全面描述的客观实体,人为地做某些假定,设想出一个简化模型,并通过对简化模型的数学求解,达到利用简单数学方程描述复杂物理过程的目的。模型必须具有等效性,而且要与被描述的实体的那一方面的特性相似;模型必须进行合理简化,简化模型既要反映客观实体,又有便于数学求解和使用。 4.反应器按型式来分类可以分为管式反应器、槽式反应器(釜式反应器)和塔式反应器。 5反应器按传热条件分类,分为等温反应器、绝热反应器和非等温非绝热反应器。 第一章 均相单一反应动力学和理想反应器 1、目前普遍使用关键组分A 的转化率来描述一个化学反应进行的程度,其定义为:0 0A A A A A A n n n x -==组分的起始量组分量转化了的 2、化学反应速率定义(严格定义)为单位反应体系内反应程度随时
间的变化率。其数学表达式为dt d V r ξ1=。 3、对于反应D C B A 432+=+,反应物A 的消耗速率表达式为dt dn V r A A 1-=-;反应产物C 的生成速率表达式为:dt dn V r C C 1= 4.反应动力学方程:定量描述反应速率与影响反应速率之间的关系式称为反应动力学方程。大量的实验表明,均相反应的速率是反应物系的组成、温度和压力的函数。 5.阿累尼乌斯关系式为RT E C C e k k -=0,其中活化能反应了反应速率对温 度变化的敏感程度。 6、半衰期:是指转化率从0变为50%所需时间为该反应的半衰期。 7、反应器的开发大致有下述三个任务:①根据化学反应动力学特性来选择合适的反应器型式;②结合动力学和反应器两方面特性来确定操作方式和优化操条件;③根据给定的产量对反应装置进行设计计算,确定反应器的几何尺寸并进行评价。 8.在停留时间相同的物料之间的均匀化过程,称之为简单混合。而停留时间不同的物料之间的均匀化过程,称之为返混。 9.根据返混情况不同反应器被分为以下类型:间歇反应器、理想置换反应器(又称平推流反应器或活塞流反应器)、全混流反应器(又称为连续操作的充分搅拌槽式反应器)。 10.反应器设计计算所涉及的基础方程式就是动力学方程式、物料衡算方程式和热量衡算方程式,其中物料衡算所针对的具体体系称为体积元。 11、停留时间又称接触时间,用于连续流动反应器,指流体微元从反
第三章 理想流动均相反应器设计题解 1、[间歇反应器与全混釜恒容一级] 有一等温操作的间歇反应器进行某一级液相反应,13分钟后,反应物转化了70%.今拟将此反应转至全混流反应器,按达到相同的转化率应保持多大的空速? 解:㏑CA 0CA =kt, CA0CA CA0 - =0.7 , C A =0.3C A0 间歇釜中∴㏑0.3=-13k , k=0.0926 min -1 在全混釜中τ=VR V0=CA0 XA k CA =0.70.30.0926?=25.2 min -1 ∴空速S=1τ=125.2=0.0397min -1 2、[平推流恒容一级] 有一个活塞流管式反应器于555K,0.3MPa 压力下进行A →P 气相反应,已知进料中含30%A(mol),其余70%为惰性物料.加料流量为6.3mol/s.该反应的动力学方程为r A =0.27C A mol/m 3 ·s,要求达到95%转化.试求⑴所需的空时? ⑵反应器容积? 解: τP =VR V0=1k ㏑CA 0CA =1 k ㏑PA0PA =1k ㏑ A0 A y y =1k ㏑1 1A x -=10.27㏑110.95-=11.1 S ∴V R =τP ·v 0=τP 00 A A F C 而C A0= A P RT =30.30.082555??=0.0198mol/L=19.8mol/m 3 V R =11.1s × 3 6.3/19.8/mol s mol m =3.53m 3 3、[平推流变容过程一级] 有一纯丙烷裂解反应方程式为C 3H 8→C 2H 4+CH 4.该反应在772℃等温条件下进行,其动力学 方程式为-dP A /dt=kP A ,忽略存在的副反应,并已知k=0.4h -1 反应过程保持恒压0.1MPa. 772℃和0.1MPa 下的体积进料量为800L/h,求转化率为0.5时所需的平推流反应器的体积. 解: ∵εA =21 2-=0.5 ∵k τP =-(1+εA )㏑(1-ΧA )- εA ΧAf 0.4τP =-(1+0.5)㏑(1-0.5)-0.5×0.5 ∴τP =1.5ln 20.25 0.4-=1.974h V R =τP v 0=1.974×800=1579L=1.579 m 3 4、[间歇釜变容一级] 一级气相反应A →2R+S ,在等温等压间歇实验反应器中进行,原料中含75%A(mol),25%(mol)惰性气体,经8分钟后,其体积增加一倍.求此时达到了多大的转化率? 速率常数多大? 解: 膨胀因子 δA =3-11=2 膨胀率 εA =y A0δA =0.75×2=1.5
第三章 理想流动反应器 概述 按照操作方式,可以分为间歇过程和连续过程,相应的反应器为间歇反应器和流动反应器。 对于间歇反应器,物料一次性加入,反应一定时间后把产物一次性取出,反应是分批进行的。物料在反应器内的流动状况是相同的,经历的反应时间也是相同的。 对于流动反应器,物料不断地加入反应器,又不断地离开反应器。 考察物料在反应器内的流动状况。有的物料正常的通过反应器,有的物料进入反应器的死角,有的物料短路(即近路)通过反应器,有的物料在反应器内回流。 在流动反应器中物料的流动状况不相同,造成物料浓度不均匀,经历的反应时间不相同,直接影响反应结果。 物料在反应器内的流动状况看不见摸不着。人们采用流动模型来描述物料在反应器内的流动状况。流动模型分类如下: 理想流动模型 流动模型 非理想流动模型 特别强调的是,对于流动反应器,必须考虑物料在反应器内的流动状况;流动模型是专指反应器而言的。 第一节 流动模型概述 3-1 反应器中流体的流动模型 平推流模型 全混流模型
一、物料质点、年龄、奉命及其返混 1.物料质点 物料质点是指代表物料特性的微元或微团。物料由无数个质点组成。 2.物料质点的年龄和寿命 年龄是对反应器内质点而言,指从进入反应器开始到某一时刻,称为年龄。 寿命是对离开反应器的质点而言,指从进入反应器开始到离开反应器的时间。 3.返混 (1)返混指流动反应器内不同年龄质点间的混合。 在间歇反应器中,物料同时进入反应器,质点的年龄都相同,所以没有返混。 在流动反应器中,存在死角、短路和回流等工程因素,不同年具的质点混合在一起,所以有返混。 (2)返混的原因 a.机械搅拌引起物料质点的运动方向和主体流动方向相反,不 同年龄的质点混合在一起; b.反应器结构造成物料流速不均匀,例如死角、分布器等。 造成返混的各种因素统称为工程因素。在流动反应器中,不可避免的存在工程因素,而且带有随机性,所以在流动反应器中都存在着返混,只是返混程度有所不同而已。
1.过程工业包括哪些过程? 2.什么是化工产品生产的关键过程。 3.化工过程可以同时发生在很宽的时间尺度和空间尺度上,都有哪些尺度? 4.什么是数学模型? 5.按照反应的可逆性,化学反应分为哪些类型? 6.按照反应的热效应,化学反应分为哪些类型? 7.按照压力的操作条件,反应过程分为哪些类型? 8.按照操作方法,反应过程分为哪些类型? 9.根据操作方法的不同,工业反应器可分为哪些类型? 10.釜式反应器和槽式反应器的区别是什么? 11.什么是停留时间分布? 12.什么是寿命分布? 13.什么是年龄分布? 14.什么是流动模型? 15.什么是流动的数学模型? 16.理想流动模型进行的两种极限情况是哪些? 17.平推流模型的特点有哪些? 18.全混流模型的特点有哪些? 19.化学反应过程主要包括哪两方面的内容? 20.按照是否使用催化剂,化学反应分为哪些类型? 21.按照反应物系相态分类,化学反应分为哪些类型? 22.什么是转化率? 23.什么是化学膨胀因子? 24.什么是同时反应? 25.什么是平行反应? 26.什么是连串反应? 27.什么是收率? 28.什么是选择率? 29.选择率,收率和转化率之间的关系是? 30.什么是间歇系统的反应速率? 31.什么是空间速度?空间速度和接触时间什么关系? 32.什么是液空速? 33.什么是湿空速? 34.什么是干空速? 35.提问:已知NA0,XA,CA0,VS0,τ0,试建立rA和XA,CA0,τ0之间的关系式。 36.化学计量式的左边,右边及等号各代表什么含义? 37.写出反应速率常数,并指出各字母代表的含义。 38.体积反应速率常数,表面反应速率常数和质量反应速率常数之间存在怎样的关系? 39.反应速率从常数和温度之间存在怎样的关系? 40.对于不可逆的单一反应,温度对其有怎样的影响? 41.对于不可逆的单一反应,为了获得较大的反应速率,在实际生产中还应考虑哪些问题? 42.对于可逆吸热的单一反应,温度对其有怎样的影响? 43.对于平行反应,反应物A1的消耗速率和产物A3,A4生成速率之间的关系是什么?
3 釜式反应器 3.1在等温间歇反应器中进行乙酸乙酯皂化反应: 325325+→+CH COOC H NaOH CH COONa C H OH 该反应对乙酸乙酯及氢氧化钠均为一级。反应开始时乙酸乙酯及氢氧化钠的浓度均为0.02mol/l ,反应速率常数等于5.6l/mol.min 。要求最终转化率达到95%。试问: (1) (1) 当反应器的反应体积为1m 3时,需要多长的反应时间? (2) (2) 若反应器的反应体积为2m 3,,所需的反应时间又是多少? 解:(1)002220 00001()(1)110.95169.6min(2.83) 5.60.0210.95 ===?---= ?=?-??Af Af X X A A A A A A A A A A A dX dX X t C C R k C X kC X h (2) 因为间歇反应器的反应时间与反应器的大小无关,所以反应时间仍为2.83h 。 3.2拟在等温间歇反应器中进行氯乙醇的皂化反应: 223222+→++CH ClCH OH NaHCO CH OHCH OH NaCl CO 以生产乙二醇,产量为20㎏/h ,使用15%(重量)的NaHCO 3水溶液及30%(重量)的氯乙醇水溶液作原料,反应器装料中氯乙醇和碳酸氢钠的摩尔比为1:1,混合液的比重为1.02。该反应对氯乙醇和碳酸氢钠均为一级,在反应温度下反应速率常数等于5.2l/mol.h ,要求转化率达到95%。 (1) (1) 若辅助时间为0.5h ,试计算反应器的有效体积; (2) (2) 若装填系数取0.75,试计算反应器的实际体积。 解:氯乙醇,碳酸氢钠,和乙二醇的分子量分别为80.5,84 和 62kg/kmol,每小时产乙二醇:20/62=0.3226 kmol/h 每小时需氯乙醇:0.326680.5 91.11/0.9530%?=?kg h 每小时需碳酸氢钠:0.326684 190.2/0.9515%?=?kg h 原料体积流量: 091.11190.2 275.8/1.02+= =Q l h 氯乙醇初始浓度:00.32661000 1.231/0.95275.8?==?A C mol l 反应时间: 02000110.95 2.968(1) 5.2 1.23110.95===?=-?-??Af Af X X A A A A B A A dX dX t C h kC C kC X 反应体积:0(')275.8(2.9680.5)956.5=+=?+=r V Q t t l
3 釜式反应器 3、1在等温间歇反应器中进行乙酸乙酯皂化反应: 325325+→+CH COOC H NaOH CH COONa C H OH 该反应对乙酸乙酯及氢氧化钠均为一级。反应开始时乙酸乙酯及氢氧化钠的浓度均为0、02mol/l,反应速率常数等于5、6l/mol 、min 。要求最终转化率达到95%。试问: (1) (1) 当反应器的反应体积为1m 3时,需要多长的反应时间? (2) (2) 若反应器的反应体积为2m 3,,所需的反应时间又就是多少? 解:(1)002220 00001()(1)110.95 169.6min(2.83)5.60.0210.95 ===?---=?=?-? ?Af Af X X A A A A A A A A A A A dX dX X t C C R k C X kC X h (2) 因为间歇反应器的反应时间与反应器的大小无关,所以反应时间仍为2、83h 。 3、2拟在等温间歇反应器中进行氯乙醇的皂化反应: 223222+→++CH ClCH OH NaHCO CH OHCH OH NaCl CO 以生产乙二醇,产量为20㎏/h,使用15%(重量)的NaHCO 3水溶液及30%(重量)的氯乙醇水溶液作原料,反应器装料中氯乙醇与碳酸氢钠的摩尔比为1:1,混合液的比重为1、02。该反应对氯乙醇与碳酸氢钠均为一级,在反应温度下反应速率常数等于5、2l/mol 、h,要求转化率达到95%。 (1) (1) 若辅助时间为0、5h,试计算反应器的有效体积; (2) (2) 若装填系数取0、75,试计算反应器的实际体积。 解:氯乙醇,碳酸氢钠,与乙二醇的分子量分别为80、5,84 与 62kg/kmol,每小时产乙二醇:20/62=0、3226 kmol/h 每小时需氯乙醇:0.326680.5 91.11/0.9530%?=?kg h 每小时需碳酸氢钠:0.326684 190.2/0.9515%?=?kg h 原料体积流量:091.11190.2275.8/1.02+==Q l h 氯乙醇初始浓度:00.32661000 1.231/0.95275.8?==?A C mol l 反应时间: 02000110.95 2.968(1) 5.2 1.23110.95===?=-?-??Af Af X X A A A A B A A dX dX t C h kC C kC X 反应体积:0(')275.8(2.9680.5)956.5=+=?+=r V Q t t l (2) (2) 反应器的实际体积: 956.512750.75= ==r V V l f
2010级第一章习题参考答案 1-1 在银催化剂上进行甲醇氧化为甲醛的反应:进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。试计算:(1)反应的选择性;(2)反应器出口气体的组成 解一:(1)由(1-17)式得反应的选择性为: 0.629 Y S0.961196.11% X0.720 ==== (2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),当进入反应器的总原料量为 设甲醇的转化率为 A P 醛和二氧化碳的摩尔数n A 、n P 和n c 分别为: n A=n A0(1-X A)=7.672 mol n P=n A0Y P=18.96 mol n C=n A0(X A-Y P)=0.7672 mol 结合上述反应的化学计量式,水(n W )、氧气(n O )和氮气(n N )的摩尔数分别为: n W=n W0+n P+2n C=38.30 mol n O=n O0-1/2n P-3/2n C=0.8788 mol n N=n N0=43.28 mol 解二:(1)根据定义:目的产物收率 L A Y= A 消耗于主产物上的关键组分的量进入反应系统的的初始量 目的产物选择率 L A S= A 消耗于主产物上的关键组分的量转化了的关键组分的量 反应物的转化率 A A A x 转化了的关键组分的量= 进入反应系统的的初始量 转化率、收率和选择率的关系Y=S A x 已知:x CH3OH = 72% Y HCHO = 69.2% 则 % 11 . 96 % 72 % 2. 69 3 = = = OH CH HCHO x Y S
第一章 绪论 1. 化学反应工程是一门研究______________的科学。(化学反应的工程问题) 2. 化学反应工程是一门研究化学反应的工程问题的科学,既以_______作为研究对象,又以_______为研究对象的学科体系。(化学反应、工程问题) 3. _______是化学反应工程的基础。( 三传一反) 4. 化学反应过程按操作方法分为_______、_______、_______操作。(分批式操作、连续式操作、半分批式) 5. 化学反应工程中的“三传一反”中的三传是指_______、_______、_______。(传质、传热、动量传递) 6. 不论是设计、放大或控制,都需要对研究对象作出定量的描述,也就要用数学式来表达个参数间的关系,简称_______。(数学模型) 7. 在建立数学模型时,根据基础资料建立物料、热量和动量衡算式的一般式为_______。(累积量=输入量-输出量) 第二章 均相反应动力学 1. 均相反应是指_。(参与反应的物质均处于同一相) 2. aA + bB pP + sS 对于反应,则=P r _______)(A r -。(a p ) 3.着眼反应组分K 的转化率的定义式为_______。( 00 K K K K n n n -=χ) 4.当计量方程中计量系数的代数和等于零时,这种反应称为_______,否则称为_______。(等分子反应、非等分子反应) 5. 化学反应速率式为βαB A C A C C K r =-,用浓度表示的速率常数为C K ,假定符合理想气体状态方程,如用压力表示的速率常数P K ,则C K =_______P K 。()()(βα+RT ) 6. 化学反应的总级数为n ,如用浓度表示的速率常数为C K ,用逸度表示的速率常数f K ,则 C K =_______f K 。(n RT )() 7. 化学反应的总级数为n ,如用浓度表示的速率常数为C K ,用气体摩尔分率表示的速率常数y K ,则 C K =_______y K 。(n p RT ???? ??) 10. 活化能的大小直接反映了______________对温度的敏感程度。(反应速率) 12.生成主产物的反应称为_______,其它的均为_______。(主反应、副反应) 13. 平行反应A P(主) S(副)均为一级不可逆反应,若主E >副E ,选择性S p 与_______无关,仅是_______
解:01A A A x c kt x = - 把数据代入得100.2m in A c k -= 当x A =0.75时解得t=15min 所以,增加的时间为15-5=10min 3-2 解:() ()11 0111n n A A x n c kt ---=+- (式A ) 把x A =0.75和t=10min 代入解得1 0.1n A c k -= 再把t=30min 代入(式A )解得x A =1.25 所以,转化率应为1 3-3 解:设反应动力学方程为:n A A dc kc dt -= 则()()11 0111n n A A x n c kt ---=+-,且c A0=1 因此有 ()()() ()1110.811810.91118 n n n k n k ---=+--=+- 解得:n=2;k=0.5L/mo l ·min -1 3-4 1)计算进料中酸、醇和水的摩尔浓度c A0、c B0、c S0(注意进料中水的浓度c S0不为0)。 2)列出当酸的转化率为x A 时,各组分浓度的表示式: ()0000001A A A B B A A R A A S S A A c c x c c c x c c x c c c x =-=-==+ 3)将上列各式及各组分初浓度代入反应速率式,整理得 ()6 2 7.9310 10.220.1 2.58A A A dx x x dt -=-?-+ 4)计算转化率达35%所需的时间为 () 0.356 20 7.9310 10.220.1 2.58A A A dx t x x -= ?-+? 上述积分可查积分表用公式计算,也可用MA TLAB 语言的quad 解算子计算,结果为 71532t s h =≈ 5)计算所需反应器体积。先计算每天的反应批数,再计算每m 3反应体积每天的生产量,然后再计算达到要求产量所需反应器体积。答案为 V R =51.9m 3
化学反应工程复习题 一.选择题 1.可逆放热反应,在转化率一定时,反应速率随温度升高而( ) A.降低B.升高C.A、B均可能D.同可逆吸热反应 2.可逆吸热反应,在转化率一定时,反应速率随温度升高而( ) A.降低B.升高C.A、B均可能D.同可逆吸热反应 3.不可逆反应,在转化率一定时,反应速率随温度升高而( ) A.降低B.升高C.A、B均可能D.同可逆吸热反应 4.当瞬时选择性随关键组分转化率增大而单调增加时, 收率顺序: A、间歇釜<多个连续釜串联<单一连续釜 B、多个连续釜串联>间歇釜>单一连续釜 C、间歇釜>单一连续釜>多个连续釜串联 D、间歇釜>多个连续釜串联>单一连续釜5.当瞬时选择性随关键组分转化率增大而单调下降时, 收率顺序: A、间歇釜<多个连续釜串联<单一连续釜 B、多个连续釜串联>间歇釜>单一连续釜 C、间歇釜>单一连续釜>多个连续釜串联 D、间歇釜>多个连续釜串联>单一连续釜 6、正常动力学,转化速率-RA随XA增加而降低。 A、多釜串联比单釜有利,总反应体积小于单釜体积。 B、多釜串联比单釜有利,总反应体积大于单釜体积。 C、单釜比多釜串联有利,单釜的反应体积小于串联釜的总体积。 D、单釜比多釜串联有利,单釜的反应体积小于串联釜的总体积。 7、反常动力学,转化速率-RA随XA增加而增加。 A、多釜串联比单釜有利,总反应体积小于单釜体积。 B、多釜串联比单釜有利,总反应体积大于单釜体积。 C、单釜比多釜串联有利,单釜的反应体积小于串联釜的总体积。 D、单釜比多釜串联有利,单釜的反应体积大于串联釜的总体积。 8、下列叙述正确的是() A、对于可逆吸热反应,反应速率随XA的变化升高而升高 B、对于可逆放热反应,反应速率随XA的变化升高而升高 C、对于可逆吸热反应,存在最佳温度Top D、对于可逆放热反应,存在最佳温度Top 9、下列叙述正确的是() A、对于可逆吸热反应(温度一定),反应速率随XA的变化升高而降低 B、对于可逆放热反应(温度一定) ,反应速率随XA的变化升高而升高 C、对于可逆吸热反应,存在最佳温度Top D、对于可逆放热反应,不存在最佳温度Top 1. 化学反应工程中的“三传一反”中的三传是指传质 2. 一级连串反应,在平推流反应器中,为提高目的产物的收率,应k2/k1。(增高或降低)。 3. 停留时间分布的两个函数间的关系是停留时间在0~∞间的物料占总物料的分率应为。 4. 对于循环操作的平推流反应器,当循环比0时为反应器,而当∞时则相当于反应器。 5. 若一级反应的反应速率rA采用kmol/(m3·s)为单位,浓度采用kmol/m3为单位,则k 的单位为,若反应速率以kmol/(kg·s)表示,则k的单位为 6. 如果将管式反应器出口的产物部分返回到入口处与原始物料混合,这类反应器为
华东版 3-1 解:01A A A x c kt x = - 把数据代入得1 00.2min A c k -= 当x A =0.75时解得t=15min 所以,增加的时间为15-5=10min 3-2 解:() ()11 0111n n A A x n c kt ---=+- (式A ) 把x A =0.75和t=10min 代入解得1 00.1n A c k -= 再把t=30min 代入(式A )解得x A =1.25 所以,转化率应为1 3-3 解:设反应动力学方程为:n A A dc kc dt -= 则() ()11 0111n n A A x n c kt ---=+-,且c A0=1 因此有()()()()1110.8118 10.91118 n n n k n k ---=+--=+- 解得:n=2;k=0.5L/mo l ·min -1 3-4 1)计算进料中酸、醇和水的摩尔浓度c A0、c B0、c S0(注意进料中水的浓度c S0不为0)。 2)列出当酸的转化率为x A 时,各组分浓度的表示式: ()0000001A A A B B A A R A A S S A A c c x c c c x c c x c c c x =-=-==+ 3)将上列各式及各组分初浓度代入反应速率式,整理得 ()62 7.931010.220.1 2.58A A A dx x x dt -=-?-+ 4)计算转化率达35%所需的时间为 () 0.35 62 7.931010.220.1 2.58A A A dx t x x -=?-+? 上述积分可查积分表用公式计算,也可用MA TLAB 语言的quad 解算子计算,结果为 71532t s h =≈ 5)计算所需反应器体积。先计算每天的反应批数,再计算每m 3反应体积每天的生产量,然
1、分批式操作的完全混合反应器非生产性时间t0不包括下列哪一项( ) A. 加料时间 B. 反应时间 C. 物料冷却时间 D. 清洗釜所用时间 2、在间歇反应器中进行等温二级反应A →B,当 s l mol C r A A ? = -/ 01 .02 时,求反应至所需时间t为多少秒. A. 8500 B. 8900 C. 9000 D. 9900 3、在全混流反应器中,反应器的有效容积与进料流体的容积流速之比为。 A. 空时τ B. 反应时间t C. 停留时间t D. 平均停留时间 4、空间时间的定义是() A 停留时间与非生产时间的和 B 实际反应时间与真实停留时间的和 C 反应器有效容积与入口体积流率的比值 D 反应物微元在反应器内经历的时间 5、返混的定义是() A 不同空间位置的粒子的混合 B 不同停留时间的粒子的混合 C 参与不同反应的粒子的混合 D 不同反应器内粒子的混合 6、反应器的类型不同,则( )也将有不同。 A.反应动力学B.传递特性 C.反应的相态D.反应的可逆性 7、平推流反应器中诸参数不随()而变 A 反应物的组成 B 反应器的轴向位置 C 反应器的空间时间D反应器的径向位置 8、等温一级不可逆液相反应,采用下列三种方案进行: (1)一个间歇反应釜,容积V1(仅考虑反应时间所需), (2)一个平推流反应器,容积V2, (3)二个等体积全混流反应器串联,总容积为V3。 上述三种情况反应温度、物料处理量及转化率均相同,则容积比较为( ) A.V1
《化学反应工程原理》复习思考题 第一章绪论 1、了解化学反应工程的研究内容和研究方法。 2、几个常用指标的定义及计算:转化率、选择性、收率。 第二章化学反应动力学 1、化学反应速率的工程表示,气固相催化反应及气液相非均相反应反应区的取法。 2、反应速率常数的单位及其换算。 3、复杂反应的反应速率表达式(可逆、平行、连串、自催化)。 4、气固相催化反应的步骤及基本特征。 5、物理吸附与化学吸附的特点。 6、理想吸附等温方程的导出及应用(单组分吸附、解离吸附、混合吸附)。 7、气固相催化反应动力学方程的推导步骤。 8、不同控制步骤的理想吸附模型的动力学方程的推导。 9、由已知的动力学方程推测反应机理。 第三章理想间歇反应器与典型化学反应的基本特征 1、反应器设计的基本方程式。 2、理想间歇反应器的特点。 3、理想间歇反应器等温、等容一级、二级反应反应时间的计算及反应器体积的计算。 4、自催化反应的特点及最佳工艺条件的确定及最佳反应器形式的选择。 5、理想间歇反应器最优反应时间的计算. 7、可逆反应的反应速率,分析其浓度效应及温度效应。 8、平行反应选择率的浓度效应及温度效应分析。 9、平行反应反应器形式和操作方式的选择。 10、串连反应反应物及产物的浓度分布,t opt C p.max的计算。 11、串连反应的温度效应及浓度效应分析。 第四章理想管式反应器
1、理想管式反应器的特点。 2、理想管式反应器内进行一级、二级等容、变容反应的计算。 3、空时、空速、停留时间的概念及计算。 4、膨胀率、膨胀因子的定义,变分子数反应过程反应器的计算。 第五章理想连续流动釜式反应器 1、全混流反应器的特点。 2、全混流反应器的基础方程及应用。 3、全混釜中进行零级、一级、二级等温、等容反应时的解析法计算。 4、全混釜的图解计算原理及图解示意。 5、全混流反应器中的浓度分布与返混,返混对反应的影响。 6、返混产生的原因及限制返混的措施。 7、多釜串联反应器进行一级、二级不可逆反应的解析法计算。 8、多釜串联反应器的图解法计算原理。 第七章化学反应过程的优化 1、简单反应过程平推流反应器与全混流反应器的比较及反应器形式的选择。 2、多釜串连反应器串连段数的选择分析。 3、自催化反应反应器的选型分析。 4、可逆放热反应速率随温度的变化规律,平衡温度和最优温度的概念。 5、平行反应选择率的温度效应及浓度效应分析,反应器的选型,操作方式的确定。 6、串连反应影响选择率和收率的因素分析,反应器的选型及操作方式的确定。 7、平推流与全混釜的组合方式及其计算。 第八章气固相催化反应过程的传递现象 1、气固相催化反应的全过程及特点。 2、等温条件下催化剂颗粒的外部效率因子的定义。 3、外扩散、内扩散对平行反应、连串反应选择性的影响分析。 4、气体流速对外扩散的影响分析。 5、等温条件下催化剂颗粒的内部效率因子的定义。
第一章 1. 化学反应工程是一门研究 (化学反应个工程问题)的科学。 2. 所谓数学模型是指 (用数学方法表达各变量间的关系)。 3. 化学反应器的数学模型包括 (动力学方程式、 物料横算式子、 热量衡算式、 动量衡算式 和 参数计算式) 4. 所谓控制体积是指 (能把反应速率视作定值的最大空间范围)。 5. 模型参数随空间而变化的数学模型称为 ( 分布参数模型)。 6. 模型参数随时间而变化的数学模型称为 (非定态模型)。 7. 建立物料、热量和动量衡算方程的一般式为 (累积量=输入量-输出量)。 第二章 1. 均相反应是指 (在均一的液相或气相中进行的反应)。 2. 对于反应aA + bB → pP + sS ,则r P =( p/a )r A 。 3.着眼反应物A 的转化率的定义式为(转化率Xa=转化了的物料A 的量/反应开始的物料A 的量)。 4. 产物P 的收率ΦP 与得率ХP 和转化率x A 间的关系为( Xp/Xa )。 5. 化学反应速率式为r A =k C C A αC B β,用浓度表示的速率常数为k C ,假定符合理想气体状态方 程,如用压力表示的速率常数k P ,则k C =[ (RT)的a+B 次方]k P 。 6.对反应aA + bB → pP + sS 的膨胀因子的定义式为 (P+S )-(A+B))/A 。 7.膨胀率的物理意义为 (反应物A 全部转化后系统的体积变化率)。 8. 活化能的大小直接反映了 (反应速率) 对温度变化的敏感程度。 9. 反应级数的大小直接反映了(反应速率) 对浓度变化的敏感程度。 10.对复合反应,生成主产物的反应称为 (主反应),其它的均为(副反应)。 11. 平行反应A → P 、A → S 均为一级不可逆反应,若E 1>E 2,选择性S p 与 (A 的浓度) 无关,仅是 (A 的浓度) 的函数。 12. 如果平行反应A → P 、A → S 均为一级不可逆反应,若E 1>E 2,提高选择性S P 应(提到 温度)。 13. 一级连串反应A → P → S 在平推流反应器中,为提高目的产物P 的收率,应(降 低)k 2/k 1。 14. 产物P 的收率的定义式为 (生成的全部P 的物质的量/反应掉的全部A 的物质的量) 15. 产物P 的瞬时收率φP 的定义式为(生成的物质的量/反应的A 的物质的量) 16. 产物P 的选择性S P 的定义式为(单位时间内产物P 的物质的量/单位时间内生成产物S 的物质的量) 17. 由A 和B 进行均相二级不可逆反应αA A+αB B = αS S ,速率方程为: r A =-dC A /dt=kC A C b 。 求: (1)当C A0/C B0=αA /αB 时的积分式 (2)当C A0/C B0=λ≠αA /αB 时的积分式 18. 反应A → B 为n 级不可逆反应。已知在300K 时要使A 的转化率达到20%需,而在340K 时达到同样的转化率仅需,求该反应的活化能E 。 第三章 1. 理想反应器是指(理想混合反应器 平推流反应器)。 2. 全混流反应器的空时τ是 (反应器容积) 与(进料的体积流量)之比。 3. 全混流反应器的放热速率Q G ={ 00()A A Hr Ft y x ? }。 4. 全混流反应器的移热速率Q r ={ 012()pm Ft C T T - } 5. 全混流反应器的定常态操作点的判据为{ G r Q Q = }。 6. 全混流反应器处于热稳定的定常态操作点的判据为{ G r Q Q = G r dQ dQ dT dT > }。
第一章 1.1在银催化剂上进行甲醇氧化为甲醛的反应: 3222CH OH O 2HCHO 2H O +→+ 32222CH OH 3O 2CO 4H O +→+ 进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。试计算 (1) (1) 反应的选择性; (2) (2) 反应器出口气体的组成。 解:(1)由(1.7)式得反应的选择性为: 0.629Y S 0.961196.11% X 0.720==== (2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比), A P 出口甲醇、甲醛和二氧化碳的摩尔数n A 、n P 和n c 分别为: n A =n A0(1-X A )=7.672 mol n P =n A0Y P =18.96 mol n C =n A0(X A -Y P )=0.7672 mol 结合上述反应的化学计量式,水(n W )、氧气(n O )和氮气(n N )的摩尔数分别为: n W =n W0+n P +2n C =38.30 mol n O =n O0-1/2n P -3/2n C =0.8788 mol n N =n N0=43.28 mol
1. 1. 2工业上采用铜锌铝催化剂由一氧化碳和氢合成甲醇,其主副反应如下: 23CO 2H CH OH +? 23222CO 4H (CH )O H O +?+ 242CO 3H CH H O +?+ 24924CO 8H C H OH 3H O +?+ 222CO H O CO H +?+ 由于化学平衡的限制,反应过程中一氧化碳不可能全部转化成甲醇,为了提高原料的利用率,生产上采用循环操作,即将反应后的气体冷却,可凝组份变为液体即为粗甲醇,不凝组份如氢气及一氧化碳等部分放空,大部分经循环压缩 Bkg/h 粗甲醇100kmol 放空气体 原料气和冷凝分离后的气体组成如下:(mol ) 组分 原料气 冷凝分离后的气体 CO 26.82 15.49 H 2 68.25 69.78 CO 2 1.46 0.82 CH 4 0.55 3.62 N 2 2.92 10.29 粗甲醇的组成为CH 3OH 89.15%,(CH 3)2O 3.55%,C 3H 9OH 1.10%,H 2O 6.20%,均为重量百分率。在操作压力及温度下,其余组分均为不凝组分,但在冷凝冷却过程中可部分溶解于粗甲醇中,对1kg 粗甲醇而言,其溶解量为CO 2 9.82g,CO 9.38g,H 2 1.76g,CH 4 2.14g,N 25.38g 。若循环气与原料气之比为7.2(摩尔比),试计算: (1) (1) 一氧化碳的单程转换率和全程转化率; (2) (2) 甲醇的单程收率和全程收率。 解:(1)设新鲜原料气进料流量为100kmol/h ,则根据已知条件,计算进料原料
3 釜式反应器 在等温间歇反应器中进行乙酸乙酯皂化反应: 该反应对乙酸乙酯及氢氧化钠均为一级。反应开始时乙酸乙酯及氢氧化钠的浓度均为l,反应速率常数等于。要求最终转化率达到95%。试问: (1)(1)当反应器的反应体积为1m3时,需要多长的反应时间? (2)(2)若反应器的反应体积为2m3,,所需的反应时间又是多少? 解:(1) (2) 因为间歇反应器的反应时间与反应器的大小无关,所以反应时间仍为。 拟在等温间歇反应器中进行氯乙醇的皂化反应: 以生产乙二醇,产量为20㎏/h,使用15%(重量)的NaHCO 水溶液及30%(重 3 量)的氯乙醇水溶液作原料,反应器装料中氯乙醇和碳酸氢钠的摩尔比为1:1,混合液的比重为。该反应对氯乙醇和碳酸氢钠均为一级,在反应温度下反应速率常数等于,要求转化率达到95%。 (1)(1)若辅助时间为,试计算反应器的有效体积; (2)(2)若装填系数取,试计算反应器的实际体积。 解:氯乙醇,碳酸氢钠,和乙二醇的分子量分别为,84 和 62kg/kmol,每小时产乙二醇:20/62= kmol/h 每小时需氯乙醇: 每小时需碳酸氢钠: 原料体积流量: 氯乙醇初始浓度: 反应时间: 反应体积: (2)(2)反应器的实际体积: 丙酸钠与盐酸的反应: 为二级可逆反应(对丙酸钠和盐酸均为一级),在实验室中用间歇反应器于50℃等温下进行该反应的实验。反应开始时两反应物的摩尔比为1,为了确定反应进行的程度,在不同的反应时间下取出10ml反应液用的NaOH溶液滴定,以确定 500kg/h,且丙酸钠的转化率要达到平衡转化率的90%。试计算反应器的反应体积。假定(1)原料装入以及加热至反应温度(50℃)所需的时间为20min,且在加热过程中不进行反应;(2)卸料及清洗时间为10min;(3)反应过程中反应物密度恒定。 解:用A,B,R,S分别表示反应方程式中的四种物质,利用当量关系可求出任一时刻盐酸的浓度(也就是丙酸钠的浓度,因为其计量比和投量比均为1:1)为: