
专题11 金属及其化合物
【学生版】
A 、三年(2018-2020)高考真题赏析
(其它试题在后面的课时学案里)
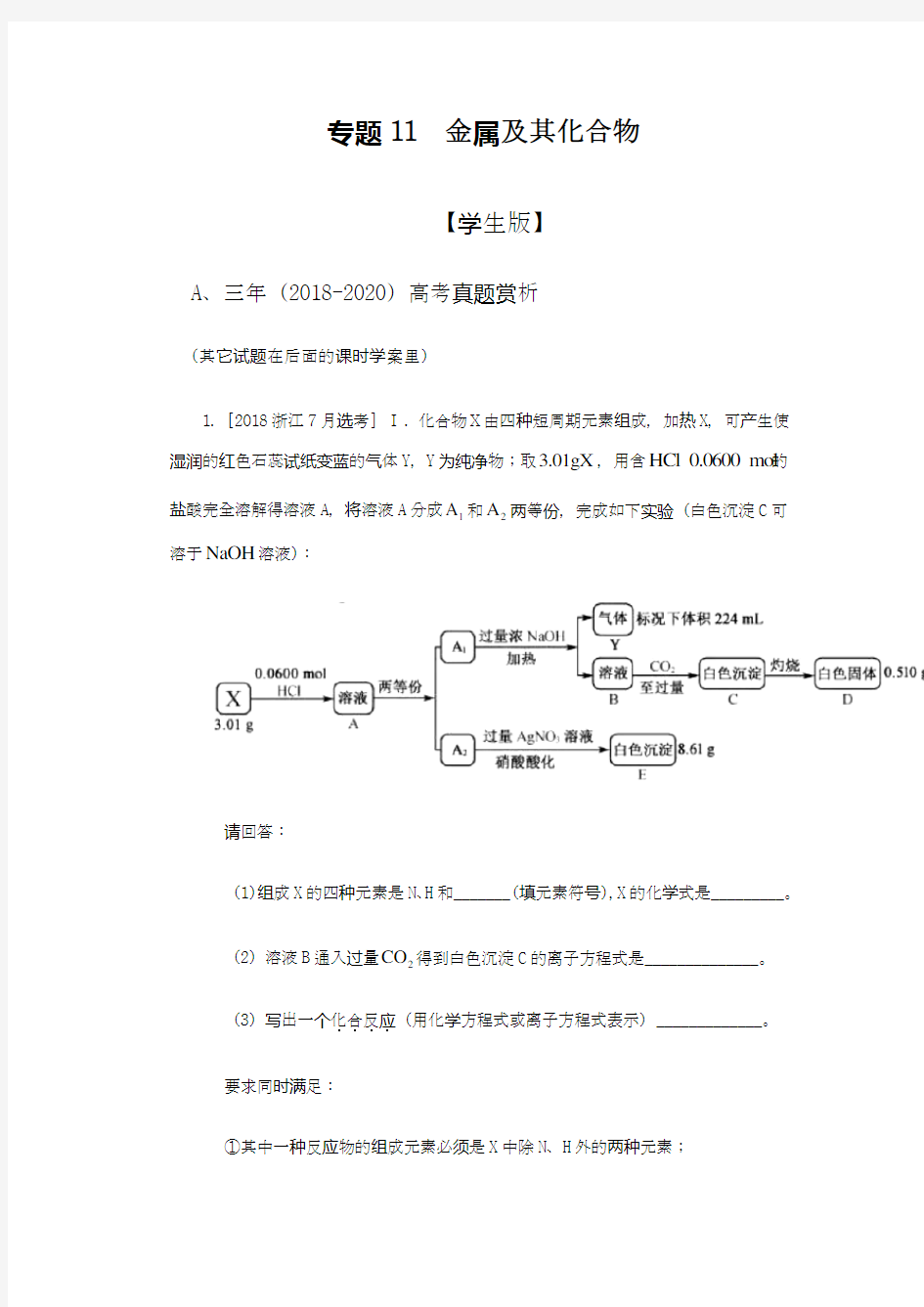
1.[2018浙江7月选考] Ⅰ. 化合物Ⅹ由四种短周期元素组成,加热X ,可产生使湿润的红色石蕊试纸变蓝的气体Y ,Y 为纯净物;取3.01gX ,用含HCl 0.0600 mol 的盐酸完全溶解得溶液A ,将溶液A 分成1A 和2A 两等份,完成如下实验(白色沉淀C 可溶于NaOH 溶液):
请回答:
(1)组成X 的四种元素是N 、H 和_______(填元素符号),X 的化学式是_________。
(2)溶液B 通入过量2CO 得到白色沉淀C 的离子方程式是______________。
(3)写出一个化合反应....
(用化学方程式或离子方程式表示)_____________。 要求同时满足:
①其中一种反应物的组成元素必须是X 中除N 、H 外的两种元素;
②反应原理与“34HCl NH NH Cl +”相同。
Ⅱ. 某兴趣小组为验证浓硫酸的性质进行实验,如图。实验中观察到的现象有:锥形瓶内有白雾,烧杯中出现白色沉淀。请回答:
(1)将浓硫酸和浓盐酸混合可产生HCl 气体的原因是_____________。
(2)烧杯中出现白色沉淀的原因是_____________。
2.[2018江苏卷]次氯酸钠溶液和二氯异氰尿酸钠(C 3N 3O 3Cl 2Na )都是常用的杀菌消毒剂。 NaClO 可用于制备二氯异氰尿酸钠。
(1)NaClO 溶液可由低温下将Cl 2缓慢通入NaOH 溶液中而制得。制备 NaClO 的
离子方程式为 ▲ ;用于环境杀菌消毒的NaClO 溶液须稀释并及时使用,若在空气中暴露时间过长且见光,将会导致消毒作用减弱,其原因是 ▲ 。
(2)二氯异氰尿酸钠优质品要求有效氯大于60%。通过下列实验检测二氯异氰尿酸钠样品是否达到优质品标准。实验检测原理为
333223333C N O Cl H 2H O C H N O 2HClO -+++=+
22HClO 2I H I Cl H O -+-++=++ 2222346I 2S O S O 2I ---+=+
准确称取1.1200 g 样品,用容量瓶配成250.0 mL 溶液;取25.00 mL 上述溶液于碘量瓶中,加入适量稀硫酸和过量KI 溶液,密封在暗处静置5 min ;用10.1000mol L -?Na 2S 2O 3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗Na 2S 2O 3溶液20.00 mL 。
①通过计算判断该样品是否为优质品。
(写出计算过程,HClO 2100%?=?测定中转化为的氯元素质量该样品的有效氯样品质量
) ②若在检测中加入稀硫酸的量过少,将导致样品的有效氯测定值 ▲ (填“偏高”或“偏低”)
B 、2021届高三化学复习精品知识
【学案】
■知识储备——核心要点填充 1.金属及其化合物的相互转化关系
(1)钠及其化合物之间的转化关系
a .写出图中标号的化学方程式:
③2Na 2O 2+2CO 2===2Na 2CO 3+O 2;
⑤2NaHCO 3=====△Na 2CO 3+CO 2↑+H 2O 。
b .写出图中标号的离子方程式:
①2Na +2H 2O===2Na ++2OH -+H 2↑;
②2Na 2O 2+2H 2O===4Na ++4OH -+O 2↑;
④2Cl -+2H 2O=====电解2OH -+H 2↑+Cl 2↑;
⑥Na ++NH 3+CO 2+H 2O===NaHCO 3↓+NH +4;
⑦CO 2-3+CO 2+H 2O===2HCO -3。
(2)镁及其化合物之间的转化关系
写出图中标号的化学方程式:
①3Mg +N 2=====△Mg 3N 2;
②2Mg +CO 2=====点燃2MgO +C ;
③Mg 3N 2+8H 2O===3Mg(OH)2+2NH 3·H 2O ;
④Mg +2H 2O=====△Mg(OH)2+H 2↑。
(3)铝及其化合物之间的转化关系
a .写出图中标号的化学方程式: ①2Al +2NaOH +2H 2O===2NaAlO 2+3H 2↑;
⑥2Al +Fe 2O 3=====高温2Fe +Al 2O 3。
b .写出图中标号的离子方程式:
②Al 2O 3+2OH -===2AlO -2+H 2O ;
③Al 3++3NH 3·H 2O===Al(OH)3↓+3NH +4;
④Al(OH)3+OH -===AlO -2+2H 2O ;
⑤AlO -2+CO 2+2H 2O===Al(OH)3↓+HCO -3
或2AlO -2+CO 2+3H 2O===2Al(OH)3↓+CO 2-3。
(4)铁及其化合物之间的转化关系
a .写出图中标号的化学方程式:
①3Fe +4H 2O(g)=====高温Fe 3O 4+4H 2;
⑤4Fe(OH)2+O 2+2H 2O===4Fe(OH)3。
b .写出图中标号的离子方程式:
②Fe 2O 3+6H +===2Fe 3++3H 2O ;
③Cu +2Fe 3+===2Fe 2++Cu 2+;
④2Fe 2++H 2O 2+2H +===2Fe 3++2H 2O 。
(5)铜及其化合物之间的转化关系
写出图中标号的化学方程式:
①2Cu +O 2+CO 2+H 2O===Cu 2(OH)2CO 3;
②Cu +2H 2SO 4(浓)=====△CuSO 4+SO 2↑+2H 2O ;
③Cu 2(OH)2CO 3+4HCl===2CuCl 2+CO 2↑+3H 2O 。
2.金属及其化合物的特性及应用
(1)Na 2O 2遇CO 2或H 2O 可产生O 2,可用于呼吸面具中供氧剂。
(2)碳酸氢钠可用于胃酸中和剂的原理是(写出离子方程式)HCO -3+H
+===CO 2↑+H 2O ,但胃溃疡者慎用。
(3)纯碱清洗油污的原理是(写离子方程式)CO 2-3+H 2O HCO -3+OH -。
(4)明矾和铁盐作净水剂的原理是在水中生成胶体,吸附悬浮物后沉降。
(5)侯氏制碱法涉及的物质有NaCl 、NH 3、CO 2、H 2O 。
(6)FeCl 3溶液可用于腐蚀印刷Cu 电路板的化学方程式为2FeCl 3+Cu===CuCl 2+2FeCl 2。
(7)CuSO4可用于杀菌消毒的原因是Cu2+使蛋白质变性。
(8)泡沫灭火器中的两试剂是NaHCO3和Al2(SO4)3溶液,反应的化学方程式为6NaHCO3+Al2(SO4)3===2Al(OH)3↓+6CO2↑+3Na2SO4。
■1感悟考法考向
1.下列关于金属及其化合物的叙述正确的是________(填序号)。
①乙醇和水都可与金属钠反应产生可燃性气体,说明乙醇分子中的氢与水分子中的氢具有相同的活性
②将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶,集气瓶中产生大量白烟,瓶内有黑色颗粒产生,说明CO2具有氧化性
③向2 mL 0.1 mol·L-1的FeCl3溶液中加足量铁粉,振荡,加1滴KSCN 溶液,黄色逐渐消失,加KSCN溶液颜色不变,说明还原性:Fe>Fe2+
④Al2(SO4)3和小苏打反应应用于泡沫灭火器灭火
⑤将MgCl2溶液加热蒸干制备无水MgCl2
⑥配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释
⑦将NaOH浓溶液滴加到饱和FeCl3溶液中制备Fe(OH)3胶体
⑧除去Cu粉中混有CuO的方法是加入稀硝酸溶解、过滤、洗涤、干燥
⑨因为铁比铜金属性强,所以可用FeCl3腐蚀Cu刻制印刷电路板
⑩钠在空气中燃烧可生成多种氧化物。23 g钠充分燃烧时转移电子数为N A
?将稀盐酸滴入碳酸钠与氢氧化钠的混合溶液中,立即产生气泡
?用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的
液态铝滴落下来,说明铝的熔点较低
?浓硝酸滴入用砂纸打磨过的铝条中,产生红棕色气体
?氯化铝溶液滴入浓NaOH溶液中,产生大量白色沉淀
?将铜粉加入1.0 mol·L-1Fe2(SO4)3溶液中,现象是溶液变蓝,有黑色固体出现
?碳酸钠可用于去除餐具的油污
?Al(OH)3可用于中和过多胃酸
2.某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是______________________________
_________________________________________________________。
(2)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为
_________________________________________________________ _________________________________________________________。