第三单元微粒间的相互作用力从微观
结构看物质的多样性
[考纲导航]
知识条目加试要求核心素养
(1)化学键的含义 a
1.变化观念与平衡思想:认
识化学键的本质是原子间
的静电作用,能多角度、动
态的分析化学键。
2.科学探究与创新意识:能
发现和提出有探究价值的
化学键问题,确定探究目
的,设计实验方案。
3.科学态度与社会责任:具
有可持续发展意识和绿色
化学观念,能对与化学键和
晶体结构有关的社会热点
问题做出正确的价值判断。
(2)离子键、共价键的概念和成因 b
(3)离子化合物、共价化合物的概念 a
(4)简单离子化合物、共价分子的电子式 b
(5)常见离子化合物的形成过程 b
(6)简单共价分子的结构模型、结构式 a
(7)碳的成键特点与有机化合物的多样性
的联系
a
(8)分子间作用力的含义、分子间作用力
对分子构成的物质的某些物理性质影响
b
(9)简单共价分子的空间结构和键能 a
(10)氢键的概念、形成条件和原因,氢键
对物质性质的影响
b
(11)NaCl、金刚石、足球烯、干冰、石英
中微粒的空间排列方式及相互作用力
a
(12)离子晶体、分子晶体、原子晶体、金
属晶体的形成方式
a
(13)离子晶体、分子晶体、原子晶体、金
属晶体的主要特性
a
考点1离子键和共价键
[主干精讲]
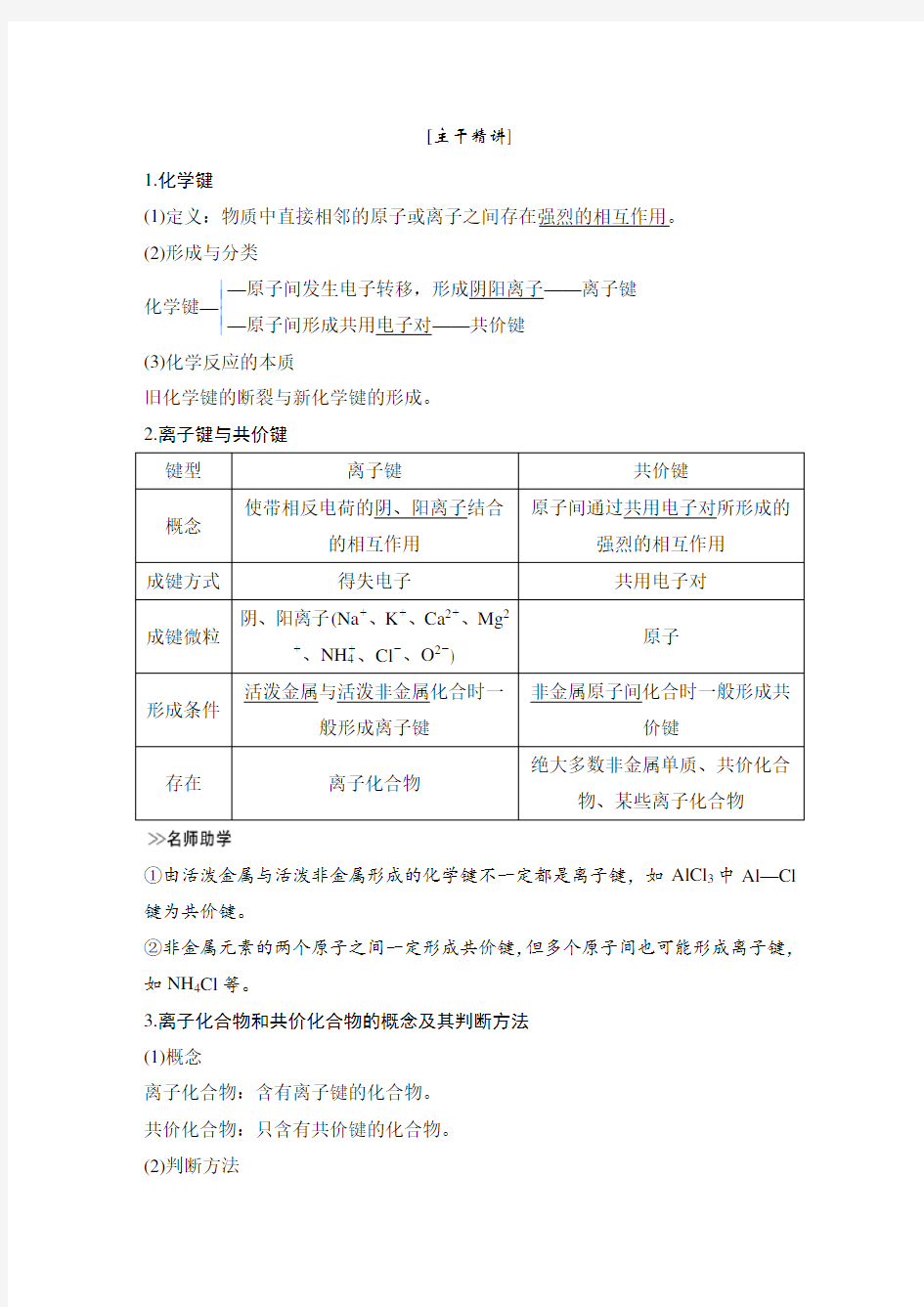
1.化学键
(1)定义:物质中直接相邻的原子或离子之间存在强烈的相互作用。
(2)形成与分类
化学键—
??
??
—原子间发生电子转移,形成阴阳离子——离子键
—原子间形成共用电子对——共价键
(3)化学反应的本质
旧化学键的断裂与新化学键的形成。
2.离子键与共价键
键型离子键共价键
概念
使带相反电荷的阴、阳离子结合
的相互作用
原子间通过共用电子对所形成的
强烈的相互作用
成键方式得失电子共用电子对
成键微粒
阴、阳离子(Na+、K+、Ca2+、Mg2
+、NH+4、Cl-、O2-)
原子
形成条件
活泼金属与活泼非金属化合时一
般形成离子键
非金属原子间化合时一般形成共
价键存在离子化合物
绝大多数非金属单质、共价化合
物、某些离子化合物
①由活泼金属与活泼非金属形成的化学键不一定都是离子键,如AlCl3中Al—Cl 键为共价键。
②非金属元素的两个原子之间一定形成共价键,但多个原子间也可能形成离子键,如NH4Cl等。
3.离子化合物和共价化合物的概念及其判断方法
(1)概念
离子化合物:含有离子键的化合物。
共价化合物:只含有共价键的化合物。
(2)判断方法
①根据化学键的类型判断
凡含有离子键的化合物,一定是离子化合物;只含有共价键的化合物,是共价化合物。
②根据化合物的类型来判断
大多数碱性氧化物、强碱和盐都属于离子化合物(AlCl3等除外);非金属氢化物、非金属氧化物、含氧酸等都属于共价化合物。
③根据化合物的性质来判断
一般熔点、沸点较低的化合物是共价化合物。熔融状态下能导电的化合物是离子化合物,如NaCl;不能导电的化合物是共价化合物,如HCl。
4.化学键与物质类别的关系
①不是所有物质中都存在化学键,如稀有气体分子是单原子分子,分子中无化学键;除稀有气体外,非金属单质只有共价键。
②熔化时导电的化合物一定是离子化合物;溶解时导电,不能判别。
5.化合物溶于水或受热熔化时化学键变化情况
离子化合物共价化合物
溶于水破坏离子键,也可能破坏共
价键如:NaHSO4===Na++
H++SO2-4
若与水反应,破坏化学键;
若电离,破坏化学键;若不
电离,不破坏化学键
受热熔化(但不分解) 只破坏离子键不破坏化学键6.电子式的书写方法
7.简单共价化合物的结构模型、结构式
物质HCl Cl2H2O NH3CH4
结构式H—Cl Cl—Cl H—O—H
球棍模型
比例模型
[速检速测]
1.[明辨是非]正确的打“√”,错误的打“×”
(1)形成离子键的静电作用指的是阴、阳离子间的静电吸引作用。()
(2)某些金属与非金属原子间也能形成共价键。()
(3)非金属元素组成的化合物中只含共价键。()
(4)原子最外层只有一个电子的元素跟卤素结合时,所形成的化学键一定是离子键。()
(5)所有物质中均含有化学键。()
(6)有化学键断裂的变化一定是化学变化。()
(7)在水溶液中能导电的化合物一定是离子化合物。()
(8)离子化合物在任何状态下都能导电。()
(9)固体溶于水时,一定破坏了化学键。()
(10)加热熔化NaCl固体时无新物质生成,化学键没有被破坏()
答案(1)×(2)√(3)×(4)×(5)×(6)×(7)×(8)×(9)×(10)×
2.有以下8种物质:①Ne②HCl③P4④H2O2⑤Na2S⑥NaOH⑦Na2O2
⑧NH4Cl。
请用上述物质的序号填空:
(1)不存在化学键的是_____________________________________________。
(2)只存在共价键的是____________________________________________。
(3)只存在离子键的是____________________________________________。
(4)既存在离子键又存在共价键的是_________________________________。
答案(1)①(2)②③④(3)⑤(4)⑥⑦⑧
3.写出下列微粒的电子式
(1)—OH________,OH-________,H3O+________,NH+4________,
N2H+5________。
(2)HClO________,CCl4________,CO2________,CS2________,COS________,HCHO________,C2H4________,(CN)2________,(SCN)2________,COCl2________,N2H4________。
(3)Na2S________,NaH________,NH4H________,NaCN________,MgCl2________,Na2O2________ NaClO________,NaOH________ 答案
[模拟题组]
化学键的判断
1.(2019·辽宁大连第二十高级中学月考)化学键使得一百多种元素构成了世界万物。关于化学键的下列叙述中,正确的是()
A.化学键是相邻原子或离子间的相互作用,它存在于分子、原子团中
B.离子键是阴、阳离子通过静电作用而形成的化学键
C.共价键只存在于共价化合物中
D.非金属元素的原子之间不可能形成离子键
答案 B
2.下列哪一组元素的原子间反应容易形成离子键()
原子 a b c d e f g
M层电子数 1 2 3 4 5 6 7
A.a和c
B.c和g
C.e和g
D.b和g
答案 D
【易错警示】
(1)由金属元素与非金属元素形成的化学键不一定是离子键。如BeCl2、AlCl3等中的化学键为共价键,它们是共价化合物。
(2)由阳离子和阴离子结合生成的化合物不一定是离子化合物。如H++OH-===H2O,2H++CO2-3===CO2↑+H2O。
(3)由两种共价化合物结合生成的化合物不一定是共价化合物。如NH3+HCl===NH4Cl。
共价化合物和离子化合物
3.下列关于化学键与化合物的叙述正确的是()
①离子化合物中一定含有金属元素
②共价化合物中一定不含有金属元素
③离子化合物中一定含有离子键
④离子化合物中一定不含有共价键
⑤离子化合物中可能含有共价键
⑥共价化合物中可能含有离子键
⑦共价化合物中一定不含有离子键
A.①⑤⑥⑦
B.②③④
C.③⑤⑦
D.②③⑥⑦
答案 C
4.(2019·浙江省嘉兴一中期末)下列有关说法正确的是()
A.该组化合物中只含有共价键:H2O、NH4Cl、H2O2
B.非金属原子间以共价键结合的物质都是共价化合物
C.Na2O、NaOH和Na2SO4为离子化合物,HCl、NH3、NH4NO3、H2SO4为共价化
合物
D.由不同种非金属原子间通过共用电子对形成的化合物是共价化合物
解析NH4Cl中既含有共价键,也含有离子键,A错;非金属原子以共价键结合形成的可能为共价化合物如HCl,也可能为单质,如H2、O2,B错;NH4NO3为离子化合物,C错;不同非金属原子间通过共用电子对形成的化合物是共价化合物,D对。
答案 D
【方法技巧】
离子化合物和共价化合物的判断方法
(1)含有K+、Ca2+、Na+、Mg2+、Ba2+、NH+4等离子的化合物为离子化合物,若离子化合物中存在原子团,则一定含有共价键。
(2)在熔化状态下能导电的化合物一定是离子化合物。
物质变化与化学键
5.(2018·福建厦门中学质检)下列物质的变化过程中,共价键明显被破坏的是()
A.从NH4HCO3中闻到了刺激性气味
B.NaCl颗粒被粉碎
C.I2升华
D.NaOH溶于水
答案 A
6.(2017·沧州高三调研)化学反应的本质是反应物化学键断裂和生成物化学键形成的过程,下列关于化学反应2Na2O2+2CO2===2Na2CO3+O2的叙述正确的是()
A.反应过程中只涉及离子键和极性共价键的断裂
B.反应过程中只涉及离子键和非极性共价键的形成
C.反应过程中既涉及离子键和极性共价键的断裂,又涉及离子键和非极性共价键的形成
D.反应过程中既涉及离子键、极性和非极性共价键的断裂,又涉及离子键、极性和非极性共价键的形成
解析Na2O2中存在离子键和非极性共价键,CO2中存在极性共价键,Na2CO3中
存在离子键和极性共价键,O2中存在非极性共价键,D项符合题意。
答案 D
【归纳总结】
化学键断裂或形成与物质变化
(1)化学变化中一定有化学键的断裂和形成。
(2)有化学键断裂或形成的变化不一定是化学变化。如NaCl熔化、HCl溶于水等,只有旧化学键的断裂没有新化学键的形成;从溶液中析出晶体时,无化学键的断裂但有化学键的形成,均未发生化学变化。
微粒组成及电子式的书写判断
7.下列分子中各原子都满足8电子稳定结构的化合物是()
A.C6H6
B.HCN
C.CO2
D.N2
解析氢原子不满足8电子稳定结构,A、B项错误;N2是单质,不是化合物,D项错误。
答案 C
8.写出符合下列要求的电子式:
(1)化合物乙的球棍模型为“”,写出乙的电子式:________。
(2)漂白粉是由丙、丁形成的混合物,丙的水溶液显碱性,丙的水溶液中存在酸戊,戊的电子式为________,丁的水溶液呈中性,丁的电子式为________。
(3)电石(CaC2)遇水生成乙炔(C2H2),电石的电子式为________;萤石(CaF2)可以制备能刻蚀玻璃的酸,写出该酸的电子式:________。
(4)以硼酸为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,其电子式为_____________________________________________________。
答案(1)∶N??C∶C??N∶
【练后反思】
电子式书写常见的四大误区
[真题对接]
1.正误判断,正确的打“√”,错误的打“×”
(1)(2018·浙江4月选考,19A)CaCl2中既有离子键又有共价键,所以CaCl2属于离子化合物()
(2)(2018·浙江4月选考,19B)H2O汽化成水蒸气,分解为H2和O2,都需要破坏共价键()
(3)(2017·浙江11月选考,20A)Mg2+和S2-的最外电子层都形成8个电子的稳定结构()
(4)(2017·浙江4月选考,20B)化学变化发生时,需要断开反应物中的化学键,并形成生成物中的化学键()
(5)(2017·浙江4月选考,20C)CH4和CCl4中,每个原子的最外层都具有8电子稳定结构()
(6)(2017·浙江4月选考,20D)NaHSO4晶体溶于水时,离子键被破坏,共价键不受影响()
(7)(2016·浙江10月选考,20C)氢氧化钠在熔融状态下离子键被削弱,形成自由移动的离子,具有导电性()
(8)(2016·浙江4月选考,20C)N2和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构()
(9)(2015·浙江10月选考,15A)HCl属于共价化合物,溶于水能电离出H+和Cl-()
(10)(2015·浙江10月选考,15B)NaOH是离子化合物,该物质中只含离子键() 答案(1)×(2)×(3)√(4)√(5)×(6)×(7)√(8)√(9)√(10)×2.正误判断,正确的打“√”,错误的打“×”
(1)(2018·浙江4月选考,8C)乙烯的球棍模型()
(2)(2018·浙江4月选考,8D)NaCl的电子式()
(3)(2017·浙江11月选考,8B)二氧化碳的结构式:O===C===O()
(4)(2017·浙江11月选考,8C)甲烷的球棍模型:()
(5)(2017·浙江4月选考,7A)CO2的电子式:()
(6)(2017·浙江4月选考,7B)Cl2的结构式:Cl—Cl()
(7)(2016·浙江4月选考,7B)乙炔的结构式:CH≡CH()
(8)(2015·浙江10月选考,7A)水分子的结构式:()
(9)(2015·浙江10月选考,7C)氯气的比例模型:()
答案(1)√(2)×(3)√(4)√(5)√(6)√(7)×(8)√(9)×
3.(2018·11月浙江选考)下列表示不正确的是()
A.Na+结构示意图
B.乙烷的比例模型
C.乙醛的结构简式CH3CHO
D.氯化钙的电子式
解析该模型属于乙烷的球棍模型。
答案 B
考点2分子间作用力晶体类型
[主干精讲]
1.分子间作用力
(1)定义:分子间存在着将分子聚集在一起的作用力。最常见的是范德华力和氢键。
(2)特点:
①分子间作用力比化学键弱得多,它主要影响物质的熔点、沸点等物理性质,而化学键主要影响物质的化学性质。
②分子间作用力存在于由共价键形成的多数共价化合物和绝大多数气态、液态、固态非金属单质分子之间。但像二氧化硅、金刚石等由共价键形成的物质,微粒之间不存在分子间作用力。
(3)变化规律:
①组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔、
沸点也越高。例如,熔、沸点:I2>Br2
>Cl2>F2。
②相对分子质量接近的物质,分子极性越大,分子间作用力越大,熔沸点越高。
2.氢键
(1)概念:像水分子间,一个水分子中的氢原子与另一个水分子中的氧原子间所形成的分子间作用力。
(2)形成条件:跟吸电子能力较强的原子(如:N、O、F等)成键的氢原子,与其他的吸电子能力较强的原子间易形成氢键,可表示如下:A—H……B(A、B一般为N、O、F等原子)。
(3)形成原因:在“A—H……B”中由于A原子吸电子能力较强,使H原子显正电性,同理,由于B原子吸电子能力较强,B原子显负电性,这样在分子间,氢原子与B原子间通过静电作用形成氢键。
(4)对物质性质的影响:分子间氢键会使物质的熔点和沸点升高,溶解性增强。
(1)存在氢键的物质有:蛋白质分子、醇、羧酸分子、H2O、NH3、HF等分子之间
(2)分子间作用力、共价键对物质性质影响比较
分子间作用力共价键
对物质性质的影响①影响物质的熔点、沸点、溶解度等物理性质;
②组成和结构相似的物质,随相对分子质量的增大,物
质的熔、沸点升高。如熔、沸点CF4 ③分子间氢键的存在,使物质的熔、沸点升高,在水中 的溶解度增大,如熔、沸点:H2O>H2S,HF>HCl, NH3>PH3 ①影响分子的 稳定性;②共价 键键能越大,分 子稳定性越强 3.晶体类型及性质的比较 晶体类型离子晶体分子晶体原子晶体构成晶体的粒子阳离子、阴离子分子原子 组成晶体粒子间相 互作用离子键 范德华力(有的存 在氢键) 共价键 典型实例NaCl 冰(H2O)、干冰 (CO2) 金刚石、晶体硅、 SiO2、SiC及Si3N4 等大多数新型高温 结构陶瓷 晶 体 的 物 理 性 质 熔、沸点熔点较高,沸点高熔、沸点低熔、沸点高 导热性不良不良不良 导电性 固态不导电,熔化 或溶于水能导电 固体、熔融态不导 电,部分化合物溶 于水能导电 不导电机械加工性能不良不良不良硬度略硬而脆硬度低高硬度 晶体结构在NaCl晶体中, 每个Na+同时吸引 6个Cl-,每个Cl- 同时吸引6个Na+ ①干冰晶体中,每 个CO2分子周围等 距且紧邻的CO2分 子有12个; ②冰的晶体模型 中,每个水分子与 相邻的4个水分子 以氢键相连接 ①金刚石晶体中, 每个C与另外4个 C形成共价键,最 小的环是6元环; ②SiO2晶体中,每 个Si原子与4个O 成键,每个O原子 与2个硅原子成 键,最小的环是12 元环 4.晶体熔、沸点的比较 (1)不同类型晶体的熔、沸点高低的一般规律:原子晶体>离子晶体>分子晶体。 (2)同种类型的晶体: 离子晶体:离子所带电荷越多,离子半径越小,离子键的键能越大,熔沸点越高。分子晶体:分子间作用力越大,熔沸点越高。存在氢键,熔沸点越高。 原子晶体:共价键键长越短,键能越大,熔沸点越高。 [速检速测] 1.[明辨是非]正确的打“√”,错误的打“×” (1)分子间作用力和氢键的判断和应用 ①HBr比HCl的热稳定性差说明HBr的分子间作用力比HCl弱() ②HCl、HBr、HI的分子间作用力依次增大,热稳定性也依次增强() ③H2O、H2S、H2Se的分子间作用力依次增大,沸点依次升高() ④HF比HCl稳定是因为HF间存在氢键() ⑤氢键是氢元素与其他元素形成的化学键() ⑥乙醇分子和水分子间可以形成氢键() ⑦水分子间既存在范德华力又存在氢键() ⑧分子内共价键越强,分子越稳定,其熔、沸点也越高() 答案①×②×③×④×⑤×⑥√⑦√⑧× (2)晶体结构和性质 ①碘晶体受热转变为碘蒸气,吸收的热量用于克服碘原子间的作用力() ②在O2、CO2和SiO2中,都存在共价键,它们均由分子构成() ③KOH和MgCl2都是离子晶体,均存在共价键和离子键() ④金刚石、NaCl、H2O、HCl晶体的熔点依次降低() ⑤金刚石和足球烯都是通过共用电子对形成空间网状结构,所以都是原子晶体() ⑥某晶体固态时不导电,水溶液能导电,说明该晶体一定是离子晶体() 答案①×②×③×④√⑤×⑥× 2.如图中每条折线表示元素周期表中第ⅣA~ⅦA族中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是() A.H2S B.HCl C.PH3 D.SiH4 答案 D 3.下列现象与氢键有关的是() ①NH3的熔、沸点比ⅤA族其他元素氢化物的高 ②小分子的醇、羧酸可以和水以任意比互溶 ③冰的密度比液态水的密度小 ④水分子高温下很稳定 A.①②③④ B.仅①②③ C.仅①② D.仅①③ 答案 B [模拟题组] 分子间作用力和氢键的判断和应用 1.(2017·浙江省台州中学高三上学期第四次统练)在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的作用力依次是() A.范德华力、范德华力、范德华力 B.范德华力、范德华力、共价键 C.范德华力、共价键、共价键 D.共价键、共价键、共价键 解析“石蜡→液体石蜡→石蜡蒸气”属于石蜡的“三态”之间的转化,转化的过程中要克服分子间作用力;“石蜡蒸气→裂化气”属于化学变化,必然要破坏化学键(共价键),故选B。 答案 B 2.氨气溶于水时,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子。根据氨水的性质可推知NH3·H2O的结构式为() 解析从氢键的成键原理上讲,A、B都成立;但从空间构型上讲,由于氨分子是三角锥形,易于提供孤对电子,所以,以B方式结合空间阻碍最小,结构最稳定;从事实上讲,依据NH3·H2O NH+4+OH-,可知答案是B。 答案 B 晶体类型和性质 3.下列叙述正确的是() A.离子晶体中,只存在离子键,不可能存在其他化学键 B.原子晶体中,只存在共价键;稀有气体的原子能形成分子晶体 C.NaHSO4、Na2O晶体中的阴、阳离子个数比均为1∶2 D.晶体的熔点:金刚石>食盐>干冰>冰 答案 B 4.(2017·浙江省桐庐中学高三年级模拟)下列说法正确的是() A.CaCl2晶体中存在共价键 B.H2SO4溶于水能电离出H+和SO2-4,所以硫酸是离子化合物 C.SiO2属于原子晶体,熔化破坏共价键和分子间作用力 D.I2是分子晶体,加热升华过程中只需克服分子间作用力 答案 D [真题对接] 1.(2017·浙江4月选考)下列说法正确的是() A.干冰和石英晶体中的化学键类型相同,熔化时需克服微粒间的作用力类型也相同 B.化学变化发生时,需要断开反应物中的化学键,并形成生成物中的化学键 C.CH4和CCl4中,每个原子的最外层都具有8电子稳定结构 D.NaHSO4晶体溶于水时,离子键被破坏,共价键不受影响 解析干冰和石英的化学键都是共价键,前者为分子晶体,熔化时克服分子间作用力,后者为原子晶体,熔化时克服共价键,A错误;CH4中H原子最外层没有达到8电子结构,C错误;NaHSO4晶体中Na+与HSO-4之间为离子键,HSO-4内原子之间为共价键,溶于水后电离过程为NaHSO4===Na++H++SO2-4,离子键和 部分共价键破坏,故D错误。 答案 B 2.(2016·10月浙江选考)下列说法不正确的是() A.Cl2、Br2、I2的分子间作用力依次减小 B.石英是由硅原子和氧原子构成的原子晶体,加热熔化时需破坏共价键 C.氢氧化钠在熔融状态下离子键被破坏,形成自由移动的离子,具有导电性 D.水电解生成氢气和氧气,有化学键的断裂和形成 解析A项,Cl2、Br2、I2相对分子质量增大,分子间作用力依次增强,错误。答案 A 3.(2017·课标全国Ⅲ,12改编)短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系正确的是() A.简单氢化物沸点:W<Z B.最高价氧化物对应水化物的酸性:Y>W C.化合物熔点:Y2X3<YZ3 D.简单离子的半径:Y<X 解析根据短周期元素W、X、Y和Z在周期表中的相对位置可知四种元素位于2、3周期,又知这四种元素原子的最外层电子数之和为21,可设Y的最外层电子数为x,则有x+(x+2)+(x+3)+(x+4)=21,x=3,所以W、X、Y、Z依次为N、O、Al、Cl。A项,NH3分子之间存在氢键,故沸点:NH3>HCl,错误;B 项,Y的最高价氧化物对应的水化物为Al(OH)3,W的最高价氧化物对应水化物为HNO3,则HNO3酸性强于Al(OH)3,错误;C项,Al2O3为离子晶体,而AlCl3为分子晶体,离子键要比分子间作用力强得多,故一般离子晶体熔沸点高于分子晶体熔沸点,错误;D项,O2-与Al3+的电子层结构相同,但O2-的核电荷数少,故其半径较大,正确。 答案 D 课时训练 一、选择题 1.(2017·诸暨中学高三期中)下列关于二氧化硅晶体的描述错误的是() A.分子式为SiO2 B.熔化时共价键断裂 C.属于酸性氧化物 D.1 mol SiO2中含有4 mol Si—O键 解析 A.二氧化硅晶体是由硅原子和氧原子构成的原子晶体,不含分子,因此没有分子式,故A错误;B.二氧化硅是原子晶体,熔化时破坏共价键Si—O键,故B正确;C.二氧化硅能与强碱溶液反应生成盐和水,属于典型的酸性氧化物,故C正确;D.在二氧化硅晶体中,每个硅原子形成四条Si—O键,1 mol SiO2中含有4 mol Si—O键,故D正确。 答案 A 2.(2019·湖州市安吉县上墅私立高级中学高三月考)下列各项中表达正确的是() A.NH3分子的电子式: B.CH4分子的比例模型: C.Cl2的球棍模型: D.N2的结构式:N≡N 答案 D 3.(2017·11月浙江选考)下列说法不正确的是() A.Mg2+和S2-的最外电子层都形成了8个电子的稳定结构 B.石英和金刚石都是原子间通过共价键结合形成的原子晶体 C.浓H2SO4与H2O混合时放出热量与微粒之间的作用力有关 D.H2O2易分解是因为H2O2分子间作用力弱 解析A选项的两个离子Mg2+和S2-的最外电子层都形成了8个电子的稳定结构,故A选项正确;B选项石英和金刚石是原子晶体,由原子通过共价键结合,故B 选项正确;C选项浓硫酸与水混合时,浓硫酸发生电离,破坏了共价键,属于微