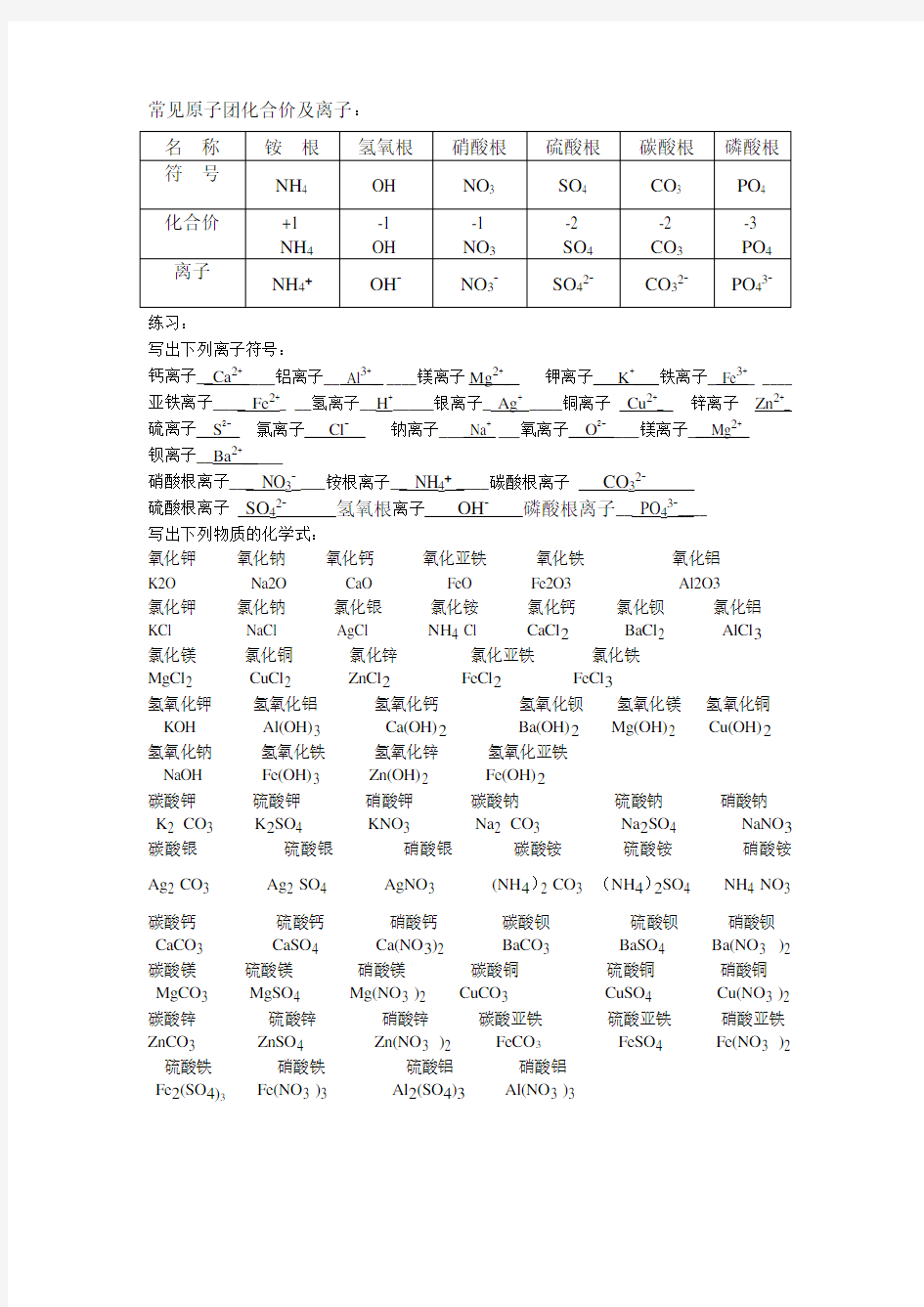
常见原子团化合价及离子:
练习:
写出下列离子符号:
钙离子__Ca2+____铝离子__ Al3+_ ____镁离子Mg2+_ 钾离子___K+___铁离子_ Fe3+_ ____亚铁离子____Fe2+_ __氢离子__H+_____银离子_Ag+____铜离子Cu2+_ 锌离子Zn2+_ 硫离子S2-氯离子Cl-钠离子___ Na+ ___氧离子__O2-____镁离子__ Mg2+_
钡离子__Ba2+_____
硝酸根离子___ NO3-___铵根离子__ NH4+____碳酸根离子CO32-
硫酸根离子SO4-氢氧根离子OH-磷酸根离子__ PO4-____
写出下列物质的化学式:
氧化钾氧化钠氧化钙氧化亚铁氧化铁氧化铝
K2O Na2O CaO FeO Fe2O3 Al2O3
氯化钾氯化钠氯化银氯化铵氯化钙氯化钡氯化铝KCl NaCl AgCl NH4 Cl CaCl2BaCl2 AlCl3
氯化镁氯化铜氯化锌氯化亚铁氯化铁
MgCl2 CuCl2 ZnCl2FeCl2FeCl3
氢氧化钾氢氧化铝氢氧化钙氢氧化钡氢氧化镁氢氧化铜KOH Al(OH)3 Ca(OH)2Ba(OH)2Mg(OH)2 Cu(OH)2
氢氧化钠氢氧化铁氢氧化锌氢氧化亚铁
NaOH Fe(OH)3 Zn(OH)2 Fe(OH)2
碳酸钾硫酸钾硝酸钾碳酸钠硫酸钠硝酸钠
K2 CO3 K2SO4 KNO3 Na2 CO3 Na2SO4 NaNO3碳酸银硫酸银硝酸银碳酸铵硫酸铵硝酸铵
Ag2 CO3 Ag2 SO4 AgNO3 (NH4)2 CO3 (NH4)2SO4 NH4 NO3
碳酸钙硫酸钙硝酸钙碳酸钡硫酸钡硝酸钡CaCO3 CaSO4 Ca(NO3)2 BaCO3 BaSO4 Ba(NO3 )2 碳酸镁硫酸镁硝酸镁碳酸铜硫酸铜硝酸铜MgCO3 MgSO4 Mg(NO3 )2 CuCO3 CuSO4 Cu(NO3 )2 碳酸锌硫酸锌硝酸锌碳酸亚铁硫酸亚铁硝酸亚铁ZnCO3 ZnSO4 Zn(NO3 )2 FeCO3FeSO4 Fe(NO3 )2 硫酸铁硝酸铁硫酸铝硝酸铝
Fe2(SO4)
3Fe(NO3 )3 Al2(SO4)3Al(NO3 )3
根据化合价写化学式 1.常见元素的化合价的口诀: 2.常见原子团的化合价口诀: 一、请写出下列元素常见的化合价: 1.氧______ 2.氢_______ 3.钡_______ 4.钠______ 5.钾______ 6.铝_______ 7.银_______ 8.钙______ 9.镁______ 10.铁_____,______ 11.硫酸根_________ 12.碳酸根_________ 13.铵根________ 14.硝酸根________ 15氢氧根_______ 16.磷酸根________ 二.规律:单质中的元素化合价为_______ 单质: 1.氧气_____ 2.氢气______ 3.氮气_______ 4.氯气______ 5.臭氧_______ (稀有气体)1.氦气_____ 2.氖气_______ 3.氩气____ (非金属固态单质)1.碳(木炭,石墨,金刚石)______ 2.红磷(或白磷)_____ 3.硫(硫磺)_______ (金属单质)1.铁____ 2.铝____ 3.铜____ 4.镁____ 5.锌____ 6.银____ 7.汞____ 三、结合化合价的知识写出下列物质的化学式: 原则:在化合物中各元素的____________的代数和为________。 (一)氧化物(氧元素常显_____价) 1.氧化镁________ 2.氧化钡__________ 3.氧化铝____________ 4. 氧化铁(+2)_________ 5.氧化亚铁(+2)_______ 6.氧化钙(生石灰)________ 7.氧化铜(+2)_________ 8.氧化亚铜________ 9.水________ 10.过氧化氢(双氧水)_______ 11.一氧化碳___________12.二氧化碳_______ 13.二氧化硫_______ 14.三氧化硫_______15.一氧化氮_______ 16.二氧化氮_______ 17.五氧化二氮______ 18. 五氧化二磷中磷的化合价为+5价_________ (二)酸: 1.稀硫酸_______ 2.稀盐酸______ 3.硝酸.______ 4.碳酸______ 5.磷酸______ (三)碱(氢氧根的化合价为______价) 1.氢氧化钠______ 2.氢氧化钙(熟石灰)_______
(一)元素符号 1、元素符号的书写规则 (1)由一个字母表示的元素符号要大写。如H、C、S、P、K。 (2)由两个字母表示的元素符号,第一个字母要大写,第二个字母要小写。如Na、Mg。 2、元素符号的意义 宏观意义:表示某种元素;微观意义:表示某种元素的一个原子。如:“H”的含义为:①氢元素;②1个氢原子。 对于直接由原子构成的单质来讲,元素符号还表示某种单质,如“Fe”的含义为:①铁元素;②1个铁原子; ③铁单质。 注意:在元素符号前加上系数后,就只能表示原子的个数,如2H只能表示2个氢原子 (二)离子符号 1、书写:在元素符号或原子团的右上角标上离子所带电荷,数目在前,正负号在后。离子带1个单位正电荷或1个单位负电荷时,“1”省略不写。如Na+、Cl-、Mg2+、S2-、SO 2-等。 4 2、离子符号的意义 表示某种离子;表示某元素的一个离子。如:“Mg2+”的含义为:①镁离子;②1个镁离子。 注意:①离子符号中数字的意义:表示某种离子所带的电荷数,如“Mg2+”中“2”的含义表示一个镁离子带两个单位的正电荷。 2+ 只能表示3个二氧化碳分子。 注意:化学式前加上系数后,就只能表示分子的个数,如3CO 2 (四)化学方程式 1、化学方程式的意义 ①表示反应物、生成物以及反应条件。 ②表示反应物、生成物之间的质量关系(即质量比)。 ③反应物、生成物的各粒子的相对数量关系。 例如:S + O SO2 2 ①质的方面:硫与氧气在点燃的条件下生成二氧化硫。 ②量的方而:每32份质量的硫跟32份质量的氧气完全反应生成64份质量的二氧化硫。 ③粒子方面:1个硫原子与1个氧气分子反应生成1个二氧化硫分子。 2、化学方程式的书写 (1)书写步骤 写:在式子的左、右两边写出反应物和生成物的化学式,中间用短线连接。 配:配平化学方程式,并检查。 标:标明化学反应发生的条件,把短线改成等号。 (2)配平方法:最小公倍数法;设“1”法 (3)“↑”和“↓”在化学方程式中使用规则如下: ①因为“↑”和“↓”是生成物的状态符号,所以,无论反应物是气体还是固体,都不应该标出“↑”或“↓”。 ②若反应物中无气态物质,则反应生成的气态物质必须标出“↑”;若反应物中有气体,则反应生成的其他气体就不应标出“↑”。
化合价与化学式书写练习 一、请默写出元素周期表中前20号元素的名称及符号。(P62) 二、请写出下列元素的元素符号或名称。 1.铁 2.铜 3.锌 4.汞 5.Ca 6.He 7.Al 8.O 9.Mg 10.Na 11. Ag 三、请写出下列常见物质的化学式。 1.氢气 2.氧气 3.氮气 4. 氯气 5. 硫 6.铝箔 7.碳 8.红磷 9.铁丝 10. 五氧化二磷 11.二氧化碳 12.二氧化硫 13.四氧化三铁 14.水15.过氧化氢 16.二氧化锰 17.高锰酸钾 18.锰酸钾 19.氯酸钾 20.氯化钾 21.氯化氢 22.碳酸钙 四、请标出下列元素的常见化合价(P85) H Cl Na K Ag O Ca Mg Ba Zn Al Si P Cu Hg OH NO3 SO4 CO3 NH4 化学式及名称。(86) 六、化合物由不同种的元素组成。{练习}写出下列物质的化学式。 (一)氧化物(氧元素常显_____价) 1.水 2. 过氧化氢 3. 二氧化锰 4. 五氧化二磷 5.二氧化硫 6.二氧化碳
7.一氧化碳 8. 二氧化氮 9.氧化铁 10.氧化亚铁 11.四氧化三铁 12.氧化铜13.氧化镁 14.氧化钙 15.氧化铝 (二)酸:1.盐酸 2.碳酸 3.硫酸 4.硝酸 (三)碱:(氢氧根的化合价为______价) 1.氢氧化钠 2.氢氧化钙 3.氢氧化铝 4.氢氧化镁 5.氢氧化钡 6. 氢氧化钾 (四)盐 (1)氯化物(氯元素常显______价) 1.氯化钠_______ 2.氯化钙_______ 3.氯化铝_______ 4.氯化铁(+3)________ 5.氯化亚铁(+2)________ 6.氯化铜______ 7.氯化银______ 8.氯化钡_______ 9.氯化铵.______ 10.氯化锌_______ 11.氯化镁_____ 12.氯化钾_________ (2)硫酸盐(硫酸根显_____) 1.硫酸钾_______ 2.硫酸钡_______ 3.硫酸亚铁(+2)_____ 4.硫酸铝_______ 5.硫酸铁(+3)_______ 6.硫酸镁_________ 7.硫酸锌_______ 8.硫酸钠_______ 9.硫酸钙__________ 10.硫酸铜(+2) ________ (3)碳酸盐(碳酸根显_______价) 1.碳酸钙________ 2.碳酸钠_______ 3.碳酸钡________ 4碳酸钾________5.碳酸铵_______ (4)硝酸盐:(硝酸根显______价) 1.硝酸钠_______ 2.硝酸锌______ 3.硝酸银________ 4.硝酸钡_______ 5.硝酸钾_______ 6.硝酸钙_______ 7.硝酸镁_______ 8.硝酸铝________ 9.硝酸亚铁_______ 10.硝酸铁_______ 11. 硝酸铜_______ 12. 硝酸铵______ (5)其它常见:氯酸钾_______ 高锰酸钾_______ 锰酸钾 _______ 附:(一)、常见元素化合价口诀 1价 H、Cl、K、Na、Ag , 2价O、Mg、Ca、Ba、Zn, 3(价)Al 4(价)Si 5价P ,变价元素记心中, 2、3(价) Fe , 2、4(价) C , Cu、Hg +2价最常见,莫忘单质为0价 (二)、原子团的化合价口诀 -1价OH、NO3, -2价SO4、CO3 ,只有+1是NH4
化合价与化学式手册写 练习测试 集团公司文件内部编码:(TTT-UUTT-MMYB-URTTY-ITTLTY-
化合价与化学式书写练习一、请默写出元素周期表中前20号元素的名称及符号。(P62) 二、请写出下列元素的元素符号或名称。 1.铁2.铜3.锌4.汞5.Ca6.He 7.Al8.O9.Mg10.Na11.Ag 三、请写出下列常见物质的化学式。 1.氢气 2.氧气 3.氮气 4.氯气 5.硫 6.铝箔 7.碳 8.红磷 9.铁丝10.五氧化二磷11.二氧化碳12.二氧化硫13.四氧化三铁14.水15.过氧化氢16.二氧化锰17.高锰酸钾18.锰酸钾19.氯酸钾 20.氯化钾21.氯化氢22.碳酸钙 四、请标出下列元素的常见化合价(P85) HClNaKAgOCaMgBaZn AlSiPCuHgOHNO 3SO 4CO 3NH 4 五、{练习}将左竖显正价的元素或原子团与右横显负价的元素或原子团组成的化合物的化学式及名称。(86) 六、化合物由不同种的元素组成。{练习}写出下列物质的化学式。 (一)氧化物(氧元素常显_____价) 1.水 2.过氧化氢 3.二氧化锰 4.五氧化二磷 5.二氧化硫 6.二氧化碳 7.一氧化碳 8.二氧化氮 9.氧化铁10.氧化亚铁11.四氧化三铁12.氧化铜13.氧化镁14.氧化钙15.氧化铝 (二)酸:1.盐酸2.碳酸3.硫酸4.硝酸
(三)碱:(氢氧根的化合价为______价) 1.氢氧化钠 2.氢氧化钙 3.氢氧化铝 4.氢氧化镁 5.氢氧化钡 6.氢氧化钾 (四)盐 (1)氯化物(氯元素常显______价) 1.氯化钠_______ 2.氯化钙_______ 3.氯化铝_______ 4.氯化铁(+3)________ 5.氯化亚铁(+2)________ 6.氯化铜______7.氯化银______ 8.氯化钡_______9.氯化铵.______10.氯化锌_______11.氯化镁_____12.氯化钾_________(2)硫酸盐(硫酸根显_____) 1.硫酸钾_______ 2.硫酸钡_______ 3.硫酸亚铁(+2)_____ 4.硫酸铝_______ 5.硫酸铁 (+3)_______6.硫酸镁_________7.硫酸锌_______8.硫酸钠_______9.硫酸钙 __________10.硫酸铜(+2)________ (3)碳酸盐(碳酸根显_______价) 1.碳酸钙________ 2.碳酸钠_______ 3.碳酸钡________4碳酸钾________5.碳酸铵_______ (4)硝酸盐:(硝酸根显______价) 1.硝酸钠_______ 2.硝酸锌______ 3.硝酸银________ 4.硝酸钡_______ 5.硝酸钾_______ 6.硝酸钙_______ 7.硝酸镁_______ 8.硝酸铝________ 9.硝酸亚铁_______10.硝酸铁 _______11.硝酸铜_______12.硝酸铵______ (5)其它常见:氯酸钾_______高锰酸钾_______锰酸钾_______ 附:(一)、常见元素化合价口诀 1价H、Cl、K、Na、Ag,2价O、Mg、Ca、Ba、Zn,3(价)Al4(价)Si5价P,变价元素记心中,2、3(价)Fe,2、4(价)C,Cu、Hg+2价最常见,莫忘单质为0价 (二)、原子团的化合价口诀 -1价OH、NO 3,-2价SO 4 、CO 3 ,只有+1是NH 4
(一)常见元素的化合价口诀: 钾钠氢银正一价,钙镁钡锌正二价; 铝是正三氧负 二,氯负一价最常见; 硫有负二正四六,正二正三 铁可变; 正一二铜二四碳,单质零价永不变; 其它 元素有变价,先死后活来计算。 表壬1常见元素的化舍价哀 -3H t 磷酸根P04铵根NH 4 -2-2-2-2 硫酸根S04亚硫酸根SQ碳酸根C03锰酸根Mn04 斗-4-4-4 氢氧根0H硝酸根N03氯酸根ClO3高锰酸根Mn04 一价铵根硝酸根;氢卤酸根氢氧根。高锰酸根氯酸根;高氯酸根醋酸根。二价硫酸碳酸根;氢硫酸根锰酸根。暂记铵根为正价;负三有个磷酸根 :■、化合物化学式的书写 (一)根据化合价书写化学式:
1书写口诀:正左负右标上头,约分交叉和为零 例:书写下列物质的化学式 氧化铝氯化镁硫酸铵 (二)根据名称书写化学式 常见的化合物有四种读法,不论是哪一种读法,从化合价角度看,都只有正价和负价两部分,只要找出这两部分,按上述方法,就能写出化学式,具体如下: 1、“某化某”,即“某”和“某”两部分 ■1-2 例:氧化钠,即“氧”和“钠”,Na O Na?。 2A 氯化亚铁,即“氯”和“亚铁”Fe Cl FeCl2(某兀素有多价态时,为了区分使 七 23 用低价态要加“亚”字,如:Fe Fe,当使用Fe) 练习:书写下列物质的化学式 硫化钾氧化亚铁氯化钾氟化铜 硫化铵氯化锌硫化铝氟化铵 2、“氢氧化某”,即“氢氧根”和“某”两部分 2-4 例:氢氧化铜,即“氢氧根”和“铜Cu OH Cu(OH )2 练习:书写下列物质的化学式 氢氧化钙氢氧化钡氢氧化亚铁氢氧化镁 氢氧化铝氢氧化钾氢氧化钠氢氧化铁 3、“某酸某”,即“ X酸根”和“某”两部分
化学式与化合价专题讲解 一、化学式: 1、定义:用元素符号和数字的组合表示物质组成的式子叫化学式。如: Fe、C、P、H2O、O2、H2、NaCl等 2、化学式表示的意义: ①由分子构成的物质,其化学式意义(以CO 2 为例): ②由原子构成的物质,其化学式的意义(以Fe为例): 微观:表示该物质的一个原子:一个铁原子。 3、化学式的读写方法: 化学式在初中主要有以下五种形式,各种化学式的读写方法既有规则发也有约定发。 类型写法读法举例 元素符号型写元素符号读单字Fe、Cu、S P、He、C、Si 双原子单质型元素符号右下角写2 常温下为气体,读某气; 常温下为固体,读单字 O 2 (氧气)、H 2 (氢气) I 2 (碘) 多原子单质型元素符号下写数字约定读法或元素加数字 O 3 (臭氧) C 60 (碳-60) 两原子化合型氧化物:“X”在前,氧元 素在后 金属元素和非金属元素组 成化合物:金属元素在 前,非金属元素在后 先写后读; 读出每种元素的原子个数 (个数为1的一般不 读); 特殊情况下个数1也要读 SO 2 (二氧化硫) Al 2 O 3 (三氧化二 铝) CO 2 (二氧化碳) CO(一氧化碳) 多原子化合型一般原子团在后,其他元 素在前 读法不固定,但一般先读 原子团 NaOH(氢氧化钠) H 2 SO 4 (硫酸) NaCO 3 (碳酸钠)
说明:有些物质化学式读法是特定的:如:H 2O(水)、CH 4 (甲烷)等 二、化合价: 1、化合价含义:元素的化合价是元素的原子在形成化合物时表现出来的一种性质,他用来表示原子之间相互 化合的数目。反映化合物中固定的原子个数比。 2、化合价与离子符号的书写区别: 数字位置不同,正负号位置不同,化合价的“1”不能省略 联系:同种元素(或原子团)的化合价和离子的电荷,通常数值相等,正、负号相同,只是位置不同。 3、规律: 氧元素通常显-2价,氢元素通常显+1价; 金属一般显正价,非金属一般先负价; 一些元素在不同的化合物中可显不同的化合价。 单质中元素的化合价为零; 化合物中各元素的化合价分别乘以他们的脚标(个数),最后相加之和为0。 4、化合价的应用: (1)根据化合价书写化学式:一般把正价元素或原子团写在左边,负价元素或原子团写在右边;将正负化合价绝对值相约至最简整数后,将 其交叉写在元素符号或原子团的右下角。 (2)根据化学式确定化合价:依据化合物中正负化合价代数和为零的原则;依据原子团中正负化合价代数和为根价的原则,计算确定。
2015-2016第一学期龙田片区化学教研活动 课题:化合价及化学式的书写 地点:客楼中学九(1)班 上课教师:肖培昌(龙田中学) 教学目标: 1.了解化合价的概念,掌握化合价的表示方法。 2.熟悉化合价的一般规律及常见元素和原子团的化合价。 3、掌握根据化合价书写化学式的方法。 教学重点: 1、化合价的表示方法 2、根据化合价书写化学式 教学难点: 1、化合价概念的建立 2、化合价与离子符号的区别于联系 教学手段:媒体(班班通) 教学过程: 新课导入: 比赛开始了,快点!写出下面几种物质的化学式: 二氧化碳水五氧化二磷四氧化三铁 CO2H2O P2O5Fe3O4 化学式中各原子个数比都是固定且唯一的,这是什么原因呢?原来原子个数比是由元素的化合价决定的。 板书:一、化合价 1、化合价是用来表示不同元素原子之间相互化合时具有确定的原子个数比的性质。
4、元素在单质中的化合价
单质中由于同种原子没有相互化合,因此元素的化合价为零。例如铁单质中铁为0价,氧气中氧也为0价。 5、根据化合价书写化学式要遵循的原则 (1)一般正的写在左边,负的写在右边。 (2)在化合物里,正负化合价的代数和为零。 (3)在单质里的化合价为零。
课堂小结: 1、化合价及化合价的表示方法 2、根据化合价书写化学式要遵循的原则 (1)一般正的写在前边,负的写在右边。(2)在化合物里,正负化合价的代数和为零。(3)在单质里的化合价为零。 3、根据化合价书写化学式 板书设计: 化合价及化学式的书写 一、化合价 1、化合价的概念 2、化合价的表示方法 3、常见元素和原子团的主要化合价 4、元素在单质中的化合价 5、根据化合价书写化学式要遵循的原则 (1)一般正的写在前边,负的写在右边。 (2)在化合物里,正负化合价的代数和为零。 (3)在单质里的化合价为零。 二、化合价的运用 1、根据化合价书写化学式
(一)常见元素的化合价口诀:钾钠氢银正一价,钙镁钡锌正二价; 铝是正三氧负二,氯负一价最常见; 硫有负二正四六,正二正三铁可变; 正一二铜二四碳,单质零价永不变; 其它元素有变价,先死后活来计算。 (二)常见原子团(根)的化合价: 磷酸根 3 PO - 4 铵根 1 NH + 4 硫酸根 2 4 SO - 亚硫酸根 2 3 SO - 碳酸根 2 3 CO - 锰酸根 2 4 MnO - 氢氧根 1 OH - 硝酸根 1 3 NO - 氯酸根 1 3 ClO - 高锰酸根 1 4 MnO - 一价铵根硝酸根;氢卤酸根氢氧根。高锰酸根氯酸根;高氯酸根醋酸根。二价硫酸碳酸根;氢硫酸根锰酸根。暂记铵根为正价;负三有个磷酸根二、化合物化学式的书写 (一)根据化合价书写化学式:
1、书写口诀:正左负右标上头,约分交叉和为零 例:书写下列物质的化学式 氧化铝 氯化镁 硫酸铵 2、练习:在下表中空格几,填写出相应的化学式 1H + 1Na + 2Fe + 3Fe + 14NH + 2O - 1OH - 2 3CO - (二)根据名称书写化学式 常见的化合物有四种读法,不论是哪一种读法,从化合价角度看,都只有正价和负价两部分,只要找出这两部分,按上述方法,就能写出化学式,具体如下: 1、“某化某”,即“某”和“某”两部分 例:氧化钠,即“氧”和“钠”, 1Na + 2 O - 2Na O 氯化亚铁,即“氯”和“亚铁” 2Fe + 1Cl - 2FeCl (某元素有多价态时,为了区分使用低价态要加“亚”字,如:2Fe + 3Fe +,当使用2 Fe +) 练习:书写下列物质的化学式 硫化钾 氧化亚铁 氯化钾 氟化铜 硫化铵 氯化锌 硫化铝 氟化铵 2、“氢氧化某”,即“氢氧根”和“某”两部分 例:氢氧化铜,即“氢氧根”和“铜”2Cu + 1OH - ()Cu OH 2 练习:书写下列物质的化学式 氢氧化钙 氢氧化钡 氢氧化亚铁 氢氧化镁 氢氧化铝 氢氧化钾 氢氧化钠 氢氧化铁 3、“某酸某”,即“X 酸根”和“某”两部分
化学式与化合价教学设计 教学目标: 1、知识与技能 (1)了解化学式的涵义 (2)知道一些常见的元素和根的化合价 (3)能用化学式表示某些物质的组成,并能利用化合价推求化学式。 (4)了解相对分子质量的涵义,并能利用相对原子质量和相对分子质量计算物质的组成。 (5)能看懂某些商品标签或说明书上标示的物质成分和含量 重点: 一些元素和根的化合价,用化学式表示物质的组成,并利用化合价推求化学式,利用相对原子质量和相对分子质量计算物质的组成。 难点: 化学价的理解,化学式的书写,利用化合价写化学式 第一课时 复习提问: 1、小测元素符号 2、书写物质分类表,每种物质各举两例,写出该物质的名称。 情景导入: 物质的名称很难确切表达一种物质的组成,化学式可以简单明了地表示物质分子的组成,一种纯净物只用一种化学式表示,化学式是国际通用的,它为学习和研究带来方便。 讲授新课: 一、化学式(板书) 讲解:什么是化学式? 1、化学式:见课本第79页(板书) 2、化学式的写法、读法(板书) (1)单质化学式的写法、读法(板书) 提问:什么是单质?(追问:单质的化学式怎样书写?) 板书:在学生板书的物质分类表各类物质的后边将名称改为化学式。 (2)化合物化学式的写法、读法(板书) 提问:什么是化合物? 讨论:化合物不是由一种元素组成而是由两种或两种以上元素组成的纯净物。书写
化合物的化学式要抓住关键的两点?哪两点? 小结:书写化合物化学式的关键在抓住:元素符号排列顺序的规定;原子个数、原子个数(解码)的书写部位。 讲解:①氧化物:如:HgO、SO2、Fe3O4 写法:另一元素在前,氧元素在后 读法:氧化某几氧化几某 ②金属与非金属元素组成的化合物:如:NaCl、ZnS、KCl 写法:金属元素在左,非金属元素在右 读法:某化某 练习:课本第82页活动与探究 3、化学式的意义(板书) 提问:O2的意义?(追问:2O2的意义,再进一步追问符号O、2O表示的意义) 小结: 表示一种物质及这种物质的组成 化学式的意义:表示这种物质的一个分子以及这种物质的分子构成(由分子构成的物质) 提问:H2O表示的意义? 小结:H2O表示:水,水是由氢氧两种元素组成;还表示一个水分子;每个水分子是由2个氢原子和1个氧原子构成。 提问:2H2O所表示的意义? 小结:由分子构成的物质化学式前面的化学计量数表示分子个数。 表示2个水分子 表示每个水分子中有两个氢原子 练习:口答下列符号各表示什么意义? H、 2H、 H2、2H2、H+、2H+ 、O、2O、O2、2O2、CO2、2CO2 讲评并小结:元素符号前边的化学计量数表示原子个数;化学式前边的化学计量数表示分子个数(由分子构成的物质);元素符号右下角的小数字表示构成一个分子的原子个数。构成两个氢分子的原子个数的计算:构成一个分子的原子个数与分子个数的乘积。如:两个氢分子是由4个氢原子构成。又如:两个水分子中(2H2O)中,有4个氢原子和2个氧原子。 作业:新学案 板书设计 课题4 化学式与化合价 一、什么是化学式? 1.定义:由元素符号表示物质组成的式子叫做化学式。
化合价与化学式 一、知识梳理 1、化合价的定义 初中知识梳理高中知识梳理 化学式的定义原子结构示意图 化合价的定义原子核外电子的排布规律 常见元素和根的化合价常见元素的主要化合价及其递变规律 化合物中元素化合价的判断元素化合价与最外层电子数之间的关系 知识衔接点拨:这部分内容在初中教材中介绍的不够深入,虽然也可能进行过大量训练,但是由于初中知识的局限性,大多数同学对化合价的概念没有掌握,以至于在进入高中后的学习过程中感到与化合价的变化密切相关的氧化还原理论非常艰涩难懂,甚至在整个高中化学的学习过程中都分不清关于氧化还原反应的相关概念,更不用说弄清它们之间的关系了。因此,要想从根本上解决这个问题,首先应把常见元素的符号及常见化合价记准背熟,再次应下大力气弄清1-18号元素的核外电子排布和原子结构示意图,按照结构决定性质、性质反映结构的观点,用元素周期律揭示常见元素的主要化合价的递变规律,最后用元素周期表中元素所处的位置印证元素的性质与原子结构之间的关系,就能真正的领会掌握元素的“位(位置)、构(原子结构)、性(元素性质)”三者之间的关系,从而更深刻地理解并掌握元素化合价的定义,最终为氧化还原理论的深入学习打下坚实的基础,做好知识的充分准备。 针对性训练:1、科学家研究发现,以Y2O3、BaCO3和CuO为原料经研磨烧结后可以合成一种高温超导物质,其化学式可写成Y2Ba4Cu6O13,且在合成过程中各元素的化合价均无变化,则() A、此合成过程的反应类型是化合反应,Y的化合价为+2价 B、此合成过程的反应类型是化合反应,Y的化合价为+3价 C、此合成过程的反应类型不是化合反应,Y的化合价为+2价 D、此合成过程的反应类型不是化合反应,Y的化合价为+3价 2、根据元素化合价书写化学式 初中知识梳理高中知识梳理 根据元素化合价书写物质化学式的一般步 主要用于确定有机物的结构简式、解释化学键的形成 骤 描述某些典型物质分子的空间构型 能用化学式表示物质的组成并能用 化合价推求化学式 常见金属、非金属元素的一般化合价在有机化学中引入氧化数的概念在更广义的范畴上研究化 合价 确定化合物中各种元素原子数目的方法 知识衔接点拨:根据元素化合价书写物质的化学式是学习化学的基本素质和基本技能,在高中阶段更加注重的是使用元素化合价与原子最外层电子数的关系解释化学键的形成、某些有机物分子的空间构型,特别是在确定并书写有机物的同分异构体时应用的更为广泛,由此可以看出:上述能力要求的本质仍然是理解并应用化合价的概念,因此要求同学们一定要彻底掌握它。 针对性训练:2、为了防染病疫情发生,必须对发生重大自然灾害的地区进行环境消毒,下列有关常
化学式的书写练习 基础知识: 1、构成物质的基本粒子:分子、原子、离子。由分子构成的物质: 由原子构成的物质:;由离子构成的物质: 。 2、分子、原子、离子的特点:(1),(2)(3) 。1滴水中大概有1.67x1021 个水分子说明分子的特点(填序号下同);物体的热胀冷缩;炒菜时闻到香味。 3、用分子原子的观点解释变化的实质:分子与原子的本质区别是。 4、质子数= == ,决定原子种类的是,决定元素化学性质的是。 5、相对原子质量= = 。 6、根据原子结构示意图和元素的性质,我们可以把元素周期表的元素分为三类:(1)稀有气体:最外层电子数为(He为),化学性质 (2)金属元素:最外层电子数为,化学性质 (3)非金属元素:最外层电子数为,化学性质 因此只有一个电子层时,我们认为最外层电子数是达到相对稳定结构;不止一个电子层时,我们认为最外层电子数是达到相对稳定结构。 7、H的意义,Cu的意义 CO2的意义。 在元素符号前面加数字表示;在离子符号前面加数字表示 在化学式前面加数字表示。 例如:4个铁原子2个硫酸根离子3个二氧化碳分子 8、周期表中前20号元素。
9、氢氧根离子硝酸根离子硫酸根离子 碳酸根离子磷酸根离子铵根离子 高锰酸根离子锰酸根离子碳酸氢根离子 10、物质分为纯净物和混合物。其中纯净物是指,纯净物又分为单质和化合物。单质是指:化合物是指: 化合物又分为有机物和无机物,有机物是指(除了不是)无机物中又包含氧化物,氧化物是指。 11、水电解负极产生的气体是,检验的方法:现象:正极产生的气体是,检验的方法:其表达式为: 12、氧原子的原子结构示意图,其符号为:它在化学变化中容易电子,变成离子,其结构示意图为,符号为,因此我们就说氧元素在化学变化中显价。 13、化合价口诀: 14、书写化学式的依据是,其口诀: 例如氯化钾,碳酸钠,硫酸。 15、根据化学式求化合价的依据是。例如求NaNO2中N的化合价。 16、地壳中前五位元素: 17、乡村净水使用的沉淀剂是,其净水原理:。 活性炭的作用:,其属于变化。 18、过滤的作用: 19、硬水:软水: 其区别:硬水的危害: 硬水转化为软水的方法:生活中,实验室中。 一、单质的化学式的书写
课题四化学式与化合价 教学目标: 1、知识与技能 (1)了解化学式的涵义 (2)知道一些常见的元素和根的化合价 (3)能用化学式表示某些物质的组成,并能利用化合价推求化学式。 (4)了解相对分子质量的涵义,并能利用相对原子质量和相对分子质量计算物质的组成。 (5)能看懂某些商品标签或说明书上标示的物质成分和含量 重点: 一些元素和根的化合价,用化学式表示物质的组成,并利用化合价推求化学式,利用相对原子质量和相对分子质量计算物质的组成。 难点: 化学价的理解,化学式的书写,利用化合价写化学式 第一课时 复习提问: 1、小测元素符号 2、书写物质分类表,每种物质各举两例,写出该物质的名称。 情景导入: 物质的名称很难确切表达一种物质的组成,化学式可以简单明了地表示物质分子的组成,一种纯净物只用一种化学式表示,化学式是国际通用的,它为学习和研究带来方便。 讲授新课: 一、化学式(板书) 讲解:什么是化学式? 1、化学式:见课本第79页(板书) 2、化学式的写法、读法(板书) (1)单质化学式的写法、读法(板书) 提问:什么是单质?(追问:单质的化学式怎样书写?) 板书:在学生板书的物质分类表各类物质的后边将名称改为化学式。 (2)化合物化学式的写法、读法(板书) 提问:什么是化合物? 讨论:化合物不是由一种元素组成而是由两种或两种以上元素组成的纯净物。书写
化合物的化学式要抓住关键的两点?哪两点? 小结:书写化合物化学式的关键在抓住:元素符号排列顺序的规定;原子个数、原子个数(解码)的书写部位。 讲解:①氧化物:如:HgO、SO 2、Fe 3 O 4 写法:另一元素在前,氧元素在后 读法:氧化某几氧化几某 ②金属与非金属元素组成的化合物:如:NaCl、ZnS、KCl 写法:金属元素在左,非金属元素在右 读法:某化某 练习:课本第82页活动与探究 3、化学式的意义(板书) 提问:O 2的意义?(追问:2O 2 的意义,再进一步追问符号O、2O表示的意义) 小结: 表示一种物质及这种物质的组成 化学式的意义:表示这种物质的一个分子以及这种物质的分子构成(由分子构成的物质) 提问:H 2 O表示的意义? 小结:H 2 O表示:水,水是由氢氧两种元素组成;还表示一个水分子;每个水分子是由2个氢原子和1个氧原子构成。 提问:2H 2 O所表示的意义? 小结:由分子构成的物质化学式前面的化学计量数表示分子个数。 表示2个水分子 表示每个水分子中有两个氢原子 练习:口答下列符号各表示什么意义? H、 2H、 H 2、2H 2 、H+、2H+ 、O、2O、O 2 、2O 2 、CO 2 、2CO 2 讲评并小结:元素符号前边的化学计量数表示原子个数;化学式前边的化学计量数表示分子个数(由分子构成的物质);元素符号右下角的小数字表示构成一个分子的原子个数。构成两个氢分子的原子个数的计算:构成一个分子的原子个数与分子个数的乘积。如:两个氢分子是由4个氢原子构成。又如:两个水分子中(2H 2 O)中,有4个氢原子和2个氧原子。 作业:新学案 板书设计 课题4 化学式与化合价 一、什么是化学式?
常见元素离子、化合价与某些物质化学式的练习 一、常见的离子 1.氢离子_ 2.氧离子_ 3.氟离子_ 4.钠离子_ 5.镁离子_ 6.铝离子_ 7.硫离子_ 8.氯离子_ 9.钾离子_ 10.钙离子_ 11.铜离子_ 12.亚铁离子_ 13.铁离子_ 14.银离子_ 15.钡离子_ 16.锌离子_ 17.氢氧根离子_ 18.硝酸根离子_ 19.硫酸根离子_ 20.碳酸根离子_ 21.铵根离子_ 二、常见元素(化合物中)的化合价 1. H _ 价 2. O _ 价 3. F _ 价 4. Na _ 价 5. M g _ 价 6. Al 价 7. K _ 价 8. Ca _ 价 9.Zn _ 价10.A g_ 价11. Ba _ 价12.H g价 13.Br_ 价14.Fe_ 价15.Cu _ _ 价 三、某些物质的化学式 1、单质 (1)单原子类 ①稀有气体类 氦气_ 氖气_ 氩气_ ②非金属固体类 碳_ 硫黄_ 红磷(白磷)_ ③金属类 汞(水银)_ 铁_ 铜_ (2)多原子类(形如Xn) ①某气 氢气_ 氧气_ 氮气_ 氯气 ②其他臭氧_ 2、化合物
(1)氧化物 水过氧化氢氧化亚铁三氧化二铁(氧化铁)四氧化三铁氧化亚铜氧化铜氧化汞 三氧化二铝(氧化铝)氧化镁氧化钙二氧化锰五氧化二磷二氧化硫三氧化硫 一氧化氮二氧化氮一氧化碳二氧化碳(2)金属化合物 氯化钾氯化钠氯化钙氯化钡 氯化银氯化亚铜氯化铜氯化镁 氯化锌氯化亚铁氯化铁氯化铝 碘化钾硫化钠 (3)根团化合物 ①氢氧化某 氢氧化钾氢氧化钠氢氧化钙氢氧化钡 氢氧化铜氢氧化亚铁氢氧化铁氢氧化铝 ②硝酸某 硝酸钾硝酸钠硝酸铜硝酸汞硝酸银 硝酸钡硝酸锌硝酸镁硝酸亚铁硝酸铁 ③硫酸某 硫酸钾硫酸钠硫酸铜硫酸钡 硫酸钙硫酸亚铁硫酸铁硫酸铝 ④碳酸某 碳酸钾碳酸钠碳酸钡碳酸钙碳酸镁 ⑤某铵 氯化铵硫酸铵碳酸铵硝酸铵 ⑥某酸 盐酸硫酸碳酸硝酸 ⑦其他氯酸钾高锰酸钾锰酸钾
根据化合价书写化合物的化学式导学案 学习目标 1、学会根据化合价写出常见物质的化学式 2、根据化学式能说出物质的名称 教学重点难点 根据元素化合价写出物质的化学式 一、化合价的应用归纳(回顾) 1、根据化合价书写离子符号 2、根据化学式判断元素的化合价 3、根据化合价写出化合物的化学式 (原理:化合物中元素正负化合价的代数和为零) 二、根据化合价书写化学式 1、认识化合价与化学式之间的关系 (1)观察下列物质的化学式,标出元素化合价,并找出其元素及化合价与化学式的关系? NaCl MgCl2AlCl3Na2O MgO Al2O3 有什么样的关系? 2、化学式书写的一般原则是: (1)一般正价元素(或原子团)的元素符号写在边,负价元素(或原子团)的元素符号写在边。原子的数目用阿拉伯数字写在元素符号的。 (2)化合物中元素正负化合价的代数和为。 (3)化学式书写中,先读的写,后读的写。 3、如何正确书写物质的化学式 (1)写出组成物质的各元素符号(正价在,负价在) (2)标出有关元素的化合价 (3)化合价数、角码交叉写 (4)化成最简(某些特殊的化合物中不需要化简,如:) (5)检验(看化合物中元素化合价代数和是否为) 4、试写出下列物质的化学式 氯化钾氯化铜氯化铁氯化钙氧化钾氧化锌氧化铝氧化亚铁思考:为什么铁有铁和亚铁的读法之分? 5、化学式中含有原子团时的书写 (1)原子团要加角码时得先用括号括起 (2)当角码是“1”时要省略,括号也要省略 6、试写出下列带原子团的物质的化学式 硫酸钠氢氧化铜氢氧化铁硫酸铝硫酸铵硝酸钡 三、化合物的命名 1、根据化学式读出物质名称,并试着说出其特点 (1)CO2SO2CO P2O5
化学式的书写及命名 班级______ 姓名__________学号_______ 1.列物质名称和对应的化学式都正确的一组是() A.镁Mg B.碳酸钠NaCO3 C.氧化铁Fe2O3 D.硫酸铜Cu(SO4)2 2.用化学用语填空: (1)两个氮原子;(2)氯化亚铁中的阳离子;(3)氧化镁中镁元素显+2价;(4)地壳中含量最多的金属元素和最多的非金属元素组成的化合物为。 3.用元素符号或化学式填空 (1) 氧元素 (2) 4个水分子 (3) 5个铜原子 (4) 3个亚铁离子 (5) 二氧化锰中+4价的锰元素 (6)地壳中含量最多的非金属元素与含量最多的金属元素组成的化合物的化学 式。 4.某物质含有A、B两种元素,已知A、B两种元素原子的相对原子质量之比为7∶2,经测定该物质A、B两元素的质量比为7∶3,则该物质的化学式为( ) A.A2B3 B.AB2 C.A2B D.A3B2 5.下列物质的化学式书写不正确的是() A.氧化镁MgO B.氧化钠NaO C.硫酸锌ZnSO4D.氢氧化铜Cu(OH)2 6.下列各组物质属于同种物质的是() A.生石灰、熟石灰、CaO B.食盐、纯碱、NaCl C.石灰石、熟石灰、Ca(OH)2D.火碱、烧碱、NaOH 7. Mn2O7是一种强氧化剂,其中Mn元素的化合价为() A.+2 B.+3 C.+5 D.+7 8.从 C、N、H、S、O、Cl、Fe、Ca、Na等元素中选择恰当的元素,用离子符号、化学式或化学方程式按下列要求填空: (1)无色、无味且剧毒的气体; (2)能使紫色石蕊溶液变红的气体化合物; (3)2个硝酸根离子; (4)可用于改良酸性土壤的“碱”; (5)一个“中和反应”的化学方程式。 9.(1)原子数相同、核外电子总数也相同的粒子(分子或离子)互称为等电子体,等电子体往往具有相同的结构和相似的性质,写出下列各粒子的等电子体:CH4、 NO3-。 (2)金属和碳形成的化合物都可以看作离子化合物,可以与水发生复分解反应生成相应的金属氢氧化物和碳氢化合物。如CaC2+2H2O=Ca(OH)2+C2H2↑。试写出下列金属碳化物与水反应生成的碳氢化合物的化学式:ZnC2、Zn2C3。 10.(1)“化学使天更蓝,水更清。”汽车尾气处理装置能使某些有毒气体转化为无毒气体:2NO+2CO→N2+2CO2。在该反应中化合价变化的元素为①(填写元素名称);反应所涉及的物质中:②是光合作用的原料,③能与血红蛋白结合,其中有一种气体是空气中含量最高的,其体积分数约为④。
……………………………………………………………最新资料推荐………………………………………………… 1 常见原子团化合价及离子: 练习: 写出下列离子符号: 钙离子__Ca 2+ ____铝离子__ Al 3+ _ ____镁离子Mg 2+ _ 钾离子___K + ___铁离子_ Fe 3+ _ ____ 亚铁离子____ Fe 2+ _ __氢离子__H + _____银离子_ Ag + ____铜离子 Cu 2+ _ 锌离子 Zn 2+ _ 硫离子 S 2- 氯离子 Cl - 钠离子___ Na + ___氧离子__O 2-____镁离子__ Mg 2+ _ 钡离子__Ba 2+ _____ 硝酸根离子___ NO 3- ___铵根离子__ NH 4+ ____碳酸根离子 CO 32- 硫酸根离子 SO 42- 氢氧根离子 OH - 磷酸根离子__ PO 43- ____ 写出下列物质的化学式: 氧化钾 氧化钠 氧化钙 氧化亚铁 氧化铁 氧化铝 K2O Na2O CaO FeO Fe2O3 Al2O3 氯化钾 氯化钠 氯化银 氯化铵 氯化钙 氯化钡 氯化铝 KCl NaCl AgCl NH 4 Cl CaCl 2 BaCl 2 AlCl 3 氯化镁 氯化铜 氯化锌 氯化亚铁 氯化铁 MgCl 2 CuCl 2 ZnCl 2 FeCl 2 FeCl 3 氢氧化钾 氢氧化铝 氢氧化钙 氢氧化钡 氢氧化镁 氢氧化铜 KOH Al(OH)3 Ca(OH)2 Ba(OH)2 Mg(OH)2 Cu(OH)2 氢氧化钠 氢氧化铁 氢氧化锌 氢氧化亚铁 NaOH Fe(OH)3 Zn(OH)2 Fe(OH)2 碳酸钾 硫酸钾 硝酸钾 碳酸钠 硫酸钠 硝酸钠 K 2 CO 3 K 2SO 4 KNO 3 Na 2 CO 3 Na 2SO 4 NaNO 3 碳酸银 硫酸银 硝酸银 碳酸铵 硫酸铵 硝酸铵 Ag 2 CO 3 Ag 2 SO 4 AgNO 3 (NH 4)2 CO 3 (NH 4)2SO 4 NH 4 NO 3 碳酸钙 硫酸钙 硝酸钙 碳酸钡 硫酸钡 硝酸钡 CaCO 3 CaSO 4 Ca(NO 3)2 BaCO 3 BaSO 4 Ba(NO 3 )2 碳酸镁 硫酸镁 硝酸镁 碳酸铜 硫酸铜 硝酸铜 MgCO 3 MgSO 4 Mg(NO 3 )2 CuCO 3 CuSO 4 Cu(NO 3 )2 碳酸锌 硫酸锌 硝酸锌 碳酸亚铁 硫酸亚铁 硝酸亚铁 ZnCO 3 ZnSO 4 Zn(NO 3 )2 FeCO 3 FeSO 4 Fe(NO 3 )2 硫酸铁 硝酸铁 硫酸铝 硝酸铝 Fe 2(SO 4)3 Fe(NO 3 )3 Al 2(SO 4)3 Al(NO 3 )3
化合价和化学式
化合价和化学式 一、基本用语 (一)元素符号 1、1~20号元素(按顺序)的名称及符号: 氢 H 氦He 锂Li 铍 Be 硼 B 碳 C 氮 N 氧 O 氟 F 氖Ne 钠 Na 镁 Mg 铝 Al 硅 Si 磷 P 硫 S 氯 Cl 氩Ar 钾 K 钙 Ca 【注意】:元素符号必须是大写字母,如果有两个字母的,则第一个大写,第二个小写。 2、金属活动性顺序表: 钾K 钙Ca 钠Na 镁Mg 铝Al, 锌Zn 铁Fe 锡Sn 铅Pb 氢H, 铜Cu 汞Hg 银Ag 铂Pt 金Au,. 3、其它重要元素:钡 Ba 锰 Mn 碘 I 。 (一)化合价部分 常见元素的化合价口诀: 钾钠氢银正一价 1 K +1 Na +1 Ag + 钙镁钡锌正二价 2 Ca +2 Mg +2 Ba +2 Zn + 通常氧硫负二价 2 O -2 S - 铜、汞二,铁二、三 2 Cu +2 Hg +2 Fe +3 Fe + 氟、氯负一铝为三 1 F -1 Cl -3 Al + (二)常见原子团(根)的化合价:
磷酸根3PO -4 铵根1 NH +4 硫酸根2 4SO - 亚硫酸根23SO - 碳酸根23CO - 锰酸根 2 4MnO - 氢氧根1OH - 硝酸根13NO - 氯酸根13ClO - 高锰酸根 1 4MnO - ①“原子团”一般是两种原子按一定方式形成的一个特定的组合(原子集团),又叫“根”它是构成化合物的一个组成部分。 ②常见的这十种原子团里有8种是酸根,形成为XO 4或XO 3,一般来说X 是某元素就代表是某酸根,如“PO 4”叫磷酸根,“NO 3”是特例,叫硝酸根。难点是记熟酸根中氧的脚码是3或4。 二、化合物化学式的书写 (一)根据化合价书写化学式: 1、书写口诀:正左负右标上头,约分交叉和为零 例:书写下列物质的化学式 氧化铝 氯化镁 硫酸铵 2、练习:在下表中空格几,填写出相应的化学式 1 H + 1 Na + 2 Fe + 3 Fe + 1 4NH + 2 O - 1 OH - 2 3CO - (二)根据名称书写化学式
根据化合价写化学式 1. 常见元素的化合价的口诀: 一价氢氯钾钠银;二价氧钙钡镁锌,三铝四硅五氮磷;二三铁二四碳,二四六 硫都齐全;铜贡二价最常见。氢一氧二为标准,单质价态总为零。? 2. 常见原子团的化合价口诀: 一价铵根硝酸根;氢卤酸根氢氧根? 高锰酸根氯酸根;高氯酸根醋酸根? 二价硫酸 碳酸根;氢硫酸根锰酸根? 暂记铵根为正价;负三有个磷酸根? 一、请写出下列元素常见的化合价: 5. 锌 6. 银 7.汞 三、结合化合价的知识写出下列物质的化学式:
(二) 酸: 2.稀盐酸________ 3.硝酸. _______ 4.碳酸________ 5.磷酸 (三)碱(氢氧根的化合价为___ 价) 1.氢氧化钠______ 2. 氢氧化钙(熟石灰)___________ 3. _______________________ 氢氧化亚铁(+2) ___________ 4. 氢氧化铁(+3)________________________ 5. _______________ 氢氧化铝_________________________ 6.氢氧化铜(+2)___ 7.氨水____________ 8. 氢氧化镁 _____ 9. 氢氧化钡 __________ 10. 氢氧化钾___________ (四)盐 (1)氯化物(氯元素常显____ 价) 1.氯化钠_______ 2. 氯化钙 _________ 3.氯化铝__________ 4.氯化铁(+3) ____________ 5. 氯化亚铁(+2) ______ 6.氯化铜________ 7.氯化银 _______ 8. 氯化钡_______ 9. 氯化铵. ______ 10.氯化锌____________ 11.氯化镁________ 12.氯化钾 (2)硫酸盐(硫酸根显_____ ) 1.硫酸钾_______ 2.硫酸钡__________ 3. 硫酸亚铁(+2)______ 4. 硫酸铝_______ 5.硫酸铁(+3) _______ 6. 硫酸镁________________ _______ 5. 碳酸氢铵______________ 四.常见的化学式 1.高锰酸钾_________ 2. 锰酸钾____________ 3.氯酸钾___________ 4. ___________ 氨气 5. ________________ 五水硫酸铜 6. __________________ 碱式碳酸铜______________ 7.碳酸氢钠 8.十水碳酸钠_________ 9.亚硝酸钠 _________ 10. ______________________ 氨水(一水合氨)________ 11. 氢硫酸气体 12.氯化氢气体____ 13. 亚硫酸___________ 五:有机物 1.甲烷CH、 2.酒精(乙醇)C2H5OH 3.甲醇CH30H 4.醋酸(乙酸)CH3C00H 5.乙炔C 2H