皮肤中的P物质及其作用
- 格式:docx
- 大小:27.76 KB
- 文档页数:7

人皮下发现的酶种类和大致含量
人体皮肤下存在多种酶,这些酶在维持皮肤健康和功能方面发
挥着重要作用。
以下是一些常见的酶种类和它们的大致含量:
1. 脂肪酶,脂肪酶在皮肤中起着分解脂肪的作用,帮助维持皮
肤的水脂平衡。
它的含量会因个体差异而异,一般来说,脂肪酶的
含量在皮肤中是适量的。
2. 胶原酶,胶原酶有助于分解和合成胶原蛋白,这是皮肤中重
要的结构蛋白,能够维持皮肤的弹性和紧致度。
胶原酶的含量会随
着年龄增长而逐渐减少。
3. 氧化酶,氧化酶参与调节氧化还原反应,有助于清除自由基
和抗氧化。
它的含量会受到环境因素和生活方式的影响,一般来说,皮肤中氧化酶的含量是适量的。
4. 氨基酸酶,氨基酸酶帮助分解蛋白质,促进皮肤细胞的更新
和修复。
它的含量在皮肤中是适量的,有助于维持皮肤的健康状态。
总的来说,人体皮肤下存在多种酶,它们各自在维持皮肤健康
和功能方面发挥着重要作用。
然而,这些酶的含量会受到多种因素的影响,如年龄、环境、遗传等,因此具体的含量会因个体差异而异。
维持适量的酶含量有助于保持皮肤的健康和年轻状态。

皮肤生理知识
皮肤是人体最大的器官,具有多种生理功能。
以下是一些关于皮肤生理的知识:
1. 保护功能:皮肤作为人体的第一道防线,能够防止外界有害物质入侵,保护内部器官和组织不受损伤。
2. 吸收功能:皮肤能够吸收外界物质,如水分、营养物质、药物等。
皮肤的吸收主要通过角质层进行,一些物质可以通过角质细胞间隙进入皮肤。
3. 分泌与排泄功能:皮肤通过汗腺和皮脂腺分泌汗液和皮脂,这些物质可以调节体温、排泄废物和毒素。
4. 感觉功能:皮肤内含有丰富的感觉神经末梢,可以感受外界的各种刺激,产生触觉、痛觉、压力觉、温度觉等感觉。
5. 防晒功能:皮肤中的黑色素细胞能够合成黑素体,吸收紫外线,减少紫外线对皮肤的伤害,预防肌肤老化。
6. 调节体温功能:皮肤通过收缩和舒张血管来调节体温,保持体温的恒定。
7. 代谢功能:皮肤参与人体的代谢过程,合成和分解一些物质,如维生素D 等。
8. 免疫功能:皮肤是人体免疫系统的一部分,能够抵御外界病原体的入侵,保护内部组织不受损伤。
此外,根据皮肤的特点,还可以将其分为不同的类型,如油性皮肤、干性皮肤、敏感性皮肤和中性皮肤等。
不同类型皮肤的生理特点和护理方法也有所不同。
了解皮肤的生理知识有助于维护皮肤的健康,保持身体的正常生理功能。



皮肤生理知识皮肤是人体最大的器官之一,具有多种重要的生理功能。
它不仅起到保护内部器官的作用,还参与体温调节、感觉传导和免疫防御等重要功能。
本文将以人类的视角,详细介绍皮肤的生理知识。
皮肤的主要组成部分包括表皮、真皮和皮下组织。
表皮是最外层的一层,由多层角质化的上皮细胞构成。
它起到了防止外界物质和微生物侵入的作用。
表皮中还含有黑色素细胞,它们产生黑色素来赋予我们的皮肤颜色。
真皮位于表皮下方,由结缔组织和弹性纤维构成。
真皮中含有毛囊、汗腺和神经末梢等结构,它们与皮肤的感觉和调节有关。
皮下组织位于真皮下方,主要由脂肪组织构成,起到保护和绝缘的作用。
皮肤的一个重要功能是调节体温。
当我们体温升高时,汗腺会分泌汗液,通过蒸发来散发热量,从而降低体温。
另外,皮肤中的血管可以调节血液的流动,通过扩张或收缩来调节体温。
当环境温度较低时,血管会收缩,减少热量散失;而当环境温度较高时,血管会扩张,增加热量散失。
感觉传导也是皮肤的重要功能之一。
皮肤中的神经末梢能够感知各种刺激,如触觉、痛觉和温度等。
这些感觉信息会通过神经传递到大脑,使我们能够感知和反应外界刺激。
例如,当我们触碰到热物体时,神经末梢会立即传递热觉信息到大脑,引发我们的回避反应。
皮肤还具有免疫防御的功能。
它作为我们与外界环境的第一道屏障,能够抵御细菌、病毒和其他有害物质的侵入。
表皮细胞的角质化过程使得皮肤表面形成一层保护膜,防止微生物进入体内。
同时,皮肤中的免疫细胞也能够识别和消灭入侵的病原体,保护我们的身体免受感染。
总结起来,皮肤是一个复杂而重要的器官,具有保护、调节体温、感觉传导和免疫防御等多种生理功能。
通过深入了解皮肤的生理知识,我们能够更好地保护和维护我们的皮肤健康。
只有保持良好的生活习惯和皮肤护理,才能使我们的皮肤保持光滑、健康和年轻。

皮肤中的P 物质及其作用吴胜,吴仲敏*,傅磊冕(台州学院医学院解剖学教研室, 浙江台州,318000)摘要:P 物质是一种高活性的神经肽类物质,广泛地分布于神经系统和其他外周组织器官内,具有多种生理功能。
在皮肤,P 物质主要由感觉神经末梢释放,它通过趋化免疫细胞、调节细胞因子的产生以及舒张微血管等参与皮肤局部免疫炎症反应;还可促进皮肤内多种细胞的分裂、增殖以及细胞DNA的合成,参与皮肤创伤的修复;此外,P 物质作为一种重要的瘙痒介质,与多种瘙痒性皮肤疾病的发生和发展有关。
关键词:P 物质;皮肤;组织修复;炎症;瘙痒1 P 物质的生物学特点P 物质(substance P,SP) 是世界上发现最早的神经肽。
由Von Euler 和Gaddum 于1931 年在马肠中提取乙酰胆碱时发现,因当时不知道其化学性质,故取名P 物质。
1970 年Chang 和Leeman 将SP 纯化,提出十一肽序列,Arg-Pro-Lys-Pro-Gln-Gln-Phe-Phe-Gly-Leu-Met-NH2,分子量为1340,1972 年Tregear等用化学方法成功地合成此肽。
1973 年Powel 建立了放射免疫分析测定SP 的方法,将SP 的研究和应用提高到一个新的高度。
用重组DNA 技术研究SP 的前体发现SP 来源于前速激肽原( pre-pro-totchykinin,PPT),因此SP 有速激肽类物质之称,PPT分成PPT-A 和PPT-B 两种,PPT-A 又分为α-PPT-A、β-PPT-A 和γ-PPT-A。
分子水平的研究进一步发现,PPT-A 的mRNA 含SP 片段。
与经典神经递质(如乙酰胆碱、单胺类、氨基酸类) 的合成方式不同,SP 不是在神经末梢内合成,无活性的SP前体首先在神经元胞体内的核糖体上边合成边进入粗面内质网,经高尔基复合体的修饰加工后形成分泌囊泡,分泌囊泡在向神经末梢运输的过程中,仍可对其中的SP 加工修饰,装配在大囊泡中运至神经末梢,当神经末梢受刺激时,囊泡中的SP 即释放,并与其特异性受体结合以发挥作用。
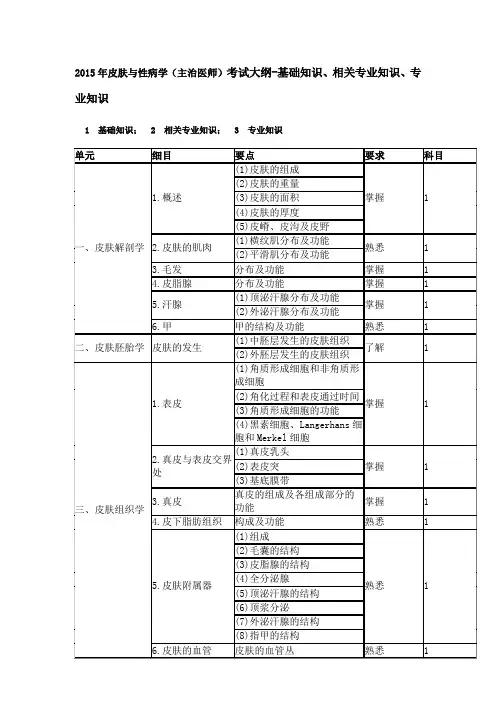
2015年皮肤与性病学(主治医师)考试大纲-基础知识、相关专业知识、专业知识1 基础知识;2 相关专业知识;3 专业知识(3)诊断及鉴别诊断(4)治疗12.血栓性静脉炎(1)临床表现熟悉 3 (2)诊断及鉴别诊断四十七、营养与代谢障碍性皮肤病1.维生素A缺乏症(1)病因及发病机制熟悉2(2)临床表现 3(3)治疗 32.维生素B缺乏症(1)病因及发病机制熟悉2(2)临床表现 3(3)诊断及鉴别诊断 3(4)治疗 3 3.烟酸缺乏症(1)病因及发病机制掌握2(2)临床表现 3(3)实验室检查 3(4)诊断及鉴别诊断 3(5)治疗 3 4.卟啉症(1)病因及发病机制了解2(2)临床表现 3(3)实验室检查 3(4)诊断及鉴别诊断 3(5)治疗 3 5.黄瘤病(1)分型及临床表现熟悉 3(2)组织病理(3)实验室检查6.原发性皮肤淀粉样变(1)临床表现掌握 3(2)组织病理(3)诊断及鉴别诊断7.粘液性水肿(1)病因及发病机制熟悉2(2)临床表现 3(3)实验室检查 3(4)组织病理 3(5)治疗 3 8.硬肿病(1)临床表现熟悉 3(2)组织病理(3)诊断及鉴别诊断9.肠病性肢端皮炎(1)临床表现了解 3(2)实验室检查(3)诊断及鉴别诊断(4)治疗10.痛风(1)病因及发病机制了解2(2)临床表现 3(3)实验室检查 3(4)治疗 3 11.类脂质渐进性(1)病因及发病机制熟悉 2医疗机构从业人员行为规范与医学伦理学。

⽝猫⽪肤病-⽪肤的结构和⽣理(⼆)-⽑发⽑发是哺乳动物的标志,具有很好的隔热和感知觉功能,是阻⽌化学、物理、光线和微⽣物侵害的屏障。
⽑发可以通过长度、厚度和密度的改变,以及髓质的形成过程帮助调节体温。
总的来说,质地细长,髓质少的⽑发,再加上竖⽑肌增加⽑根深度的作⽤,就能让动物很好地适应寒冷的⽓候。
颜⾊和光泽的变化也能够调节温度和隔绝光线。
浅⾊⽑使动物更容易适应⾼温。
光亮的被⽑可以更好地反光,⽽不是吸收热量。
⽑发的直径取决于⽑基质上⽪;⽑发的长度取决于⽑根⽣长的速度和⽑发⽣长初期(anagen)的持续时间。
⽝猫⾝上的主⽑和次⽑都是有髓⽑发,主⽑也叫被⽑或护⽑,次⽑也叫底⽑。
胎⽑是指⽆髓质的⽑发,因此“胎⽑”⼀词⽤在⾮胎⼉期的⽝猫⾝上不太准确。
猫的次⽑远远多于主⽑(背部10:1,腹部24:1)。
猫的⽑发从外观分三类:护⽑(最粗,⽑直,⽑尖渐细)、芒⽑(较细,接近⽑尖处略略肿胀)、柔⽑(最细,均匀弯曲)。
总之,⽑囊的形状决定了⽑发的弯曲程度,直的⽑囊⽣成笔直的⽑发,卷曲的⽑囊⽣成卷曲的⽑发。
⽑囊在出⽣前就已经形成,出⽣后不会再形成新的⽑囊。
准确地说,⽑发在幼⽝的⽣长过程中不会失去,⽽是会逐渐获得更多成年⽝的⽑发。
幼⽝在12周龄之前会从单⼀⽑囊内长出次⽑。
所有⽑囊都会与表⽪形成30-60度⾓,使⽑发倾斜⽣长。
不同区域的⽑倾斜的⾓度略有不同,从⽽⾃然形成⽑束。
但是⽑束的真正意义和形成原因商不清楚。
⽑发的倾斜可以减少运动阻⼒,同时还有排⽔的作⽤,⽽不是让⽔浸润⾝体,这也是⽑发隔热作⽤的⼀种体现。
⽑发⽣长周期控制或影响⽑发的因素很多,机制⾮常复杂。
成年和幼年阶段⽑的变化也很⼤,由于对热调节、伪装、性吸引和社会交流的需求⽽表现出很多不同。
另外,⽑囊的循环活性和周期性脱⽑是机体的⼀种功能,通过这种功能可使动物的⽑发更加适应⾝边的温度或环境。
光周期的变化对此功能的影响很⼤,它通过对下丘脑、脑垂体、松果体的影响,调节各种激素⽔平的变化(⿊⾊素、促乳素,以及源⾃性腺的、甲状腺的、肾上腺的激素),⽽这些激素是改变⽑囊内在节律的关键。

瘙痒的发生机制作者:王玎来源:《中国社区医师》2011年第28期瘙痒是由于体内外各种物理、化学性有害因素的刺激,导致局部组胺、激肽和蛋白分解酶等化学介质的释放,后者作用于神经末梢,引起痒觉的神经传导。
皮肤发痒就会产生搔抓的欲望,过度搔抓会加重皮肤病。
许多患者为图一时痛快,用力搔抓皮肤瘙痒处,直抓到皮肤出血为止,结果是越抓越痒,越痒越抓,形成恶性循环。
本文就瘙痒发生的机制作阐述。
引起瘙痒的化学介质引起瘙痒的化学介质包括:①二十烷类:前列腺素E2、前列腺素H2;②肽类:组胺、5-羟色胺(5-HT);③神经肽类:P物质;④类阿片类:M-脑啡肽、L-脑啡肽、β-内啡肽;⑤神经因子类:IL-2。
目前,对组胺及组胺释放物、激肽、前列腺素、激肽酶、神经肽及阿片样物质研究较多。
组胺组胺致痒的作用有两个方面:①直接作用:由组胺H1受体传递;②间接作用:可能促使其他介质相继释放。
组胺有3种受体,人类皮肤的研究表明,组胺诱导的瘙痒与H1受体有关,而与H2受体无关。
但组胺诱导的瘙痒并不一定伴组胺增多,如:吗啡能使肥大细胞释放组胺而引起瘙痒,但剂量不足以引起组胺释放的吗啡、内啡肽和甲硫脑啡肽类似物,可增强组胺诱导的瘙痒,故这种强化作用不是组胺释放或前列腺素产生引起的。
阿片样物质(β-内啡肽、强啡肽及脑啡肽) 阿片样物质既是神经递质又是神经激素,是免疫系统中重要的神经因子,同时阿片样物质有中枢致痒作用。
Koenigstein通过动物研究,推测β-内啡肽可能在脑部作为产生痒觉的介质。
将少量阿片样物质注入脊膜腔或硬膜外,在减轻疼痛的同时引起瘙痒,且瘙痒部位无红斑或风疹块,提示无组胺释放。
而且该种瘙痒可被阿片样物质拮抗剂有效地抑制。
同时阿片样物质对外周也有致痒作用,且这种瘙痒似乎不是组胺释放或前列腺素形成所引起。
5-HT 可被血管壁上交感神经末梢摄取并经过5-HT 受体介导,刺激痒觉感受器而引起瘙痒。
痒觉的神经传导通路痒觉感受器一般认为表皮和真皮交界处的游离神经末梢是痒觉感受器,可能属痛觉C纤维。

肥大细胞及P物质与经络的相关研究肥大细胞是一种具有独特功能的细胞,它在免疫和炎症过程中发挥着重要作用。
肥大细胞存在于全身各个组织和器官内,它们由骨髓来源,并在成熟后进入循环系统。
肥大细胞含有许多颗粒,其中包括一种称为P物质的化学物质。
P物质在许多生理和病理过程中都有重要作用,它与神经系统的调节有关,同时也参与了免疫和炎症反应。
在中医理论中,经络是人体内部的重要通道,它贯穿全身各个组织器官,调节着人体的生理功能。
现代研究表明,肥大细胞及其释放的P物质与经络的相关性备受关注。
这种相关性可能对于理解中医经络系统的作用机制,以及为肥大细胞相关疾病的治疗提供新思路具有重要意义。
肥大细胞和P物质在经络中的分布肥大细胞最初由德国科学家保尔·艾哈德·埃罗利希于1878年发现,他将这种细胞描述为具有大量颗粒的细胞。
后来,科学家们发现,肥大细胞存在于人体各个组织中,特别是在皮肤、呼吸道、血管壁等处。
肥大细胞的颗粒内含有丰富的生物活性物质,例如组胺、5-羟色胺、P物质、白三烯C4等。
P物质是一种神经传导介质,被发现在中枢神经系统、外周神经系统和免疫细胞中。
P物质的主要功能是传递神经冲动,参与痛觉传导和免疫调节。
经络作为中医理论中的重要概念,一直是中医学研究的焦点之一。
经络被认为是一种无形的通道,它连接着人体的各个组织器官,是调节生理功能的重要通道。
现代研究发现,在经络中存在着大量的肥大细胞,这些肥大细胞含有丰富的P物质。
科学家们开始关注肥大细胞与P物质在经络中的分布情况,以及它们对经络功能的影响。
肥大细胞及P物质与经络的生理作用肥大细胞及其释放的P物质在经络中可能发挥着重要的生理作用。
研究表明,P物质是神经传导介质和免炎介质,它对于神经调节和免炎反应都具有重要作用。
而经络被认为是一种调节生理功能的通道,它通过调节气血运行,来维持人体的正常生理活动。
肥大细胞及其释放的P物质可能通过经络对人体的生理功能发挥着调节作用。

P物质对表皮细胞聚集、分化控制及在皮肤创伤修复中的应用彭希亮;张玉红;倪文琼【期刊名称】《中国组织工程研究》【年(卷),期】2016(020)011【摘要】背景:表皮干细胞是皮肤及其附属器修复的源泉细胞,研究其分化、迁移的调控机制是实现其完美愈合的关键。
目的:探讨P物质在皮肤创伤修复中的应用效果。
方法:采用随机对照方法将30只Wistar大鼠分为P物质组、辣椒素组和对照组,每组10只。
建立皮肤缺损模型后分别于创面局部注射外源性神经肽P 物质、辣椒素、生理盐水,均连续注射5 d。
用药不同时间点检测3组大鼠皮肤厚度、皮肤创伤面积、BrdU阳性细胞率。
结果与结论:1用药第14天3组大鼠皮肤厚度差异无显著性意义(P〉0.05);随着用药时间的不断延长,表皮厚度开始变薄;用药第42天,P物质组表皮厚度明显缩小,对照组表皮厚度变化不明显,辣椒素组表皮厚度有所缩小。
2皮肤创伤3,5,7 d时P物质组皮肤创伤面积显著小于对照组和辣椒素组(P〈0.05),辣椒素组和对照组的创伤面积差异无显著性意义(P〉0.05)。
3P物质组在用药第3,5,7,12天时Brd U细胞阳性率显著高于辣椒素组和对照组(P〈0.05);辣椒素组在第3,5,7,12天时BrdU细胞阳性率显著低于对照组(P〈0.05)。
4结果提示P物质能够促进表皮细胞增殖,加速创面部位愈合。
【总页数】6页(P1538-1543)【作者】彭希亮;张玉红;倪文琼【作者单位】郑州大学附属郑州中心医院,河南省郑州市450007【正文语种】中文【中图分类】R318【相关文献】1.透明质酸在皮肤创伤修复中的应用 [J], 金艳;李大伟;祝美华;陈建英2.递进减张技术在皮肤缺损性创伤修复中的应用 [J], 陆海山;何冬梅;郭剑;陈智勇;夏东胜;赵启明3.脂肪干细胞在皮肤创伤修复中的研究进展与应用前景 [J], 傅士博;王雪;温从吉;王丹茹4.皮肤创伤修复中Wnt信号途径对皮肤干细胞增殖分化的调控机制 [J], 丘日升;杨斌5.P物质对表皮细胞聚集、分化控制及在皮肤创伤修复中的应用 [J], 彭希亮;张玉红;倪文琼因版权原因,仅展示原文概要,查看原文内容请购买。
过氧化物酶体增殖物激活受体γ在炎症相关疾病中作用的研究进展任润健;赵虎;毕波【摘要】Peroxisome proliferator-activated receptor gamma(PPARγ)is a member of typeⅡ nuclear receptor superfamily,as a ligand-dependent transcription factor. In recent years,studies have shown that activated PPARγ is capable of modulating the expression of numerous genes and is involved in many physiological and pathological processes,including anti-obesity,anti-atherosclerosis,anti-diabetes mellitus,anti-cancer and anti-inflammatory skin diseases. These diseases are closely related to inflammation. In this review,the research progress of PPARγ in inflammation and inflammatory-related diseases will be summarized.%过氧化物酶体增殖物激活受体γ(PPARγ)是一种配体依赖性转录因子,属Ⅱ型核受体超家族成员.近年来的研究表明,配体激活的PPARγ能够调控大量基因表达,参与抗肥胖、抗动脉粥样硬化、抗糖尿病、抗肿瘤、抗皮肤炎症性疾病等机体众多的生理和病理过程,而这些疾病与炎症息息相关.因此,文章主要就PPARγ在炎症以及炎症相关疾病中的研究进展作一综述.【期刊名称】《检验医学》【年(卷),期】2017(032)002【总页数】5页(P153-157)【关键词】过氧化物酶体增殖物激活受体γ;炎症;配体【作者】任润健;赵虎;毕波【作者单位】复旦大学附属华东医院检验科,上海 200040;复旦大学附属华东医院检验科,上海 200040;复旦大学附属华东医院检验科,上海 200040【正文语种】中文【中图分类】R446.62过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor gamma,PPARγ)是一种配体依赖性转录因子,是PPAR的亚型之一,属Ⅱ型核受体超家族成员。
感觉神经肽P物质在损伤修复中的作用及分子机制(作者:___________单位: ___________邮编: ___________)【摘要】为探讨感觉神经肽P物质(SP)在损伤修复中的作用,围绕感觉神经与修复进程中创面/伤口SP代谢的关系、SP在修复细胞表达生长因子及受体、表皮干细胞迁移、分化等方面的作用开展了研究。
研究证实感觉神经释放的SP可上调成纤维细胞表达神经肽,诱导成纤维细胞表达生长因子及受体,调控表皮干细胞迁移、分化的作用,进入肉芽组织内的表皮干细胞可跨胚层向血管内皮细胞和成纤维细胞分化,提示感觉神经肽SP参与介导感觉神经调控损伤修复。
【关键词】感觉神经肽损伤修复P物质Effect of sensory neuropeptide SP on wound healing and its molecular mechanismAbstract:To investigate the effect of sensory neuropeptide substance P(SP) on wound healing and relatedmolecular mechanism.The research was carried out on the relationship between sensory nerves and metabolism of sensory neuropeptide SP in the wounds,the role of SP in the expression of growth factors and those receptors by repair cells,and participation in migration and differentiation of epidermal stem cells.The results were as follows: SP released from sensory nerves in skin wounds up regulated neuropeptide expression of the fibroblast cells,induced fibroblast cells to express some growth factors and those receptors,played an important role in migration and differentiation of epidermal stem cells,which can transdifferentiate into fibroblast or endothelial cells if the stem cells migrated into graduration tissue.The results suggest that SP as a mediator of sensory nervers participates in the regulation of wound healing.Key words:sensory neuropeptide;wound repair;substance P感觉神经肽为感觉神经元胞体合成的一类神经肽,包括P物质(SP)、降钙素基因相关肽(CGRP)、神经肽Y(NY)、K物质等,其中SP与损伤修复关系最为密切。
变态反应学综述变态反应(allergic reaction)也叫超敏反应,是指机体对某些抗原初次应答后,再次接受相同抗原刺激时,发生的一种以机体生理功能紊乱或组织细胞损伤为主的特异性免疫应答。
变态反应的发生需要具备两个主要条件:一是容易发生变态反应的特应性体质。
这是先天遗传决定的,并可传给下代,其机率遵循遗传法则;二是与抗原的接触。
有特应性体质的人与抗原首次接触时即可被致敏,但不产生临床反应,被致敏的机体再次接触同一抗原时,就可发生反应,其时间不定,快者可在再次接触后数秒钟内发生,慢者需数天甚至数月的时间。
根据其发生机理,变态反应可分为四种类型:Ⅰ型变态反应即速发型,又称过敏反应过敏原进入机体后,诱导B细胞产生IgE 抗体。
IgE与靶细胞有高度的亲和力,牢固地吸附在肥大细胞、嗜碱粒细胞表面。
当相同的抗原再次进入致敏的机体,与IgE抗体结合,就会引发细胞膜的一系列生物化学反应,启动两个平行发生的过程:脱颗粒与合成新的介质。
①肥大细胞与嗜碱粒细胞产生脱颗粒变化,从颗粒中释放出许多活性介质,如组胺、蛋白水解酶、肝素、趋化因子等;②同时细胞膜磷脂降解,释放出花生四烯酸。
它以两条途径代谢,分别合成前列腺素、血栓素A2和白细胞三烯(LTs)、血小板活化因子(PAF)。
各种介质随血流散布至全身,作用于皮肤、粘膜、呼吸道等效应器官,引起小血管及毛细血管扩张,毛细血管通透性增加,平滑肌收缩,腺体分泌增加,嗜酸粒细胞增多、浸润,可引起皮肤粘膜过敏症(荨麻疹、湿疹、血管神经性水肿),呼吸道过敏反应(过敏性鼻炎、支气管哮喘、喉头水肿),消化道过敏症(食物过敏性胃肠炎),全身过敏症(过敏性休克),小结:由于IgE多由粘膜分泌,所以I型多引起粘膜反应。
Ⅱ型变态反应即细胞毒型抗体(多属IgG、少数为IgM、IgA)首先同细胞本身抗原成分或吸附于膜表面成分相结合,然后通过四种不同的途径杀伤靶细胞。
(1)抗体和补体介导的细胞溶解:IgG/IgM类抗体同靶细胞上的抗原特异性结合后,经过经典途径激活补体系统,最后形成膜攻击单位,引起膜损伤,从而靶细胞溶解死亡。
皮肤中的P物质及其作用吴胜,吴仲敏*,傅磊冕(台州学院医学院解剖学教研室,浙江台州,318000)摘要:P物质是一种高活性的神经肽类物质,广泛地分布于神经系统和其他外周组织器官内,具有多种生理功能。
在皮肤,P物质主要由感觉神经末梢释放, 它通过趋化免疫细胞、调节细胞因子的产生以及舒张微血管等参与皮肤局部免疫炎症反应; 还可促进皮肤内多种细胞的分裂、增殖以及细胞DNA勺合成,参与皮肤创伤的修复;此外, P物质作为一种重要的瘙痒介质,与多种瘙痒性皮肤疾病的发生和发展有关。
关键词:P物质;皮肤;组织修复;炎症;瘙痒1 P物质的生物学特点P物质(substanee P, SP)是世界上发现最早的神经肽。
由Von Euler和Gaddum于1931 年在马肠中提取乙酰胆碱时发现,因当时不知道其化学性质,故取名P物质。
1970年Cha ng 和Leeman将SP纯化,提出^一肽序列,,分子量为1340,1972年Tregear等Arg- Pro-Lys-Pro-GI n-GI n-P he-Phe-Gly-Leu-Met-NH2用化学方法成功地合成此1973年Powel建立了放射免疫分析测定SP的方法,将SP的肽。
研究和应用提高到一个新的高度。
用重组DNA技术研究SP的前体发现SP来源于前速激肽原,PPT),因此SP有速激肽类物质之称,PPT分成PPT-A和PPT-B两(pre-p ro-totchykinin种,PPT-A又分为a -PPT-A、3 -PPT-A和丫-PPT-A。
分子水平的研究进一步发现,PPT-A的mRNA含SP 片段。
与经典神经递质(如乙酰胆碱、单胺类、氨基酸类)的合成方式不同,SP不是在神经末梢内合成,无活性的SP前体首先在神经元胞体内的核糖体上边合成边进入粗面内质网,高尔基复合体的修饰加工后形成分泌囊泡,分泌囊泡在向神经末梢运输的过程中,仍可对其中的SP加工修饰,装配在大囊泡中运至神经末梢,当神经末梢受刺激时,囊泡中的SP即释放,并与其特异性受体结合以发挥作用。
与SP结合的特异性受体有神经激肽 1 (NK1 )受体、NK2受体和NK3受体,这些速激肽受体均属于G蛋白偶联受体。
因SP与NK1受体的亲和力最基金项目:台州市科技局科研项目(081ky44 );台州学院学生科研项目(08XS46)*通讯作者,,Tel:大,故 NK1 受体特称为 SP 受体[1] 。
2 皮肤中 SP 的来源和分布皮肤中的 SP 主要源自于感觉神经纤维末梢, 少数由组织细胞如角质形成细胞 (KC) 、肥 大细胞、单核巨噬细胞等细胞合成。
皮肤中 SP 大部分在背根神经节的小型神经元胞体中合 成,然后由轴浆运输至外周感觉神经末梢(主要是C 纤维)贮存、释放;在人类正常皮肤中,SP 免疫反应阳性神经纤维主要分布在真皮浅层微血管周围,并经乳头层进入表皮,维持皮 肤的正常感觉和对伤害性刺激的感受,在表皮基底层、真皮乳头层、毛囊、汗腺、小血管膜 及其周围均有SP 样物质分布[2]。
另外,SP 受体在KC 朗格汉斯细胞、成纤维细胞和肥大细3 SP 在皮肤中的作用支配皮肤的 SP 阳性感觉神经元具有双向传导功能, 其所释放的 SP 不仅可作为神经递质 向中枢传递刺激信息, 也可作为神经调质在外周发挥生物学效应, 在皮肤免疫炎症、 创伤修 复、瘙痒等方面均扮演了重要角色。
SP 与皮肤免疫炎症反应研究表明, SP 对皮肤免疫和炎症反应的作用主要体现在三个方面:趋化免疫细胞、调 节细胞因子的产生以及舒张微血管。
SP 对T 细胞、单核/巨噬细胞、嗜酸性粒细胞具有趋化作用,SP 还是中性粒细胞的趋化因子,10-9mol/L 的SP 可直接影响其向炎症部位的迁移 ⑷SP 及其Ca 端片段对中性粒细胞尚有启动效应 [5],可延缓中性粒细胞的凋亡, 表明SP 在炎症的迁延过程中起作用 [6] ; SP 可以激活肥大细胞,引起胞内 Ca 2+ 动员和细胞脱颗粒,释放组 胺[7],促发皮肤红斑和水肿;SP 还能够促进角朊细胞释放IL-1、IL-8、TNF-a ,促进单核/ 巨噬细胞产生和释放IL-1、IL-6、TNF-a 和IFN- 丫,增强活化的T 细胞产生IL-2以及表达IL-2 受体,刺激肥大细胞产生TNF-a,中性粒细胞及血管内皮细胞产生IL-8。
并借用这些细胞因子的作用, 影响和调控皮肤免疫和炎症反应。
由皮肤感觉神经末梢释放出来的 SP 首先与 NK1 受体结合 , 所引起的皮肤神经源性炎症反应是以血浆渗漏的形式出现 舒张、血流增加继而出现潮红及皮疹。
Scholzen [8] 等发现 , 引起人体皮肤微血管血浆渗漏仅 需微摩尔浓度的SP 。
人体皮肤C 纤维是否释放足量的SP 才可导致疹块的形成还不十分清楚。
Lofgren [9] 等发现 , 尽管在应用 SP 后有组织胺的释放增加 , 但在人体皮肤应用组织胺拮抗剂却不能减少由辣椒素引起的皮肤潮红 ,而许多NK1受体拮抗剂,如RP6758C 和CP96345均胞上也有表达,且这种表达受炎症性细胞因子调控[3], 并伴随小动脉血管胞来源, 维持上皮和角质层的形成。
而成纤维细胞是组织修复过程中的主要细胞,外基质和胶原的产生, 是组织修复和创伤愈合的必需过程 [16,17,18]。
SP 可以明显促进成纤维 细胞胶原的合成和代谢, 使增殖期胶原合成增加, 为后期角质形成细胞的大量增殖并向创面迁移覆盖提供支架。
从而加速伤口的上皮化速率,促进伤口的成熟。
细胞对内源性生长因子及其受体的表达上调,如 EGF 、 FGF 、 NGF 等 。
从林等 采用放射 免疫法测定 20例增生性瘫痕组织中 SP 的含量 , 并与20例非增生性瘫痕组织及正常皮肤进行 对比 , 发现增生性瘢痕组织中 SP 含量明显增高 , 增生性瘫痕组织中 SP 免疫阳性分布密度 显着高于非增生性瘢痕和正常皮肤组织。
Crowe [21] 分别检测了 9例增生性瘢痕、 扁平性瘢痕、3例正常皮肤组织中的神经肽,提示 SP 与病理性瘢痕增生有密切的关系。
SP 还在难愈创面的修复中起重要的调控作用,它不仅自身具有促进修复细胞增殖分化 的能力,更重要的是 SP 可增强修复细胞自身合成内源性神经营养因子的能力,进一步通过 这种放大效应促进糖尿病等难愈创面的修复。
SP 与皮肤瘙痒反应SP 是一种重要的瘙痒介质,参与了多种瘙痒性皮肤疾病的发生与发展。
健康志愿者皮 内注射 SP 引发皮肤红肿和瘙痒反应 [22] 。
小鼠皮内注射 SP 亦能诱发后肢搔抓等瘙痒相关行为可抑制啮齿动物皮肤血管的血浆渗漏。
SP 与皮肤创面的修复Lai 等 [10] 证明外周感觉神经及其释放的 SP 在创伤愈合的过程中扮演了重要角色,周围 神经末梢释放的 SP 有促进伤口愈合效应, SP 参与创伤局部炎症反应及免疫反应, 促进创面的修复。
SP 是皮肤损伤修复、瘢痕愈合及不断增生过程中的重要介质[11]。
在皮肤创伤的早期,创伤局部组织的 SP 部分由感觉神经末梢释放,部分由伤口修复细 胞包括成纤维细胞、血管内皮细胞、巨噬细胞等自身合成。
自身合成的SP 作为神经源性介质,促进创伤早期炎性细胞浸润, 加强炎症反应, 而创伤早期的炎症反应是创伤愈合全过程 的先导,适度的炎症反应是创伤愈合后续过程的基础和前提。
此外,SP 还能诱导炎性细胞释放多种细胞因子和趋化因子,引导多核巨噬细胞的聚集,后者吞噬坏死组织及细胞碎片, 有利于成纤维细胞、角质形成细胞、血管内皮细胞在创面的增殖覆盖 [12]。
Burbach等[13]研究发现, SP 可调节角质形成细胞对神经生长因子的表达,从而保持皮肤感觉神经的完整性。
在创伤愈合的后期, SP 可促进多种细胞如成纤维细胞、角质形成细胞、血管内皮细胞 等分裂和增殖以及细胞 DNA 的合成。
如SP 可促进成纤维细胞和血管平滑肌细胞的增殖 14]促进角质形成细胞的有丝分裂及角膜上皮的迁移15]。
角质形成细胞是皮肤表皮层的主要细调节细胞SP 还可以使多种修复反应[23]。
特应性皮炎患者真皮乳头层和真-表皮交界处的SP阳性神经纤维数目较正常对照组显着增多[24]。
特应性皮炎小鼠皮损中SP水平比正常皮肤明显升高[25]。
NK1受体拮抗剂可明显抑制特应性皮炎小鼠的搔抓行为[26];银屑病皮损中SP含量升高,皮损中SP阳性神经纤维比非皮损区及正常皮肤明显增多[27],辣椒辣素治疗银屑病有效,这可能与辣椒辣素耗竭皮肤神经末梢中SP有关[28]。
增生性瘢痕组织中SP阳性神经纤维的分布比正常皮肤及非增生性瘢痕更加广泛。
上述结果表明,SP与特应性皮炎、银屑病、增生性瘢痕等瘙痒性皮肤病的发病有密切的关系。
SP引起瘙痒的机制可能有二: 是通过激活传导痒觉的无髓C纤维上NK1受体直接引起瘙痒;二是通过促进其他瘙痒介质的释放间接引起瘙痒,如SP促进角质形成细胞释放白三烯B4或一氧化氮而引起或增强瘙痒;刺激肥大细胞释放组胺而引起瘙痒等。
4.结语综上所述,SP不仅是一种重要的神经递质,而且在体皮系统中是传递信息、调节皮肤免疫炎症反应的重要信使,同时,SP作为一种重要的瘙痒介质,参与了多种瘙痒性皮肤疾病的发生与发展,另外,SP在创伤愈合的全过程中扮演了重要角色, SP是皮肤损伤修复、瘢痕愈合及不断增生过程中的重要介质。
随着人们对SF研究的不断深入,SP在皮肤组织中的作用会更加清晰,因而具有广阔的应用前景。
参考文献[1] Severini C , Improta G, Falconieri-Erspamer G, et al. The tachy-kinin peptidefamily[J]. Pharmacol Rev, 2002; 54(2):285-322.[2] 樊 卓, 樊翌明 . P 物质的外周致痒机制研究进展 [J]. 中国麻风皮肤病杂志 , 2007;23(4):323-325.[3] Andoh T, Honma Y, Kawaharada S , et al. Inhibitory effect of the repeatedtreatment with unsei-in on substance P induced itch associated responses through the downregulation of the expression of NK(1) tachykinin receptor in mice[J]. Biol Pharm Bull, 2003; 26(6):896-898.张世红 , 赵 晏. P 物质的免疫调节作用 [J]. 生理科学进展 ; 2002, 33(3):235-238.substance P:involvement of caspase cascade[J]. Peptides, 2001; 22(4):661-670. [7] Ohshiro H, Suzuki R, Furuno T, et al. Atomic force microscopy to study directneurite mast cell (RBL) communication in vitro[J]. Immunol Letters, 2001; 74(3):211-214.[8] Scholzen TE, Stander S. Modulation of cutaneous inflammation byangiotension-converting enzyme[J]. J Immunol, 2003; 170(7):3866-3873. [9] Lofgren O, Qi Y. Inhibitory effects of tachykinin receptor antagonists onthermally induced inflammatory reactions in a rat model[J]. 25(2):125-129ending on endogenous expression of epidermal growth factor and its healing[J]. Chin J Traumatol, 2002; 5(3):176-179[11] 邓云川 , 李世荣 , 丛林 . P 物质及其受体对成纤维细胞的作用 [J]. 实用美容整形外科杂志 , 2002;13(6):317-319.[12] Moore K, Ruge F, Harding KG, T lymphocytes and the lack of activated macrophages in woundmargin biopsies from chronic leg ulcers[J]. Br J Dermatol, 1997; 137(2):188-194.[10] Lai X, Wang Z, Wei L, et al. Effect of substance P released from peripheral nerve [4] [5] Sun J, Ramnath RD, Bhatia M.Neuropeptide substance P upregulates chemokine and chemokine receptor expressionin primary mouse neutrophils[J] . AmJ Physiol CellPhysiol,?2007; 293(2): 696 -704.[6] Bockmann S, Seep J, Jonas L.Delay of neutrophil apoptosis by the neuropeptidesBurns, 1999;receptor in world[13]Burbach GJ, Kim KH, Zivony AS, et al. The neurosensory tachykinins substanceP and neurokinin A directly induce keratinocyte nerve growth factor[J]. J InvestDermatol, 2001; 117(5):1075-1082.[14]Wiedermann CJ, Auer B, Sitte B, et al. Induction of endothelial celldifferentiation into capillary-like structures by substance P[J]. Eur JPharmacol, 1996; 298(3):335-338.[15]KemenyL, Von Restoff B. Specific binding and lack of growth-promoting activityof substance P in cultured human keratinocytes[J]. J Invest Dermatol, 1994;103:605.[16]秦全红,王德文. 成纤维细胞在皮肤创伤愈合中的作用及其调控[J]. 国外医学,创伤与外科基本问题分册,2000; 21(1):33-38.[17]Wang HJ, Pieper J, Schotel R, et al. Stimulation of skin repair is dependenton fibroblast source and presence of extracellular matrix[J]. Tissue Eng, 2004;10(7-8):1054-1064.[18]Shephard P, Hinz B, Smola Hess S, et al. Dissecting the roles of endothelin,TGF-beta and GM-CSFon myofibroblast differentiationby keratinocytes[J]. Thromb Haemost, 2004; 92(2):262-274.[19]MuangmanP, Spenny ML, Tamura RN, et al. Fatty acids and glucose increase neutralendopeptidase activity in humanmicrovascular endothelial cells[J]. Shock, 2003;19(6):508-512.[20]从林,李世荣,徐友奇.增生性瘫痕P物质含量的放射免测定[J].中华整形烧伤外科杂志, 1998; 14(6):401-403.[21]Crowe R, Parkhouse N, McGrouther D, et al. Necropeptide-containing nerves inpainful hypercrophic human car tissne[J]. Br J Dermatol, 1994; 130(4):444-452.[22]Stander S, Steinhoff M, Schmelz M, et al. Neurophysiology of pruritus:cutaneouselicitation of itch[J]. Arch Dermatol, 2003; 139(11):1463-1470.[23]Andoh T, Kuraishi Y. Inhibitory effects of azelastine on substance P induceditch associated response in mice[J]. Eur J Pharmacol, 2002; 436(3):235-239.[24]Jarvikallio A, Harvima IT, Naukkarinen A. Mast cells, nerves and neuropeptidesin atopic dermatitis and nummular eczema[J]. Arch Dermatol Res, 2003; 295(1):2-7.[25]Katsuno M, Aihara M, Kojima M, et al. Neuropeptides concentrations in the skinof a murine (NC/Nga mice) model of atopic dermatitis[J]. J Dermatol Sci, 2003;33(1):55-65.[26] Ohmura T, Hayashi T, Satoh Y, et al. Involvement of substance P in scratchingbehaviour in an atopic dermatitis model[J]. Eur J PharMacol, 2004; 491(2-3):191-194.[27] Chan J, Smoller BR, Raychauduri SP, et al. Intraepidermal nerve fiber expressionof calcitonin gene-related peptide, vasoactive intestinal peptide and substance P in psoriasis[J]. Arch Dermatol Res, 1997; 289(11):611-616.[28] Raychaudhuri SP, Farber EM. Neuroimmunologic aspects of psoriasis[J]. Cutis,2000; 66(5):357-362.。