
现行法规对药品研发和生产的要求
、依据ICH Q10,建立制药质量体系
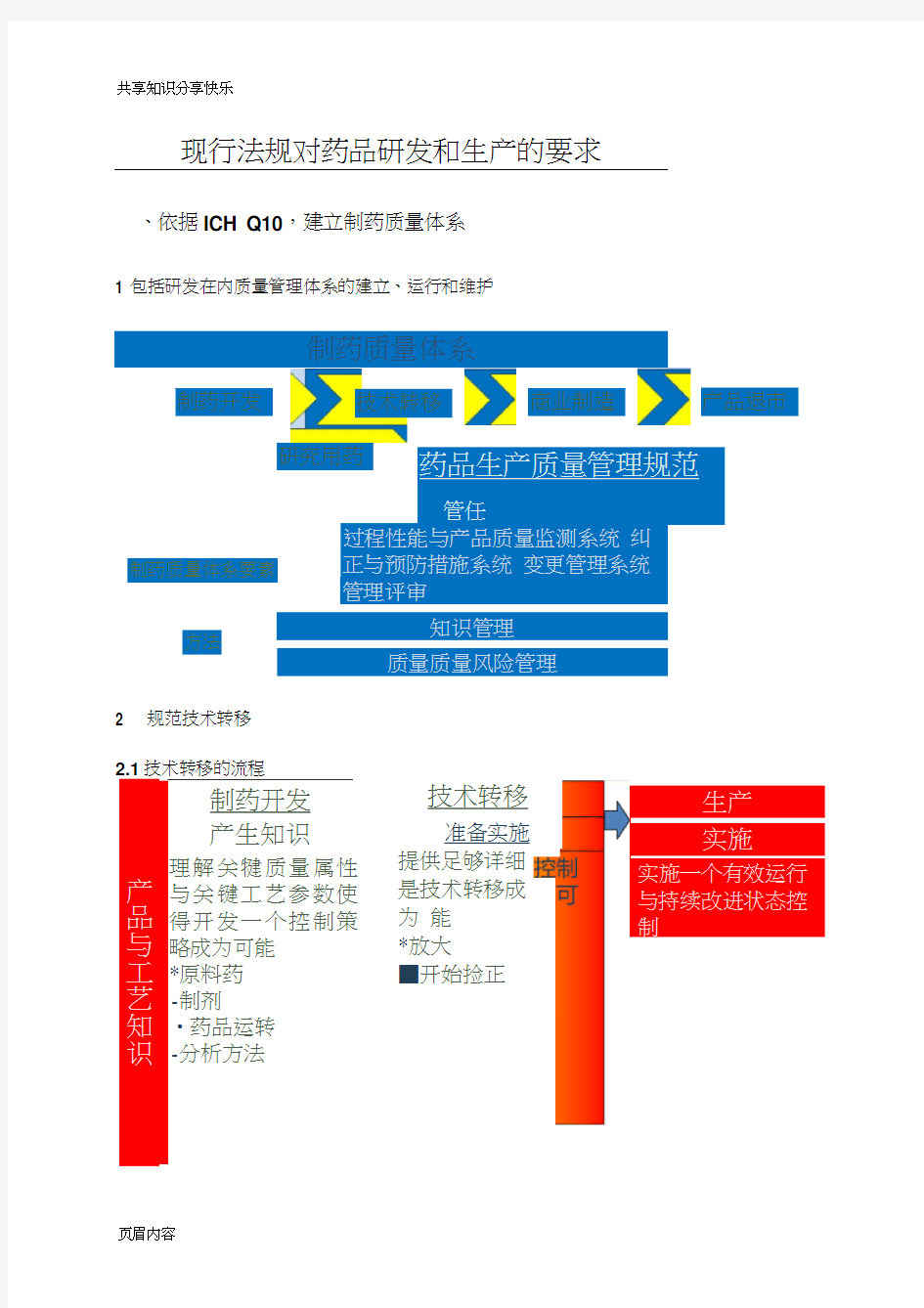
1 包括研发在内质量管理体系的建立、运行和维护
制药质量体系
过程性能与产品质量监测系统 纠正与预防措施系统 变更管理系统 管理评审
知识管理 质量质量风险管理
2 规范技术转移
制药开发
产生知识
理解关犍质量属性 与关键工艺参数使 得开发一个控制策 略成为可能 *原料药 -制剂
?药品运转 -分析方法
技术转移
准备实施 提供足够详细 是技术转移成为 能 *放大
■开始捡正
制药开发 硏究用药
技术转移
商业制造 产品退市
药品生产质量管理规范
管任
制药质量体系要素
方法
产品与工艺知识
生产 实施
实施一个有效运行 与持续改进状态控 制
2.2技术转移各阶段的工作内容
前期决议1 可行硏究阶段
转移元成最终决定匕"项目完成
操作阶段
共享知识分享快乐
二、依据ICH Q11 开展原料药的开发和生产
1 辨识原料药潜在关键质量属性
确立原料药的预期质量时,应考虑原料药在制剂中的用途,即明确和理解对制剂产品研发产生影响的物理、化学、生物与微生物属性或特性(例如,原料药的溶解性可能影响剂型的选择),以便于研究和控制影响制剂产品质量的属性。质量目标产品概况(QTPP)、制剂产品潜在关键质量属性(CQAs)及相关产品经验有助于辨识原料药的潜在关键质量属性。
关键的质量属性是一个物理、化学、生物学或微生物学属性或性状,在某个合适的限度、范围或分布内才能确保所需的产品质量。
原料药关键质量属性通常包括那些影响鉴别、纯度、生物活性和稳定性的性质或性状。当物理性质对制剂成品的生产或性能具有重要影响时,也规定其为关键的质量属性。
风险评估可能被用于进行质量属性的分级和优先级。
2 确定一个合适的制造工艺;
3 物料属性及工艺参数与原料药关键质量属性的关联
制造工艺的开发程序应当确认必须控制那些物料的属性(例如原料的、起始物料的、试剂的、溶剂的、工艺助剂的、中间体的)及工艺参数(CPP)。风险评估可以帮助辨识那些对原料药的关键质量属性(CQAs)有潜在影响的物料属性和工艺参数(CPP)。
辨识工艺变化的潜在因素;
辨识可能对原料药质量有最大影响的物料属性及工艺参数,可基于以前
的知识及风险评估工具;
设计并开展研究(例如,机理,和/ 或动力学评价、多变量试验设计、模拟试验、建
立模型)来辨识与确认物料属性以及工艺参数与原料药关键质量属性之间的
关系;
对数据进行分析与评估,设定合适的范围,包括需要建立设计空间。
确定关键性的决策树
4 设计空间
设计空间是输入变量(例如物料属性)与已经证明能提供质量保证的工艺 参数的多维组合
及相互作用。设计空间内的操作不被认为是变更。超出设计 空间运行则被看作是变更(启动药政部门的批准后变更程序)。设计空间由 申请人提出,送药政部门评估与批准。
可以基于以前知识、基本原则,和/或对工艺的经验理解来开发设计空间 使用可用模型(例如定性的、定量的)来支持多种规模与设备的设计空间。
设计空间体现了质量源于设计(QbD )的理念。 4.1最低限度和传统的研发过程
产品特征
QTPP ,临床应用,剂型 > 剂量,包装、产品 质量标
准,药物活性单位对药代的影响等。
F
-----------------------------------------------------------------------------------------------------------------------------------------------
1
关键质量属性
OQA :在特乜蚩II 人」的“确保产品质量的物 理性、化学性,生物,微生梭胥特性。
优化后的制剂配方
选择优化的配方工艺。
所选的生产工艺
选择合适的生产工艺。
控制策略
公司利用任何机会在产品的生命周期中持续 地利用创新的方法来改善产品的质僦“
非关
关键
高风险
4.2 QbD的研发过程
质量源于设计(QbD)-系统性方法
乔p,咋床应用,剂型「剂量:包装,产品质量标淮「药物
活性单位对药代的彭响等口
CQA :在特定范围内的:确保产品质量的物理性‘化学性,
生物,微生澹特性。
在质量风险管理中的基于科学过程对影响产品关犍质量属性
的物料属性的识别?
对物料属性和工艺参数(过程输入)与产品关键质量属性相互
关系的描述口
经过设计并确保符合要求产品质量的产品被持续产品的手
段。
公司利用任何机会在产品的生命周期中持续地利用创新的方
法来改善产品的质量°
持续改进
最低限度/传统方法先进的/质量源于设计方法
产品特征
关键质最属性
优化后的制I剂配方
所选的生产工艺控制策略风险评f
占设计空
间控制策
rm
F设
卅*
k
4.3两种方法的比较
4.4质量源于设计是针对:
目标产品终端用户(病人,消费者等)的需求;
满足客户需求的质量目标产品(制剂)概况(QTPP);
能够保证质量目标产品(制剂)概况的关键质量属性(CQAs),包括API
的(CQAs);
实现关键质量属性(CQAs)所需要的关键工艺参数(CPP),包括API的的关键工艺参数(CPP);
依据关键质量属性(CQAs)与关键工艺参数(CPP)所设计出的控制战略,确保可持续地产出质量目标产品;
质量源于设计概念的循环使用与不断与时俱进地完善。
4.5设计控制设计的核心内容
,4个可以生产出符
合质量产品的区
域;
-包括材料特性与工
艺参数;
?通过在知识空间中
重复应用风险评
估和实验设计;
?包括对规模和设备
的评估等
4.6设计空间的内容
设计空间是通过质量风险评估与关键性相连接的; 这种连接确定关键质量属性(CQA )和关键工艺参数(CPP ); 设计空间阐述的是CQAs 和CPPs 之间的多变量函数关系; 设计空间应该包括和提供跨不同操作单元的链接;
设计空间变量间函数关系的取得是通过重复应用风险评估,实验设计 (DOE ,模型推算及参考文献与前期知识;
设计空间还包含关键工艺参数(CPP ) “验证过的接受范围” (RAR )及 与其相关的关键质量属性(CQAs )的接受值。
关键质量 属性
设计空间
5 制策略 控制策略是来源于对现有产品和工艺的理解一系列确保生产工艺实施和 产品质量的控制计划。控制策略可以包括,但不限于以下内容:
物料属性的控制(包括原料,起始物料,中间体,试剂,原料药的基 本包装材料等);
隐含在生产工艺设计中的控制(纯化步骤的顺序(生物技术和生物产 品),或者试剂(化学品)的加料顺序);
中间控制(包含中控测试和工艺参数); 原料药的控制(如放行测试)。
物料 属性
风险 评估
控制战略
关键工莒 参数