
第3章燃烧学的数学物理基础
本章内容:
燃烧中的物理现象
张量基础
多组分混合气体流动的基本参数
分子传输的几个基本定律
基本守恒方程:质量守恒方程、组分守恒方程、动量守恒方程、能量守恒方程
斯蒂芬流问题
3.1燃烧中的物理现象
从可燃混合气的形成、升温、着火燃烧、火焰传播到散热等都是通过一系列的物理、化学变化过程来完成的。在这些过程中有介质的流动、传热、蒸发、对流、扩散、传质等物理现象。这些现象有些是相继发生的,有些则是同时发生的。根据燃烧条件的不同,有些是定常问题,有些是非定常问题。一般说来,这些现象可以用质量守恒、动量守恒、能量守恒、组分守恒等基本方程来描述。而牛顿粘性定律、傅里叶导热定律及费克扩散定律又是各守恒方程的基础。
燃烧现象中的流动问题常常涉及到两种不同性质的介质间的相互运动以及流体与固定壁面间的相对运动。因而,许多现象又与边界层问题有关。
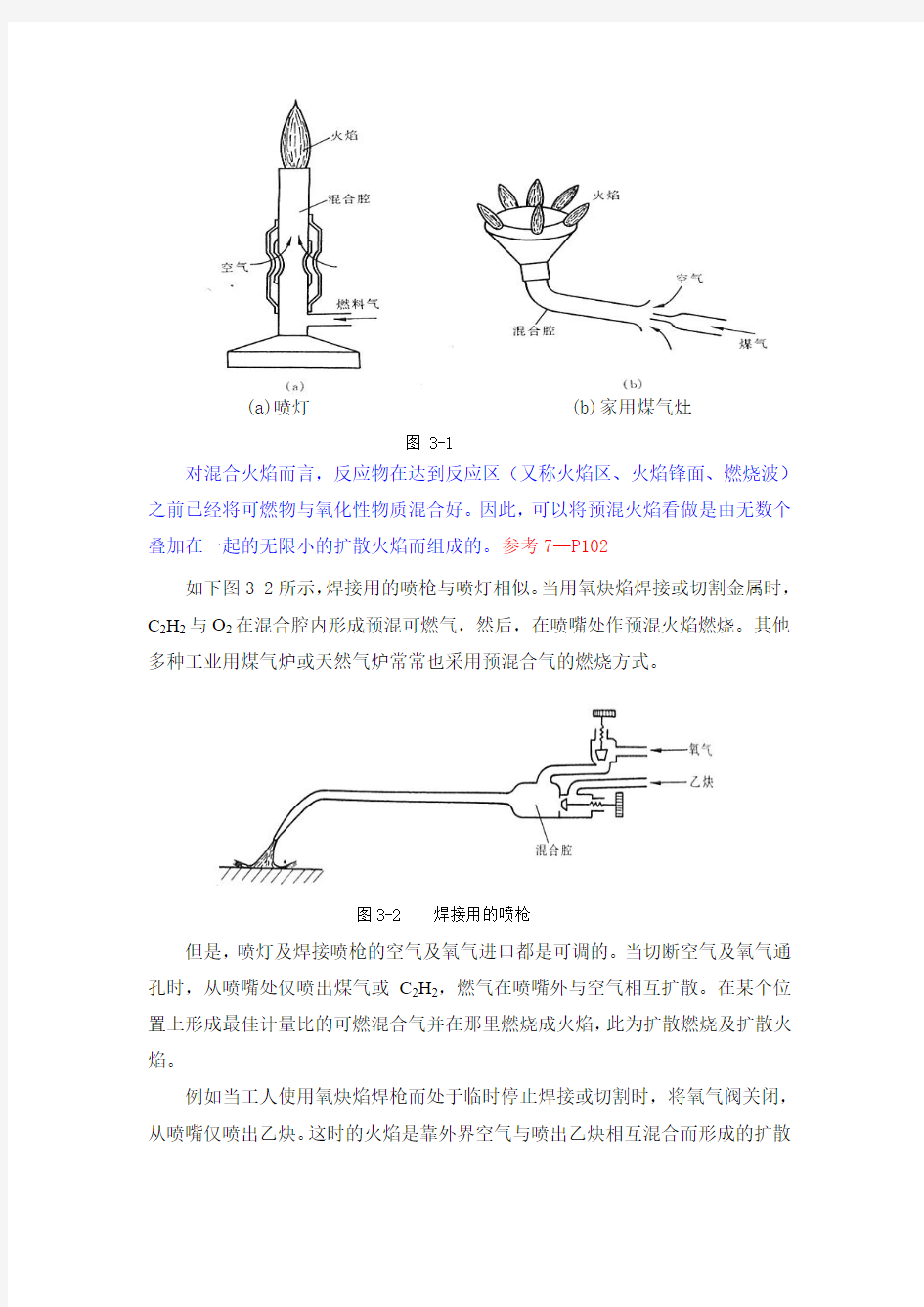
从可燃混合气的形成及燃烧的方式可将燃烧现象分成预混燃烧及扩散燃烧两类。预混合燃烧是燃料与氧化剂事先混合成可燃混合气以后才进行燃烧的,在预混可燃气体的燃烧中,化学动力学过程和流动(传热、传质)过程几乎起着同样重要的作用。预混燃烧不仅仅存在于气体中,许多液体、固体的燃烧也同样属于预混燃烧。如在一定条件下,使液体燃料雾化蒸发,其蒸气与氧化性气体混合酒形成了可燃混气,此时的燃烧就属于预混燃烧。再如,军事技术上,固体火箭发动机中双基推进剂(火药)、复合推进剂、火炸药工业中的粉状铵梯炸药、黑火药等等,它们的燃烧都属于预混燃烧的范围,都是固体可燃物与富氧物质的混合物。图3-1所示的是:(a)喷灯及(b)家用煤气灶。有一定流速的煤气将外界的空气卷吸进混合腔,形成可燃混合气后在喷口外燃烧形成火焰,此为预混合火焰。
(a)喷灯 (b)家用煤气灶
图 3-1
对混合火焰而言,反应物在达到反应区(又称火焰区、火焰锋面、燃烧波)之前已经将可燃物与氧化性物质混合好。因此,可以将预混火焰看做是由无数个叠加在一起的无限小的扩散火焰而组成的。参考7—P102
如下图3-2所示,焊接用的喷枪与喷灯相似。当用氧炔焰焊接或切割金属时,C2H2与O2在混合腔内形成预混可燃气,然后,在喷嘴处作预混火焰燃烧。其他多种工业用煤气炉或天然气炉常常也采用预混合气的燃烧方式。
图3-2 焊接用的喷枪
但是,喷灯及焊接喷枪的空气及氧气进口都是可调的。当切断空气及氧气通孔时,从喷嘴处仅喷出煤气或C2H2,燃气在喷嘴外与空气相互扩散。在某个位置上形成最佳计量比的可燃混合气并在那里燃烧成火焰,此为扩散燃烧及扩散火焰。
例如当工人使用氧炔焰焊枪而处于临时停止焊接或切割时,将氧气阀关闭,从喷嘴仅喷出乙炔。这时的火焰是靠外界空气与喷出乙炔相互混合而形成的扩散
火焰,如图3-3(a)所示。
当喷灯的空气进口调得较小,混合腔内混合气处于空气不足时,在喷口外会形成二层火焰:里面一层蓝色火焰为预混火焰,此处燃料还不能全部烧完,多余燃料在外层火焰处形成扩散火焰,依靠外界卷吸扩散来的空气将全部燃料烧完,如图3-3(b) 。
在使用液体燃料的设备中,根据燃料的性质不同有不同燃烧方式:汽油、苯、酒精等挥发性很强的燃料大多用于火花引燃式内燃机中,并采用准预混合燃烧方式。在传统的汽油机(见图3-4)吸气行程中,空气流经化油器的喉口处时流速增加、压力降低将汽油从量孔吸出,在喉口及进气管中与空气混合并迅速蒸发形成油-空气混合气进入气缸。当活塞将混合气压缩接近至上止点时,在燃烧室内由
图3-3 火焰特征图3-4 汽油机
火花塞点火,火焰从火花塞处向外传播直至最远处。此为准预混合燃烧。
现代电控汽油喷射式汽油机中,一般在吸气过程中将汽油喷至进气门前,在吸气和压缩两过程实现油-气混合。其他如航空煤油、柴油、重油、渣油等则因其挥发性较差,难以迅速与空气在低温下形成蒸气—空气混合气,而采用喷射方式将燃油喷成极细的油滴在高温的燃烧室内蒸发、扩散与空气形成可燃混合气后燃烧。图3-5(a)所示为单油滴的蒸发与燃烧,(b)为液体燃料喷雾燃烧,(c)为燃气轮机燃烧室中的喷雾燃烧,(d)为柴油机中的喷雾燃烧。
根据燃烧过程中火焰与燃烧室有无相对运动又可分为定置火焰与行进火焰。定置火焰在其燃烧过程中位置与燃烧室系统或某一固定坐标系统没有行进性的运动,看起来火焰与上述固定体系是相对不动的,如各种类型的喷雾燃烧(如涡
轮机、锅炉、窑炉、柴油机等)及喷灯火焰等。
而行进火焰则在着火后,火焰阵面相对于燃烧系统有行进性的运动。例如,汽油机的燃烧便是从火花塞处着火后火焰逐渐向外传播,直到将燃烧室内的混合气烧完为止。又如点着泼在地面上的一层可燃性油,其火焰也是从点火源处着火后向四周传播直到烧光燃油为止。
在动力机械及热能工程上除火花引燃式汽油机、煤气机外大多数情况为定置火焰,而火灾中的矿井坑道煤气着火后的燃烧、宏观上鸟瞰草原或森林火灾则为行进火焰。
图 3-5
着火的方式可分为引燃与自燃两类:引燃,亦即是强制着火,是可燃混合物依靠外部点火源(如电火花、引燃火焰、火星等)来引燃的。对可燃混合气体来说,在其内部某处,用外部能源点着一层混合气体,而后火焰燃烧波就自动地传播到混合气体的其余部分,因此强迫着火就是火焰的局部引发以及相继的火焰传播。如汽油机、煤气机、燃气轮机燃烧室、锅炉、窑炉、家用煤气、矿井的火灾、草原或森林火灾、工厂中含有大量可燃粉尘的气体的爆炸等均是引燃。点火源可以是电热线圈、电火花、炽热质点和点火火焰等。自燃,亦即是自发着火,则不需要外界的火源引火,在适当的温度压力条件下可燃混合物自身所释放的热量足以
抵消并大于热散失,能使反应自行持续下去,而不需要外部再提供热量,混合物的反应速率即可自行加速而着火燃烧或爆炸。如柴油机中的喷雾燃烧、散热通风不良的贮煤垛的自燃均属此类着火燃烧。参考6-P72
根据可燃混合物的流动情况又可分为层流燃烧与湍流燃烧两类。工业上的燃烧装置大多要求有较大的燃烧速度,多为湍流流动,其火焰为湍流火焰(燃烧);当我们在使用烛灯、喷灯及家用煤气作小火燃烧时,燃料供给速度很低,这时为层流火焰(燃烧)。
3.2 张量基础
3.3 多组分混合气体流动的基本参数
在研究燃烧现象的物理问题时总是涉及到多组分气体的流动、传热与传质。混合气的组分决定着这些过程中物理参量的数值。
3.3.1 混合气体的密度及质量比
如在微元体?V 内含有混合气的质量为?m ,则混合气的密度为
m
V
ρ?=
? (3.1)
它与混合气的组分的关系为
111
1j j
j
k
k k k k k m m m V V
V ρρ===??==
?==???∑∑∑ (3.2) 式中:?m k 为其组分k(k=1,…,j)在体积?V 内的质量;ρk 为组分k 的密度。
组分k 在混合气中的质量分数为
k m
k Y m
?=? (3.3) 应有
1
1
1j
j
k
k k k m Y m ==?==?∑∑
(3.4) 显然,组分密度ρk 与混合气密度ρ之间可用质量分数来联系:
k k k k m Y m
Y V V
ρρ???=
==???
(3.5) 及
1
1
j
j
k k k k Y ρρρ====∑∑ (3.6)
3.3.2混合气的平均分子量及体积百分比(或摩尔百分比)
设混合气的摩尔浓度为C(即单位体积中摩尔数),平均分子量为M ;组分k 的摩尔浓度为C k ,分子量为M k 。应有
CM ρ=
k k k C M ρ=
混合气的摩尔浓度应是各组分摩尔浓度之和,即
1j
k k C C ==∑
(3.7) 故混合气的平均分子量应当是
1
1
j
k k
k
k j
k
k
k C M M C
C C ρ
ρ
==∑∑=
=
=
∑∑ (3.8)
组分K 在混合气中所占有的摩尔比X K 为
k
C k X = (3.9)
组分K 在混合气中的摩尔比与质量比之间的关系为 k
k k k
C M M k k CM M Y X ρρ
=
=
=?
(3.10)
从上述关系还可以得到混合气平均分子量与各组分分子量及其摩尔比、质量比间的关系。
1j
k k k M X M ==∑
(3.11)
及
1
1
/j
k k
k Y M M ==
∑ (3.11’)
3.3.3 混合气(或可互溶的液体)的流动
1.流速与通量
在多组分的流体流动中各组分分子常常有不同的运动速度。当然,这里不是指单个分子的运动,而是对每一个组分分子及混合物分子群体而论(即具有统计意义的)。故混合物中某组分的流速u k 就是该组分分子的平均速度。混合物流动的质量平均速度u 是各组分分子平均速度u k 的质量加权平均值,即混合物的质量平均速度u 可定义为:当混合物全部分子以速度u 运动时所具有的动量与混合物的实际动量相等,故
1
j
k k
k u u ρρ
=∑=
(3.12)
混合物流动平均通量(或简称为混合物的流动通量)为
1
1
j j
T k k k k k G u u G ρρ=====∑∑
(3.13)
从上式可知,混合物流动通量是各组分平均质量通量之和。 2.混合流中的组分扩散
组分k 的流速u k 与混合气的质量平均流速u 之差使组分k 相对混合气流以扩散速度u dk 运动,即
.d k k u u u =-
(3.14)
其质量扩散通量为
d k k d k G u ρ??=?
(3.15)
在稳定的混合物流中,各组分扩散通量之和为零,即
1
1
1
1
1
1
1
()0
j
j j j j
d k
k d k k k k k k k k k k k j j
k k k T k k G
v v v v v
v v G G ρρρρρρ=========-=-=-=-=∑∑∑∑∑∑∑ (3.16)
3. 混合流中组分k 的对流通量G c.k
组分k 的对流通量是混合流平均速度携带组分k 流动的通量G c.k
c k k k k T G u Y u Y G ρρ?===
(3.17)
各组分对流通量之和为
1
1
j
j
c k
k T T k k G
Y C G ?====∑∑
即混合流中各组分对流通量之和为混合流的通量。 从组分扩散速度u dk ,知 k d k k k k u u u ρρρ?=-
即 d k k c k G G G ??=- (3.18)
或 k d k c k G G G ??=+
即组分k 的平均质量通量为该组分在混合流中的扩散通量与对流量之和,于是
1
1
1
j j j
k
d k c k
k k k G G G
?+
?====∑∑∑ (3.19)
因为 1
0j
d k k G ?==∑
所以 1
1
j j
k c k T k k G G G ?====∑∑
可以看出,尽管各组分的扩散流通量不等于其对流通量,但组分平均质量通量之和与对流通量之和相等,并等于混合流总通量。
3.4分子传输的几个基本定律
燃烧现象与气体中的分子传输密切相关。这里我们分别就分子传输与流体粘性阻力、扩散、导热的关系加以简单说明。这涉及到流体力学、传热学等课程的内容。
3.4.1牛顿粘性定律
在流体流层之间有速度差存在时,流层之间就有一定的剪切力,流速慢的流层对速度快的流层有相应的阻力。单位面积上剪切力与其速度梯度成正比,但方向是阻止流动。故
2(/)u N m y
τμ?=-? (3.20)
式中:μ为流体的动力粘度,其单位为Pa ·s ;u y
??为速度梯度;"-"表示剪切
力的方向与速度u 增加的方向相反。
引入运动粘度v μ
ρ
=
,上式又可写成 ()
u u y
y
ρτνρν
??=-=-?? (3.21) 式中ρu 为流体的动量。显然,剪切力与流体的动量梯度成正比,其方向与动量增加的方向相反。其中运动粘度的单位为m 2/s 。
3.4.2 傅里叶导热定律
傅里叶导热定律适用于固体及流体。导热是由于物质系统内各处分子有强烈不等、杂乱的随机运动,并携带着热量进行异地间的能量交换,使热量由高温处向低温处传递的过程。单位时间、经过单位面积的导热量(热流heat flux)与温度梯度成正比,而方向与温度梯度相反,即
2[/()]T
q
J m s y
λ?''=-?? (3.22)
上式又可以用热扩散系数p
c λ
αρ=表示。在不考虑密度ρ及比热容c p 随位置的变化时,有:
()T
p p c T q
c y y
ραρα
??''=-=?? (3.23) 式中: ρc p T 为单位体积物体的热焓(或热容量);λ、α的单位分别为J/(m 2?s ?K)及m 2/s 。
因此,傅里叶定律也可叙述为:单位时间内经过单位面积的导热量与焓的梯度成正比,而方向与焓的梯度方向相反。
3.4.3 费克的组分扩散定律
1815年Parrot 发现:在由两种以上的不同气体组成的混合气体中,当各组分在不同位置上浓度不等时,其浓度不平衡会自然消失,这种与对流无关的系统
内宏观传质现象是一种分子扩散。
后来费克(Fick )于1855年总结成组分扩散定律,也叫费克定律,即在一等温、等压的,由两种组分A 、B 所组成的混合物系统中,组分A 沿y 方向的扩散速度(以质量通量mass flux 表示)为
"22/()/()A A AB C W D g m s mol m s y
???=-??? 或 (3.24) 式中:C A 为组分A 在混合物系统中的当地浓度g/m 3或mol/m 3; D AB 为组分A 通过组分B 的质量扩散系数,或简称为扩散系数(m 2/s) 。“-"号表示组分A 的扩散方向与浓度梯度的方向相反。
在双元组分中有:混合气体的总摩尔浓度是各组分摩尔浓度之和,故有C A = C - C B 。
当混合物各处的p 及T 恒定时,C 也是恒定的,故/0C y ??=, 于是上式在y 方向的偏导数为:
A B C C
y y
??=-?? (3.25) 组分B 沿y 方向的扩散速度为
B B BA
C W
D y
?''=-? (3.26)
相对于混合物,任意处各组分的扩散通量之和为零,故有
A B
W W ''''=- (3.27)
于是可以从上述关系得到
AB BA D D =
(3.28)
即在双元系统中两种成分的相互扩散的扩散系数相等。 Fick 的扩散方程用质量浓度ρA ,ρB 表示时可以写成
"A A AB
W D y
ρ?=-? (3.28’)
用质量分数Y A ,Y B 表示时,则
A A A A
B AB
Y Y W D y y
ρ??''=-=-Γ?? (3.29)
其中 ΓAB =ρ D AB 称为组分交换系数。
牛顿粘性定律、傅里叶导热定律及费克扩散定律分别描述了由于分子运动所涉及的动量传输、能量传输及质量传输问题。且运动粘性系数、热扩散系数及扩散都有相同的量纲,因而可用一通用的传输方程
p
F D
y
?=-? (3.30) 来表示它们。
在不同的传输现象中F ,D ,P 分别表示不同的物理参数见下表。
表3-1
传输系数ν、α、D 之间有一定的内在联系,分别用一些准则来表示: Prandtl 数 Pr ≡ν/α , Schmidt 数 Se ≡ν/D,
Lewis 数
Le ≡α/D ≡Se/Pr 。
在工程中常取: Le = Se = Pr = 1
表3-2为一些双元气体的扩散系数D 0,在其他状态条件下,
D = D 0(T/T 0)·(p/p 0) (3.31)
上式中对于永久性气体 m ?1.75;对于可凝结性气体m ?2.00。
表3-2 一些双元气体的扩散系数(T 0=298K ,p 0=0.1Mpa )
气体对 D 0 /cm 2·s -1 气体对 D 0 /cm 2·s -1 气体对 D 0 /cm 2·s -1 气体对 D 0
/cm 2
·s -1 N 2-He
0.71 H 2-nC 4H 10 0.38 CO 2-CO 0.14 空气-O 2 0.18 N 2-Ar 0.20 H 2-O 2 0.81 CO 2-C 2H 4 0.15 空气-CO 2 0.14 N 2-H 2 0.78 H 2-CO 0.75 CO 2-CH 4 0.15 空气-H 2O 0.23 N 2-O 2 0.22 H 2-CO 2 0.65 CO 2-H 2O 0.19 空气-CS 2 0.10 N 2-CO 0.22 H 2-CH 4 0.73 CO 2-C 3H 8 0.09 空气-乙醚 0.08 N 2-CO 2
0.16 H 2-C 2H 4 0.60 CO 2-CH 3O 0.09 空气-甲醇
0.11
H
N2-H2O 0.24 H2-C2H60.54 CO2-C6H60.06 空气-C6H60.08
N2-C2H40.16 H2-H2O 0.90 O2-C6H80.07 H2O-CH40.28
N2-C2H60.15 H2-Br20.58 O2-CO 0.21 H2O-C2H40.20
N2-C4H100.10 H2-C6H60.34 CO-C2H40.13 H2O-O20.27
CO2-O20.18 空气-H20.63
表3-3为粘性系数。
表3-3 一些气体及蒸气的粘性系数(单位为:105P a·s)
T/℃ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 0 171 94 139 166 83 85 91 102
10 180 72 140 170 84 87 92 103 170 81 76
20 183 76 148 173 87 91 101 109 178 84 80
30 186 79 153 175 90 94 104 113 184 88 84
40 190 82 157 177 92 88 108 117 188 90 87
50 68 194 85 168 180 94 101 110 120 192 94 90
75 82 210 91 180 188 98 100 108 120 129 127 203 100 63 96
100 105 93 218 97 190 196 108 105 114 126 133 125 211 108 68 102 126 150 110 242 108 211 218 124 112 127 140 148 136 229 120 77 114 144 200 125 255 120 232 240 138 122 141 154 160 152 245 134 85 125 164 250 196 275 132 250 266 153 130 155 167 170 170 253 151 92 137 189 300 147 295 145 268 294 166 130 171 180 181 188 280 170 100 202 350 158 313 158 286 180 146 193 211 295 221 400 166 332 174 304 194 156 205 311 241 500 360 333 171 226 340
600 390 361 185 256 369
700 420 389 198 285 381
800 442 415 211 419
900 470 440 224 440
1000 500 470 235 460
标号意义:1.醋乙酸蒸气2.丙酮蒸气3.空气4.乙炔5.苯蒸气6.二氧化碳7.一氧化碳8.乙醇蒸
气9.氢10.乙炔11.乙烯12.甲烷13.甲醇蒸气14.氮15.丙烯16.正辛烷蒸气17.丙烷18.水蒸气表3-4为一些气体的准则数。
表3-4 一些气体的Pr、Le数及Se数(T=273K,p=0.1Mpa)
气体Se Pr Le
氩0.75 0.67 1.12
氮0.74 0.71 1.04
甲烷0.70 0.74 0.95
氧0.74 0.72 1.03
二氧化碳0.71 0.75 0.95
氢0.73 0.71 1.03 简单动力学计算值0.83 0.67 1.25 表3-5为一些气体及水蒸气的导热系数。在其它温度时,
()00/n
T T λλ= (3.32)
上式中对于永久性气体 Tmax <1000℃时, n=0.94;对于可凝结性气体Tmax <600℃时, n=1.83。
表3-5 一些气体及水蒸气的导热系数0λ(在T 0=273℃时)
3.5基本守恒方程
参考6—P54
设Φ为通用物理量变量,它可以是标量,也可以是矢量。其对应的广义线密度,广义面密度,广义密度分别记作''''''ΦΦΦ,,。通用变量对时间的变化率
记作Φ ,相应地有''''''ΦΦΦ ,,。
空间取控制体V ,有控制面S 所包围。实线表示控制体V 在t 时刻的状况和
位置,虚线表示控制体V 在t+△t 时刻的状况和位置,n 为微元控制面△S 的单位外法线矢量。
图3.6 控制体示意图
追踪控制体,时间从t 到t+△t ,在不考虑对流的情况下,Φ从Φt 到Φt+△t ,在这段时间内,通过表面流进控制体的量为Φin ,流出控制体的量为Φout ,这段时间内控制体物理量的总变化为
()()=t t t out in +??ΦΦ-Φ+Φ-Φ
两边同除以t ?,并令0t ?→,得
()S D v n dS Dt t
Φ?Φ'''=+Φ???
(◆)(3.33) 根据广义密度定义V
dV '''Φ=Φ?
所以
V
dV t t ?Φ?
'''=Φ??? 当Φ为标量函数时,如Φ代表质量或能量,'''Φ也为标量函数,根据奥高公式,(3.33)式变为
()V V D dV v dV Dt
t '''Φ?Φ'''=+??Φ???
又由于()v v v '''''''''??Φ=Φ??+??Φ
故
V D D v dV Dt Dt '''
ΦΦ??'''=+Φ?? ???
? (●)
(3.34) 当Φ 为矢量函数时,如代表动量,'''Φ
也为矢量函数。根据奥高公式,(3.33)
式改写为
V D v dV Dt t '''??
Φ?Φ'''=+Φ?? ????
?
(3.35)
守恒条件为
0D Dt Φ
= 0D Dt
Φ
= 3.5.1质量守恒方程(连续方程)
将(3.36)式中的Φ表示为质量m ,'''Φ即为密度ρ,守恒条件为
0Dm
Dt
= 故
0V v dV t ρ
ρ???+??= ????
? (3.36) 由于V 是任取的,被积函数连续,所以
0v t ρρ?+??=?
(3.37) 或 0D v Dt
ρρ+??=
(3.38) (3.37)和(3.38)式即为连续方程常用的两种形式。 对于定常流动
0t ρ?=? 故 0v ρ??=
(3.39)
对于不可压缩流动
0D Dt ρ
= 故 0v ρ??=
(3.40)
3.5.2组分守恒方程(扩散方程)
若Φ代表多组元流体中某一组元的质量m i 时,'''Φ即为该组分的密度ρi ,根据定义知
1n
i
i m m ==∑
1
n i
i ρρ==∑
根据通式
i i i V Dm v dV Dt t ρ
ρ???=+?? ????? (3.41)
mi 的变化通常是由于物质扩散和化学反应而引起的,若i v
代表i 组分的扩散速度,wi 是单位体积内i 组分的化学反应速率,则有
i i i i V S Dm w dV v ndS Dt ρ-
=+???
(3.42)
等式后第一项为i 组分的物质流,第二项为i 组分的扩散流,从(3.39)和(3.42)式得
[()]i i i i v v w t ρρ?+??+=-?
(3.43)
此式为混合物中i 组分的质量平衡方程。如果混合物是由n 种组分组成,那么(3.43)式这样的方程也就会有n 个,但由于总质量守恒,只有n-1个组分守恒方程式独立的。
i 组分的质量分数,即相对密度为
i
i Y ρρ=
根据菲克定律知
i i i i v D ρρ=-?
故
i i i i v D Y ρρ=-?
(3.44)
因此
()()()i i i i i Y Y v w D Y t ρρρ?+??=-+????
(3.45)
等式左侧第一项为净变化率,第二项为对流项,等式右侧第一项为化学反应速率即流场的源项,第二项为扩散项。若将连续方程(3.37)代入则有
()i
i i i DY D Y w Dt ρ
ρ=???- (3.46)
对于定常流动
0i
Y t ρ
?=?
故
()i i i i v Y D Y w ρρ??=???-
(3.47)
若Φ和'''Φ分别代表动量M mv = 和动量密度v ρ ,即可得到
()
()V DM v vv dV Dt t ρρ???=+???????
? (3.48)
积分号内展开,且利用连续方程(3.37)代入
()()()()v v vv v v v v v t t t ρρρρρρ???+??=++??+?????
整理后得
()()v Dv vv t Dt ρρρ?+??=?
(3.49)
我们知道,系统动量随时间的变化率等于作用于系统上的合外力,而外力又
可分为体积力Fv 和表面力Fs
。
设i f
为组分i 单位质量的体积力,则
i i
i
Fv f ρ=∑
表面力可以用一个二阶张量P 来表示
2
3()2P p v I μμε=-+??+
代入动量方程有
i i i Dv f P Dt ρρ=+??∑ (3.50)
23
(2)()i i i Dv p v f Dt ρμεμρ=-?+??-???+∑
(3.51)
当忽略体积力时,
Dv
P Dt ρ=?? (3.52)
没有体积力作用时的定常流方程的形式为
23()()(2)v p v ρμμε??=-?-???+??
(3.53)
由于表示能量的方法很多,为了方便,在不同的场合用不同的表达方式,因此能量守恒方程也就可以写成不同的形式。最常用的有内能形式、焓的形式和温度形式。
1. 内能形式
以u 代表混合物单位质量的内能,以e 代表单位质量的总能,则有
2
2v e u =+
如果考虑各组分的差异,可以把内能再细分为各组分的内能i u (单位质量)
i i
i
u Yu =∑
通式中Φ代表总能量E ,e ρ代表单位体积的总能,称为能量密度,对应守恒方程中的'''Φ,所以
()
()V De e ev dV Dt t ρρ???=+???????? (3.54)
将(3.54)式中被积函数展开,且利用连续方程,(3.37)代入(3.54)式可简化为
V De de
dV Dt dt ρ=? (3.55)
根据热力学第一定律知,系统内部总能量变化率等于外界传给系统热量的速率和外力对系统所做功率的和。传给系统热量的途径不外是辐射、对流和传导。通过控制S ,外界传给系统的辐射热为
r r S
V
q ds q dV
-=-????
(3.56)
由扩散对流和热传导引起的换热公式为
S
V
qds qdV -=-????
()i i i V
V
i
qdV T hV qdV
λρ-??=-???-∑??
(3.57)
右方积分号内第一项为温差传热项,第二项为扩散对流项,其中i h 为i 组分单位
质量的焓,包括显焓和化学焓
0T
i i pi T h h C dT
=+? (3.58)
0i h 为i 组分在标准温度T0下单位质量的生成焓,pi C 为i 组分单位质量的恒压
比热。(3.57)式中i V 是i 组分相对于混合物的扩散速度,它与宏观流速v
存在着如下的关系
i v
是i 组分相对于空间静坐标系(实验室坐标系)的速度。
由于控制体所受外力包括体积力和表面力两部分,因此外力对系统所做的功业应由两部分组成,
()i i i V
i
f v dV
ρ?∑?
(3.59)
和
()V
v P dV
????
(3.60)
在(3.60)式中
()()()v P v P P v ???=???+??
(3.61)
根据动量方程(3.61)式知
()()()
i i Dv v P v v f Dt ρρ???=?-?∑
(3.62)
根据表面张力公式,
()P v p v ψ??=-??+
(3.63)
223v I v
ψμμε??????=-??+???? ?????????
(3.64)
ψ为粘性力引起的耗散功。
综合以上分析,可得到能量守恒方程
()()()()i i i r i i i
i i
De T hV q v P f v Dt ρλρρ=???-??+??+???+?∑∑
V v v =-
(3.65)
等式右方第一项为传热项,第二项为对流项,第三项为辐射项,第四项为表面功项,第五项为体积力功项,或写为
()()()i i i r i i i
i i Du p v T hV q f v Dt ρλρψρ+??=???-??+??++?∑∑
(3.66)
这就是能量守恒方程的内能形式。
2. 焓的形式
根据热力学中内能与焓的关系/h u p ρ=+ 所以
2
1Dh Du Dp p D Dt Dt Dt Dt ρ
ρρ=+- (3.67)
将(3.67)、(3.66)和(3.37)式联立则可得能量守恒方程焓的形式
()()()i i i r i i i
i i Dh Dp T h V q f v Dt Dt ρλρψρ=+???-??+??++?∑∑
(3.68)
3. 温度形式 已知
i i
i
u Yu =∑ i i
i
h Y h =∑
00T
i i vi T u u C dT
=+? 0
0T
i pi T hi h C dT
=+?
故
()i i i i i i i i i
DY Dh Dh D
Y h h Y Dt Dt Dt Dt ==+∑∑∑ 根据方程(3.46)式,
[]1
()i i
i i i i i
i
DY h h D Y Dt ρωρ=???-∑∑ (3.69)
又根据热力学知
00T i i i
i pi T i
i
Dh Dh D Y Y C dT Dt Dt Dt ??
=+????∑∑?
《燃烧理论基础》复习题 第一章燃烧中的化学热力学及燃烧化学问题 1、我国目前能源与环境的现状怎样? 2、什么叫燃烧? 3、从正负两方面论述研究燃烧的意义。 4、不同的学科研究燃烧学各有设么侧重点? 5、简述能量转化与守恒关系。 6、标准生成焓、生成焓的定义? 7、反应焓的定义及计算方法? 8、燃烧焓的定义? 9、用图示的方法(△H-T)表达放热反应与吸热反应。 10、燃烧焓与燃烧能近似相等的原因? 11、燃料热值与燃烧焓的关系? 12、高热值和低热值的区别和转换方法怎样? 13、液体以及气体燃料热值的测试方法如何? 14、反应焓和温度的关系? 15、什么叫化学平衡? 16、平衡常数的三种表达方式和相互间的关系怎样? 17、反应速度、生成速度或消耗速度的表达式? 18、反应度的概念及计算方法? 19、Gibbs函数的定义? 20、自由焓与温度变化的关系? 21、自由焓与压力变化的关系? 22、孤立系统与非孤立系统的反应平衡关系各自通过什么来判断? 23、过量空气系数(φat)与当量比(φ)的概念? 24、浓度以及化学计量浓度的概念? 25、化学反应中达到平衡状态时的反应度及各组分的摩尔比的计算方法怎样? 26、氧化反应中,燃烧空气量与燃烧产物的计算方法怎样? 27、绝热火焰温度的计算方法(反应度为1、反应度小于1、考虑高温热分解三种)怎样? 28、净反应速度的定义? 29、化学反应过程中浓度岁时间的变化关系怎样? 30、反应级数的定义(反应物浓度的指数和)与确定?一般烃类的燃烧反应级数为多少? 31、Arrhenius定律的内容是什么?(它考察了比反应速度与温度的关系) 32、为什么说Arrhenius定律的结论与分子碰撞理论对化学反应速度的解释是一致的? 33、热爆理论的局限性体现在什么地方? 34、什么叫链反应?它是怎样分类的? 35、链反应一般可以分为几个阶段? 36、以氢气与溴反应生成溴化氢微粒推导该反应的反应级数。 37、分支链反应为什么能极大地增加化学反应的速度? 38、图解燃烧半岛现象。 39、常见的有机类燃料及其衍生物有哪几种? 40、图解碳氢化合物燃烧过程中出现的现象。
CH1 1.何谓燃烧?燃烧是一种急速、剧烈的发光发热的氧化反应过程。 2. 化合物的标准生成焓: 化合物的构成元素在标准状态下(25oC,0.1MPa)定温—定容或者定温定压;经化合反应生成一个mol的该化合物的焓的增量(kJ/mol)。 所有元素在标准状态下的标准生成焓均为零。 3. 反应焓: 在定温-定容或定温-定压条件下,反应物与产物之间的焓差,为该反应物的反应焓(kJ)。 4. 反应焓的计算 ?? 5. 燃烧焓: 单位质量的燃料(不包括氧化剂)在定温—定容或定温—定压条件下,燃烧反应时的反应焓之值(kJ/kg)。 6.燃料热值: 燃料热值有高热值与低热值之分,相差一个燃烧产物中的水的气化潜热。 7.化学反应速度、正向反应速度、逆向反应速度、反应速度常数 ?? 8.平衡常数的三种表达方式和相互间的关系 ?? 按浓度定义的反应平衡常数,以分压定义的反应平衡常数,以体积百分比定义的平衡常数?? 平衡常数越大,反应进行得越彻底 9.反应度λ: 表示系统达到平衡时反应物能有效变为产物的程度 反应式: aA+bB→(1-λ)*(aA+bB)+λ(cC+dD) 10. Gibbs函数的定义: 自由焓,为状态参数。g=h-Ts 11. Helmholtz函数自由能f f=u-Ts 12.焓与生成焓仅是温度的单一函数,而自由焓与P、T有关。 13.标准反应自由焓 14.平衡常数kp与反应自由焓的关系 15.过量空气系数: 燃烧1kg燃料,实际提供空气量/ 理论所需空气量。 16.当量比(φ) C-实际浓度,Cst-理论浓度 17.浓度(燃空比): 一定体积混合气中的燃料重量/ 空气重量 18. 化学计量浓度时的浓度时的浓度 19. 绝热燃烧火焰温度的求解方法,尤其是考虑化学平衡时的计算方法 首先分别根据平衡常数kp和能量守恒方程得到反应度λ和绝热火焰温度Tf 的关系,然后采用迭代法计算得到Tf 。 20.绝热燃烧火焰温度计算程序及数据处理 CH2 1. 化学反应动力学是研究化学反应机理和化学反应速率的科学。 2. 燃烧机理研究的核心问题有:燃烧的反应机构、反应速度、反应程度、燃烧产物的生成机理等 3.净反应速度: 消耗速度与生成速度的代数和。 4.反应级数n: 一般碳氢燃料n=1.7~2.2≈2
1;描述燃烧物理现象的方程有哪些? 质量守恒方程,动量守恒方程,能量守恒方程,组分守恒方程。 2:研究基础有哪些基本定律和现象? 牛顿粘性定律,傅里叶导热定律,费克扩散定律,斯蒂芬流问题。 例子:喷灯、家用煤气、气焊枪。温度场,浓度场,速度场。 3:牛顿粘性定律表明:粘性是动量交换的必要条件。由速度梯度变为动量梯度 傅里叶导热定律表明:热扩散是能量交换的必要条件。由温度梯度变为焓的梯度费克扩散定律表明:传质(扩散)是组分扩散的必要条件。由密度梯度变为质量分数的梯度。 4:Stefen流产生的物理条件、化学条件:斯蒂芬流产生的条件是在相分界外既有扩散现象存在,又有物理和(或)化学过程存在,这两个条件是缺一不可的。 第四章着火 1:着火过程由什么因素控制的? 着火与混合气的压力、温度、浓度、壁面的散热率、(点火能量)气流运动有关。2:燃烧速度的决定因素有哪些?举例说明哪些燃烧现象受物理过程控制,哪些受化学过程控制? 由扩散、流动、传热及其他物理过程决定燃烧过程速度的燃烧为扩散控制燃烧,物理因素起主要的控制作用。例如油滴、喷雾燃烧,未作预混合的气体射流燃烧,蜡烛、碳球的燃烧等均属此类。汽油机、煤气机、喷灯等预混合气有火焰传播的燃烧则同时受化学动力学及扩散的控制。 3:燃烧反应过程中浓度与温度的关系 燃烧反应速度主要与反应气体混合剂的温度及初始反应物、中间产物、最终产物的浓度有关。反应速度与温度的关系常用Arrhenius指数项或简单的指数Tm的关系式表示。 4:简单反应或热反应:反应速度只受初始反应物浓度影响的反应复杂反应或自催化反应:反应速度受中间产物或最终产物浓度影响的反应 5:热着火需要满足的条件是什么? 可燃混合剂在某一条件下由外界加热,如火花塞、热容器壁、压缩等,到达某一特定温度时,反应物在此温度下的放热速度大于散热损失的速度。 6化学链着火需要满足的条件是什么? 若燃烧反应有中间载链基的分枝链反应时,则甚至在等温条件下也能着火。如产生载链基的速度超过其消亡的速度则反应逐渐加速并导致着火。而链反应自身的引发则需要一外来的热能或光能源。一旦此链已经引发,在上述的载链基产生速度得以满足时,则移去外能源后也能发生着火。 7:自发着火举例:柴油机着火燃烧、油溅泼到赤热的表面上的着火燃烧、汽油机中的爆震等。 强制着火举例:汽油机点火燃烧 8:Semonov自燃理论的基础是什么? 在热爆炸理论 9:自燃必要条件有两个判据,他们的表达式怎样?
本课程的学习内容 第一章燃烧热力学 第二章化学动力学 第三章燃烧物理系 第四章着火(自然与引燃) 第五章预混合气体燃烧火焰 第六章扩散火焰与液体燃料燃烧 第七章气体燃料的喷射与燃烧 第八章固体燃料的燃烧 课程实验 考试说明 课程考核形式 闭卷考试 依托大纲,参考教材 70%考卷,30%平时 题型:填空、(判断、)多项选择、名词解释、简答、计算、图解分析 考试时间:6月9日下午或晚上 第一章 1 2 3.化合物的标准生成焓 化合物的构成元素在标准状态下(25℃,0.1MPa)。定温——定容或者定温定压;经化合反应生成一个mol的该化合物的焓的增量(KJ/mol) 所有元素在标准状态下的标准生成焓均为零。 4.反应焓(**) 在定温——定容或定温——定压条件下,反应物与产物之间的焓差为该反应物的反应焓(KJ)。 5.反应焓的计算(**) 6.燃烧焓(**) 单位质量的燃料(不包括氧化剂)在定温——定容或定温——定压条件下,燃烧反应时的反应焓之值(KJ/Kg)。 7.燃料热值(**) 燃料热值有高热值与低热值之分,相差一个燃烧产物中的水的汽化潜热。 8.平衡常数的三种表达方式和相互间的关系(**) 按浓度定义的反应平衡常数,以分压定义的反应平衡常数,以体积百分比定义的反应平衡常数。 9.反应度λ(**)
表示系统达到平衡时反应物能有效变为产物的程度 10.Gibbs函数的定义 自由焓,为状态参数。g=h-Ts 11.Helmholtz函数 自由能f 12.焓与生成焓仅是温度的单一函数,而自由焓与P、T有关。 ) 13.过量空气系数(**)(?a=m a m ast 燃烧1Kg燃料,实际提供空气量/理论所需空气量。 14.当量比(?=!#@¥%!@) C——实际浓度,Cst——理论浓度 15.浓度(空燃比)(C=#@¥) 一定体积混合气体中的燃料重量/空气重量 16.化学计量浓度 ?a=1时的浓度 17.绝热火焰温度的求解方法,尤其是考虑化学平衡时的计算方法(**)(附图) 首先分别根据平衡常数Kp和能量守恒方程得到的反应度λ和绝热火焰温度T f的关系,然后采用迭代法计算得到T f 18.绝热燃烧火焰计算程序及数据处理。 第二章化学动力学 1.化学反应动力学是研究化学反应机理和化学反应速率的科学。(*) 2.燃烧机理研究的核心问题有:燃烧的反应机构,反应速度,反应程度,燃烧产物的生成机理等 3.净反应速度(*)(公式见书本) 消耗速度与生成速度的代数和。 4.反应级数n 一般碳氢燃料n=1.7~2.2≈2 5.Arrhenius定律 A-频率因子(分子间碰撞的频率);E-活化能;T-温度 ? 比反应速度k n=Ae?E RT 6.分子碰撞理论与Arrhenius定律属热爆燃理论 7.热爆燃理论(**) 反应物在一定温度的反应系统中,分子碰撞使部分分子完成放热反应,放出的燃烧热提高反应系统中的温度,从而加速反应速度。反应系统处于一种正反馈的加热、加速反应过程。当反应速度趋于无穷大,就产生爆炸。这种由于反应热量聚集的加速反应乃至燃烧爆炸的理论称为热爆燃理论。 8.热爆燃理论的局限性体现在什么地方?
1、火炸药化学变化的类型:(1)热分解:火炸药整体受热发生分解,一般是最弱的化学键发生断裂。(2)燃烧、(3)爆轰:是一种较之燃烧更为剧烈的物理化学变化,它是一种以爆轰波的形式沿炸药装药高速自行传播的现象 主要不同点: (1) 过程传播机理不同 (2) 过程传播速度不同(3) 受外界影响不同 (4)产物质点运动方向不同 2、燃烧的定义:燃烧是一种激烈的氧化还原反应过程,放出大量的热和气体,同时伴有发热、发光的或者火焰。 3、燃烧三要素:可燃物、氧、达到一定的温度(着火点) 4、燃烧与国民经济、国防建设的关系:①燃料燃烧是主要能源②国防;热兵器的发射能源主要来自于火药的燃烧(发射药)。③其他日常生活、燃烧与安全(火灾防止等)、燃烧与环境(温室效应、保护臭氧层) 5、研究燃烧理论的意义:①从理论上讲,研究理论用于指导实践。揭示燃烧现象的本质和规律。用于研究燃烧过程。(工业,武器中)②提高能量利用率。(柴油添加剂……)③安全生产④环境保护(作为理论基础)⑤特殊燃烧规律的应用 第一章 1、热力学第一定律:体系吸收的热量dQ分别用于增加体系的内能dU和对外界做功dW;本质:能量守恒 2、热力学第二定律本质:不可能从单一热源吸热而不引起其他变化。(高温到低温)在化学反应中的本质:表明化学反应的方向。(表征:熵S) 3、阿累尼乌斯定律 ln RT E dT K d 适用范围:它适用于各种类型的反应,包括气相、液相、催化和异相反应,在固体火药的热分解和燃烧中常用以表征分解速度和燃烧速度。 3、两种燃料着火方式的定义、区别以及着火条件。 定义:自动着火,即可燃物质整体受到均匀的加热或压缩,当化学反应产生的热量超过散失的热量,反应加速,直至整体着火; 强制点火,即可燃物质和一能量源局部接触,强烈受热而起燃,火焰向其余部分传播。 区别:两者的主要区别在于前者主要是依靠自身反应热量的积累,后者是依赖于外界热量的供给 着火条件:如果在一定的初始条件下,系统将不能在整个时间区段保持低温水平的缓慢反应态,而将出现一个剧烈的加速的过度过程,使系统在某个瞬间达到高温反应态,即达到燃烧态,那么这个初始条件就是着火条件。 4.电极熄火距离、电极危险距离。 电极熄火距离:不能引燃混气的电极间的最大距离; 电极危险距离:在给定条件下,电极距离有一最危险值,电极距离大于或小于最危险值时,最小引燃能增加。 5、影响电火花引燃的因素。 (1、热容越大,最小引燃能Emin越大,混气不容易引燃,因为热容大,混气升温时吸收的热量多; (2、导热系数K越大,最小引燃能Emin越大,混气不容易引燃。因为火花能量被迅速传导出去,使与火花接触的混气温度不易升高; (3、燃烧热大,最小引燃能Emin小,混气容易引燃; (4、混气压力大,即密度大,最小引燃能Emin小,表明混气容易引燃;
第五章 煤粉燃烧的理论基础和燃烧设备 (一)教学要求 1.掌握炭粒的三个燃烧区域,理解影响燃烧反应的化学因素和物理因素 2.掌握煤粉气流着火的影响因素和完全燃烧的条件 3.了解直流射流的特性,理解直流燃烧器的结构型式及其布置情况 4.了解旋流射流的特性,理解旋流燃烧器的结构型式及其布置情况 5.了解W 型火焰燃烧技术 (二)重点和难点 重点:1.炭粒燃烧的动力燃烧区、扩散燃烧区、过渡燃烧器三个区域 2.煤粉气流着火的影响因素 3.煤粉完全燃烧的条件 难点:1.直流燃烧器的结构型式及其布置情况 2. 旋流燃烧器的结构型式及其布置情况 (三)教学方式 课堂讲授、多媒体教学结合课堂讨论及现场模型讲授 (四)教学内容 第一节 燃烧的基本理论 复习几种热损失。为了减小热损失,锅炉燃烧需要作到:稳定着火、快速燃尽。为实现该目的,需寻找强化燃烧的方法,这就要认识燃烧过程的本质。从而,需要学习基础燃烧理论。 燃烧是气体、液体或固体燃料与氧化剂之间发生的一种强烈的化学反应;同时伴随各种物理过程 燃烧反应根据参加反应的物质不同分为: 一、化学反应速度 某一反应物浓度的减少速度或生成物浓度的增加速度表示。 1.浓度 浓度越大,反应速度越快。 质量作用定律:对于均相反应,在一定温度下化学反应速度与参加反应的各反应物的浓度乘积成正比,而各反应物浓度项的方次等于化学反应式中相应的反应系数。 对于异相反应:化学反应在炭粒表面进行,认为碳粒浓度不变,化学反应速 度指单位时间内碳粒表面上氧浓度的变化。 质量作用定律说明:在温度不变的情况下,反应物的浓度越高,分子的碰撞 hH gG bB aA +→+b B a A C kC w =b B B kC w =
可燃液体的燃烧,实质上是燃烧可燃液体蒸发出来的蒸气,所以叫蒸发燃烧。 对于难挥发的可燃液体,其受热后分解出可燃性气体,然后这些可燃性气体进行燃烧,这种燃烧形式称为分解燃烧。 可燃固体的燃烧可分为简单可燃固体、高熔点可燃固体、低熔点可燃固体和复杂的可燃固体燃烧等四种情况。 固体碳和铝、镍、铁等金属熔点较高,在热源作用下不氧化也不分解,它们的燃烧发生在空气和固体表面接触的部位,能产生红热的表面,但不产生火焰,燃烧的速度和固体表面的大小有关。这种燃烧形式称为表面燃烧。 闪点的影响因素 同系物液体的闪点随着相对分子量、相对密度、沸点的增加和蒸汽压的降低而增高。 同类组分混合液,如汽油、煤油等,由烃类的同系物组成,其闪点随着馏分的增高而增高。异构体的闪点低于正构体。 能溶于水的易燃液体,闪点随浓度的降低而增高。 油漆类液体的闪点取决于油漆中所含溶剂的闪点。 两种可燃液体混合物的闪点一般低于这两种液体闪点的平均值。 易燃气体:a)与空气的混合物按体积分类占13%或更少时可点燃的气体;b) 不论易燃下限如何,与空气混合,燃烧范围的体积分数至少为12%的气体。 非易燃无毒气体:在20℃压力不低于280 kPa条件下运输或以冷冻液体状态运输的气体(窒息性气体、氧化性气体、不属于其他项别的气体) 易燃液体:在其闪点温度(其闭杯试验闪点不高于60.5℃,或其开杯试验闪点不高于65.6℃)时放出易燃蒸气的液体或液体混合物,或是在溶液或悬浮液中含有固体的液体。 氧化性物质:本身不一定可燃,但通常因放出氧或起氧化反应可能引起或促使其他物质燃烧的物质。 有机过氧化物:分子组成中含有过氧基的有机物质,该物质为热不稳定物质,可能发生放热的自加速分解。该类物质还可能具有以下一种或数种性质:a) 可能发生爆炸性分解;b) 迅速燃烧;c) 对碰撞或摩擦敏感;d) 与其他物质起危险反应。e) 损害眼睛 毒性物质:经吞食、吸入或皮肤接触后可能造成死亡或严重受伤或健康损害的物质。 经口摄取半数致死量:固体ld50≤200 mg/kg,液体ld50≤500 mg/kg;经皮肤接触24 h,半数致死量ld50≤1 000 mg/kg;粉尘、烟雾吸入半数致死浓度lc50≤10 mg/L的固体或液体 染性物质:含有病原体的物质,包括生物制品、诊断样品、基因突变的微生物、生物体和其他媒介,如病毒蛋白等。 放射性物质:含有放射性核素且其放射性活度浓度和总活度都分别超过GB 11806规定的限值的物质,放射性比活>7.4×104Bq/kg 腐蚀性物质:通过化学作用使生物组织接触时会造成严重损伤、或在渗漏时会严重损害甚至毁坏其他货物或运载工具的物质。 腐蚀性物质包含与完好皮肤组织接触不超过4 h,在14 d的观察期中发现引起皮肤全厚度损毁,或在温度55℃时,对s235jr+cr型或类似型号钢或无覆盖层铝的表面均匀年腐蚀率超过6.25 mm/a的物质。 热冲量起爆:加热或局部引燃炸药不稳定燃烧(加速) 爆轰---DDT过程DDT过程的长短与炸药自身的物理化学性质,装药直径,密度,外界压力,初温,外界强度有关。 机械冲量起爆:机械冲击的作用形式:撞击、摩檫。机械冲击“热点”或活化中心热点扩张(低速燃烧)爆轰 爆轰能否传播下去,取决于第一层受冲击炸药爆炸产生的能量大小,如果能激发下一层
燃烧理论与技术——作业题 第一组测试题: 1、什么是反应级数?反应级数与反应物初始浓度之间的关系如何? 答:化学反应速率表达式ω=kc A a c B b中,浓度指数之和n=a+b即为反应级数。反应级数与反应物初始浓度的关系:ω=-dc/dτ=kc n(n——反应级数) 2、什么是着火孕育时间?请图示。并解释:为何堆放在煤场上的煤在常温下也经常会发生自燃,而直吹式煤粉锅炉一次风管道中的煤粉在高于150℃的条件下也不会发生自燃? 1)答:着火孕育时间:满足临界着火条件下,可燃混合物从开始反应到出 现火焰需要的时间,其物理意义为:从环境温度T 0升高到着火温度T C 所需要 的时间。 如右图所示: 系统的温度变化与反应放热和系 统散热量的差值有关。 ①对于曲线Ⅰ、Ⅱ,热量之差越 来越接近于零,系统温度逼近渐近线 T lj 。 ②对于Ⅲ,系统温度不断升高, 在t时出现拐点,拐点之前的那段时间 就是着火孕育时间。 ③提高初温相当于缩短着火孕育时间如曲线Ⅳ、Ⅴ。 2)答:着火、熄火是反应放热因素和散热因素相互作用的结果:堆放在 煤场上的煤在常温下发生氧化作用,反应放热大于散热,故能发生自燃;而直吹式煤粉锅炉一次风管道中的煤粉尽管温度高达150℃,但其散热大于放热,故无法发生自燃。 3、为什么扩散火焰不容易脱火也不容易回火?为什么全预混火焰既容易脱火也
容易回火?结合火焰区域的图进行解释。 答:扩散燃烧时所形成的火焰即为扩散火焰;同理,预混燃烧时所形成的火焰即为预混火焰。 扩散燃烧时,燃烧缓慢,燃烧 空间热强度低。扩散火焰的稳定燃 烧范围宽,故不容易脱火也没有回 火的危险。 而预混火焰形成的火焰短,火 焰温度高,要注意防止其发生脱火 和回火。 4、试解释为什么相同煤制成的水煤浆和煤粉着火温度不同? 答:水煤浆由65%-70%不同粒度分布的煤,29-34%左右的水和约1%的化学添加剂制成的混合物。水煤浆在燃烧时。里面水分的加热蒸发需要大量的热,故即使是相同煤制成的水煤浆和煤粉着火温度也不会相同。 5、当一个反应由很多中间步骤完成时,反应速率是由步骤中哪些步骤决定的? 答:反应速率由反应速率最慢的一个步骤决定,又称限速步骤。
华中科技大学能源与动力工程学院 博士入学考试《燃烧理论》考试大纲 第一部分考试说明 1.答卷方式:闭卷,笔试。 2.答卷时间:180分钟。 3.卷面满分:100分。 4.所列题目全部为必答题。 第二部分考查要求 1.燃烧与火焰的概念,燃烧与国民经济及能源的关系,燃烧科学的发展,燃烧学的研究对象及研究方法。 2.燃烧化学热力学和燃烧化学动力学 化学热力学:生成热、反应热、热化学定律;热力学平衡与自由能;标准自由能和平衡常数;气体的离解;绝热火焰温度。 化学动力学:化学反应速度;反应级数;压力、浓度、温度、活化能对化学反应速度的影响;反应速度碰撞理论;反应速度过渡状态理论;链式反应。 3.燃烧物理学 各组份气体基本参量;分子输运基本定律(牛顿粘性定律、傅立叶导热定律、费克扩散定律);基本守恒方程(连续方程、动量守恒方程、组份守恒方程、能量守恒方程)基本理论与基本概念;泽尔多维奇转换和广义雷诺比拟的概念;斯蒂芬流概念。 4.气体燃料及液滴的扩散燃烧 气体燃料射流扩散燃烧过程;射流扩散燃烧主要特征;旋转射流扩散火焰基本概念和基本理论
5.预混可燃气体的燃烧 预混可燃气体的层流燃烧:层流火焰传播速度的定义及传播机理;层流火焰传播速度的无量纲分析理论;分区近似解与渐进分析解的理论方法;物理化学参数对s 的影响;层流火焰传播速度的测量方法。 i 预混可燃气体的湍流燃烧:皱折表面燃烧理论;容积燃烧理论;湍流火焰实验。 6.着火与熄火 着火过程与熄火过程基本概念;热自燃理论:着火条件;非稳态分析法基本理论、稳态分析法基本理论;强迫点火理论:热平板点燃基本理论、电火花点火基本理论、热气流点火基本理论;着火的链式反应基本理论;熄火现象:理想燃烧室的着火熄火现象描述;预混可燃气的熄火现象。 7.火焰稳定 一维火焰的稳定条件;本生灯火焰稳定性分析;回火与吹熄的临界条件;防止回火的方法;钝体稳定火焰的机理;预混火焰稳定的其他方法;湍流扩散火焰稳定的方法。 8.煤的燃烧基础 煤的形成过程及分类;煤的化学成分及性质;煤的成份分析;煤质特性的评价;热的热解及实验方法;煤的热解模型;碳粒燃烧的两种研究方法;理论分析孔隙和灰层对炭粒燃烧的影响;单颗碳粒的着火理论分析;单颗煤粒的着火理论分析。 9.煤的先进燃烧技术—了解基本原理、基本技术方法 燃煤锅炉的低NOX燃烧技术;循环硫化床燃烧技术 10.燃煤烟气净化技术—了解基本原理、基本技术方法 烟气净化基本原理;颗粒物的脱除技术;烟气脱硫技术;烟气脱硝技术;同时脱硫脱硝技术;燃煤电站锅炉重金属和汞牌坊控制技术
燃烧理论与技术 -- 作业题 第一组测试题: 1、什么是反应级数反应级数与反应物初始浓度之间的关系如何 答:化学反应速率表达式=k8a C B b中,浓度指数之和n=a+b即为反应级数。反应级数与反应物初始浓度的关系:=-dc/d T =kc!n(n -- 反应级数) 2、什么是着火孕育时间请图示。并解释:为何堆放在煤场上的煤在常温下也经 常会发生自燃,而直吹式煤粉锅炉一次风管道中的煤粉在高于150 C的条件下也不会发生自燃 1)答:着火孕育时间:满足临界着火条件下,可燃混合物从开始反应到出现火焰 需要的时间,其物理意义为:从环境温度T o升高到着火温度T C所需要的时间。 如右图所示: 系统的温度变化与反应放热和系 统散热量的差值有关。 ①对于曲线I、U,热量之差越 来越接近于零,系统温度逼近渐近线T j ②对于川,系统温度不断升高, 在t时出现拐点,拐点之前的那段时间 就是着火孕育时间。 ③提高初温相当于缩短着火孕育 时间如曲线IV>Vo 2)答:着火、熄火是反应放热因素和散热因素相互作用的结果:堆放在 煤场上的煤在常温下发生氧化作用,反应放热大于散热,故能发生自燃;而直吹式煤粉锅炉一次风管道中的煤粉尽管温度高达150C,但其散热大于放热,故无法发生自燃。 3、为什么扩散火焰不容易脱火也不容易回火为什么全预混火焰既容易脱火也容 易回火结合火焰区域的图进行解释。 答:扩散燃烧时所形成的火焰即为扩散火焰;同理,预混燃烧时所形成的火
4、试解释为什么相同煤制成的水煤浆和煤粉着火温度不同 答:水煤浆由65%-70%不同粒度分布的煤,29-34%左右的水和约1%的化学 添加剂制成的混合物。水煤浆在燃烧时。里面水分的加热蒸发需要大量的热,故 即使是相同煤制成的水煤浆和煤粉着火温度也不会相同。 5、当一个反应由很多中间步骤完成时,反应速率是由步骤中哪些步骤决定的 答:反应速率由反应速率最慢的一个步骤决定,又称限速步骤。 1 矗P 带制诽 1可綠音气 I a 1 liji 1 扩散燃烧时,燃烧缓慢,燃烧 空间热强度低。扩散火焰的稳定燃 烧范围宽,故不容易脱火也没有回 火的危险。 而预混火焰形成的火焰短,火 焰温度高,要注意防止其发生脱火 和回火。 焰即为预混火焰
目录 燃烧与爆炸理论及分析 (2) 1. 引言 (2) 2. 可燃物的种类及热特性 (2) 2.1 可燃物的种类 (2) 2.2可燃物的热特性 (3) 3. 燃烧理论 (6) 3.1 燃烧的条件 (6) 3.2 着火形式 (6) 3.3 着火理论 (7) 3.4灭火分析 (14) 4. 爆炸理论 (18) 4.1 爆炸种类及影响 (18) 4.2 化学爆炸的条件 (21) 4.3 防控技术 (23) 5. 结论 (24) 1
燃烧与爆炸理论及分析 摘要:本文主要叙述了当前主要的燃烧及爆炸理论。首先介绍了燃烧条件、着火形式以及具体的燃烧理论,然后对四种燃烧理论分别进行了灭火分析。然后阐述了爆炸的种类、爆炸条件过程及防控技术。最后对本文的内容作了总结,并且通过分析提出自己的观点。 关键词:燃烧理论;爆炸理论;防控技术。 1. 引言 火灾是一种特殊形式的燃烧现象。爆炸(化学)是一种快速的燃烧,为了科学合理地预防控制火灾及爆炸(化学),应当对燃烧的基本理论有一定的了解。燃烧是可燃物与氧化剂之间发生的剧烈的化学反应,要使它们发生化学反应需要提供一定的外加能量,反应的结果则会放出大量的热能。燃烧前后的物质与能量变化可以要据物质与能量守恒定律确定。 2. 可燃物的种类及热特性 2.1 可燃物的种类 可燃物是多种多样的。按照形态,可分为气态、液态和固态可燃物,氢气(H2)、一氧化碳(CO)等为常见的可燃气体,汽油、酒精等为常见的可燃液体,煤、高分子聚合物等为常见的可燃固体。可燃物之所以能够燃烧是因为它包含有一定的可燃元素。主要是碳(C)、氢(H)、硫(S)、磷(P)等。碳是大多数可燃物的主要可燃成分,它的多少基本上决定了可燃物发热量的大小。碳的发热量为 3.35×107J/kg,氢的发热量为1.42×108J/kg,是碳的4 倍多。了解可燃元素及由其构成的各类可燃化合物的燃烧特性可定量计算燃烧过程中的物质转换和能量转换。有些元素发生燃烧后可以生成完全燃烧产物,也可生成不完全燃烧产物,不完全 2
燃烧理论基础简介 一、碳粒燃烧的动力区、扩散区、过渡区 1.动力区: 温度低于900~1000℃时,化学反应速度小于氧气向碳粒表面的扩散速度,氧气的供应十分充足,提高扩散速度对燃烧速度影响不大,燃烧速度取决于温度。 2.扩散区: 温度高于1200℃时,化学反应速度大于氧气向碳粒表面的扩散速度,以至于扩散到碳粒表面的氧气立刻被消耗掉,碳粒表面处的氧浓度接近于0,提高温度对燃烧速度影响不大,燃烧速度取决于氧气向碳粒表面的扩散速度。 3.过渡区: 介于动力区和扩散区之间,提高温度和提高扩散速度都可以提高燃烧速度。若扩散速度不变,只提高温度,燃烧过程向扩散区转化;若温度不变,只提高扩散速度,燃烧过程向动力区转化。 二、直流煤粉燃烧器 1、煤粉燃烧器的作用 煤粉燃烧器是燃煤锅炉燃烧设备的主要部件。其作用是: (1) 向炉内输送燃料和空气; (2) 组织燃料和空气及时、充分的混合; (3) 保证燃料进入炉膛后尽快、稳定的着火,迅速、完全的燃尽。
在煤粉燃烧时,为了减少着火所需的热量,迅速加热煤粉,使煤粉尽快达到着火温度,以实现尽快着火。故将煤粉燃烧所需的空气量分为一次风和二次风。一次风的作用是将煤粉送进炉膛,并供给煤粉初始着火阶段中挥发分燃烧所需的氧量。二次风在煤粉气流着火后混入,供给煤中焦炭和残留挥发分燃尽所需的氧量,以保证煤粉完全燃烧。直流燃烧器通常由一列矩形喷口组成。煤粉气流和热空气从喷口射出后,形成直流射流。 (二)、直流煤粉燃烧器的类型 直流煤粉燃烧器的一、二次风喷口的布置方式大致上有两种类型。一类适用于燃烧容易着火的煤,如烟煤、挥发分较高的贫煤以及褐煤。这类燃烧器的一、二次风喷口通常交替间隔排列,相邻两个喷口的中心间距较小。我们称为均等配风方式,这种方式适合烟煤的燃烧。 因一次风携带的煤粉比较容易着火,故希望在一次风中煤粉着火后及时、迅速地和相邻二次风喷口射出的热空气混合。这样,在火焰根部不会因为缺乏空气而燃烧不完全,或导致燃烧速度降低。因而沿高度相间排列的二次风喷口的风量分配就接近均匀。 我公司三期锅炉燃烧器 燃烬风喷口 煤粉喷口 油层喷口 着火区煤粉高度集中,可能造成着火区供氧不足,延缓燃烧进程;一次风喷嘴附近为高温区,喷嘴易变形,使喷嘴出口附近气流速度分布不均,容易出现空气、煤粉分层现象。为了消除这种现象,有时将一
《工程燃烧学》理论与技术专题案例蜡烛的燃烧原理与技术《工程燃烧学》理论与技术案例 1、蜡烛的燃烧原理与技术 资料编辑:韩奎华 2013年10月30日
1蜡烛燃烧原理与技术 由蜡烛想到的:春蚕到死丝方尽,蜡炬成灰泪始干,烛光里的妈妈、浪漫的烛光晚餐、粉彩多姿的生日蜡烛……从古至今,蜡烛给予我们人类光明、温暖和浪漫,蜡烛燃烧蕴含的燃烧理论与技术您知道多少呢? 1.1蜡烛的燃烧理论 蜡烛组分:石蜡C22H46/C28H58、硬脂酸C17H35COOH;常温固态,150℃以上液化和气化形成蒸气,分解、燃烧生成物为CO2和H2O 热传递:光和热辐射 燃烧中伴有的物理化学现象:蜡的液化、蒸发相变现象;蜡烛芯中发生的导热、毛细抽吸作用 蜡烛火焰组成:CH原子团形成蓝色火焰、炽热的烟炱颗粒燃烧形成黄色火焰;由内至外可分为三层:第一层焰心(淡蓝色,温度最低,也最暗),未燃烧的蜡蒸气及其产物碳氢自由基。第二层内焰(金黄色,最亮)在焰心的外围,焰心的蜡蒸气及碳氢自由基扩散到内焰,在这里开始燃烧。第三层外焰(暗红色),受外界空气影响较大,而且和外界空气的能量交换剧烈,火焰的温度受到很大的影响,易形成烟炱。 思考问题: 在地球上燃烧的蜡烛,火焰细长明亮。在国际空间站上点燃的蜡烛会是什么样子呢? 蜡烛在氧气中的燃烧状态? 蜡烛火焰温度是怎样的? 火焰颜色与温度有关系吗? 制造工艺相同的两支蜡烛在地球上和空间站上的燃烧时间相同吗?(假设燃烧气氛相同)空间站蜡烛燃烧形成圆球形的蓝色火苗,虽然漂亮,但照明效果不甚理想。重力越小燃烧越不剧烈,在国际空间站这种环境下,空气在所有方向密度是相同的,因此可燃气体向四周均匀地扩散并且燃烧,所以产生的火焰是圆球形。 蜡烛燃烧火焰属于扩散火焰:通过扩散的燃料和氧化剂在反应区中相遇后燃烧所形成的火焰。化学反应区将包含氧化性气体的气态介质与包含还原性气体混合物分割开来,形成扩散火焰。
4燃烧理论基础 4.1燃烧反应的热力学基础 1、单相反应:在一个系统内反应物与生成物属同一物态。 2、多向反应(异相反应):在一个系统内反应物与生成物不属与同一物态。 3、浓度:单位体积中所含某物质的量。 摩尔浓度: 质量浓度: 摩尔相对浓度: 质量相对浓度: 4、标准生成焓、反应焓、燃烧焓、显焓、绝对焓(P98-100) 5、化学反应速率:单位时间内,反应物(或生成物)浓度的变化量。其单位为:kg/(m3s)、 kmol/(m3s)、 分子数/(m3s) ①例: a 、b 、c 、d 为对应于反应物A 、B 和产物C 、D 的化学反应计量系数 ②反应速率可以表示为: ③化学反应速率与计量系数之间有如下关系: /i i mi i i i i i i i i n N V M V N n C X N n C M Y M n ρρ== ===∑∑∑∑∑==aA bB cC dD +→+,,C A B D A B C D dC dC dC dC r r r r d d d d ττττ =-=-==或1111::::::C A B D A B C D dC dC dC dC a d b d c d d d r r r r a b c d ττττ -=-==?=
④化学反应速率的三种表示方法:反应物的消耗速度、生成物的生成速度、r 为反应速度 ⑤影响化学反应的因素:(温度、活化能、压力、浓度、可燃混合气的配比、混合气中的惰性成分) 1. 浓度:浓度越大,反应速度越快。 2. 压力:对于气体燃料,压力升高,体积减少,浓度增加,反应速度加快。(压力对化学反应速度的影响与浓度相同。) 3. 温度:温度增加,反应速度近似成指数关系增加,体现在反应速度常数。 ①阿累尼乌斯定律: A —常数,频率因子,由实验确定; R —通用气体常数,8.28kJ/molK ,1.98kcal/molK ; E —活化能,J/mol ,由实验确定 ? 气体分子的运动速度、动能有大有小; ? 在相同温度下,分子的能量不完全相同,有 些分子的能量高于分子的平均能量,这样的分子称为活1111G A B H A B G H dC dC dC dC r a d b d g d h d r ar r br r gr r hr ττττ-=-====-=-==b B a A C kC =r RT E Ae k -=
燃烧理论复习 一、复习提纲 燃气的高低热值 1 m 3燃气完全燃烧后,其烟气被冷却至初始温度所放出的热量称为该燃气的热值,单位为kJ/m 3。当燃烧烟气中H 2O 以气体状态排出时,燃烧所放出的热量称之为低热值;当H 2O 以凝结水状态排出时,蒸汽中所含的潜热得以释放,此种状态下所放出的热量称之为高热值。显然,燃气的高热值大于低热值,差值为水蒸气的气化潜热。 如何得到混合气体的热值 混合气体的热值可以由各单一气体的热值根据混合法则进行计算 n n r H r H r H H +++= 2211 理论空气需要量 理论空气需要量:指按燃烧反应计量方程式,1m 3(或kg )燃气完全燃烧所需的空气量,是燃气完全燃烧所需的最小空气量,单位为m 3/m 3或m 3/kg 。 过剩空气系数 实际供给的空气量与理论空气需要量之比称为过剩空气系数 0V V =α 热量计温度 热量计温度。假设燃烧过程在绝热条件下(Q 2=0),且完全燃烧( Q 3=0 ),忽略烟气成分的高温分解( Q 4=0 ),由燃气和空气带入的全部热量完全用于加热烟气本身,这时烟气所能达到的温度称为热量计温度 燃烧热量温度 燃烧热量温度。在上述(1)的假设条件下,若不计燃气和空气带入的物理热(I g =I a =0),并且假设α=1,得到的烟气温度称为燃烧热量温度 理论燃烧温度 理论燃烧温度。在绝热且完全燃烧的条件下,所得到的烟气温度称为理论燃烧温度,它表明某种燃气在一定条件下燃烧,其烟气所能达到的最高温度。 实际燃烧温度 实际燃烧温度。实际燃烧温度与理论燃烧温度的差值随工艺过程和炉窑结构的不同而不同,很难精确地计算出来。实际工作中采用经验公式 th act t t μ= 式中 μ—高温系数。对于一般燃气工业炉窑可取μ=0.65~0.85;无焰燃烧器的火道可取μ=0.9。
燃烧理论与污染控制
目录 1.绪论 (3) 的生成机理 (11) 3.低NO X燃烧技术 (35) 4.新型低NO X燃烧技术 (61) 5.烟气脱硝 (67) 的生成与控制 (70)
第一章:绪论 &燃烧对大气的污染,污染物的组成及其危害 污染物按状态分类 污染物一次污染物二次污染物 固态尘悬浮(气体介质中)固体粒子 d=1~20 μm 无 烟气溶胶(含微粒) d=~1 μm 无 雾液体微粒的悬浮体,酸雾 液滴悬浮物 无 气 态 硫化物SO2,H2S SO3,H2SO4,M2SO4 2 氮化合物(NO,NO)NO,NH3NO2,HNO3,MNO3 碳氢化合物HC醛,酮,过氧乙酰基, 硝酸酯(PAN)碳氧化合物CO,CO2无 卤素化合物HF,HCl无 一次污染物:污染源直接排入大气。 二次污染物:污染物与大气中成分,污染物之间化学反应,光化学反应生成的污染物。
烟雾和粉尘 1.烟雾 本质:一种含有固体颗粒和液体微滴的气溶胶。 固体颗粒:烟黑,粉粒等。 液体微滴:水滴,硫酸微滴等。 主要成分为烟黑:C 、H 、O 、N 、S 组成的复杂化合物。 产生机理: (1)煤形成烟黑:不完全燃烧,高温下热解→产生多环化合物→烟黑 成分:苝、芘、苊(C 12H 10)、蒽(C 14H 10)、菲全是至癌物质。引起鼻炎、支气管 炎、肺癌。(d<5μm 的颗粒等被肺部吸收) 生成烟黑的煤种顺序:无烟煤→焦碳→褐煤→低挥发分的烟煤→高挥发分的烟煤 (2)石油,天然气形成烟黑: 机理:石油,泾类不断脱氢缩合,脱氢之后碳含量升高,形成烟黑物质。天然气 形成烟黑过程类似石油 生成烟黑的顺序为:煤焦油→重油→中油→轻油 (3)工业上黑烟的分类 ?? ?:如烟黑,硫酸烟雾等烟气:颗粒小于煤粉等:如飞灰,金属粉末,烟尘:颗粒大于um b um a 1.1. 2.粉尘 (1)???:不易沉降 <飘尘::粉煤,大部分飞灰等 >降尘:烟尘中飞灰um d um d 1010 (含有细灰尘,也有碱金属,重金属等化合物,飘尘中富含有重金属元素) (2)粉尘的危害: a.吸入→引起肺病→死亡 b.大气中SO 2,遇到含有重金属飘尘催化,氧化成SO 3→硫酸烟雾 c.飘尘吸附大气中NO 2及致痤物质→污染环境 d.粉尘还会吸附太阳中的紫外线物质,散射吸收阳光,不利于人与动物的生长。
绪论 1、燃烧的定义:燃烧是一种激烈的氧化还原反应过程,放出大量的热和气体,同时伴有发热、发光的或者火焰。 本质:氧化还原反应做功物质:热和气体现象:发热、发光的或者火焰 2、燃烧三要素:可燃物、氧、达到一定的发火温度(着火点) 3、燃烧形式、区别与联系:三种化学反应形式:热分解、燃烧、爆轰 主要不同点:(1) 过程传播机理不同(2) 过程传播速度不同(3) 受外界影响不同(4)产物质点运动方向不同 本质特征:化学键断裂的程度不同 联系:在一定条件下,三种形式可发生相互转化 4、燃烧与国民经济、国防建设的关系 ①燃料燃烧是主要能源大多数国家90%以上的能源来自于燃料的燃烧。 ②国防热兵器的发射能源主要来自于火药的燃烧(发射药)。 ③其他日常生活燃烧与安全(火灾防止等)燃烧与环境(温室效应、保护臭氧层) 5、研究燃烧理论的意义 ①从理论上讲,研究理论用于指导实践。揭示燃烧现象的本质和规律。用于研究燃烧过程。(工业,武器中)②提高能量利用率。(柴油添加剂)③安全生产④环境保护(作为理论基础)⑤特殊燃烧规律的应用 6、燃烧学的研究方法 ①实验研究研究燃烧的现象和规律,获得经验公式反复观察—总结规律—经验公式 ②理论研究(模型化)推导—结论—验证—修正—(反复多次)—理论 ③综合研究实验研究和理论研究结论历史资料,经验和亲自实践的经验不同学科,专业的知识,理论的综合 第一章 1、热力学第一定律:体系吸收的热量dQ分别用于增加体系的内能dU和对外界做功dW 本质:能量守恒 2|、热力学第二定律 本质:不可能从单一热源吸热而不引起其他变化。(高温到低温) 在化学反应中的本质:表明化学反应的方向。(表征:熵S) 3、化学反应类型 简单反应:经过一步反应完成的复杂反应:经过许多中间阶段完成的 典型复杂反应: 连续反应:由许多基元反应组成,前一反应生成物是后一反应的反应物反应连续进行。 平行反应:一个反应进行的同时还进行着其它反应。 共轭反应:一个反应仅当另一个反应存在时才能发生,而两个反应的反应物又是不同的,其中一个反应是另一个反应发生的条件。(催化作用) 可逆反应:一个反应的生成物又能相互作用生成原来的反应物。 链锁反应:是由于活化中心(如自由基)的形成和发展产生的反应,分为直链反应和分支链反应。 4、阿累尼乌斯定律 阿累尼乌斯公式(自己补) 适用范围:它适用于各种类型的反应,包括气相、液相、催化和异相反应,在固体火药的热
燃烧理论与燃烧设备试题A 考试形式:闭卷答题时间: 90 分钟本卷面成绩占课程成绩 100% (所有答案必须写在答题纸上、标清题号) 一、名词解释(每题2分) 1、高位发热量:1kg燃料完全燃烧放出的全部热量,包括水蒸汽凝结时放出的热量。 2、结渣温度:灰渣在无冷却的表面上(或已被沉积层覆盖的有冷却的表面上)开始形成 突峰状沉积层的烟气温度,叫结渣温度。 3、燃点:外界火焰能点燃油并维持5秒以上的最低温度称为燃点 4、焦炭:煤析出挥发分、水分后得到的固态物质称为焦炭 5、粘温特性:指灰渣的粘度随温度变化的关系,用以判断结渣倾向灰熔点。 6、化合物的生成焓:当化学元素在化学反应中构成一种化合物时,根据热力学第一定律, 化学能转变为热能(或者相反)。转变中生成的能称之为化合物的生成焓。 7、燃烧热:1mol的燃料完全燃烧释放的热量称为化合物的燃烧热。 8、活化能:活化粒子与普通分子平均能量之差称为活化能。 9、直流射流:射流不旋转,切向速度为零。 10、火焰传播速度:沿火焰锋面的法向,火焰移动的速度称为火焰传播速度。 二、简答题(每题6分) 1、燃烧学的研究主要从哪两方面进行的,并简述之? 答:(1)燃烧理论的研究 ?研究燃烧过程所涉及的各种基本现象的机理 ?如燃料的着火、熄火、火焰传播及火焰稳定、预混火焰、扩散火焰、层流和湍流燃烧、液滴燃烧、碳粒燃烧、煤的热解和燃烧、燃烧产物的形 成等过程的机理 (2)燃烧技术的研究 ?应用燃烧基本理论解决工程技术中的各种实际燃烧问题 ?如对现有燃烧方法进行分析和改进,对新的燃烧方法进行探索和实践,提高燃料利用范围和利用效率,实现对燃烧过程的控制,控制燃烧过程 中污染物质的生成和排放等等。 2、简述元素分析成分的构成。 答:碳、氢、氧、氮、硫、灰分和水分 3、简述水分对燃烧过程的影响。 答:燃料的发热量 –着火、燃烧过程吸收大量热量,降低燃烧温度 –排烟热损失
煤气燃烧理论及合理使用 1、煤气的燃烧反应 太钢除了极少量焦炉煤气作为还原性介质在可控气氛退火炉中作为还原剂使用外,到目前为止把煤气作为燃料使用,外单位还有从焦炉煤气中用变压吸附法提取氢气,从高炉煤气中提取一氧化碳来合成尿素等化工用途,其经济效益比太钢当作燃料要高得多。 煤气燃烧是煤气中各个组分气体剧烈的氧化反应,同时都放出大量热能。如下所述:2CO+O2=2CO2 大分子的燃烧,不是一次完成的,而是有阶段的,存在一些中间产物,逐次分解,分布燃烧,而小分子的燃烧就会快一些。 气体燃料的正常燃烧,必须同时具备以下三个条件,缺乏其中任何一个条件都会熄火。 (1)有可燃物质即有煤气的连续供应。 (2)充分第供应助燃的空气或氧气。 (3)达到煤气的燃点温度以上。 焦炉煤气的燃点是530℃,高炉煤气的燃点是700℃,发生炉煤气的燃点是550℃,转炉煤气的燃点是520℃。燃点是煤气稳定持续燃烧的最低温度,如发生闪火时的闪点不一样,燃点比闪点温度高,煤气成分波动时燃点也有波动。 2、煤气的发热值 单位体积的煤气,完全燃烧时产生的热量叫做煤气的发热值,这是煤气作为燃料使用的最重要的性能指标,反映了煤气供热能力的大小和燃烧温度的高低。 含氢燃料燃烧时,生成的水如果以液态存在则水蒸汽放出了气化潜热,测出煤气发热值较高,叫煤气高位发热值,也叫总发热值,如果燃烧后的废气温度高,在水蒸汽冷凝温度以上,水蒸汽仍以气态存在,水蒸汽的气化潜热不能放出,则测出了煤气发热值较低,叫煤气的低位发热值,也叫真发热值。通常在工业条件下的煤气发热值都是低位发热值,用Hj表示。 煤气发热值可以用化学实验方法测定,也可以根据气体组成的成分用公式计算。 3、燃烧需要的空气量 在本章第一节已经说明气体燃烧的三个必要条件,有一条是充分供应助燃空气或氧气,单位体积(1Nm3 )煤气完全燃烧时所需要的最低空气量叫理论空气量,这时空气中的氧气完全燃烧化合,没有剩余,但在在实际燃烧时,仅用理论空气量达到完全燃烧几乎是不可能的。需要更多一点空气量,这是因为仅有理论空气量要与煤气充分接触是有困难的,必须送入过量的空气才能达到完全燃烧,这种过量的空气叫做过剩空气,适当的过剩空气随煤气热值、燃烧装置、操作条件等因素而不同。 实际使用的空气量A,与理论空气量A 0之比,称为空气过剩系数m ,关系式为:m=A/A 或 A = m A 煤气比固体燃料和液体燃料更容易与空气混合,因此过剩空气系数较小,煤气热值不同时需要的助燃空气量也有区别。 因此,煤气用户在煤气热值改变时要配合改变助燃空气量,才能完全燃烧达到最佳的燃烧效果。 4、燃烧生成的废气量 煤气燃烧生成的废气,要及时全部抽走,才能保证炉窑内的负压,保证空气和煤气的引入,使燃