
关注WHO《癌症早期诊断指南》
2017年2月3日,WHO发布《Guide to cancer early diagnosis》(《癌症早期诊断指南》)。旨在通过确保卫生服务机构重点关注癌症的早期诊断和治疗,提高癌症患者的生存机会,同时降低医疗费用。
最新数据表明,全球每年有880万人死于癌症,大多在低收入和中等收入国家。目前,全
球癌症死亡人数占总死亡人数的近六分之一。每年有1400多万新发癌症病例,预计到2030年这一数字将增加到2100多万。
寰宇医家介绍到,世卫组织指出目前一个非常严重的问题就是许多癌症病例诊断过晚,即使在具有良好的卫生系统和卫生服务设施的国家,许多癌症病例都是在晚期才得到诊断的。而有效的早期诊断可以在发病的早期阶段检出癌症,使治疗更为有效,费用更低。
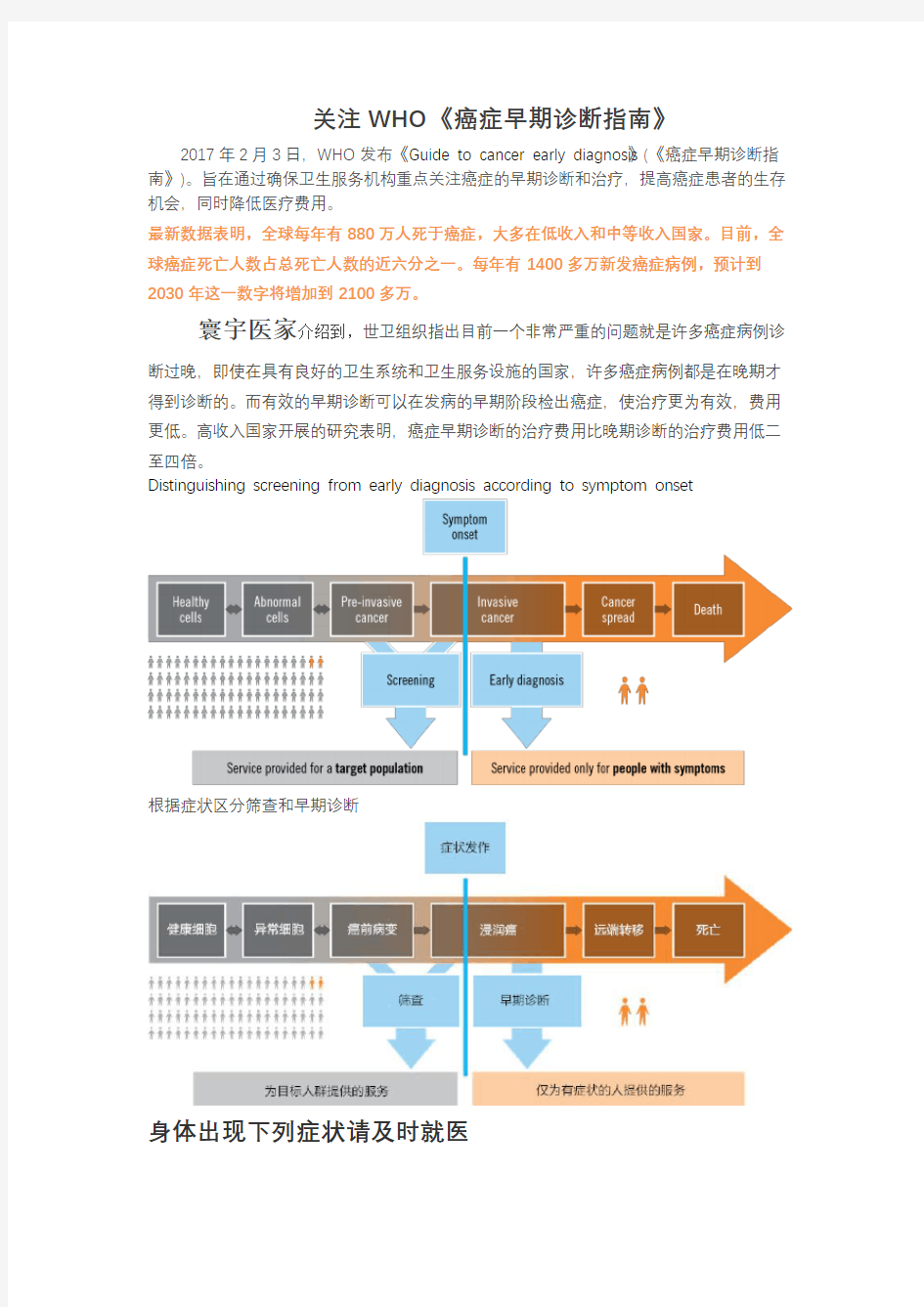
高收入国家开展的研究表明,癌症早期诊断的治疗费用比晚期诊断的治疗费用低二至四倍。Distinguishing screening from early diagnosis according to symptom onset
根据症状区分筛查和早期诊断
身体出现下列症状请及时就医
Common symptoms and signs that may be due to cancer
常见的症状和体征可能是由癌症引起的
Source: Adapted from WHO 2007 (5).
寰宇医家,致力于为中国的广大病患传递全球最新的医疗新技术黑科技,提供包括海
外重疾转诊、国内名医导诊、辅助生殖、体检抗衰等领域的一站式服务。
研究标题: 单纯调强放疗与调强放疗联合同期化疗治疗II、III期鼻咽癌的非劣效性II期 临床试验 研究申办方:中山大学附属肿瘤医院 --------------------------------------------------------------------- 研究者姓名:....................... 电话 ................... 地址:.............................................................. ................................................................... __________________________________ 患者姓名:....................... 出生日期:...... 年......月......日 __________________________________ 1.简介 您的医生已经告知您,目前您所患疾病的最主要治疗方法是放疗。您正受邀 参加一项临床研究,其目的是比较单纯调强放疗与调强放疗联合同时期化疗治疗 AJCC分期II、III期鼻咽癌患者的疗效、副反应与生活质量。 目前同时期放化疗是目前Ⅱ~Ⅳb期鼻咽癌的标准治疗方案。在这些确定同 时期化疗地位的临床研究中,放射治疗技术采用的均为二维的常规放疗技术。在 常规放疗技术条件下,同期放化疗确实可以提高局部中晚期的生存,然而同期放 化疗的生存获益主要是通过提高局部控制率实现的。10余年来,调强放射治疗 技术的物理学优势以及鼻咽癌的临床解剖和生物学特点,使得调强放射治疗在鼻 咽癌治疗中得到广泛应用,众多临床实验结果也表明调强放射治疗技术使鼻咽癌 的治疗疗效达到一个新的高度,调强放射治疗技术的应用,削弱了同期放化疗+/- 辅组化疗在局部晚期鼻咽癌中的作用。 并且同时期化疗加重了鼻咽癌患者近期和远期副反应的发生率,如血液毒 性、体重下降及耳毒性等毒副反应。在众多化疗药物中,顺铂是治疗中晚期鼻咽 癌的经典一线药物。但是,由于顺铂引起的胃肠道反应较重,例如剧烈的恶心、 呕吐等,导致部分患者不能耐受化疗;而顺铂直接损害肾实质,治疗时需要水化 和利尿;顺铂的神经毒性和放疗后的远期毒性放射性听神经损伤叠加,严重影响 了患者的生活质量。 因此,根据现有的调强放射治疗结果和同期化疗的疗效,以及常规放射
注册指南请仔细阅读本指南,如有疑问,请与我们联系。 一、什么样的临床研究需要注册? 所有在人体进行的研究,包括各种干预措施的疗效和安全性的有对照或无对照试验(如随机对照试验、病例-对照研究、队列研究及非对照研究)、预后研究、病因学研究、和包括各种诊断技术、试剂、设备的诊断性试验,均需注册并公告。 二、中、英文双语注册 在完成中文注册申请表后,必须于两周内完成英文注册申请表。如果两周内不能完成英文版,请与我们联系采用英文翻译服务。在完成中、英文注册资料的上传后15天内可获得注册号,一个月内可在世界卫生组织国际临床试验注册平台检索入口(WHO ICTRP search portal)检索到已注册试验。 未完成英文注册申请表者不算完成注册。 三、注册是否需要费用? 中国临床试验注册中心为非赢利机构,一律免费注册。 四、哪些项目需要收费? 1、只有那些需要我们指导设计的试验才收取一定的服务费用,仅仅用于维持机构运转。参考目前国际注册机构收费标准,任何类型的单个研究设计指导费用均为1500元; 2、翻译服务:500元。 五、伦理审查及其费用 中国临床试验注册中心组建的中国注册临床试验伦理审查委员会由资深各专业临床医学家、临床试验专家、医疗卫生服务用户代表、WHO患者安全保护联盟中国区代表、律师及药物公司代表组成,宗旨是保障受试者权益,审查临床试验的合理性,评估安全性,凡未经其他伦理委员会审查的临床试验均需在中国临床试验注册中心临床试验伦理委员会接受审查。临床试验伦理审查费用标准为每项2000元。 六、申请注册程序 1. 全部注册程序均为在线申报; 2. 首先在中国临床试验注册中心网站上建立申请者账户:点击ChiCTR首页右侧的“用户登陆”区的“注册”; 3. 弹出个人信息注册表,请将你的信息录入此表后点击“注册”,则您的账户就建立起来了;
骨质疏松症的分类及诊断标准 骨质疏松症主要分为原发性OP和继发性OP,原发性OP 除特发性外,分为I型和II型,I型又称为绝经后骨质疏松,为高转换型,主要原因为雌性激素缺乏;II 型又称为老年性骨质疏松,为低转换型,由于年龄的老化。 1.原发性特发性:幼年型成年型经绝期老年性绝经后骨质疏松症(I型):指主要由绝经后雌激素水平低落引起的骨质疏松症,常于绝经后5~l0年发病,属原发性骨质疏松症。其特征是全身的骨量减少及骨组织微结构改变,以至骨脆性增高,易于骨折,使妇女的残废率和死亡率增加,其治疗机理主要在于调节下丘脑-垂体-卵巢轴的功能,提高绝经后妇女体内性激素水平,抑制骨吸收,并通过对机体的全身性、多环节的调节作用而达到治疗的目的。 老年性骨质疏松症(II 型):老年人肾脏虚衰,三焦气化不利;或脾胃虚弱,气血亏虚,气虚无力行血;或脾虚湿盛;或久病入络,气血运行不畅;或寒凝筋脉等均可导致瘀血痰浊痹阻筋脉,致筋骨失养;同时,痰瘀还可导致肾虚的产生及进一步衰竭,从而诱发或加重老年性骨质疏松的产生。对于老年性骨质疏松的治疗,主要以补肾(温补肾阳,填补肾精)为主,并在补肾的基础上根据其临床表现分别采取健脾益气、补益肝肾、活血化瘀、化痰通络、温化寒湿等法。 2.继发性继发性OP是继发于长期用药的不良反应(如糖皮质激素),或继发于甲状腺机能亢进、糖尿病、肾小管性酸中毒、多发性骨髓瘤等疾病。
.内分泌性皮质醇增多症甲状腺功能亢进症原发性甲状旁腺功能亢进症肢端肥大症性腺功能低下糖尿病等.妊娠哺乳 .营养性蛋白质缺乏维生素CD缺乏低钙饮食酒精中毒等 .遗传性成骨不全染色体异常 .肝脏病 .肾脏病慢性肾炎血液透析 .药物皮质类固醇抗癫痛药抗肿瘤药(如甲氨蝶呤)肝素等 .废用性全身性骨质疏松见于长期卧床截瘫太空飞行等;局部性的见于骨折后Sudecks肌萎汐伤后肌萎缩)等.胃肠性吸收不良胃切除 .类风湿性关节炎 .肿瘤多发性骨髓瘤转移癌单核细胞性白血病 Mast-Cell病等 .其他原因吸烟骨质减少短暂性或迁徙性骨质疏松 骨的生长期:受精至20~25岁 平衡期:20~25稳定期,35~40岁骨吸收与骨生成平衡 骨衰老下降期:35岁以后开始衰老,骨量下降。妇女绝经后(50岁以后),10年内,每年以1.5~2%丢失。 骨质疏松难以控制的因素: ①绝经;②性别;③年龄;④种族;⑤体型瘦小(57kg 以下,危险性更大);⑥种族史。 骨质疏松可以改变的危险因素: ①日照不足;②长期低钙饮食;③不良的生活习性;④运动量少;⑤药物;⑥疾病。 骨质疏松的危险因素大小: 激素>糖尿病>外来激素>抗癫痫药>泻药>低钙饮食
临床试验手册(4)——临床试验和注册基本知识 1. 药物的研发过程 2. 何谓GCP GCP是Good Clinical Practice的缩写,即《药物临床试验质量管理规范》。我国共颁布了三次GCP。我国现行的GCP是2003年开始执行的新GCP,上一版的是1999颁布的《药品临床试验管理规范》,第一版是98年由卫生部颁布的《药品临床试验管理规范》。此外,ICH-GCP在我国作为注册的参考标准。关于新和旧的GCP的区别,请参考“资料下载”中的相关内容。 3. 何谓SOP 即标准操作规程(Standard Operating Procedure, SOP),为有效地实施和完成某一临床试验中每项工作所拟定的标准和详细的书面规程。 4. 临床试验和临床研究 在ICH-GCP中,临床试验(clinical trial)和临床研究(clinical study)是同一个概念。在我国的GCP中,上述两个不是同一个概念。根据《药品注册管理办法》第24条,临床研究包括临床试验和生物等效性试验,而临床研究必须遵循GCP的规定。在2004年一次SFDA举办的高级监查员培训班的内容,也说明在国内两个概念不一样。因此,本网中文名采用“临床研究”。 5. CRA应具备的知识和能力 CRA即clinical research associate 的缩写,是一个职位的名称。在我国很多人就叫监查员(非检查员)。根据GCP中监查员的职责,以及科人团队数年的临床研究经验,CRA应该具备下列能力: ●具有耐心和细心的个性 ●具备相关的法规知识和医学知识(尽管在国外,CRA没有是医学背景的,但国内的情况不 一样,需要CRA有一定的专业背景)
一项评价西达本胺联合联合泼尼松、环磷酰胺、依托泊苷及甲氨蝶呤治疗复发或难治性外周T细胞淋巴瘤的多中心、单臂、开放性II期临床试验 知情同意书 受试者姓名: 受试者姓名缩写: 受试者编号: 联系电话: 联系地址:
受试者须知 尊敬的患者:您好! 首先感谢您有意参加本项临床试验。在您同意参加本项临床试验之前,请您仔细阅读这份知情同意书,如果您愿意也可以和您的亲人或朋友商量,或向您的医生或研究人员提出任何您需要了解的问题,直至得到满意的答复。 参加本临床试验是自愿的,如果您同意参加,请您签署此知情同意书,并且保存该份经您和研究者双方签字的知情同意书副本。本临床试验遵循《药物临床试验质量管理规范》和《赫尔辛基宣言》,并获得国家食品药品监督管理局和医院伦理委员会的批准,这将会保证您的权益在本试验中不受侵犯。 签署知情同意书不会改变您的合法权益,仅表示您已经理解了这些信息并愿意参加本试验。 【试验目的和背景】 针对外周T细胞淋巴瘤(PTCL)目前尚无标准的治疗方案,一线治疗包括CHOP 方案(环磷酰胺、阿霉素、长春新碱和强的松四药联合)或CHOP类似方案,虽然可获得较高缓解率,但维持时间短,患者生存获益差。对于难治患者或缓解后再复发的患者,特别是对于因各种原因不能进行自体干细胞移植患者,二线治疗难度更大,因此治疗指南首选临床试验。 西达本胺(Chidamide,爱谱沙)是我国自主研发的亚型选择性组蛋白去乙酰化酶(HDAC)抑制剂,为 1.1类新药。在全国多家中心完成的西达本胺片治疗复发或难治性外周T细胞淋巴瘤的II期临床试验结果显示,西达本胺单药有效率为29.1%,常见不良事件为血液学毒性、胃肠道反应、食欲不振等,超过半数患者发生的不良事件为1-2级。这些结果显示,西达本胺安全性较好,主要不良反应为可控的血液毒性,并显示了较好的综合获益,口服给药方便。2014年12月23日国家食品药品监督管理总局(CFDA)批准西达本胺单药治疗复发或难治性PTCL。 本项临床试验的主要目的是在前期相同适应症的单药临床试验基础上,对西达本胺联合泼尼松、环磷酰胺、依托泊苷及甲氨蝶呤治疗复发或难治性PTCL的疗效和安全性进行评价,为西达本胺联合用药的临床应用进一步提供依据。 【试验设计和步骤】 试验将选择合适的患者参加,计划共计入选36例受试者。在入组筛选期间,为了确定您是否适合参加本项临床试验,您的医生将询问并记录您的病史、全身健康状况以及进行相关的检查。您将被要求抽血(约5~8毫升)以及留取尿标本进行血常规、血生化、电解质和尿常规等检查,同时进行皮肤病灶拍照评估、放射学和其他必要的检查,以便了解您的疾病情况是否符合参加本项临床试验的入选标准。 本研究包括联合治疗期和维持治疗期。在联合治疗期,您将接受西达本胺联合泼尼松、环磷酰胺、依托泊苷及甲氨蝶呤的治疗:西达本胺片每次30mg,每周服用2次
颅内血管磁共振管壁成像注册登记研究方案 一、研究背景 1. 研究目的与意义 颅内动脉狭窄是缺血性卒中的重要原因。由于缺乏可靠影像学手段及病理学证据,颅内动脉粥样硬化斑块(ICAD)易损性特征一直是研究难点。基于前期高分辨磁共振(HR-MRI)管壁成像研究工作,我们提出:症状性ICAD斑块强化是斑块易损性的重要标志,其强化程度与卒中复发密切相关。我们拟通过建立的颅内动脉狭窄研究队列,采用HR-MRI技术前瞻性比较症状性与无症状ICAD斑块组成、形态结构、强化程度等定量指标,探索①HR-MRI技术在脑卒中病因学诊断,治疗方案决策方面的价值;②建立包含斑块强化特性的ICAD易损斑块评价标准,明确及其在药物治疗效果评估中的价值,为ICAD的个体化治疗提供重要的客观依据。 2. 国内外研究现状 颅内动脉粥样硬化性狭窄是引起脑梗死的重要原因颅内动脉粥样硬化性狭窄发生率存在种族差异[1]。亚洲黄种人及非洲、美洲黑人的颅内动脉狭窄的发生率较美洲白人高。基于我国的两项研究发现年龄超过60岁的正常人群中颅内动脉狭窄发生率为5.9%~6.9%[2, 3]。我国卒中患者中颅内动脉狭窄约占33%~50%,TIA患者中颅内动脉狭窄所占比例更高(>50%)。 症状性ICAD年卒中复发率较无症状ICAD年发生率显著增高。脑梗死后患者存在再卒中风险,而伴有颅内动脉狭窄患者的卒中复发率明显增加。我国国家卒中注册调查的数据显示伴有颅内动脉狭窄1年内卒中复发率随动脉狭窄程度而增加,其1年复发率从3.34%增至7.40%[4]。在WASID研究中症状性ICAD者应用阿司匹林组1年内卒中复发率为19%,而狭窄率≥70%的患者年卒中复发率高达23%;无症状颅内动脉粥样硬化性狭窄发生率为18.9%-27.3%,而其相关卒中年发生率平均3.5%。因此,ICAD导致卒中发生的风险存在显著差异,进一步的危险分层研究对于临床干预决策具有重要指导意义。颅内动脉粥样硬化引起卒中的机制复杂,包括:血栓形成、动脉-动脉栓塞、低灌注、穿支动脉闭塞等。其中血栓形成、动脉-动脉栓塞在卒中事件的发生中占有重要地位。而二者多由于局部斑块
C l i n i c a l T r i a l s g o v 网站临床试验注册辅 导
https://www.doczj.com/doc/2614806605.html,网站临床试验注册辅导 缩略语 ICMJE=International Committee of Medical Journal Editors; IRB=institutional review board; NIH=National Institutes of Health; PRS=Protocol Registration System 供稿:沈阳帕博医学信息咨询有限公司 临床试验注册一直是医学文献、通俗媒体以及美国议会所关注的焦点问题。临床试验的注册库都属于网络数据库,收录临床试验的资料,兼有伦理和学术双重作用。这些注册库确保公众对目前正在开展或既往已开展项目的了解,从而发挥伦理作用;同时还可为研究人员、期刊编辑人员和审稿专家提供一些解读研究结果所需的背景资料;通过完整罗列各项临床试验的目录清单,还可提示研究人员对当前尚未发表成果的课题加以注意。各类试验注册库因主办机构、侧重面 (综合库还是疾病专库) 以及所收录试验信息内容等多种标准不同而彼此有别。国际医学期刊编辑委员会 (ICMJE) 等多个团体均主张注册库应实行非盈利机构管理、对注册户和用户免费开放等原则。试验注册库有别于研究成果库:前者收录的通常是研究方案和研究对象招募情况,而后者则收录研究结果。仅供学习与交流,如有侵权请联系网站删除谢谢2
目前,国际上能符合ICMJE原则的最大临床试验注册库就是美国的https://www.doczj.com/doc/2614806605.html,网站(即北美临床注册中心),包含了约35 000项试验;还有英国的国际标准随机对照试验项目编号登记库,约有试验5050项。本文着重谈谈在https://www.doczj.com/doc/2614806605.html,网站进行试验注册的要点,但由于其中的大部分原则也适用于其他注册库的注册过程,文章内容因而显得简明实用。 背景 https://www.doczj.com/doc/2614806605.html,网站是由美国卫生研究所 (NIH) 下属国家医学图书馆运作的一个注册库,收录了全球由国家拨款或私募经费资助的各项试验目录。创建该库的初衷是为了帮助那些患有致命性疾病患者找到意愿参与的合适试验项目。自此以后,该库的用途越来越多,用户类型也多种多样 (见表1)。美国https://www.doczj.com/doc/2614806605.html,网站的试验注册对国内外注册户均不收费。只要能上网,任何人都可以免费使用该注册库。 仅供学习与交流,如有侵权请联系网站删除谢谢3
中药化药注册分类及临床试验的病例数要求 中药、天然、植物药物 一、注册分类 1、未在国内上市销售的从植物、动物、矿物等物质中提取的有效成分及其 制剂。 2、新发现的药材及其制剂。 3、新的中药材代用品。 4、药材新的药用部位及其制剂。 5、未在国内上市销售的从植物、动物、矿物等物质中提取的有效部位及其 制剂。 6、未在国内上市销售的中药、天然药物复方制剂。 7、改变国内已上市销售中药、天然药物给药途径的制剂。 8、改变国内已上市销售中药、天然药物剂型的制剂。 9、已有国家标准的中药、天然药物。 二、注册说明 注册分类1~8的品种为新药,注册分类9的品种为已有国家标准的药品。 1、“未在国内上市销售的从植物、动物、矿物等物质中提取的有效成分及 其制剂”是指国家药品标准中未收载的从植物、动物、矿物等物质中提 取得到的天然的单一成份及其制剂,其单一成份的含量应当占总提取物 的90%以上。 2、“新发现的药材及其制剂”是指未被国家药品标准或省、自治区、直辖 市地方药材规范(统称“法定标准”)收载的药材及其制剂。 3、“新的中药材代用品”是指替代国家药品标准中药成方制剂处方中的毒 性药材或处于濒危状态药材的未被法定标准收载的药用物质。 4、“药材新的药用部位及其制剂”是指具有法定标准药材的原动、植物新 的药用部位及其制剂。 5、“未在国内上市销售的从植物、动物、矿物等物质中提取的有效部位及 其制剂”是指国家药品标准中未收载的从植物、动物、矿物等物质中提
取的一类或数类成份组成的有效部位及其制剂,其有效部位含量应占提 取物的50%以上。 6、“未在国内上市销售的中药、天然药物复方制剂”包括: 6.1 传统中药复方制剂; 6.2 现代中药复方制剂; 6.3 天然药物复方制剂; 6.4 中药、天然药物和化学药品组成的复方制剂。 传统中药复方制剂应在传统医药理论指导下组方,以传统工艺制成,处方中药材必须具有法定标准。 现代中药复方制剂应在传统医药理论指导下组方,可以采用非传统工艺制成。 天然药物复方制剂应在现代医药理论指导下组方,其适应症用现代医学术语表述。 中药、天然药物和化学药品组成的复方制剂包括中药和化学药品,天然药物和化学药品,以及中药、天然药物和化学药品三者组成 的复方制剂。 7、“改变国内已上市销售中药、天然药物给药途径的制剂”包括:不同给 药途径之间相互改变的制剂及局部给药改为全身给药的制剂。 8、“改变国内已上市销售中药、天然药物剂型的制剂”是指在给药途径不 变的情况下改变剂型的制剂。 9、“已有国家标准的中药、天然药物”是指我国已批准上市销售的中药或 天然药物的注册申请。 三、关于临床试验 1、临床试验的病例数应当符合统计学要求和最低病例数要求。 2、临床试验的最低病例数(试验组)要求为Ⅰ期为20~30例,Ⅱ期为100 例,Ⅲ期为300例,Ⅳ期为2000例。 3、属注册分类1、2、 4、5和6.2、6.3、6.4的新药,应当进行Ⅳ期临床 试验。 4、生物利用度试验一般为18~24例。
中国临床试验注册和发表机制及实施说明 Statement for Chinese Clinical Trial Registration and Publishing System 吴泰相1,李幼平1,李静1,钟紫红2,贾万年3,代表中国临床试验注册和发表协作网 Taixiang Wu, Youping Li, Jing Li, Zihong Zhong, Wanlian Jia, on behalf of Chinese Clinical Trial Registration and Publishing Collaboration 执笔人单位: 1.卫生部中国循证医学中心、Chinese Cochrane Centre、循证医学教育部网上合作研究中心、中国临床试验注册中心,四 川大学华西医院 Chinese Evidence-Based Medicine Center Ministry of Health of the People’s Republic of China, Chinese Cochrane Centre, Ministry of Education Virtual Research Center of Evidence-Based Medicine, Chinese Clinical Trial Register, West China Hospital, Sichuan University 2.中国医学科学院协和医科大学 Peking Union Medical College, Chinese Academy of Medical Sciences 3.《解放军医学杂志》编辑部 Editorial Board of Medical Journal of Chinese People’s Liberation Army 2006年4月16~17日在成都召开第四届亚太地区循证医学研讨会期间,中国48家医(药)学期刊和中国临床试验注册中心(Chinese Clinical Trial Register, ChiCTR)、卫生部中国循证医学中心、循证医学教育部网上合作研究中心和Chinese Cochrane Centre的代表经过充分讨论达成共识,决定共同发起创建中国临床试验注册和发表机制,并成立“中国临床试验注册和发表协作网(Chinese Clinical Trial Registration and Publishing Collaboration, ChiCTRPC)”。这种临床医学研究管理新模式的创建和应用,将对提高中国临床试验信息透明度和质量、提高医学研究公信度发挥极其重要的作用。本文介绍其结构特点和运作方式。 1.中国临床试验注册和发表机制的结构特点 中国临床试验注册和发表机制是医(药)学期刊、ChiCTR、技术支撑和教育体系三部分联合协调运行的机制。 1.1 医(药)学期刊是医(药)学科技事业的重要组成部分,是传播和交流医(药)学科技信息的主要载体,反映一个国家医(药)学研究和卫生事业发展水平,承载着为各类医疗卫生决策提供证据的重任,有着其他途径不可替代的重要导向作用[1]。 医(药)学期刊是医(药)学研究结果的主要出口,发表的文献数量占医(药)学文献总量的70%[1]。要实行临床试验注册制度,必须有医(药)学期刊严把出口关,只有完全做到不发表未注册的临床试验,才能保证临床试验注册制度的完全实施。 针对中国医(药)学期刊数量多,医(药)学从业人员数量大,对临床研究知识的掌握和理解程度不一,文章数量巨大质量偏低的特点,ChiCTRPC的成员期刊经讨论决定,从2007年1月1日起优先发表已注册的临床试验,根据各期刊情况,逐步过渡到只发表已注册试验报告。 全国各医(药)学期刊是中国临床试验注册和发表机制中极为重要的环节,是整个机制成功运转的保障。我们希望全国医(药)学期刊积极参与到这件关系到医(药)学研究社会公信度的大事中来,团结一致,共同推动中国临床研究水平的提高。
中国人原发性骨质疏松症诊断标准(试行) 中国老年学学会骨质疏松委员会 骨质疏松诊断标准学科组 组长:刘忠厚 副组长:杨定焯 成员:朱汉民 王洪复 张柳 秘书:张柳(兼) 唐海 赵燕玲 主件 一、诊断原则 诊断骨质疏松以骨密度减少为基本依据,在鉴别继发性骨质疏松的同时,诊断原发性骨质疏松,可参考病史、生化和骨折进行综合考虑。 二、基本手段 11判断骨密度减少尽可能以骨矿含量和脊椎X 线片相结合,本标准目前主要以DXA (双能X 线吸收法)为手段制定,不排除多种方法的应用。 21尚无骨密度仪的单位,可以用X 线片初步诊断骨质疏松,一般常用脊椎,也可以用股骨颈、跟骨、管状骨X 线片。 三、用骨矿含量诊断及分级标准(主要用于女性成人、男性参照执行) 11经本次会议讨论,参考世界卫生组织(W HO )的标准,结合我国国情,以种族、性别、地区的峰值骨量(均值为M )为依据: >M -1SD 正常 M -1SD ~2SD 骨量减少 M -2SD 骨质疏松症(根据诊治的要求分为轻、中二级)M -2SD 伴有一处或多处骨折,为严重骨质疏松症21参考日本1996年改动版的标准,自己尚未作峰值骨密度调查,亦或自己作了一些调查,但SD 不便应用时,可用骨量丢失百分率(%)诊断法。 >M -12% 正常 M -13%~24%骨量减少 M -25% 骨质疏松症(根据诊治的要求分为轻、中二级)M -25%伴有一处或多处骨折,为严重骨质疏松症 四、X 片诊断要求 11照片质量:除跟骨仅照侧位片外,其他部位骨结构应照正位片。照片的清晰度、对比度、细致度较高,软组织、骨组织层次结构清楚。 21脊椎骨密度估计,建议用下列方法:I 度 纵向骨小梁明显;II 度 纵向骨小梁变稀疏;III 度1 中国骨质疏松杂志 1999年2月第5卷第1期
临床研究方案 放疗同步替吉奥胶囊治疗鼻咽癌 临床研究 研究者放射肿瘤科 医院海军总医院 申办者:海军总医院放射肿瘤科
一:前言 鼻咽癌是我国常见恶性肿瘤之一,在头颈部恶性肿瘤中占首位。发病率有明显的地区分布。据估计,世界上80%的鼻咽癌病例发生在我国。治疗首选放射治疗,放疗后年生存率约为34-53%。 到目前为止,其标准的治疗方案仍为以铂类药物为基础的联合化疗。由于铂类显著的肾毒性、消化道反应、血液学毒性,以及对生活质量的影响,在临床使用上受到限制。 替吉奥为抗代谢药物,有替加氟、吉美嘧啶、奥替拉西钾按1:0.4:1摩尔比组成。吉美嘧啶和奥替拉西钾通过对酶的抑制作用,使替加氟在体内生成5-氟尿嘧啶(5-FU)的有效浓度持续更长的时间,同时减少5-FU胃肠道副反应。适用于头颈部肿瘤及晚期胃癌、胰腺癌、结直肠癌、非小细胞肺癌等患者。临床荟萃分析显示,在晚期胃癌、胰腺癌、结直肠癌、非小细胞肺癌中使用替吉奥可以在提高疗效的同时,还能降低患者的不良反应的发生率。替吉奥联合同步放疗既能使肿瘤细胞的增殖周期发生改变,增加放疗的敏感性,同时不增加患者严重的不良反应发生率。 现进行放疗联合替吉奥胶囊治疗鼻咽癌的临床研究,以探讨该方案的疗效和不良反应。 二:研究目的 ◆主要研究终点:疗效(无进展生存期PFS,总生存期OS) ◆次要研究终点:不良反应(早期,晚期) 三:研究设计 本研究采用单中心、随机、平行对照试验设计,拟纳入病人50例。研究采用随机分组方法:组别1(25例)为替吉奥胶囊同步放化疗,组别2(25例)为氟尿嘧啶+顺铂(PF方案)同步放化疗,在放疗结束后维持化疗3周期治疗结束时评价疗效。任何时间发现病情进展均可停止治疗。
中国临床试验注册中心/中国医学研究信息管理中心 关于推广使用基于互联网的临床研究公共管理平台暨提供数据和安全监测服务的公告 Notification for opening the web-based medical research public management platform ResMan 为了促进临床研究的规范化管理,提高临床试验的质量和公信度,我们于 2010年 3月 1 日起正式开放基于互联网的临床研究公共管理平台(Research Manager, ResMan),供广大临床研究人员、医院科研管理部门、药物研发单位和 CRO 使用。现在,国际医学期刊编辑委员会已开始要求研究者在临床试验投稿时提供其原始数据(individual participants data, IPD)在公共数据库的信息,供编辑、审稿专家和公众共享【1】;共享临床试验原始数据(IPD)已经成为临床试验透明化的重要组成部分。 一、什么是临床试验公共管理平台?临床研究公共管理平台(Research Manager, ResMan)是指将临床试验的管理流程、试验过程中记录的受试者基线资料包括人口学资料、入组时检查的基线数据、试验过程中的实施情况、结果数据等相关资料即“病历记录表(case record form, CRF)”的所有内容,基于互联网在线记录并传送到中央数据库保存管理。每项试验只允许该课题组研究人员进入并实施操作;对基金资助课题,项目管理者、试验申办者或投资者有权浏览实时资料但不能对之做任何更改。由研究者决定是否公开研究结果数据。数据一旦录入并保存,以后对数据所做的任何改动都会自动显示和追踪。研究者决定可公开的资料后,公众可通过“公众浏览”看到,以了解试验的进展情况和试验数据,但不允许看到或不能通过公开资料追索到受试者的任何个人信息。 二、为什么要使用临床研究公共管理平台? 1. 临床试验是研究者和参与者为解决医学领域的科学问题一起共同承担风险,为全社会获得相关医学知识所做出的奉献,因此,让全社会了解研究的细节是对奉献者最大的尊重; 2. 所有临床试验所获得的结果都可能应用于大众,涉及每一位公众的健康,因此,公众有权知道临床试验的所有细节和结果。无论试验结果如何,都应该让公众了解临床试验的细节,这是医学研究伦理的需要; 3. 项目管理机构、试验申办者或投资人可根据需要随时了解临床试验的执行情况和进度; 4. 让公众了解临床试验执行细节和过程可保证临床试验资料的真实性,增加临床试验的公信度; 5. 国际医学期刊编辑委员会要求投稿时需提交在公众可及(public accessible database)的公共数据库查询到原始数据,供医学期刊编辑和审稿专家审核稿件时核查; 6. 便于试验研究者保存和管理试验资料; 7. 可免除使用纸张记录,减少集中录入数据的错误可能性和工作量,提高记录可靠性,利于提高临床试验质量;
为100例,III期为300例,IV期为2000例。注册分类1、2避孕药:II期临床试验应当完成至少100对6个月经周期的随机对照试验;III期临床试验完成至少1000例12个月经周期的开放试验;IV期临床试验应当充分考虑该类药品的可变因素,完成足够样本量的研究工作。 注册分类3、4:应当进行人体药代动力学研究和至少100对随机对照临床试验。多个适应症的,每个主要适应症的病例数不少于60对。注册分类3、4避孕药:应当进行人体药代动力学研究和至少500例12个月经周期的开放试验,局部用药且仅发挥局部治疗作用的制剂及不吸收的口服制剂可以免予进行人体药代动力学研究。 注册分类5:口服固体制剂进行生物等效性试验,一般为18至24例。难以进行生物等效性试验的口服固体制剂及其他非口服固体制剂,应当进行临床试验,临床试验的病例数至少为100对。缓释、控释制剂应当进行单次和多次给药的人体药代动力学的对比研究和必要的治疗学相关的临床试验,临床试验的病例数至少为100对。注射剂应当进行必要的临床试验。需要进行临床试验的,单一活性成份注射剂,临床试验的病例数至少为100对;多组份注射剂,临床试验的病例数至少为300例(试验药);脂质体、微球、微乳等注射剂,应根据注册分类1和2的要求进行临床试验。 注册分类6:口服固体制剂,应当进行生物等效性试验,一般为18至24例。需要用工艺和标准控制药品质量的,应当进行临床试验,临床试验的病例数至少为100对。验证性试验:对已获得的初步治疗作用进行确证。Ⅲ期临床是对Ⅱ期临床探索出的初步治疗作用进行验证。注册分类3等药物的临床试验是对有上市基础的药物治疗作用的验证。探索性试验中会设有不同的剂量组,有时还会设有不同的适应症组。验证性试验的适应症、剂量、疗程基本都是确定的。创新性药物Ⅲ期临床的适应症和剂量选择应该以Ⅱ期临床探索后确定的适应症和剂量为依据。注册分类3药物的临床试
中国骨质疏松杂志2014年9月第20卷第9期Chin J Osteoporos,September 2014,Vol 20,No.9 Published online www. wanfangdate. com. cn doi: 10. 3969 / j. issn. 1006-7108. 2014. 09. 001 1007 编者按 中国老年学学会骨质疏松委员会各学科组专家委员会成立两年了,各学科专家委员会组织本领域专家开展 了学科指南或专家共识的编写工作。经过专家们多次认真讨论,反复修改,在2014年4月杭州国际会议上 各学科组报告了指南或专家共识,与会代表反响很好,并提出了进一步的修改建议,大部分专家委员会按期完 成了专家共识的编写工作。这些学科组的指南或共识参考了国外最新研究进展,贴近我国骨质疏松诊疗研的实 际,旨在为各级医疗或研究机构开展骨质疏松临床和研究提供参考或指导。本刊将在近期陆续刊登各学科组专 家委员会编写的指南或共识。本次刊登的指南或专家共识,以学科组署名的,表明该学科组专家委员会已建 立。有的学科组专家委员会尚未建立起来,将用学科组牵头单位的名义发表专家共识,2015 版指南或专家共识将全部以学科组专家委员会名义发表。这些专家共识将于2015年4月17日北京春季国际会议前夕在北京五环大酒店向与会代表再次报告,各单位如要建立研究手段,欢迎参会学习,请留意学会发出的后续通知。 中国人骨质疏松症诊断标准专家共识( 第三稿·2014版) 中国老年学学会骨质疏松委员会骨质疏松症诊断标准学科 组组长张智海刘忠厚李娜 其他审阅专家:张萌萌黄琪仁马远征王亮刘勇刘新宇朱钧蓝旭李士春杨鸿兵喻恒峰汤光宇张 伟姚伟武李绍林彭俊红周晟周劲松 中国医科大学航空总医院( 张智海) ; 中国老年学学会骨质疏松委员会( 刘忠厚) ; 北京积水潭医院( 李娜) ; 吉林大学第四医 院 ( 张萌萌) ; 上海市第六医院( 黄琪仁姚伟武) ; 解放军总参谋部总医院( 309医院) ( 马远征王亮) ; 青岛大学医学院 附属医院 ( 刘勇) ; 山东大学齐鲁医院( 刘新宇) ; 湖南省怀化第一人民医院( 朱钧) ; 兰州军区总医院( 蓝旭) ; 北京石景山 医院( 李士春) ; 北京密云中医院( 杨鸿兵) ; 江西省人民医院( 喻恒峰) ; 上海市第十人民医院( 汤光宇) ; 河北省三院( 张 伟) ; 南方医科大学第三附属医院( 李绍林) ; 武汉市普爱医院( 彭俊红) ; 甘肃省中医院( 周晟) ; 成都军区总医院( 周劲松) 中图分类号: R68文献标识码: A文章编号: 1006-7108( 2014) 09-1007-04 摘要: 中国老年学学会骨质疏松委员会组织专家在2000年第二稿的基础上,复习了近年来国际国内在骨质疏松症诊断方 面的研究进展,结合中国人群特点和中国骨质疏松症防治实际情况,制定本共识为各级医疗机构开展骨质疏松症诊疗工作 提供参考。骨密度测量在骨质疏松症诊断中有重要作用,可以参照WHO- 2. 5 SD的标准,也可以根据中国人群的实 际情况采用中国老年学学会骨质疏松委员会( OCCGS) 建议的- 2. 0SD或者骨量下降25%作为诊断标准。并提出了 在使用DXA骨密度诊断时需要注意DXA的局限性,避免漏诊。根据近年来定量CT研究的成果,首次在共识中建议 采用国际临床骨密度学会 ( ISCD) 和美国放射学院( ACR) 推荐的腰椎QCT骨密度低于80 mg / cm3作为骨质疏松 的诊断标准。首次建议在骨质疏松诊断中的FRAX应用。脆性骨折作为骨质疏松症诊断标准的重要性,并推荐综合影像 检查诊断脆性骨折和鉴别诊断。强调了骨生化检查的作用。 关键词: 骨质疏松症; 骨密度测量; 诊断标准; 影像学检查 Expe rt conse nsus on the diagnosis of oste oporosis in Chine se Population ZHANG Zhihai,LIU Zhonghou,LI Na The Osteoporosis Committee of China Gerontological Society Corresponding author: LIU Zhonghou,Email: occgs@ 126. com Abstract:Based on the year 2000 the 2nd version of the diagnosis of osteoporosis,the Osteoporosis Committee of China Gerontological Society ( OCCGS) has organized experts to learn the research advance in recent years all over the w orld,to consider the characteristics of Chinese population and the medical practice in the prevention and treatment of osteoporosis in China,and to make the follow ing consensus of the diagnosis of osteoporosis for guidelines of osteoporosis management in all levels of medical *通讯作者: 刘忠厚,Email: occgs@ 126.com
临床试验和注册基本知识 1.药物的研发过程 化学和药学研究 动物研究 临床研究I、II、III期 临床研究批件 生产许可证/新药证书 药品上市 2.何谓GCP GCP是Good Clinical Practice的缩写,即《药物临床试验质量管理规范》。我国共颁布了三次GCP。我国现行的GCP是2003年开始执行的新GCP,上一版的是1999颁布的《药品临床试验管理规范》,第一版是98年由卫生部颁布的《药品临床试验管理规范》。此外,ICH-GCP在我国作为注册的参考标准。关于新和旧的GCP的区别,请参考“资料下载”中的相关内容。 3.何谓SOP 即标准操作规程(Standard Operating Procedure, SOP),为有效地实施和完成某一临床试验中每项工作所拟定的标准和详细的书面规程。 4.临床试验和临床研究 在ICH-GCP中,临床试验(clinical trial)和临床研究(clinical study)是同一个概念。在我国的GCP中,上述两个不是同一个概念。根据《药品注册管理办法》第24条,临床研究包括临床试验和生物等效性试验,而临床研究必须遵循GCP的规定。在2004年一次SFDA举办的高级监查员培训班的内容,也说明在国内两个概念不一样。因此,本网中文名采用“临床研究”。 5.CRA应具备的知识和能力 CRA即clinical research associate 的缩写,是一个职位的名称。在我国很多人就叫监查员(非检查员)。根据GCP中监查员的职责,以及科人团队数年的临床研究经验,CRA应该具备下列能力: ●具有耐心和细心的个性 ●具备相关的法规知识和医学知识(尽管在国外,CRA没有是医学背景的, 但国内的情况不一样,需要CRA有一定的专业背景) ●较强的沟通能力
骨质疏松症诊疗规范 1.概述 骨质疏松症(Osteoporosis, OP)是一种以骨量低下、骨微结构破坏、导致骨脆性增加、易发生骨折为特征的全身性骨病(WHO)。2001年美国国立卫生研究院(NIH)提出骨质疏松症是以骨强度下降、骨折风险性增加为特征的骨骼系统疾病,骨强度反映了骨骼的两个主要方面,即骨矿密度和骨质量。 该病可发生于不同性别和任何年龄,但多见于绝经后妇女和老年男性。骨质疏松症分为原发性和继发性两大类。原发性骨质疏松症又分为绝经后骨质疏松症(I型)、老年性骨质疏松症(II型)和特发性骨质疏松(包括青少年型)3种。绝经后骨质疏松症一般发生在妇女绝经后5-10年内;老年性骨质疏松症一般指老人70岁后发生的骨质疏松;继发性骨质疏松症指由任何影响骨代谢的疾病或药物所致的骨质疏松症;而特发性骨质疏松主要发生在青少年,病因尚不明。 2.病因病理 骨质疏松症分为原发性和继发性两大类。原发性骨质疏松症又分为绝经后骨质疏松症(I型)、老年性骨质疏松症(II型)和特发性骨质疏松(包括青少年型)3种。绝经后骨质疏松症一般发生在妇女绝经后5-10年内;老年性骨质疏松症一般指老人70岁后发生的骨质疏松;继发性骨质疏松症指由任何影响骨代谢的疾病或药物所致的骨质疏松症;而特发性骨质疏松主要发生在青少年,病因尚不明。 3.康复住院标准 因骨质疏松症所引起的疼痛、运动功能下降,乃至发生骨折,影响患者的日常生活。 4.临床症状 疼痛、脊柱变形和发生脆性骨折是骨质疏松症最典型的临床表现。但许多骨质疏松患者早期常无明显的症状,往往在骨折发生后经X线或骨密度检查时才发现有骨质疏松。 4.1疼痛:患者可有腰背疼痛或周身骨骼疼痛,负荷增加时疼痛加重或活动受限,严重时翻身、起坐及行走有困难。 4.2脊柱变形:骨质疏松严重者可有身高缩短和驼背,脊柱畸形和伸展受限。胸椎压缩性骨折会导致胸廓畸形,影响心肺功能。腰椎骨折可能会改变腹部解剖结构,引起便秘、腹痛、腹胀、食欲减低和过早饱胀感等。 4.3骨折:脆性骨折是指低能量或非暴力骨折,如日常活动而发生的骨折为脆性骨折。常见部位为胸、腰椎,髋部、桡尺骨远端和肱骨近端。其他部位也可发生骨折。发生过一次脆性骨折后,再次发生骨折的风险明显增加。 5.专科体征 骨质疏松症患者最常见的体征是脊柱弯曲变形,这些患者由于经常腰背疼痛,负重能力降低,双下肢乏力,因此身体多处于前倾状态,以减轻脊柱的负重。骨质疏松症患者还常常有椎体的压痛,多见于胸段、腰段椎体、钥关节外侧及胸廓,压痛部位常伴有叩击痛。如果骨质疏松症性骨折愈合欠佳,骨折两端骨折对位、对线不良,有可能发生肢体弯曲畸形。骨痛、骨骼畸形、体位异常及肢体乏力还可以导致思者体态及步态异常,活动协调性差等。 6.影像学 骨影像学检查和骨密度。 ①摄取病变部位的X线片 X线可以发现骨折以及其他病变,如骨关节炎、椎间盘疾病以及脊椎前移。骨质减少(低骨密度)摄片时可见骨透亮度增加,骨小梁减少及其间隙增宽,横行骨小梁消失,骨结构模糊,但通常需在骨量下降30%以上才能观察到。大体上可见椎
广州市社区2型糖尿病人群血清标志物与骨折风险早期 预测的前瞻性队列研究 临床研究负责单位:南方医科大学珠江医院 主要研究者:杨力、张桦、程彦臻、许雯、李婉媚、欧春泉 参加单位及负责人:南方医科大学珠江医院杨力 统计分析单位:南方医科大学生物统计学系 CRO公司:无 方案版本号:1.0 方案定稿日期:2017年4月25日
研究方案摘要
目录 1研究背景与目的 (6) 1.1研究背景 (6) 1.2研究目的 (8) 1.3研究假设 (9) 2试验设计 (9) 3研究对象(队列人群选择) (9) 3.1诊断标准 (9) 3.2入选标准 (10) 3.3排除标准 (10) 4观察指标(变量定义及观测的时间与节点) (11) 4.1一般临床特征指标(含人口学指标) (11) 4.2主要暴露因素/影响预后因素(包括对照选择) (11) 4.3研究终点 (11) 4.4潜在混杂变量 (12) 5样本量估计 (12) 6数据采集与数据管理 (14) 6.1数据来源 (14) 6.2数据采集 (14) 6.3数据库 (15) 6.4数据管理计划与质量控制 (15) 7统计分析 (15) 8伦理考虑 (16) 9质量控制和质量保证 (16) 10组织实施(时间进度) (16) 11参与各方责任及签名 (17) 12参考文献 (17)
1研究背景与目的 1.1研究背景 根据2014 年一项《近十年我国各地区骨质疏松症流行病学状况》报告[1],目前我国约2.1亿人存在低骨量问题,全国 40 岁以上的骨质疏松患者已达到 1.12 亿,随老龄化社会的进展,这一比例还将逐步增加;国际骨质疏松基金会(IOF)报告[2]也指出,在 2010 年,中国 50 岁及以上的人口中发生了大约 230 万例骨折,这一数字预计将在 2050 年上升到 600 万例。骨质疏松骨折是老年人致死、致残最常见的原因[3],《2013 年中国骨质疏松骨折防治蓝皮书》中指出:50岁以上女性椎体骨折的发病率达到15%,髋骨骨折1年内,可导致死亡率增加10~20%[4]。因此骨质疏松骨折成为影响人民身体健康和医疗支出的重大社会卫生问题。 糖尿病是造成骨质疏松的最主要的危险因素之一,随着经济水平飞速发展及生活方式的变化,我国的2型糖尿病发病率急剧升高,上海交通大学医学院附属瑞金医院宁光教授与中国疾病预防控制中心赵文华带领的研究团队的最新研究结果显示[5]:我国18岁及以上成人样本中,根据国际最新临床诊断标准进行诊断的糖尿病估测患病率为11.6%。糖尿病导致骨质量恶化所引发的骨质疏松可使髋部、腕部、脊柱骨折风险增加2~7倍[6],致残、致死率明显升高,严重威胁中国老年人群的健康和生活质量,并造成沉重的家庭、社会和经济负担。 早期防治糖尿病性骨质疏松,提高糖尿病患者对骨量丢失及相关危险因素的知晓率、寻找能早期有效预测骨折风险和生化标志物是预防和尽早治疗的重要前提,将会极大地提高糖尿病病人的生活质量和节省社会资源。而且,构建以社区为基础,建立患者社区档案与综合医院常规诊疗相结合,在社区进行糖尿病骨质疏松高风险人群筛查、教育、治疗的模式是有效防治糖尿病所致骨折的策略。本项目参照国外前瞻性研究的成功经验,开展2型糖尿病骨质疏松骨折风险预测因素的前瞻性研究,以期达到减少并延缓骨折及再次骨折的发病率、降低致残率的目的,为今后建立有效的糖尿病相关性骨质疏松早期筛查、疾病发展监控与干预体系提供理论依据与技术支持。 国内外概况 糖尿病导致骨质损伤涉及高血糖渗透性利尿导致钙磷代谢异常、胰岛素促成骨作用减弱、胰岛素样生长因子(insulinlike growth factor, IGF)缺乏,及AGEs-RAGE 途径[7]等多种因素。在糖尿病人群,常伴有其他的危险因子和糖尿病发生协同作用,使糖尿病相关骨质疏松的风险大大增加。l型糖尿病患者骨质疏松的患病率高达