醋酸的电位滴定
一、实验目的
1、掌握电位滴定法操作和确定终点的方法。
2、掌握醋酸电位滴定曲线的绘制及醋酸离解常数pK a 的测定方法。
二、实验原理
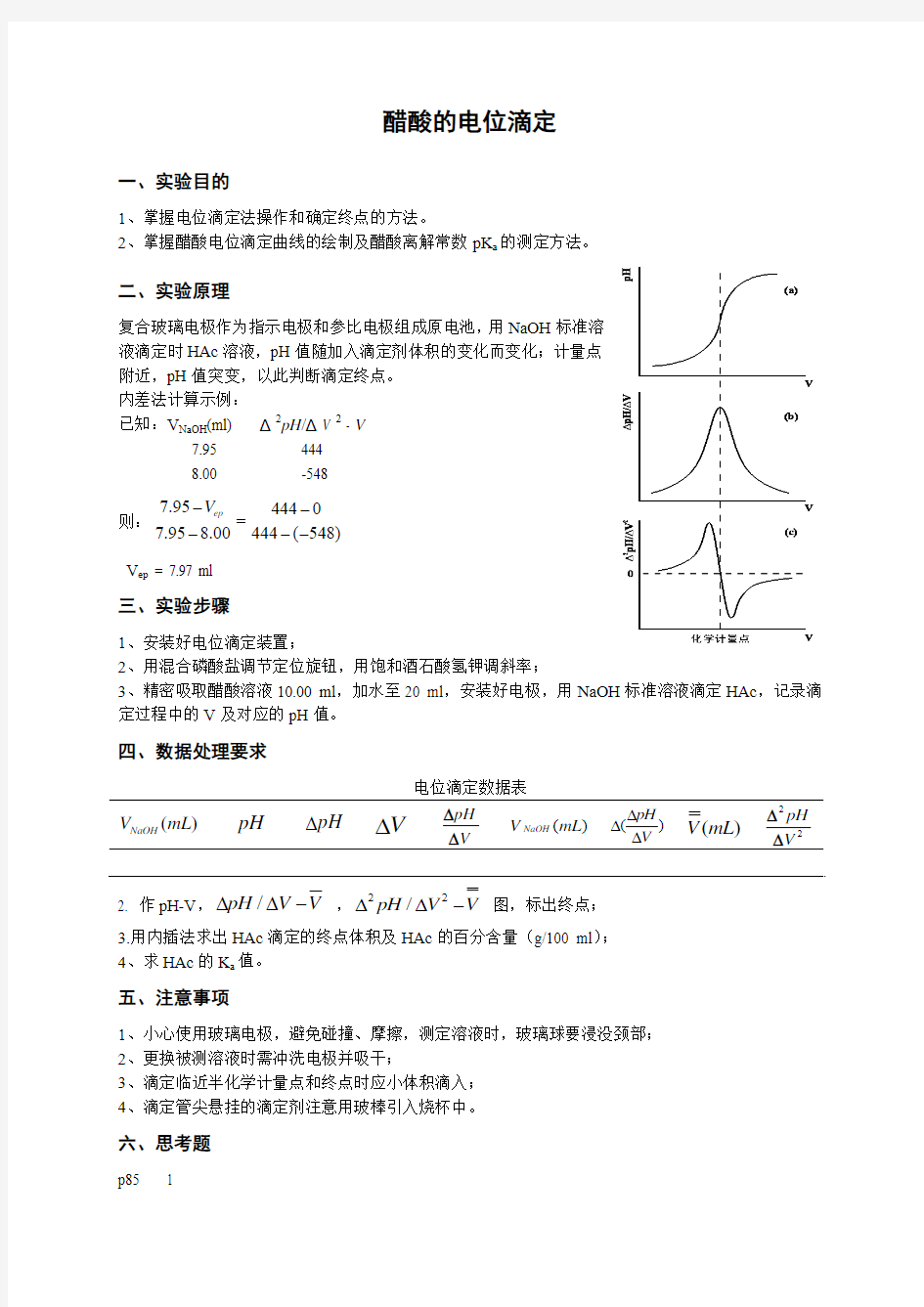
复合玻璃电极作为指示电极和参比电极组成原电池,用NaOH 标准溶
液滴定时HAc 溶液,pH 值随加入滴定剂体积的变化而变化;计量点
附近,pH 值突变,以此判断滴定终点。
内差法计算示例:
已知:V NaOH (ml) Δ2pH /ΔV 2 - V
7.95 444
8.00 -548 则:7.9544407.958.00444(548)
ep
V --=--- V ep = 7.97 ml
三、实验步骤
1、安装好电位滴定装置;
2、用混合磷酸盐调节定位旋钮,用饱和酒石酸氢钾调斜率;
3、精密吸取醋酸溶液10.00 ml ,加水至20 ml ,安装好电极,用NaOH 标准溶液滴定HAc ,记录滴定过程中的V 及对应的pH 值。
四、数据处理要求
电位滴定数据表
()
NaOH V mL pH pH ? V ? pH V ?? ()NaOH V mL ()pH V ??? ()V mL 22pH V ??
2. 作pH-V ,/pH V V ??- ,22/pH V V ??- 图,标出终点;
3.用内插法求出HAc 滴定的终点体积及HAc 的百分含量(g/100 ml );
4、求HAc 的K a 值。
五、注意事项
1、小心使用玻璃电极,避免碰撞、摩擦,测定溶液时,玻璃球要浸没颈部;
2、更换被测溶液时需冲洗电极并吸干;
3、滴定临近半化学计量点和终点时应小体积滴入;
4、滴定管尖悬挂的滴定剂注意用玻棒引入烧杯中。
六、思考题
p85 1
实验七乙酸的电位滴定分析及其解离常数的测定 目的要求 1.学习电位滴定的基本原理和操作技术; 2.运用pH- V 曲线和(△pH/△V)-V曲线与二级微商法确定滴定终点; 3.学习滴定弱酸解离常数的方法; 基本原理 乙酸HOAc为一弱酸,其pKa=4.74,当以标准碱溶液滴定乙酸试液时,再化学计量点附近可以观察到pH的突跃。 以玻璃电极和饱和甘汞电极插入试液即组成如下工作电池; Ag,AgCl‖HCl(0.1 mol·L)|玻璃膜|HOAc试液‖KCl(饱和)|Hg2Cl2,Hg 该工作电池的电动势在酸度计上反映出来,并表示为滴定过程中的pH,记录加入标准碱溶液的体积V和相应的被滴定溶液的pH,然后由pH-V曲线或(△pH/△V)-V 曲线求得终点是消耗的标准碱溶液的体积。也可用二级微商法,于△2p H/ △V2处确定终点。根据标准碱溶液的浓度、消耗的体积和试液的体积,即可求得试液中乙酸的浓度和含量。, 根据乙酸的解离平衡 HOAc = H++ OA C- 其解离常数Ka =[H+][OA C-]/[HOAc] 当滴定分数为50%时,[OA C-]= [HOAc]此时 Ka =[H+],即pKa = pH 因此在滴定分数为50%处的pH,即为乙酸的pKa 一仪器 1.酸度计pHS-3C型 2.复合电极 3.容量瓶100mL 4.吸量管5mL、10ml 5. 微量滴定管10ml 二试剂 1. 1.000 mol·L -1草酸标准溶液 2.0.010 mol·L-1 NaOH 标准溶液(浓度已标定) 3.乙酸试液(浓度约1mol·L-1) 三实验步骤 1. 按照仪器操作步骤调试仪器,将选择开关置于pH档。 2. 将pH=4.00 (20℃)的标准缓冲溶液置于100ml小烧杯中,放入搅拌子,并使电极浸入标准缓冲溶液中,开动搅拌器,进行酸度计定位,再以pH=6.88(20℃)的标准缓冲溶液校核,所得读数与测量温度下的缓冲溶液的标准值之差应在-0.005~+0.005单位之内 3. 将待定的乙酸溶液装入微量滴定管中,使液面在0.00ml处。 4. 吸取乙酸试液10.00ml,置于100ml容量瓶中,稀释至刻度,摇匀。吸取稀释后的乙酸溶液10.00ml,置于100ml烧杯中,加水至约30ml。 5. 开动搅拌器,调节至适当的搅拌速度,进行粗测,即测量在加入乙酸溶液0ml、1ml、2ml、···、8ml、9ml、10ml时的各点pH。初步判断发生pH突跃时需要的乙酸体积范围(△V e x) 6. 重复4、5操作,然后进行细测,即在化学计量点附近取较小的等体积增量,以增加测
三次函数的对称中心与切线条数问题 证明:三次函数32()(0)f x ax bx cx d a =+++≠一定有对称中心。 提示:可根据奇函数图像的平移得到。 分析:我们知道奇函数的图像关于原点对称,所以要证结论成立,只需证任意一个三次函数都可以由关于原点对称的三次函数(奇函数)平移得来,也即任意的三次函数都可以写成3()()y a x m k x m n =-+-+的形式,因为上述函数图像可以看成奇函数3y ax kx =+按向量(,)m n 平移之后的结果,一定是中心对称图形 展开得:32233(3)()y ax amx am k x n km am =-+++-- 与32y ax bx cx d =+++比较系数得:23 33am b am k c n km am d -=?? +=??--=? 容易发现,上述方程组一定是有解的,解得:3b m a =- 故三次函数一定是中心对称图形,且对称中心为(,())33b b f a a - - 问题:过三次函数图像上一点00(,)P x y 能作三次函数图像多少条切线? 分析:由于三次函数有对称中心,可假设其对称中心在原点,设3()f x ax bx =+,则2()3f x ax b '=+ 设11(,)Q x y 为函数图像上任意一点,则以Q 为切点的切线为21111(3)()y y ax bx x x -=+- 将点00(,)P x y 代入得:201101(3)()y y ax b x x -=+-,即3 320 011101()(3)()ax bx ax bx ax b x x +-+=+- 整理得:3231010 230x x x x -+=,问题转化为关于1x 的方程323 1010230x x x x -+=有几个实根的问题 为了看起来习惯,我们将上述方程中的1x 换成x ,即323 00 230x x x x -+= ① 显然当00x =时,方程①即为30x =,解得:0x =,故过(0,0)能作函数图像的一条切线 当00x ≠时,由方程①解得:0x x =或02x -,故过00(,)x y 能作函数图像的两条切线 问题:过三次函数图像外任意一点能作三次函数图像多少条切线? 分析:根据三次函数中心对称的特征,我们知道一定可以将函数图像平移至关于原点对称,而本问题的结论显然只与点P 与三次函数图像的相对位置有关,故可简单地考虑三次函数对称中心在坐标原点的情形,设三次函数的解析式为3()f x ax bx =+,并且不妨设0a >,这两个假设并不会影响本结论的一般性。 设点00(,)P x y 为平面上任意一点,易求得函数在坐标原点(对称中心)处的切线方程为y bx = 设3111(,)x ax bx +为()y f x =上任意一点,则该点处的切线方程为:321111()(3)()y ax bx ax b x x -+=+- 将点P 代入得:32011101()(3)()y ax bx ax b x x -+=+- 问题转化为讨论方程3200()(3)()y ax bx ax b x x -+=+-有几个解的问题 将上述方程化简得:32000230ax ax x y bx -?+-= 令32000()23g x ax ax x y bx =-?+-,则:0()6()g x ax x x '=- 注意到000()()g x y f x =-,00(0)g y bx =-,下面讨论函数()g x 的零点个数
电位滴定法测定食醋中醋酸的含量 一、实验目的 1 通过醋酸的电位滴定,掌握电位滴定的基本操作、PH的变化及指示剂的选择。 2 学习食用醋中醋酸含量的测定方法。 二、实验原理 食用醋的主要酸性物质是醋酸(HAC),此外还含有少量其他的弱酸。醋酸的解离常数Ka=×10-5,用NaOH标准溶液滴定醋酸,化学计量点的PH为,可选用酚酞作指示剂,滴定终点时溶液由无色变为微红色。两者的反应方程式为:HAc + NaOH = NaAc + H2O。然而在本实验滴定过程中,由于食用醋的棕色无法使用合适的指示剂来观察滴定终点,所以它的滴定终点用酸度计来测量。 本实验选用邻苯二甲酸氢钾(KHP)作为基准试剂来标定氢氧化钠溶液的浓度。邻苯二甲酸氢钾纯度高、稳定、不吸水、而且有较大的摩尔质量。标定时可用酚酞作指示剂 三、主要试剂和仪器 1 仪器:pHS-2C型酸度计、天平、电子分析天平、电磁搅拌器、容量瓶(150ml)、锥形瓶(250ml)、吸量管( ,25ml)、碱式滴定管、烧杯(250ml)、量筒(50ml) 2 试剂:NaOH、KHC8H4O4基准物质、食用醋、酚酞、去离子水 四、实验内容和步骤 1 酸度计的安装与校正
(1)开机预热30min,连接复合电极,安排好滴定管和酸度计的位置 (2)用标准缓冲溶液校准仪器(测定前要开动搅拌器):将搅拌棒放入标准缓冲溶液中,把电极插入溶液中使玻璃球完全浸没在溶液中,开动搅拌器,注意观察磁棒不要碰到电极。 (3)标准缓冲溶液定位:先将斜率旋钮顺时针调到最大,调节pHl量程至6,按下读数开关,将定位旋钮调至pH至标准缓冲溶液pH值。 (4)标准缓冲溶液调斜率:调节pH量程至8,按下读数开关,将斜率旋钮调至pH至标准缓冲溶液pH值。 (5)标准缓冲溶液定位:再调节pH量程至6,按下开关读数,将定位旋钮调至pH至标准缓冲溶液pH值。 注意事项:以上校正完成后,定位和斜率旋钮位置不能在变动! ○1在将电极插入待测溶液前,要用蒸馏水冲洗干净,用滤纸吸干水分,再放入溶液中 ○2测定应在搅拌的情况下进行 ○3测定前必须根据测量pH范围选择合适的量程 2 粗配氢氧化钠溶液 用天平称量克氢氧化钠于100ml烧杯中,加蒸馏水溶解,搅拌,可加热加速溶解。等放至室温后转移到带胶塞的试剂瓶中,共加500ml蒸馏水稀释。 3 氢氧化钠的标定(常量法)
高考总复习09:三次函数图像的切线 1.(1)求平行于直线910x y -+=,且与曲线3231y x x =+-相切的直线方程. (2)求垂直于直线320x y -+=,且与曲线32 31y x x =+-相切的直线方程. 2.(1)求函数3()2f x x =的图像在点(1,2)P 处的切线l 方程; (2)设函数3 ()2f x x =的图像为C ,求曲线C 与其在点(1,2)P 处的切线l 的所有交点坐标. 3.(1)求函数3()2f x x =的图像经过点(1,2)P 的切线方程. (2)求函数3 ()2f x x =的图像经过点(1,10)P 的切线方程. 4.已知直线y x =是函数32()31f x x x ax =-+-图像的一条切线,求实数a 的值. 5.已知0a >,且过点(,)P a b 可作函数3()f x x x =-图像的三条切线,证明:()a b f a -<<. 6.设函数3211()32 f x x ax bx c =-++(0)a >的图像C 在点(0,(0))P f 处的切线为1y =. (1)确定,b c 的值; (2)设曲线C 在1122(,()),(,())A x f x B x f x 处的切线都过(0,2)Q ,证明:若12x x ≠,则12'()'()f x f x ≠; (3)若过点(0,2)Q 可作曲线C 的三条不同切线,求a 的取值范围. 7.已知函数3211()32f x x ax bx = ++在区间[11)-,,(13],内各有一个极值点. (1)求24a b -的最大值; (2)当248a b -=时,设曲线C :()y f x =在点(1 (1))A f ,处的切线l 穿过曲线C (穿过是指:动点在点A 附近沿曲线C 运动,当经过点A 时,从l 的一侧进入另一侧),求()f x 的表达式. 8.由坐标原点(0,0)O 向曲线x x x y +-=233引切线,切于不同于点O 的点111(, )P x y ,再由1P 引切线切于不同于1P 的点222(,)P x y ,如此继续下去……,得到点(,)n n n P x y ,求1n x +与n x 的关系,及n x 的表达式.
[HAc][H +] [Ac -]K a =实验四 乙酸的电位滴定分析及其解离常数的测定 一、目的要求1.学习电位滴定的基本原理及操作技术2.运用pH-V 曲线和(ΔpH-ΔV )-V 曲线与二级微商法确定滴定终点。。3.学习测定弱酸离解常数的方法。二、实验原理乙酸HAc 是一弱酸,其p K a = 4.74,当以标准碱溶液滴定乙酸试液时,在化学计量点附近可以观察到pH 的突跃。以玻璃电极与饱和甘汞电极插入试液即组成如下的工作电池: Ag,AgCl ︱HCl(0.1 mol·L -1)︱玻璃膜︱HAc 试液︱KCl(饱和)︱Hg 2Cl 2,Hg 该工作电池的电动势在酸度计上反映出来,并表示为滴定过程中的pH ,记录加入标准碱溶液的体积V 和相应的被滴定溶液的体积。也可用二级微商法,于Δ2pH-ΔV 2=0处确定 终点。根据标准碱溶液的浓度、消耗的体积和试液的体积,即可求得试液中乙酸的浓度或含量。 根据乙酸的解离平衡:HAc(aq) H +(aq ) + Ac - (aq)其解离常数 当滴定分数为50﹪时,[Ac -] = [HAc],此时K a = [H +],即p K a = pH 因此在滴定分数为50﹪处的pH ,即为乙酸的p K a 。三、仪器和试剂1.酸度计2.玻璃电极3.甘汞电极4.容量瓶 50ml 100ml 5.吸量管6.微量滴定管7.0.1000mol/L 邻苯二甲酸氢钾标准溶液8.0.1mol/LNaOH 9. 0.1mol/LHAc 10. pH=4.00、pH=6.88标准缓冲溶液(20℃) 四、操作步骤1.调试仪器:接通电源,将选择开关置于pH 档,连接好电极,调节温度档于室温。 2.将pH=6.88(20℃)的标准缓冲溶液置于50mL 的烧杯中,放入磁力子,开动搅拌器,
、过三次函数上一点的切线问题。 3 2 设点p 为三次函数f (x ) ax bx ex d (a 0)图象上任一点,则过点P 一定有直线与y f (x ) 的图象相切。若点 P 为三次函数图象的对称中心,则过点 P 有且只有一条切线;若点 P 不是三次函数图象 的对称中心,则过点 P 有两条不同的切线。 证明 设P (x i ,y i ) 过点P 的切线可以分为两类。 1、 P 为切点 k 1 f /(x 1) 3ax 12 2bx 1 e , 2 切线方程为:y y_! (3ax 1 2bx 1 e)(x x 1) f (x )图象的切线,切于另一点 Q ( X 2, y 2) 当X 1 K —时,两切线重合,所以过点 P 有且只有一条切 线。 3a 当X 1 —时, 3a k 1 k 2,所以过点 P 有两条不同的切线。 其切线方程为: y y 1 (3ax 12 2bx 1 e)(x X 1) 3 2 1 b 2 y y 1 (— ax 1 4 bx 1 2 e)(x X 1) 4a 由上可得下面结论: 过三次函数 f (X ) 3 , 2 ax bx ex d (a 0)上异于对称中心的任一点 卩1(人,%)作y f (x )图 象的切 线,切于另一点P 2(X 2,y 2),过P 2(X 2,y 2)作y f (x )图象的切线切于P 3(X 3,y 3),如此继续,得到点 列 三次函数切线问题 k 2 y2 % 3 ax 2 3 ax bx ; bx, ex 2 ex-! X 2 ax 2 ax 1 又 k 2 f/ (X 2 ) 2 3ax 2 2bx 2 e ax 2 2 ax 1 X 2 2 ax 1 bx 1 bx 2 即 (X 2 X 1 )(2x 2 X 」) 0 x 2 a 得 3 2 1 b 2 k 2 ax 1 — bx 1 e 4 2 4a 2 讨论:当 k 1 k 2 时,3ax 1 2bx 1 e e 3ax 2 2 2bx 2 e 1 b X 1 代入( 1 )式 2 2a 3 2 1 b 2 e ,得 X 1 b —ax 1 bx 1 4 2 4a 3a P 不是切点,过P 点作y 2 ax 1x 2 2 bx 1 bx 2 e (1)
应用导数研究三次函数图像的对称性及切线条数 [教学目标] 知识与技能:(1)掌握三次函数对称中心的求法;(2)掌握三次函数切线方程的求法;(3) 了解过一点作三次函数图像切线条数的结论. 过程与方法:(1)应用导数研究三次函数的方法;(2)由特殊实例猜想一般结论,然后证 明的思想;(3)利用函数对称性,多种情形通过分析减少讨论种类. 情感与态度:(1)通过自主深入探究,增强学生学生学习数学的兴趣,独立思考的能力; (2)让学生感数学结论的完整美,数形结合的统一美. [教学重点]三次函数图像的对称中心、切线条数的探究,三次函数切线方程的求法. [教学难点]特殊到一般的归纳方法,切线条数的判断方法. [教学方法]探究式教学. [教学手段]多媒体辅助教学. [教学过程] 1 三次函数图像的对称性 1.1 创设情景,提出问题 三次函数3()f x x =是奇函数,它的图像的对称中心是(0,0)(几何画板展示),那么一般的三次函数是否有对称中心呢? 观察函数32()321g x x x x =-++的图像(几何画板展示),它也有对称中心(1,1),那么怎样求三次函数的对称中心? 1.2 回归通法,探究发现 研究三次函数我们最常用的就是通过研究其导函数来研究它本身,我们分别画出(),()f x g x 的导函数图像(几何画板展示),和原函数的对称性联系起来,通过归纳得到,三次函数有唯一的对称中心,对称中心的横坐标与其导函数顶点的横坐标相同. 1.3 追根索源,理解本质 为什么会有这样的结论?因为三次函数在两个相互对称的点处的切线是平行的(几何画板展示),所以对于任意三次函数32()(0)f x ax bx cx d a =+++≠,它的图像有唯一的对称中心(,())33b b f a a --.i 2 过一点作三次函数图像切线条数的探究 2.1 因势利导,引出问题 三次函数过对称中心(,())33b b f a a - -的切线是如何的?通过实例来探究.32()321g x x x x =-++在对称中心(1,1)处的切线方程为20x y +-=,这和我们以前形成的切线的印象不同,但它就是三次函数的切线,因为它符合切线的定义.我们注意这样的切线只有一条,那么当这一点在别的地方,切线有多少条? 2.2 恰当分类,实例探索 因为三次函数是中心对称图形,因此对称部分的情形应该是一样的,过对称中心的切线和三次函数的图像把平面分成四部分,所以上下是一种情形,左右是一种情形,三次函数图
醋酸的电位滴定 一、实验目的 1、掌握电位滴定法操作和确定终点的方法。 2、掌握醋酸电位滴定曲线的绘制及醋酸离解常数pK a 的测定方法。 二、实验原理 复合玻璃电极作为指示电极和参比电极组成原电池,用NaOH 标准溶 液滴定时HAc 溶液,pH 值随加入滴定剂体积的变化而变化;计量点 附近,pH 值突变,以此判断滴定终点。 内差法计算示例: 已知:V NaOH (ml) Δ2pH /ΔV 2 - V 7.95 444 8.00 -548 则:7.9544407.958.00444(548) ep V --=--- V ep = 7.97 ml 三、实验步骤 1、安装好电位滴定装置; 2、用混合磷酸盐调节定位旋钮,用饱和酒石酸氢钾调斜率; 3、精密吸取醋酸溶液10.00 ml ,加水至20 ml ,安装好电极,用NaOH 标准溶液滴定HAc ,记录滴定过程中的V 及对应的pH 值。 四、数据处理要求 电位滴定数据表 () NaOH V mL pH pH ? V ? pH V ?? ()NaOH V mL ()pH V ??? ()V mL 22pH V ?? 2. 作pH-V ,/pH V V ??- ,22/pH V V ??- 图,标出终点; 3.用内插法求出HAc 滴定的终点体积及HAc 的百分含量(g/100 ml ); 4、求HAc 的K a 值。 五、注意事项 1、小心使用玻璃电极,避免碰撞、摩擦,测定溶液时,玻璃球要浸没颈部; 2、更换被测溶液时需冲洗电极并吸干; 3、滴定临近半化学计量点和终点时应小体积滴入; 4、滴定管尖悬挂的滴定剂注意用玻棒引入烧杯中。 六、思考题 p85 1
三次函数切线问题 【探究拓展】 探究1:切线的辩证定义 设Q 为曲线C 上不同于P 的一点,这时,直线PQ 称为曲线的割线。随着点Q 沿着曲线C 向点P 运动,割线PQ 在点P 附近越来越逼近曲线C 。当点Q 无限逼近点P 时,直线PQ 最终就成为在点P 处最逼近曲线的直线l ,这条直线也称为曲线在P 点处的切线。 探究2:填表:曲线在P 点附近的局部图像反映出如下特点 在运动中: 探究3:切线问题的辩证策略 T n A 1 A
例1:若直线y x =是曲线3 23y x x ax =-+的切线,则a = . (零点法) ↑ y x =是曲线323y x x ax =-+相切 x a x x y )1(323-+-=与x 轴相 切 ↓ ↑ 联立()323 2 3103y x x x a x y x x ax =??-+-=? =-+?有重根→新联立?? ? -+-==x a x x y y )1(30 2 3 ↓ (重根法) 变式1:(2020年)曲线px x y +=3 与q y -=相切,求证32 032p q ???? += ? ????? 变式2:方程3 0x px q ++=有几个实根?
探究4:切线问题的辩证思考: 联系——数形结合、函数与方程、转化与化归 发展——量变与质变、运动观点 探究5:辩证思维的强化延伸 由原点向曲线x x x y +-=233引切线,切于不同于点O 的点()1 1 1 , P x y , 再由1 P 引切线切于不同于1 P 的点()2 2 2 , P x y ,如此继续下去……,得点到 (){}, n n n P x y . (1)求1 x ; (2)求1与n n x x +的关系; (3)点列{}n P 有何特点? 拓展1:若直线y x =是曲线3 231y x x ax =-+-的切线,则 a = 拓展2:直线y kx m =+对一切m ∈R 与曲线3 26910y x x x =-+-有且只有一个交 点,求k 的取值范围,并尝试一下,将结论推广到任意三次曲线的情形,此外能否从运动变化的观点阐述上述结论的几何意义.
-150 -100-50 05010015027.227.4 27.6 27.8 28.0 V/mL △2p H /△V 2 醋酸电位滴定的△2pH/△V 2-V 11 20.00,27.60,0.10()0.1027.60 0.13820.00 HAc NaOH NaOH HAc HAc NaOH NaOH HAc NaOH NaOH NaOH HAc HAc V mL V mL c mol L c V c V n n c V c mol L V --===??=?=??∴= ==? 02468 10120 5 10 1520 25 30 35 V NaOH /mL p H 醋酸电位滴定的pH-V 27.60 024681012141625 26 27 28 2930 △pH/△V V
五、数据记录与处理 1.标准曲线法 序号 1# 2# 3# 4# 5# 6# pF= 6 5 4 3 2 ? -mV 405 355 306 250 196 282 y = 52.3x + 93.2R 2 = 0.9993 150 200250300350 4004501 2 3 4 5 6 7 pF -E /m V 200 3004005006007008009000.0 3.0 6.0 9.012.015.0 V/mL E /m V 11.95 0200400600800 100011.2 11.411.611.812.012.212.412.6 V/mL △E /△V
y = 0.0827x + 0.0025 R 2 = 0.9997 0.00 0.020.040.06 0.080.100 0.2 0.4 0.6 0.8 1 1.2 c Mg /μg?mL -1 A
三次函数切线专题
过点P 一定有直线与)(x f y =图象相切。 (1)若,30a b x - =则过点P 恰有一条切线; (2) 若 ,30a b x -≠且)3()(0a b g x g -0>,则过点P 恰有一条切线; (3) 若,30a b x -≠且)3()(0a b g x g -=0,则过点P 有两条不同的切线; (4)若,30a b x - ≠且)3()(0a b g x g -0<,则过点P 有三条不同的切线。 其中).)(()()(0/0x x x f x f y x g -+-= 证明 设过点P 作直线与)(x f y =图象相切于点),,(11y x Q 则切线方程为 ),)(23(11211x x c bx ax y y -++=- 把点),(00y x P 代入得: 02)3(2001021031=--+--+cx d y x bx x ax b ax , 设.2)3(2)(000203cx d y x bx x ax b ax x g --+--+= ,2)3(26)(002/bx x ax b ax x g --+= ,)3(448)3(420020b ax abx ax b +=+-=? 令,0)(/=x g 则.3,0a b x x x -== 因为0)(=x g 恰有一个实根的充要条件是曲线)(x g y =与X 轴只相交一次,即)(x g y =在R 上为单调函数或两极值同号,所以 ,30a b x -=或,30a b x -≠且)3()(0a b g x g -0>时,过点P 恰有一条切线。 0)(=x g 有两个不同实根的充要条件是曲线)(x g y =与X 轴有 两个公共点且其中之一为切点,所以 ,30a b x -≠且)3()(0a b g x g -=0时,过点P 有两条不同的切线。 )(=x g 有三个不同实根的充要条件是曲线)(x g y =与X 轴有
三次函数图象的切线问题专练
————————————————————————————————作者:————————————————————————————————日期:
三次函数图象的切线问题专练 广西 王强芳 [问题] 一、 曲线在点P 处的切线方程 1 曲线33y x x =+在点(2,14)P --处的切线方程是 。 二、曲线经过点P 处的切线方程 2 已知曲线C :3()2f x x x =-+,则经过点(1,2)P 的曲线C 的切线方程 是 。 三、点P 不在曲线上的切线方程 3 已知曲线C :3()2f x x x =-+,试问:分别过点(1)(0,54)-,(2)(2,0), (3)16(,2)11 的曲线C 的切线有几条?如果是一条,写出切线的方向向量;如果是两条, 求两条切线之间的夹角;如果是三条,写出切线方程。 四、其它变形 4 已知曲线C :32()32f x x x x a =-++的一条切线方程为2y x =,则实数a 的值 等于 。 5 斜率为3的直线与曲线C :3y x =相切于P 点,并与曲线有另一个交点Q ,求P 、 Q 两点的坐标。 6 若方程330x x m --=有一个二重根,求方程的解集。 7 P 为曲线C :3y x =上一动点,若曲线在该点处的切线与曲线有另一交点Q ,求PQ 的中点的轨迹方程。 [答案与提示] 1 解:由'2()33f x x =+,得'(2)15f -=, 所以所求的切线方程为1415(2)y x +=+,即1516y x =+。 2 错解:由'2()31f x x =-,得'(1)2k f ==, 所以所求的切线方程为22(1)y x -=-,即2y x =。 错因剖析:此处所求的切线只说经过P 点,而没说P 点一定是切点,于是切线的斜率 k 与'(1)f 不一定相等。比如(如图)当02x π≤≤时,正弦曲线sin y x =在点P 处的切线
实验5 电位滴定法测定醋酸的含量 一、实验目的 1、熟悉电位滴定的基本原理和操作技术; 2、学习运用二级微商法确定滴定的终点。 二、实验原理 醋酸为有机酸(5108.1-?=a K ),与NaOH 的反应为:O H NaAc NaOH HAc 2+→+。用与已知浓度的NaOH 滴定未知浓度的HAc 溶液在终点时产生pH (或mV )值的突跃,因此根据滴定过程中pH (或mV )值的变化情况来确定滴定的终点,进而求得各组份的含量。 滴定终点可由电位滴定曲线(指示电极电位或该原电池的电动势对滴定剂体积作图)来确定,也可以用二次微商曲线法求得。二次微商曲线法是一种不需绘图,而通过简单计算即可求得滴定的终点,结果比较准确。这种方法是基于在滴定终点时,电位对体积的二次微商值等于零。 例:用下表的一组终点附近的数据,求出滴定终点 滴定剂 的体积 V/mL 电动势 V E △E △V V E ?? 2 2V E ?? 24.10 24.20 24.30 24.40 24.50 24.60 0.183 0.194 0.233 0.316 0.340 0.351 0.011 0.039 0.083 0.024 0.011 0.10 0.10 0.10 0.10 0.10 0.11 0.39 0.83 0.24 0.11 +2.8 +4.4 -5.9 -1.3 表中V V E V E V E ?? ?? ????-??? ????=??12 22 加入△V 为等体积,在接近滴定终点时。 从表中2 2V E ??的数据可知,滴定终点在24.30mL 与24.40mL 之间。 设: (24.30+X )mL 时为滴定的终点 02 2=??V E 即为滴定终点。
高考 浙江奉化奉港中学 罗永高 程雪飞 315500 三次函数的切线蕴含着许多美妙的性质,用导数方法探求切线的性质,为分析问题和解决问题提供了新的视角、新的方法,不仅方便实用,而且三次函数的切线性质变得十分明朗.纵览近几年高考数学试题,三次函数的切线问题频频出现,本文给出三次函数切线的三个基本问题. 一、已知斜率为k 与三次函数图象相切的切线 三次函数)0()(23≠+++=a d cx bx ax x f 1、0>a ,斜率a b a c k 332 -=时,有且只有一条切线; a b a c k 332 ->时,有两条不同的切线; a b a c k 332 -<时,没有切线; 2、0时,没有切线; 证明 c bx ax x f ++=23)(2/ 1、 0>a 当a b x 3-=时,.33)(2 min /a b a c x f -= ∴ 当a b ac k 332-= 时,方程a b a c c bx ax 33232 2-=++有两个相同解, 所以斜率为k 的切线有且只有一条;其方程为:
).3(33)3(2a b x a b a c a b f y +-=-- 当a b a c k 332 ->时,方程k c bx ax =++232,有两个不同的解21,x x ,且21x x +=-a b 32-,即存在两个不同的切点))(,()),(,(2211x f x x f x ,且两个切点关于三次函数图象对称中心对称。所以斜率为k 的切线有两条。 当a b a c k 332 -<时,方程k c bx ax =++232无实根,所以斜率为k 的切线不存在。 2、0 醋酸的电位滴定(间接电位法) 专业:能源化学工程年级:2011级姓名:翟裕学号:2011115287 实验时间:2013年11月14号 一.实验原理 等当点时,PH值突跃 二.记录及实验结果 1.实验数据记录 /mL PH ΔPH/ΔV Δ2PH/ΔV2 V NaOH 0.00 3.52 0.109 -0.009 10.00 4.61 0.055 12.00 4.72 0.013 0.093 15.00 5.00 0.043 0.200 17.00 5.40 0.140 0.410 18.00 5.81 0.280 0.620 18.50 6.12 4.93 2.10 18.60 6.33 -12.0 0.90 18.70 6.42 17.0 2.60 18.80 6.68 27.0 5.30 18.90 7.21 6.00 5.90 19.00 7.80 -29.0 3.00 19.10 8.10 -20.0 1.00 19.20 8.20 3.30 1.33 19.30 8.33 -6.30 0.70 19.40 8.40 33.3 4.00 19.50 8.80 -24.0 1.60 19.60 8.96 -3.10 0.825 20.00 9.29 -0.221 0.670 21.00 9.96 -0.380 0.290 22.00 10.25 -0.079 0.133 25.00 10.65 2.拟合滴定曲线 醋酸电位滴定曲线 0.00 2.004.006.008.0010.0012.000.00 5.00 10.0015.0020.0025.0030.00 V/mL P H 3.实验数据处理与分析结果 (1)计算终点时消耗的NaOH 溶液的体积数( V NaOH ) 内插法: ???? ???? ? ? -?-+ =???? ??????? ? ? ?????? ? ? ???2 202222-1 1 21 21p V V pH V pH V H V V V 终点 盐酸-醋酸混合液的电导滴定 一、实验目的 1、巩固电导滴定的理论知识; 2、学会电导滴定的分析操作; 3、学会绘制电导滴定曲线及滴定终点的确定方法;. 4、测定HCl和HAc混合溶液中HCl和HAc的含量 二、实验原理 电导滴定是容量分析法的一种,其终点是根据滴定过程中电导的变化来确定的。 用NaOH溶液滴定HCl和HAc混合溶液时,HCl首先被中和。溶液中迁移速度较大的H+被加入的OH-中和生成难电离的H2O及迁移速度较小的Na+所代替,反应如下: H++ Cl- + Na++ OH- = Na++ Cl- +H2O 已知Na+的摩尔电导小于H+的摩尔电导,因此,在等当点前随滴定的进行,溶液的电导不断下降。等当点后,随着过量的NaOH的加入,溶液中的OH-和Na+浓度增加,则溶液的电导也随之增大。当HCl被中和完后,HAc开始被中和,生成难电离的H2O和易离解的NaAc。 所以电导略增加,当NaOH过量时,由于OH-溶液巾OH-迁移速度很大,使电导迅速上升。以溶液的电导为纵坐标,NaOH标准溶液的体积(m1)为横坐标绘图。得出具有两个拐点的滴定曲线,第一个拐点A所对应的体积为滴定HCl时所消耗的NaOH量,而滴定HAc所消耗的NaOH量应为两个拐点A、B所对应的体积之差。 三、仪器与试剂 DDS-11A型电导率仪;DJS-1型铂黑电报;磁力搅拌器。 0.2mol/L NaOH溶液;HCl、HAc混合溶液。 四、实验步骤 1、按仪器使用方法,调好仪器,并清洗外电极。 2、所用的烧杯,移液管应保证洁净,否则要按常规方法洗干净,再用离子交换水或蒸馏水冲洗2-3次。移液管在使用前用试液清洗2-3次。 3、分别吸取未知HCl和HAc溶液各20ml,于小烧杯中(三份),并用水清洗杯壁,放入磁性搅拌子,将烧杯置于磁力搅拌器上,打开搅拌开关,使溶液充分搅拌。 4.用已知的标准NaOH溶液进行滴定,测定相应的电导,记录如下 高考中三次函数图象的切线问题 镇江实验高中 杨勇 一、已知斜率为k 与三次函数图象相切的切线 三次函数)0()(23≠+++=a d cx bx ax x f 1、0>a ,斜率a b a c k 332 -=时,有且只有一条切线; a b a c k 332 ->时,有两条不同的切线; a b a c k 332 -<时,没有切线; 2、0时,没有切线; 证明 c bx ax x f ++=23)(2/ 1、 0>a 当a b x 3-=时,.33)(2 min /a b a c x f -= ∴ 当a b ac k 332-= 时,方程a b a c c bx ax 33232 2-=++有两个相同解, 所以斜率为k 的切线有且只有一条;其方程为: ).3(33)3(2a b x a b a c a b f y +-=-- 当a b a c k 332 ->时,方程k c bx ax =++232,有两个不同的解21,x x ,且21x x +=-a b 32-,即存在两个不同的切点))(,()),(,(2211x f x x f x ,且两个切点关于 三次函数图象对称中心对称。所以斜率为k 的切线有两条。 当a b a c k 332 -<时,方程k c bx ax =++232无实根,所以斜率为k 的切线不存在。 2、0 高中数学高考中三次函数图象的切线问题 三次函数的切线蕴含着许多美妙的性质,用导数方法探求切线的性质,为分析问题和解决问题提供了新的视角、新的方法,不仅方便实用,而且三次函数的切线性质变得十分明朗.纵览近几年高考数学试题,三次函数的切线问题频频出现,本文给出三次函数切线的三个基本问题. 一、已知斜率为k 与三次函数图象相切的切线 三次函数)0()(23≠+++=a d cx bx ax x f 1、0>a ,斜率a b a c k 332 -=时,有且只有一条切线; a b a c k 332 ->时,有两条不同的切线; a b a c k 332 -<时,没有切线; 2、0时,没有切线; 证明 c bx ax x f ++=23)(2/ 1、 0>a 当a b x 3-=时,.33)(2 min /a b a c x f -= ∴ 当a b ac k 332-= 时,方程a b a c c bx ax 33232 2-=++有两个相同解, 所以斜率为k 的切线有且只有一条;其方程为: ).3(33)3(2a b x a b a c a b f y +-=-- 当a b a c k 332 ->时,方程k c bx ax =++232,有两个不同的解21,x x ,且21x x +=-a b 32-,即存在两个不同的切点))(,()),(,(2211x f x x f x ,且两个切点关于三次函数图象对称中心对称。所以斜率为k 的切线有两条。 当a b a c k 332 -<时,方程k c bx ax =++232无实根,所以斜率为k 的切线不存在。 2、0 容量滴定法、电位滴定法、库仑滴定法的比较容量分析法是化学分析中的一种,而电位分析法和库仑分析法是仪器分析中的一种。容量滴定法、电位滴定法、库仑滴定法都是对物质组成进行分析的方法。容量滴定法和电位滴定法、库仑滴定法在原理、仪器装置、应用范围等方面都存在差异,现比较如下: 1、原理 容量滴定法(又称滴定分析法)原理:滴定分析法是将一种已知准确浓度的试剂溶液,滴加到被测物质的溶液中,直到所加的试剂与被测物质按化学计量定量反应为止,根据试剂溶液的浓度和消耗的体积,计算被测物质的含量. 电位分析法的实质:电位分析是通过在零电流条件下测定两电极间的电位差(电池电动势)所进行的分析测定。 电位分析法包括电位测定法和电位滴定法。 电位测定法依据:能斯特方程.测定了电极电位就可确定离子的活度(或在一定条件下确定其浓度)。 电位滴定法原理:在滴定分析中,滴定进行到化学计量点附近时,将发生浓度的突变。如果在滴定过程中在滴定容器内浸入一对适当的电极,则在化学计量点附近可以观察到电极电位的突变,因而根据电极电位突跃可确定终点的到达. 库仑滴定法的理论基础:法拉第电解定律。 2、主要仪器装置 容量滴定法的仪器装置:移液管、容量瓶、滴定管、锥形瓶、指示剂等。 电位滴定法的仪器装置:参比电极、指示电极、电位差计。 库仑滴定法的仪器装置:电解系统(电解池、计时器、恒电流电源)和指示系统. 3、应用范围 容量滴定法:一般的酸碱滴定、沉淀滴定、氧化还原滴定、配位滴定都可适用,但对滴定反应有一定的要求: (1)反应要按一定的化学方程式进行,即有确定的化学计量关系; (2) 反应必须定量进行--反应接近完全(>99.9%); (3)反应速度要快--有时可通过加热或加入催化剂方法来加快反应速度; (4)必须有适当的方法确定滴定终点—-简便可靠的方法:合适的指示剂。 电位滴定法:容量分析法适用的范围,此外,尤为适用于有色的或浑浊的、荧光性的、醋酸的电位滴定
盐酸-醋酸混合液的电导滴定
三次函数的切线问题
高中数学高考中三次函数图象的切线问题
容量、库仑、点位滴定法的比较