
第一章氧化铝生产
2.冶金方法,主要的有色金属冶金方法有:火法冶金、湿法冶金、电冶金
火法冶金:在高温下矿石或精矿经熔炼与精炼反应及熔化作业,使其中的有色金属与脉石和杂质分开,获得较纯有色金属的过程。包括原料准备、熔炼和精炼三个主要工序。过程所需能源主要靠燃料燃烧供给,也有依靠过程中的化学反应热来提供。
湿法冶金:它是在常温(或低于100℃)常压或高温(100-300 ℃)高压下,用溶剂处理矿石或精矿,使所要提取的有色金属溶解于溶液中,而其它杂质不溶解,然后再从溶液中将有色金属提取和分离出来的过程。主要包括浸出、分离与富集和提取过程。
电冶金:利用电能提取和精炼有色金属的方法。
A、电热冶金:利用电能转变成热能在高温下提炼有色金属,本质同火法冶金。
B、电化学冶金:用电化学反应使有色金属从所含盐类的水溶液或熔体中析出。前者称为水溶液电解,可归入湿法冶金;后者称为熔盐电解,可归入火法冶金。
3.有色金属冶金主要单元过程
(1)焙烧:将矿石或精矿置于适当的气氛下,加热至低于它们的熔点温度,发生氧化、还原或其它化学变化的过程。其目的是改变原料中提取对象的化学组成,满足熔炼或浸出的要求。按控制的气氛不同,分为:氧化焙烧:还原焙烧:硫酸化焙烧:氯化焙烧等。
(2)煅烧:将碳酸盐或氢氧化物的矿物原料在空气中加热分解,除去二氧化碳或水分变成氧化物的过程。如石灰石煅烧为石灰;氢氧化铝煅烧成氧化铝,作电解铝原料。
(3)烧结和球团:将粉矿或精矿经加热焙烧,固结成多孔状或球状的物料,以适应下一工序熔炼的要求。
(4)熔炼:是指将处理好的矿石、精矿或其他原料,在高温下通过氧化还原反应,使矿物原料中有色金属组分与脉石和杂质分离为两个液相层即金属(或金属锍)液和熔渣的过程,也叫冶炼。分为:还原熔炼:造锍熔炼:氧化吹炼:
(5)火法精炼:在高温下进一步处理熔炼、吹炼所得的含有少量杂质的粗金属以提高其纯度。种类:氧化精炼、硫化精炼、氯化精炼、熔析精炼、碱性精炼、区域精炼、真空冶金、蒸馏等。
(6)浸出:用适当的浸出剂(如酸、碱、盐等水溶液)选择性地与矿石、精矿、焙砂等矿物原料中金属组分发生化学作用,并使之溶解而与其它不溶组分初步分离的过程。浸出又称浸取、溶出、湿法分解。
3. 铝合金的种类
铸造铝合金:Al-Si,Al-Cu,Al-Mg,Al-Zn系和变形铝合金(加工用铝合金)
5. 现代铝工业三个主要生产环节
(1)从铝土矿提取纯氧化铝
(2)用冰晶石-氧化铝熔盐电解法生产铝
(3)铝加工
辅助环节:(1)炭素电极制造(2)氟盐生产
6. 铝电解原理
现代铝工业生产,主要采用冰晶石-氧化铝熔盐电解法,其中氧化铝是炼铝的原料,冰晶石是熔剂。直流电通入电解槽,在阴极和阳极上发生电化学反应。电解产物,阴极上是液体铝,阳极上是气体CO2(75-80%)和CO(20-25%)。在工业电解槽内,电解质通常由质量分数为95%的冰晶石和5%的氧化铝组成,电解温度为950-970℃。电解液的密度约为2.1g/cm3,铝液密度为2.3 g/cm3,两者因密度差而上下分层。铝液用真空抬包抽出后,经过净化和过滤,浇铸成商品铝锭,纯度达99.5 -99.8%。阳极气体中还含有少量有害的氟化物、沥青烟
气和二氧化硫。经过净化后,废气排入大气,收回的氟化物返回电解槽内继续使用。
7.铝土矿分类
铝土矿是含铝矿物和赤铁矿、针铁矿、高岭石、锐铁矿、金红石、钛铁矿等矿物的混合矿,是现代电解法炼铝的原料。
铝土矿的化学成分质量分数和主要矿物成分
10. 从铝土矿中提取氧化铝的方法
生产氧化铝的方法分为碱法(如拜耳法、烧结法、拜耳烧结联合法)、酸法和电热法。工业应用的只有碱法。
用各种无机酸(硫酸、盐酸、硝酸)处理含铝原料时,原料中的氧化硅基本上不与酸起反应而残留在渣中。得到的含铁铝盐酸性水溶液经除铁净化后,可通过不同的方法得到铝盐水合物结晶或氢氧化铝结晶,煅烧这些结晶得到氧化铝。酸法分为硫酸法和盐酸法。设备腐蚀、能耗高,尚未工业应用。电热法也尚未工业应用。
拜耳法生产氧化铝占世界95%,主要采用三水铝石型铝土矿
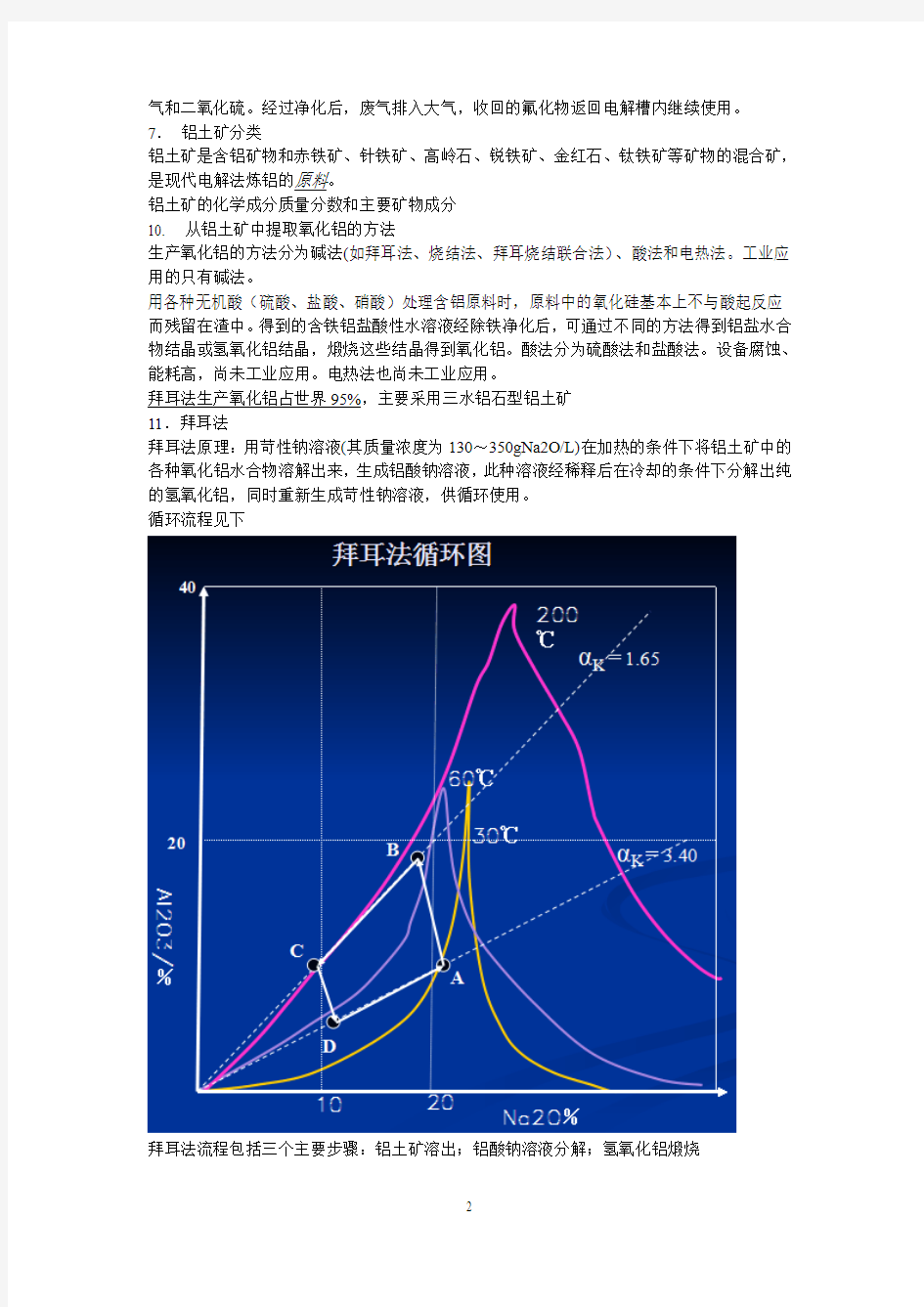
11.拜耳法
拜耳法原理:用苛性钠溶液(其质量浓度为130~350gNa2O/L)在加热的条件下将铝土矿中的各种氧化铝水合物溶解出来,生成铝酸钠溶液,此种溶液经稀释后在冷却的条件下分解出纯的氢氧化铝,同时重新生成苛性钠溶液,供循环使用。
循环流程见下
拜耳法流程包括三个主要步骤:铝土矿溶出;铝酸钠溶液分解;氢氧化铝煅烧
溶出:指把铝土矿中的氧化铝水合物(Al2O3·xH2O)溶解在苛性钠(NaOH)中,生成铝酸钠溶液。Al2O3·xH2O + 2 NaOH = 2NaAlO2 + (x+1)H2O
Al(OH)3 + NaOH = NaAl(OH)4
AlOOH + NaOH + H2O = NaAl(OH)4
分解:析出固体氢氧化铝
2NaAlO2 + 4H2O = 2NaOH +Al2O3·xH2O
(添加晶种Al2O3·3H2O)
煅烧:Al2O3·3H2O = Al2O3 + 3H2O
(高温1100℃)
13. 对氧化铝的要求
炼铝用氧化铝的质量
要求:纯度高、α-氧化铝含量低、小于40μm的粒度比例小,并且比表面积大于50m2/g 。主要杂质:氧化钠、氧化钙、氧化硅、氧化钛、铁、磷、钒、硅等。
粒度要求:限制大于200 μm和小于44 μm的比例。
14. 铝电解电极反应
解的总反应式:
Al2O3 + 1.5C = 2Al(液) +1.5CO2(气)
炭阳极的理论消耗量是333kg/t(Al)
1.5 ×12/54×100% =333kg(C) /t (Al)
C生成CO2时的电化学当量,按法拉第定律算出:
已知:12.011 –碳的相对原子质量;
4 –碳的化合价;
96485 –法拉第常数,A·s;
3600 –每小时的秒数,s。
碳的当量值= 12.011/4 =3.0028g
1法拉第= 96485/3600 = 26.8A·h
碳的电化学当量值= 3.0028/26.8 = 0.1120g/ A·h
工业铝电解槽的阳极气体组成中CO2,CO的质量分数分别为70-80%,20-30%。阳极实际消耗约为400kg。其中存在多量CO主要是由于溶解在电解质中的铝同一次气体CO2发生逆反应生成的:3CO2(气)+2Al (溶解的)= Al2O3 (溶解的)+3CO(气)铝电解的电流效率通常是指阴极上实际产出的铝量对于理论上按照法拉第定律计
算的铝量的百分数。
按照法拉第定律计算理论铝产量:
在电解过程中,通过1法拉第电量理论上应析出1摩尔的铝,因此
铝的当量值=26.98154/3= 8.9938g。
1法拉第电量=96485A·s,即96485/3600
= 26.8A·h 。
铝的电化学当量值C = 8.9938/26.80 = 0.3356g/(A·h)
设电解槽的平均电流(直流)为300 kA 它的年产铝量应为:
P =0.3356 ×300×24×365×10-3
=882t/年
理论电耗量计算
W理论=2980*(a1+a2+b)
a1:反应标准自由能变化
a2:补偿反应束缚能T*△S
b:反应物(氧化铝、碳)温度变化所需的能量
如:室温下加入氧化铝、碳,电解温度为950度,计算得到的理论电能a1=1.196伏、a2=0.698伏、b=0.227伏W理论=6320KW*hr/t-Al
生产每吨铝所需要的电能量={V/[0.3356×η] }×103kW·h
式中V—电解槽的总平均电压;η—电流效率
例:某电解槽的平均电压是 4.25V,电流效率是92%,则生产每吨铝所需的电能量=[4.25/0.3356×0.92]×103 = 13765 kW·h
节电途径
(1)提高电流效率
(2)降低平均电压
已知电解质的质量为6吨,其中CaF2 3%,Al2O3 5%,摩尔比为3.0,今欲调整到摩尔比为2.6,求所需的氟化铝量。
设K为冰晶石摩尔比;W为冰晶石质量;X为NaF 质量;Y 为AlF3质量。
X=WK/ [K+2]
Y=2W/[K+2]
由已知条件,CaF2 +Al2O3 =8%
W = 6000(1- 0.08) =5520kg
X = 5520×3/[3 + 2]=3312kg
Y = 5520 ×2/[3 + 2]=2208kg
如果所需的氟化铝量为f ,则
{3312/[2208 + f ]}×2 = 2.6
f = 332 kg
三层液电解法制取精铝
工业上用两类电解质体系:
(1)纯氟化物体系。其组成中AlF3 NaF BaF2 CaF2的质量分数分别48%,18%,10%,16%;密度(液态)约2.8g/cm3,熔点680℃,操作温度740 ℃。
(2)氯氟化物体系。其组成中AlF3 NaF BaCl2 NaCl的质量分数分别23%,13%,60%,4%;密度(液态)约2.7g/cm3,熔点700-720℃,操作温度760-800 ℃。
下层液体:阳极合金,30%铜与70%铝,密度3.4-3.7g/cm3.
中层液为电解质,纯氟化物和氯氟化物体系,密度2.7-2.8 g/cm3.
最上层精铝,用作阴极,密度2.3 g/cm3、
铝的电解精炼原理:
在阳极合金的各种金属元素当中,只有铝在阴极上溶解出来。阳极合金中,如铜、铁、硅之类比不活泼的金属元素,并不溶解,仍然残留在合金内。阳极上的电化学溶解反应是:Al - 3e = Al3+ 因此,电解液中除了原有的Al3+, Ba2+, Na+, F-, Cl-, AlF3-6, AlF4-之外,增加了上述反应中的铝离子Al3+。迁往阴极的各种阳离子中,铝的电极电位比较正,故Al3+优先在阳极上获得电子,析出金属铝:Al3+ + 3e = Al 而其余的各种阳离子,如Ba2+, Na+之类,并不放电。但是电解质本身所含的电位比铝更正的元素,例如Si和Fe,却会在阴极上析出,使铝的纯度降低
区域熔炼法制取高纯铝
基本原理:在铝的凝固过程中,杂质在固相中的溶解度小于在熔融金属中的溶解度,因此, 当金属凝固时, 大部分杂质将汇聚在熔区内.如果逐渐移动熔区, 则杂质会跟着转移,最后富集在试样的尾部.分离效果取决于元素的分配系数(固相浓度/液相浓度)
分配系数: 指杂质元素在固相中和在液相中的质量分配比率。
分配系数小于1的杂质元素在区域熔炼中富集在试样的尾部;分配系数大于1的杂质元素在区域熔炼中富集在试样的头部;分配系数等于1的杂质元素在区域熔炼中难以分离。
第2章镁冶金
2.几种重要的炼镁原料
在地壳中质量分数平均2.5%, 是地壳中第六种蕴藏量最丰富的金属.
A、碳酸盐
白云石MgCO3·CaCO3, 13% Mg
菱镁矿MgCO3 , 28% Mg
B、氯化物
光卤石MgCl·KCl·6H2O , 9%Mg
水氯镁石MgCl·6H2O , 12%Mg
C、氢氧化物
水镁石Mg(OH)2 ,42%Mg
D、硅酸盐
蛇纹石3MgO·2SiO2·2H2O 26%Mg
3. 热法炼镁
硅铁合金(含75%Si)在高温和减压下还原白云石中的MgO,得到纯镁和二钙硅酸盐渣的反应是:2(CaO·MgO(s)+ Si(Si –Fe)(s)= 2Mg(g)+ 2 CaO·SiO2(s)
Si + O2 = SiO2 2Mg + O2 = 2MgO 2MgO + Si = 2Mg + SiO2
2375℃, ?G0 = 0 这时候可能用Si还原MgO
镁的热法实际上是真空还原法, 采取温度1100 ~ 1250℃和真空度13.3~133.3Pa,可顺利还原出镁。真空除了能够降低还原的操作温度之外,还能防止还原剂硅和产品镁被空气氧化。镁的蒸馏效率计算公式
η镁= [产出的镁量/按硅量计算的镁量] ×100%
为什么使用75%的硅铁作还原剂?
85%、75%、45%和25%四种硅铁,其中,85% 的硅铁中的硅在合金组织中几乎全部是以游离硅存在;75%的硅铁中的硅是由游离硅和FeSi2存在;45%硅的硅铁是由FeSi2 和FeSi 组成;25%的硅铁完全是由FeSi 和Fe3Si2组成。
5.镁电解
镁电解的电流效率、电解槽槽型及电能消耗
(2) 电解槽槽型
有隔板槽和无隔板槽两种。
(3)镁电解中的电能消耗
W=U槽/0.4534·γ = 2.205×U槽/ γ (kWh/kg Mg)
U槽—槽电压(V)
第三章钛
1. 矿物资源
TiO2-FeO-Fe2O3三者可以可以形成无限固熔体,按照不同比例可形成多种化合物。已经发现的含钛1%以上的矿石有140多种,但有工业价值的只有十几种,其中工业应用的是:钛铁矿(FeTiO3)、金红石(TiO2)和白钛矿(CaTiSiO2)。
钛材有三大特点:
比强度大;耐腐蚀;温度适应范围广,在-253~500 ℃。
在航空、航天工业上应用。空中金属;
在化工(烧碱、造纸)、冶金(浸出槽、罐、管道、泵等)石油(开采、石化)等工业应用。陆地金属;
船舶制造、海水淡化、海洋石油开采等:前苏联建造的3000t级核潜艇6—7艘,用钛合金板制作双层壳体。这些核潜艇具有无磁性,下潜深度深(达900m)和航:速快等特点,每艘用钛560t;海上金属。
生产钛主要矿物原料是金红石和钛铁矿.
2.现行钛冶金工业的生产流程
现行钛工业生产根据产品不同分为两种类型:
第一类型:以金属钛为目标产品的海绵钛制取(占钛冶金总量的8%)-金属钛工艺;
第二类型:钛白生产.(占钛冶金总量92%)
不论Hunter法(钠还原)还是Kroll(镁还原)生产钛的过程, 都包括三个主要步骤、涉及二个循环:
(1)富钛料的制取。若用金红石为原料,这一步可省略。这一步的主要目的是尽可能除取钛铁矿中组分铁,提高原料中钛的品位。
(2)TiCl4的生产。这一步是将钛由氧化物形态转变成氯化物形态。包括氯化过程和粗TiCl4的精制、纯化过程。
(3)TiCl4的还原。这一步是将钛由氯化物还原为金属钛的过程。
(4)镁循环。内循环与外循环。
(5)氯循环。
产品:钛白、海绵钛、金属钛及其制品、钛铁合金、金属钛粉、人造金红石、四氯化钛、钛渣。
3. 钛铁矿精矿的还原熔炼预富集方法之一
富集含钛物料的原因
(1)在后续工序中,减少其他原料消耗,降低生产成本;
(2)减轻后续分离、净化、处理副产品工序的负担,简化工艺过程;
(3)增大设备单位容积的产能。
钛铁矿精矿还原熔炼原理:钛精矿中主要伴生FeO 和Fe2O3,由于钛和铁对氧的亲
和力不同,它们的氧化物生成自由焓有较大的差异,因此,经过选择性还原熔炼,分别获得生铁和富钛渣。固态还原过程(<1500K)
Fe2O3 + C = 2FeO +CO
Fe2TiO5 + TiO2 + C = 2FeTiO3 +CO
FeTiO3+TiO2=FeTi2O5(亚铁板钛矿)
FeTiO3 + C = Fe + TiO2 + CO
FeTiO3 + CO = Fe + TiO2 + CO2
CO2 + C = CO
4. 预处理方法二——从钛铁矿精矿生产人造金红石
人造金红石用途
(1)制造氯化钛的原料
(2)制备电焊条的涂料
主要方法
(1)选择氯化法
控制配碳量(约为精矿量的6~ 8 %),在800~1000 ℃下,钛铁矿中的铁被优先氯化并
挥发:FeO·TiO2(s) + C + 3/2Cl2(g) = FeCl3(g) + TiO2(s) +CO(g)
氯化后的固体料经过湿法除去过剩的碳和MgCl2, CaCl2, 磁选除去未被氯化的钛铁矿后,可获得TiO2的质量分数达90%以上的人造金红石。氯化过程在沸腾炉中进行。产生的FeCl3可回收利用。
(2)还原锈蚀法
将还原后的物料在酸性(NH4Cl的质量分数为 1.5~2%)水溶液中通空气搅拌,使铁变成Fe(OH)2,再进一步氯化变成铁锈(Fe2O3·H2O),呈细散粉末状,就很容易将其漂洗出来,获得的人造金红石中的TiO2的质量分数大于92%。
(3)酸浸法
盐酸法和硫酸法。
(4)其他方法
5. 四氯化钛的生产
氯化反应的物理化学基础
TiO2(s) + 2Cl2(g) = TiCl4(g) + O2(g)
△G0T = 199024 – 51.88T(J)
(298~1300K)
当1000K时,△G01000K = 147.1kJ
K P = pTiCl4·pO2/p2Cl2 = 2.06×10-8
由此求得系统在pO2=0.1MPa, pCl2=0.1MPa的条件下,四氯化钛平衡分压:
pTiCl4=2.06×10-9MPa。
因此,从反应热力学角度看,二氧化钛和氯气之间的反应不能自动进行。
但在有碳存在的条件下,二氧化钛的氯化反应在较低的温度(700-900 ℃)下即能顺利进行。其总反应式可表示为:
TiO2(s) + 2Cl2(g) + C(g)= TiCl4(g) + CO2(g)
△G0T = -194815 – 53.30T(J)
当1000K时,△G01000K = -248115 kJ
K P = pTiCl4·pCO2/p2Cl2 = 9.26×1012
说明反应可以自动进行。
6. 钛渣氯化的方法
在生产中有三种氯化的工艺方法,即固定床氯化、沸腾氯化和熔盐氯化。
7. 粗四氯化钛中的杂质
固体悬浮物和溶解于四氯化钛中的杂质
固体悬浮物: TiO2、SiO2、MgCl2、ZrCl4、FeCl2、C、FeCl3、MnCl2、CrCl3
可溶于四氯化钛的杂质
常温下为气体的:H2 O2 HCl Cl2 CO CO2 COCl2 COS
常温下为液体:S2Cl2 CCl4 VOCl3 SiCl4 CHCl3 CS2 CCl3COCl SnCl4
常温下为固体:AlCl3 FeCl3 NbCl5 TaCl5 MoCl5 C6Cl6 TiOCl2 Si2OCl6
8.提纯粗四氯化钛的方法
过滤法除取固体悬浮物;物理法(蒸馏或精馏)和化学法除取溶解杂质
蒸馏法是基于溶解在四氯化钛中的杂质的沸点与四氯化钛沸点的差别。在粗四氯化钛中质量分数大于0.1%的某些杂质化合物的沸点及在四氯化钛中的溶解度
10. 镁热还原法生产海绵钛
还原过程基本原理
用镁还原法生产金属钛是在密闭的钢制反应器中进行.将纯金属镁放入反应器中并充满惰性
气体,加热使镁熔化(650 ℃),在800~900 ℃下,以一定的流速放入TiCl4与熔融的镁反应。
TiCl4 +2Mg = 2MgCl2 +Ti △G01000K = -312.66kJ
原料
还原剂镁; 精TiCl4;氩气。
生产工艺
主体设备
还原反应器按有无内坩锅分两种;按排放氯化镁方式分为上排式、侧排式和下排式三种。
11.镁循环和氯循环
镁循环
外循环:在还原过程中排放出的氯化镁经熔盐电解制取金属镁后再度返回使用。
内循环:在蒸馏过程中所用的冷凝套筒在还原工序被用作内坩锅。
氯循环
镁电解副产品氯气用来四氯化钛生产,镁还原又得到氯化镁,循环使用。
12. 钛的精炼
电解精炼和碘化法精炼
电解精炼:钢制阴极,碱金属氯化物作电解质,含杂质粗钛制成棒状阳极;杂质元素与钛的析出电位不同,Ti2+ Ti3+ 形态转入熔液中,在阴极上发生低价钛离子还原成金属钛的电化学反应。电解是在800~850 ℃下进行。对铬、锰、铝、钒无能为力。电解精炼钛的纯度为99.6~99.8%。
碘化法精炼
钛在100~200 ℃与碘作用生成碘化钛蒸气:Ti(g) + 2I2(g) =TiI4(g)
碘化钛蒸气在1300~1500 ℃的钛金属丝上发生分解反应释放出来的碘在较低温取重新与粗钛反应,如此循环,由碘将纯钛输送到金属丝上。TiI4(g) = Ti(s) +2 I2(g)
第六章重金属冶炼
铁的硫化物FeS在高温下能与许多重金属硫化物形成共熔体即锍
4.造锍熔炼的基本原理
造锍熔炼的目的在于:使炉料中的铜以Cu2S的形态富集到冰铜当中;使部分硫被氧化以SO2烟气形式脱离;使炉料中的氧化物和氧化产生的铁氧化物形成炉渣,并与冰铜分离。因此,造锍熔炼属于氧化熔炼。
5.造锍熔炼时物料的物理化学变化
(1) 各类高价化合物及碳酸盐的离解(1200℃以上)
FeS2 = FeS + 0.5S2
FenSn+1 = nFeS + 0.5S2
2CuFeS2 = Cu2S +2FeS + 0.5S2
2CuS = Cu2S + 0.5S2
2Cu3FeS3 = 3Cu2S +2FeS + 0.5S2
3NiS = Ni3S2 + 0.5S2
2CuO =Cu2O + 0.5O2
CaCO3 = CaO + CO2
MgCO3 = MgO + CO2
在熔炼高温下,稳定的铜化合物物为Cu2S、Cu2O; 稳定的铁硫化物是FeS;稳定的镍硫化物
是Ni3S2.
(2) 硫化物氧化
FeS + 1.5O2 = FeO + SO2
FeS2 + 2.5O2 = FeO + 2SO2
3FeS + 5O2 = Fe3O4 + 3SO2
Cu2S + 1.5O2 = Cu2O + SO2
(3) 冰铜的形成
Cu2S + FeS = Cu2S·FeS
铜以Cu2S的形态与未被氧化的FeS及少量的其他金属硫化物形成的锍
通常冰铜中氧的质量分数约为3%,氧在冰铜中以FeO 和Fe3O4两种形态存在。
随着冰铜品位的升高,氧的含量降低;随二氧化硅含量增高,含氧量下降
选择冰铜含铜量是生产中的一个重要问题。含铜太低,会使后续的吹炼时间拉长、费用增加;太高则使炉渣中的含铜量增加,产生浪费。
火法优点:工艺成熟;生产规模大、效率高;可以综合回收自然资源
缺点:建设投资和生产费用高,能源消耗高,难处理低品位氧化矿及复杂难选矿。
湿法炼铜是在常压或高压下,用溶剂浸出矿石或焙烧矿中的铜,经净液使铜与杂质分离,而后用电积或置换等方法,将溶液中的铜提取出来。对氧化矿,大多数工厂用溶剂直接浸出;对硫化矿,一般先经焙烧然后浸出焙烧矿。
优点:成本低,环境污染轻,可处理不能处理的低品位矿或难选矿。
6.造锍熔炼炉渣及其特性
炉渣是炉料和燃料中各种氧化物的共熔体.
炉渣组成: FeO-SiO2-CaO、FeO-SiO2-Al2O3 和FeO-Fe2O3-SiO2渣系
炉渣的碱度定义:
M0 = [w(CaO) + w(MgO) +w(FeO)]/[w(SiO2 + w(Al2O3)]
M0 = 1的炉渣为中性渣;
M0 > 1的炉渣为碱性渣;
M0 < 1的炉渣为酸性渣。
7.造锍过程中杂质行为
贵金属元素:进入冰铜
FeO及精矿和熔剂中的脉石:进入炉渣
易挥发杂质及氧化物:富集于烟尘中
8.锍的吹炼
吹炼:冰铜中与熔剂在转炉中与鼓入的空气反应,使冰铜脱除铁与硫而转变为含铜达98%左右的粗铜。
吹炼目的:脱硫除铁
吹炼的目的:利用空气中的氧将锍中的铁和硫几乎全部除去,并除去部分杂质,以得到粗铜。分两个阶段:造渣期-主要进行硫化亚铁的氧化和造渣反应;造铜期-主要进行硫化亚铜的氧化反应以及硫化亚铜与氧化亚铜的相互反应,最终产出粗铜
锍中各组分在吹炼过程中的行为
A、FeS。FeS是锍的主要成分,可以氧化成FeO 和Fe3O4;无SiO2存在时,Fe3O4很难被FeS还原,而有SiO2存在时,Fe3O4与FeS 和SiO2反应生成2FeS ·SiO2的趋势大大增加。
B、Cu2S。吹炼的两个阶段:第一阶段:有FeS存在,Cu2O不能稳定存在。第二阶段:Cu2S 氧化成Cu2O, Cu2S与Cu2O反应生成金属铜.
7. 粗铜火法精炼
粗铜精炼的目的:除杂;综合回收利用
粗铜精炼过程包括火法精炼和电解精炼。火法精炼可将粗铜中部分杂质除去,并为电解精炼提供铜阳极
火法精炼是周期性作业,精炼过程在回转阳极炉或反射炉中进行
精炼周期包括装料、熔化、氧化、还原、浇铸五个阶段,其中氧化和还原是火法精炼的实质性阶段。
8. 电解精炼
电解精炼的目的:提高铜的性能;回收其中有价元素,尤其是贵金属和稀散金属。
电解精炼是以火法精炼产出的阳极板为阳极,以电解产出的薄铜片(始极片)为阴极,以硫酸铜和硫酸的水溶液为电解液,在直流电的作用下,阳极铜电化学溶解,溶液中铜离子在阴极上析出
锌冶金
1.炼锌的原料
硫化矿:闪锌矿(ZnS)、磁闪锌矿(nZnS·mFeS)等
氧化矿:菱锌矿(ZnCO3)、硅锌矿(ZnSiO4)异极矿
2.锌的生产方法
火法:火法炼锌是将焙烧所得到的焙砂在高温下用碳还原成锌蒸气,然后进一步蒸馏提纯得精炼锌。按冶炼设备不同可分鼓风炉、竖罐、电炉、平罐等炼锌方法。
湿法:湿法炼锌是用稀硫酸(即废电解液)浸出锌焙烧矿得硫酸锌溶液,经净化后用电积的方法将锌从溶液中提取出来。当前,湿法炼锌在工业上占主导地位,锌总产量的80%来自湿法炼锌。
湿法冶金
1.湿法冶金的原料,按矿物特性可分为:
自然金属矿物:铜、金、银矿,经还原焙烧的镍矿、合金废料等
硫化矿物:铜、镍、钴、锌的硫化矿,包括造锍熔炼产物—锍
氧化矿物:铜、镍氧化矿,包括经氧化或硫酸化焙烧后的铜、锌焙砂,钴黄铁矿烧渣,以及氧化烟尘,转炉渣等
砷化矿:砷钴矿,包括黄渣
湿法冶金包含下列几个连续过程
原料准备浸出净化提取金属
2.湿法炼铜是用溶剂浸出矿石使铜进入溶液,然后从含铜溶液中回收铜。此法主要用于处
理氧化矿石或低品位的氧化矿和硫化矿废矿石。湿法炼铜常用的溶剂有硫酸、氨、硫酸高铁等。选择溶剂除结合矿石成分和性质外,还必须根据脉石性质。对于含SiO2高的,宜采用酸性溶剂;对于含铁和碳酸钙(镁)高的,宜采用碱性溶剂;对于含硫化物和氧化物的混合矿石宜采用硫酸高铁酸性溶剂。
序号(学号): 有色金属冶金工艺的发展 一、摘要 摘要:我国经济在快速增长,各行业建设需要的大量金属材料推动着有色金属材料的生产持续增长。面对新的形势,传统的冶金技术和设备由于在生产、资源利用率、环境污染方面存在严重问题都要进行改进。现在,科学技术在自动化、信息化方面已有很大进步,如何把先进的科学技术用于改进落后的传统产业已经很重要。本文主要针对现代社会对有色冶金的需求、新型的有色金属冶金技术展开介绍,目的就是让读者能够了解到我国现在在有色冶金方面取得的突出成果以及了解我国未来的有色冶金发展方向。 关键词:有色冶金冶金工艺 Abstract: The rapid growth of China's economy, the industry needs a lot of construction materials to promote the production of non-ferrous metal materials continues to grow. Facing the new situation, the traditional metallurgical technology and equipment due to the production, resource utilization, environmental pollution has serious problems should be improved. Now, there are a lot of progress in science and technology automation, information technology, how can the advanced science and technology to improve traditional industries have been lagging very important. This article focused on the needs of modern society's non-ferrous metallurgy, non-ferrous metallurgy new technology to reduce environmental pollution and tailings disposal commenced introduction, the purpose is to allow the reader to understand that China is now the outstanding results achieved in terms of non-ferrous metallurgy and colored our understanding of the future metallurgical development. Keywords: ferrous metallurgy, metallurgical process
《有色金属冶金过程基础理论》课程教学大纲 开课单位:冶金工程系 课程负责人:夏文堂 适用于本科冶金工程专业 教学时数:40学时 一、课程概况 本课程是冶金工程专业有色金属冶金方向的一门专业基础课程,其原理部分是有色金属冶炼的基础,工艺学涉及从矿石原料冶炼到金属的全过程。通过本课程的学习,使学生具备有色金属火法冶金、湿法冶金、电冶金等方面的理论基础及专业知识。本课程的任务在于介绍各种有色冶金过程所遵循的内在规律,为改造老工艺、开发新工艺以及有预见性地控制现有生产提供理论依据。 本课程的先修课程主要有《冶金物理化学》、《冶金传输原理》等。 本课程的后续课程主要有《生产实习》、《毕业设计(论文)》等。 二、教学基本要求 通过本课程的学习,要求学生掌握火法冶金的焙烧、熔炼、吹炼和精练,湿法冶金的浸出、净化、沉积,电冶金的电解沉积、电解精炼和融盐电解等单元过程的基本原理,并运用这些基本原理对有色金属冶炼工艺进行分析和评述。通过本课程的学习使学生掌握有色金属冶炼的基本理论和工艺。 在每一章后习题中选择3~4题供学生练习,以加深学生对教材内容的理解,同时鼓励学生自己多做教材中的习题。 本课程为考试课,期末以闭卷方式考核。 三、教学内容及要求 1 硫化矿的火法冶金 教学内容:硫化矿火法冶金类型,金属硫化物的热力学性质,焙烧过程热力学、动力学及气相组成以及硫化矿的氧化富集造锍过程。 基本要求:掌握焙烧过程热力学分析以及硫化物氧化富集的基本原理。 重点:焙烧过程热力学分析以及硫化物氧化富集的基本原理。 难点:硫化物氧化富集的基本原理及氧化物还原在不同控制步骤时的收缩核动力学模型。 2 氧化物和硫化物的火法氯化 教学内容:概述、氯化反应的热力学、氯化反应的动力学。 基本要求:了解氯化冶金的定义、过程及分类,掌握氯化反应的热力学,了解氯化反应的步骤及动力学特征。 重点:氯化反应的热力学。 难点:氯化反应的热力学。 3 粗金属的火法精炼 教学内容:粗金属火法精炼的目的、方法及其分类,熔析精炼、萃取精炼、区域熔炼、蒸馏、氧化精炼以及硫化精炼的基本原理及步骤。 基本要求:掌握粗金属火法精炼方法分类及各种精炼方法的原理与区别。 重点:火法精炼原理。 难点:粗金属火法精炼原理。 4 湿法冶金浸出、净化和沉积 教学内容:湿法冶金反应热力学基础、浸出过程、离子沉淀、金属从水溶液中的沉积。 基本要求:了解湿法冶金优点,浸出分类;掌握湿法冶金反应的热力学基础,浸出过程的
1.金属是如何分类的?黑色金属宝库哪些? 答:有色金属和黑色金属两类。黑色金属包括:铁、铬、锰。 2.简述各种冶金方法及其特点? 答:(1)火法冶金。它是指在高温下矿石经熔炼与精炼反应及熔化作业,使其中的金属和杂质分开,获得较纯金属的过程。整个过程可分为原料准备、冶炼和精炼三个工序。过程所需能源主要靠燃料供给,也有依靠过程中的化学反应热来提供的。 (2)湿法冶金。它是在常温或低于100℃下,用溶剂处理矿石或精矿,使所要提取的金属溶解于溶液中,而其他杂质不溶解,然后再从溶液中将金属提取和分离出来的过程。由于绝大部分溶剂为水溶液,故也称水法冶金。该方法包括浸出、分离、富集和提取等工序。 3.钢铁冶炼的任务是什么? 答:在炼铁炉把铁矿石炼成生铁,再以生铁为原料,用不同方法炼成合格的钢,再铸成钢锭或连铸坯。 4.提取冶金学和物理冶金学? 答:提取冶金学:是研究如何从矿石中提取金属或金属化合物的生产过程,由于该过程伴有化学反应,故又称化学冶金。 物理冶金学:是通过成形加工制备有一定性能的金属或合金材料,研究其组成、结构的在联系,以及在各种条件下的变化规律,为有效地使用和发展特 定性能的金属材料服务。它包括金属学、粉末冶金、金属铸造、金属 压力加工等。 (3)电冶金:它是利用电能提取和精炼金属的方法。按电能形式可分为两类: 1) 电热冶金:利用电能转变成热能,在高温下提炼金属,本质上与火 法冶金相同。 2)电化学冶金:用化学反应使金属从含金属的盐类的水溶剂或熔体中 析出,前者成为溶液电解,如铜的电解冶炼,可归入湿法冶金;后者 称为熔盐电解,如电解铝,可列入火法冶金。 5.钢铁与的区别 答:钢和铁最根本的区别是含碳量不同。生铁中含碳量大于2%,钢中含碳量小于2%。钢的综合性能,特别是机械性能(抗拉强度、韧性、塑形)比生铁好得多,因而用途也比生铁广泛的多。 6.为什么要进行选矿?常用对选矿方法有哪几种? 答:选矿的目的主要是为了提高矿石品位; 常用的方法有:重力选矿法、磁力选矿法、浮游选矿法。 (1)重力选矿法:简称重选,是利用不同密度或粒度的矿粒在选矿介质中具有不同沉 降速度的特性,将在介质中运动的矿粒混合物进行选别,从而达到 使被选矿物与脉石分离的目的。 (2)磁力选矿法:简称磁选法。磁选法是利用矿物和脉石的磁性差异,在不均匀的磁
1.什么是湿法冶金?湿法冶金包括哪些过程? 在溶液中进行的冶金叫做湿法冶金。湿法冶金包括浸出、液固分离、净化、制备金属等过程。 2.什么是火法冶金?火法冶金包括哪些过程? 火法冶金是在高温条件下进行的冶金过程。火法冶金包括炉料准备、熔炼、火法精炼等过程。 3.湿法冶金和火法冶金相比各有什么特点? 火法冶金特点:反应速度快,设备产能大,成本低,但投资大,能耗高,污染也大。 湿法冶金特点:对原料适应力强,能够处理低品位的矿,回收率高;操作温度低,劳动条件好,能耗低;可直接制取纯化合物或纯金属;生产规模可大可小,因地制宜,成本低。 4.选矿的方法有哪些,其原理如何? 重选:利用被分选矿物颗粒间相对密度、粒度、形状的差异及其在介质运动速率和方向的不同,使之彼此分离的选矿方法 磁选:利用矿物颗粒磁性的不同来使矿物分离的选矿方法。 电选:根据矿物颗粒电性的差别,在高压电场中进行选别的选矿方法。 浮选:利用各种矿物原料颗粒表面对水的润湿性差异来进行选别的选矿方法。 化学选矿:利用矿物化学性质的不同,采用化学方法或物理相结合的方法分离和回收有用成份,得到化学精矿的选矿方法。 5.湿法炼铜适用于何种矿物?请简述湿法炼铜的工艺过程,常用浸出方法有哪 些? 湿法炼铜主要用来处理氧化矿、贫矿和残留矿,也可以用来处理硫化矿。工艺过程主要包括四个步骤,浸出、萃取、反萃取、金属制备(电积或置换)。 浸出方法有堆浸、槽浸、细菌浸出和高压氧浸出。 6.简述铜电解精炼过程中各类杂质的行为? ①锌、铁、镍、钴、铅等杂质,电极电位比铜更负,电解时均溶于电解液 中,但其中的铅离子会与硫酸根离子进一步生成难溶的硫酸盐而沉降进 入阳极泥。 ②金、银和铂族金属的电极电位比铜更正,几乎全部转入阳极泥,少量溶 解的银也会与电解液中的氯离子化合生成氯化银,沉入阳极泥。 ③硫、氧、硒、碲以Cu 2S、Cu 2 O、Cu 2 Se等形式存在于铜阳极中,电解时自 阳极板上脱落进入阳极泥。 ④砷、锑、铋等电极电位与铜相近的一类杂质,在电解时全部进入电解液。 7.简述火法炼铜的工艺流程及各个环节的任务和原理? ①造锍熔炼:把炉料中全部的铜富集在铜锍相,把脉石、氧化物、及杂质 汇集与熔渣相。原理:利用铜与锍的亲和力大于铁和一些杂质金属,而 铁与氧的亲和力大于铜的特性。 ②铜锍吹炼:把铜锍吹炼成含铜98.5%~99.5%的粗铜。原理:FeS氧化造渣 形成Cu 2S熔体,Cu 2 S继续氧化成Cu 2 O,同时与未氧化的Cu 2 S作用生成粗 铜。 ③火法精炼:除去粗铜中的铁、铅、锌、铋、砷、硫等杂质。原理:利用 杂质与氧的亲和力大与铜与氧的亲和力以及杂质氧化物在铜中溶解度小的特性。
名词解释 1、冰铜:冰铜是在熔炼过程中产生的重金属硫化物为主的共熔体,是熔炼过程的主要产物之一,是以Cu2S-FeS系为主并溶解少量其它金属硫化物、贵金属、铂族金属、Se、Te、As、Sb、Bi等元素及微量脉石成分的多元系混合物。 2、闪速熔炼:闪速熔炼是将经过深度脱水的粉状精矿,在喷嘴中与空气或氧气混合后,以高速度从反应塔顶部喷入高温反应塔内进行熔炼的方法。 3、碱性精炼:是加碱于熔融粗金属中,使氧化后的杂质与碱结合成盐而除去的火法精炼方法。 4、碱性炉渣: 5、酸性炉渣: 6、直接炼铅:利用硫化铅精矿粉料在迅速氧化过程中放出大量的热,将炉料 迅速熔化,产出液态铅和熔渣,同时产出少量的高So2浓度的烟气,使硫得以回收的冶金过程。 7、槽电压:阳极压降、阴极压降、母线压降、分解和极化压降、电解质压降的总和。 8、电流效率:是指在电解槽通过一定电量时,阴极实际析出的金属 实际沉积铜量??100?%量与理论应析出的金属量的百分比,理论沉积铜量9、沸腾焙烧:沸腾焙烧是强化焙烧过程的新方法,是使空气以一定速度自下而上地吹过固体炉料层,固体炉料
粒子被风吹动互相分离,其状态如同水的沸运动的粒子处于悬浮状态,并作不停的复杂运动, 腾,因此称为沸腾焙烧。 10、冰镍:熔有金属的硫化物熔体。 11、还原硫化熔炼:冰镍和冰铜相似,也是硫化物的熔体。由于这种熔炼方法是将矿石中的镍、钴和部分铁还原并使其硫化为金属硫化物与熔渣分开,故称还原硫化熔炼。 12、硬头:在还原熔炼时,少量的铁与锡一道被还原,生成各种成分的合金,称为硬头。 13、灰吹:将贵铅进行氧化熔炼 14、贵铅:工业上称Ag-Pb合金为贵铅。 15、氰化法:用含氧的氰化物溶液,浸出矿石或精矿中的金银,再从浸出液中回收金银的方法称为氰化法。 16、汞齐化:将汞与含金矿粉混合,磨细,使汞首先对金湿润,继而溶解金形成汞膏,汞膏组成由不均匀至均匀直至接近Au2Hg成分的 过程称为汞齐化,将金从含金矿石中提取出来的方法,称为混汞法。 17、炭浆法:用活性炭直接从氰化浸出矿浆中吸附金银的方法,称为炭浆法,该法不仅可省去传统氰化法中的液固分离工序,还有利于氰化浸出率的提高。 18、直接熔炼:金属硫化物精矿不经焙烧或烧结焙烧直接生产出金属的熔炼方法称为直接熔炼。 铜冶炼
有色金属行业基础知识 1.概述 1.1 有色金属的分类 有色金属是指铁、铬、锰三种金属以外所有的金属,包括:铜、铝、铅、锌、镍等常用金属;钨、钼、锡、锑等稀有金属;金、银等贵金属;铈、镧等稀土金属,以及硅、硒等半金属,共计64种元素。 国际上的研究机构大多数都将有色金属分为基本金属(Basemetals)、贵金属(Preciousmetals)、小金属(Minormetals)、稀土金属(rare earth metal)和半金属(semimetal)。基本金属包括铜、铝、铅、锌、锡、镍六种金属;贵金属包括金、银、铂、钯、钌、铑、锇、铱;小金属主要包括钨、钼、锑、钛、镁等;稀土金属包括包括镧系元素及性质相近的钪和钇,共17种元素。 1.2 有色金属的生产过程 有色金属的生产,包括地质勘探、采矿、选矿、冶炼和加工等过程。 地质勘探:“地质勘探”即是通过各种手段、方法对地质进行勘查、探测,需找、发现有工业意义的有色金属矿床,并查明矿产的质和量,以及开采利用的技术条件,提供矿山建设设计所需要的矿产储量和地质资料。 采矿:采矿是自地壳内或地表选择性地采集和搬运矿石的过程。绝大部分矿床用普通机械化方法开采。机械化开采又分为露天开采(包括
矿石和砂矿)和地下开采两大类。露天开采将矿体上覆的岩层剥离,然后自上而下顺次开采矿体。露天矿敞露地表,可以使用大型采矿机械,作业较安全,矿石损失少,贫化率低,生产能力大,采矿成本低,大型贫铁矿床和建筑材料矿床多用此法。当矿体赋存深度大,矿体厚度小,剥离工作量很大,其经济效益低于地下开采或需要保护地表和景观时,则用地下开采方法。赋存条件复杂,工业储量较小的有色和稀有金属矿床多用此法。 采矿的主要生产过程包括:①采准:在已经开拓完毕的矿床里,按开采方法的要求掘进采准巷道,将阶段划分成矿块作为独立的回采单元。②回采:将矿石崩落破碎,装入运输容器。地下回采包括落矿、出矿作业;露天回采包括穿孔、爆破和采装作业。③运输:将装入运输容器的矿石运交选矿厂或矿仓。 选矿:用物理或化学方法将矿物原料中的有用矿物和无用矿物(通常称脉石)或有害矿物分开,或将多种有用矿物分离开的工艺过程,又称“矿物加工”。 选矿的主要生产过程包括:①破碎:将矿山采出的矿块碎裂至粒度为 5~25mm的过程。②磨碎:以研磨和冲击为主。将破碎产品磨至粒度为10~300μm大小。③筛分和分级:按筛面筛孔的大小将物料分为不同的粒度级别称筛分,常用于处理粒度较粗的物料。按颗粒在介质(通常为水)中沉降速度的不同,将物料分为不同的等降级别,称分级,用于粒度较小的物料。筛分和分级是在粉碎过程中分出合适粒度的物料,或把物料分成不同粒度级别分别入选。④选别作业:矿物原料经粉碎作
第七章习题与思考题 1.计算下列反应的 ΔG θ 值: (1)MnO2+2Fe 2+ +4H + =Mn 2+ +2Fe 3+ +2H2O (2)Fe(OH)2+2H + +2e=Fe+2H2O (3)Fe(OH)2+2H + =Fe 2+ +2H2O 2. 当Zn(OH)2与纯水接触时,它将溶解到一定程度,并电 离成离子,试推倒当温度为298K时锌离子水解沉淀的平衡 条件。若 aZn 2+ =1,溶液的 PH=5.8 时,锌稳定存在是什么形 态? 3.当温度为 298K 时,反应Fe3++Ag=Fe2+Ag+的平衡常数 K=0.531,ε θ Fe 3+ /Fe 2+ =0.771V,试求 ε θ Ag+/Ag? 4. 金溶解于氰化物溶液中,形成稳定的Au(CN)2-配合离 子,其反应: Au(CN)2 - +e=Au+2(CN) - 已知 ε θ Au + /Au=1.68V,Au(CN)2-的 Kd=10 -38 ,试求 298K 时的 ε θ Au(CN)2 - /Au?
解答: 1.解:(1) ( ) KJ G G G G G G rG H Fe MnO O H Fe Mn 496 . 118 ) 0 4 ) 977 . 84 ( 2 534 . 430 ( ) 191 . 237 ( 2 ) 586 . 10 ( 2 43 . 223 4 2 2 2 2 2 2 3 2 298 - ′ + ′ + - - - ′ + - ′ + - = D + D + D - D + D + D = D + + + + q (2) + D - D - D + D = D H OH Fe O H Fe G G G G G 2 2 2 2 ) ( 298 q =0+2×(-237.191)-(-483.921)-2×0 =9.539KJ (3) + D - D - D + D = D + H OH Fe O H Fe G G G G G 2 2 2 2 ) ( 2 298 q =-84.977+2×(-237.191)-(-483.921)-2×0 =-75.438KJ 2.解:Zn(OH)2=Zn 2+ +2OH - K sp =[Zn 2+ ][OH - ] 2 =4.5×10 -17 H 2O=H + +OH - Kw=10 -14 (1) [Zn 2+ ][OH - ] 2 =K sp =4.5×10 -17 [H + ][OH - ]=Kw=10 -14 pH=-lg[H + ] 三式联立,得 Zn 2+ 开始沉淀的临界(平衡)pH 值为 pH=1/2lgK sp -lgKw-1/2loga Zn2+ =5.83- 1/2loga Zn2+ (2) pH=5.8 时,水解反应达到平衡 Zn 2+ 、Zn(OH)2 共存。 3.解: q q q ZFE K RT G p - = - = D ln ú ? ù ê ? é - - = - = + + q q q e e Ag Ag Fe Fe ZF K RT 3 ln
《有色冶金概论》复习题 4、铜的冶炼方法及工艺流程 答:有火法和湿法两大类;火法炼铜基本流程包括造锍熔炼、锍的吹炼、粗铜火法精炼或阳极铜电解精炼;湿法炼铜基本流程包括浸出、萃取。反萃、电积。 5、硫化铜精矿造锍熔炼的基本原理及两个过程的主要反应 答:利用铜对硫的亲和力大于铁和一些杂质金属,而铁对氧的亲和力大于铜的特性,在高温及控制氧化气氛条件下,使铁等杂质金属逐步氧化后进入炉渣或烟尘而被除去,而金属铜则富集在各种中间产物中,并逐步得到提纯。主要包括两个造渣和造锍两个过程主要反应:2FeS(l)+3O2(g) =2FeO(g)+2SO2(g);2FeO(g)+SiO2(s)= 2FeO·SiO2(l);xFeS(l)+yCu2S(l)= yCu2S·xFeS(l) 6、硫化铜精矿造锍熔炼的目的及必须遵循的两个原则 答:(1)造流熔炼的目的:①使炉料中的铜尽可能全部进入冰铜,同时使炉料中的氧化物和氧化产生的铁氧化物形成炉渣;②使冰铜与炉渣分离。(2)火法炼铜必须遵循两个原则:①必须使炉料有相当数量的硫来形成冰铜;②炉渣含二氧化硅接近饱和,以便冰铜和炉渣不致混溶 7、铜锍(冰铜)的吹炼的任务及实质是什么? 答:任务是将铜锍(冰铜)吹炼成含铜98.5%-99.5%的粗铜;实质是在一定压力下将空气送到液体冰铜中,利用空气中的氧将冰铜中的铁和硫几乎全部除去,并除去部分其它杂质:FeS氧化变成FeO与加入的石英熔剂造渣;而Cu2S则部分经过氧化,并与剩下的Cu2S相互反应变成粗铜。 8、铜锍(冰铜)的吹炼过程为分为哪两个两个周期?各周期的主要反应是什么? 答:造渣期:2FeS+3O2=2FeO+2SO2;2FeO+SiO2= 2FeO·SiO2;相加得总反应为2FeS+3O2+SiO2= 2FeO·SiO2+2SO2。造铜期:2Cu2S+3O2=2CuO+2SO2;Cu2S+2 Cu2O=6Cu+ SO2两式相加得总反应:Cu2S+O2=2Cu+ SO2 9、粗铜火法精炼的目的及原理是什么?粗铜火法精炼分为哪两个过程? 答:目的:部分除去粗铜中对氧亲和力较大的杂质;为电解精炼提供合乎要求的阳极铜,并浇铸成为表面平整、厚度均匀、致密的阳极板;以保证电解铜的质量和降低电解精炼的成本。每个周期包括加料熔化、氧化、还原和出铜浇铸四个基本阶段。原理:粗铜火法精炼的实质是使其中的杂质氧化成氧化物,并利用氧化物不溶于或极少溶于铜,形成炉渣浮在熔池表面而被除去;或者借助某些杂质在精炼作业温度(1100~1200℃)下,呈气态挥发除去。①氧化过程:铜首先被氧化:4[Cu] + O2 = 2[Cu2O] 生成的氧化亚铜溶于铜液中,在Cu2O与杂质元素接触时便将氧传递给杂质元素:[Cu2O] + [ M’] = 2[Cu] + [M’O];②还原过程主要还原Cu2O,常用的还原剂有:重油、天然气、液化石油气等。重油还原实际上是氢和一氧化碳对Cu2O的还原:Cu2O + H2 = 2Cu + H2O;Cu2O + CO = 2Cu + CO2 Cu2O + C = 2Cu + CO;4Cu2O + CH4 = 8Cu + CO2 + 2H2O 10、简述粗铜电解精炼的基本过程,分别写出阴阳及的主要反应。 答:铜的电解精炼是以火法精炼的铜为阳极,硫酸铜和硫酸水溶液为电解质,电铜为阴极,向电解槽通直流电使阳极溶解没在阴极析出更纯的金属铜的过程。根据电化学性质的不同,阳极中的杂质或者进入阳极泥或者保留在电解液中被脱出。阳极反应:Cu–2e = Cu2+;Me-2e=Me2+;H2O–2e =1/2 O2 + 2H+;SO42--2e =SO3 +1/2 O2阴极反应:Cu2+2e = Cu;2H++2e =H2;Me2++2e = Me 11、分析铜电解精炼和铜电积的电极反应有什么差别? 答:铜电解精炼阳极反应:Cu–2e = Cu2+;Me-2e=Me2+;H2O–2e =1/2 O2 + 2H+;SO42--2e =SO3 +1/2 O2阴极反应:Cu2+2e = Cu;2H++2e =H2;Me2++2e = Me;铜电积:铜的电积也称不溶阳极电解,以纯铜作阴极,以Pb-Ag(含Ag 1%))或Pb-Sb合金板作阳极,上述经净化除铁后的净化液作电解液。电解时,阴极过程与电解精炼一样,在始极片上析出铜,在阳极的反应则不是金属溶解,而是水的分解放出氧气。阴极:Cu2+ + 2e = Cu;阳极:H2O - 2e = 1/2O2 + 2H+ ;总反应:Cu2+ + H2O = Cu + 1/2O2 + 2H+
一选择题 1.高炉生产得产品有: A)生铁B)炉渣C)高炉煤气D)炉尘 2.高炉干式除尘得方法有: A)文氏管B)布袋除尘C)电除尘D)洗涤塔 3.高炉内对煤气阻力最大得区域为: A)块状带B)滴落带C)软熔带D)风口回旋区 4.炼钢过程得主要反应就是: A)碳得氧化B)硅得氧化C)锰得氧化D)磷得氧化 5.常用得氧枪喷头类型为: A)直孔型B)拉瓦尔型C)螺旋型D)扇型 6.炼钢终点控制主要控制: A)钢水成分B)钢水温度C)冶炼时间D)终渣量 7.碱性电弧炉炼钢按工艺方法可分为: A)双渣留渣法B)返回吹氧法C)氧化法D)不氧化法 8.氧枪得常用冷却保护介质为: A)水B)气态碳氢化合物C)燃料油D)植物油 9.采用顶吹氧底复合吹炼时,底部吹入得可能就是: A)N2 B)Ar C)O2 D)H2 10高炉中配加焦炭得作用就是: A)作还原剂B)燃烧后产生热量C)作料柱骨架,起支撑料柱作用D)氧化剂 1:A、B、C、D 2:B、C 3:C 4:A 5:B 6:A、B 7:B、C 8:A 9:A、B、C 10:A、B、C 二名词解释 1)冶金学2)热脆3)硫负荷4)烧结矿5)炉外精炼 1、冶金学就是一门研究如何经济地从矿石或其它原料中提取金属或金属化合物,并用一定 加工方法制成具有一定性能得金属材料得科学。 2、钢材在轧制与锻造时,由于温度升高,晶界上得富含硫化物得网状结构又变成液态,在力得作用下,就会引起这些富硫液相沿晶界滑动,造成钢材得破裂,产生了所谓得热脆现象 3、冶炼一吨生铁由炉料带入高炉硫得总量称为“硫负荷” 4、将各种粉状铁,配入适宜得燃料与熔剂,均匀混合,然后放在烧结机上点火烧结。在燃料燃烧产生高温与一系列物理化学变化作用下,部分混合料颗粒表面发生软化熔融,产生一定数量得液相,并润湿其它未融化得矿石颗粒。冷却后,液相将矿粉颗粒粘结成块。这一过程叫就是烧结,所得到得块矿叫烧结矿。 5、炉外精炼就是对炼钢炉得钢水在钢包或专用容器中进行再次精炼,又称“二次精炼”。包括对钢水得温度、成分进行调整,进一步去除有害元素与夹杂物,使钢水达到洁净、均匀与稳定。 三填空 1 钢铁工业得主要污染包括、与。 2 渣中与浓度之比值称为炉渣碱度。 3 氧从气相进入金属液有与两种途径。 4 在烧结过程中,烧结料沿料层高度方向由上到下依次分为,,,,。 5 高炉冶炼过程中送往高炉得热风就是由提供得。 6 钢液浇铸得任务就是,常用得方法就是。
1简述冶金学科(冶金方法)的分类; 冶金学分类: 提取冶金学和物理冶金学 2几种典型提炼冶金方法的一般流程及特点; 火法冶金: 火法冶金的工艺流程一般分为矿石准备、冶炼、精炼3个步骤。 湿法冶金: 其生产步骤主要包括:浸取、分离、富集和提取。 水法冶金的优点是环境污染少,并且能提炼低品位的矿石,但成本较高。主要用于生产锌、氧化铝、氧化铀及一些稀有金属。 电冶金:利用电能从矿石或其他原料中提取、回收和精炼金属的冶金过程。 粉末冶金:粉末冶金由以下几个主要工艺步骤组成:配料、压制成型、坯块烧结和后处理。对于大型的制品,为了获得均匀的密度,还需要采取等静压(各方向同时受液压)的方法成型。 粉末冶金在技术上和经济上有以下特点: (1)可生产普通熔炼方法无法生产的特殊性能材料,如多孔材料、复合材料等;可避免成分偏析、保证合金具有均匀的组织和稳定的性能; (2)可生产高熔点金属(如钨和钼)和不互熔的合金(如钨-银合金); (3)可大量减少产品的后续机加工量,节约金属材料,提高劳动生产率。这一点对贵重金属尤其重要; (4)粉末冶金零件的缺点是塑性和韧性较差。 3. 简述有色金属提取的特点; 有色金属提取工艺的特点:1)有色金属矿物的品位低,成分复杂。2)提取方法多,分火法和湿法。 4. 简述有色金属火法、湿法提取工艺的分类。 火法: (1)焙烧(氧化焙烧、还原焙烧、硫酸化焙烧、氯化焙烧、煅烧、烧结焙烧); (2)熔炼(造锍熔炼、还原熔炼、氧化熔炼、熔盐电解、反应熔炼,吹炼); (3)精炼(氧化精炼、氯化精炼、硫化精炼、电解精炼)。 湿法: (1)浸出 按浸出的溶剂分为:碱浸、氨浸、酸浸、硫脲浸出、氰化物浸出,等; 按浸出的方式分为:常压浸出、加压浸出、槽浸、堆浸、就地浸出,等。 (2)净化:水解沉淀净化、置换净化、气体还原(氧化)净化,等。 (3)沉积:置换沉积、电解沉积、气体还原沉积。 5. 判断下列金属那些属于稀有金属、轻金属、重有色金属及贵金属 6. 金属铝、铜、金、银的主要物理化学性质? 铜的性质: 物理性质铜呈玫瑰红色,特点是展性和延性好;导电、导热性极佳,仅次于银;无磁性;不挥发;液态铜流动性好等。熔点:1083℃。密度:8.96 g/cm3 铜的蒸气压很小,在熔点温度下仅为9×10-5Pa。高温下,液体铜能溶解氢、氧、二氧化硫、二氧化碳、一氧化碳等气体。凝固时,溶解的气体又从铜中放出,造成铜铸件内带有气孔,影响铜的机械性能和电工性能。 化学性质铜在干燥空气中不起变化,但在含有二氧化碳的潮湿空气中则能氧化形成碱式碳酸铜(铜绿)的有毒薄膜。加热至185℃,铜在空气中开始氧化,高于350℃氧化生成Cu2O和CuO。因铜为正电性元素,故不能置换酸(盐酸和硫酸)中的氢,而仅能溶于有氧化作用的酸如硝酸和有氧化剂存在时的硫酸中。铜能溶于氨水及与氧、硫、卤素等化合。 铝的性质
冶金概论题库 一、填空题 1、从矿石中提取金属的方法可归结为三种:火法冶金、湿法冶金、电冶金,其中电冶金按电能形式分为电热冶金和电化学冶金。冶金分类:钢铁冶金和有色金属冶金。 2、炼钢原材料(高炉炼铁原料)主要由铁矿石、溶剂和燃料组成。 3、铁矿石入炉前处理步骤包括破碎和筛分、焙烧、混匀、选矿。选矿包括重选、磁选和浮选。 4、非高炉炼铁按工艺特征、产品类型及用途分为直接还原法和熔融还原法。 5、高炉炼铁常用铁矿石有赤铁矿、磁铁矿、褐铁矿和菱铁矿。 6、高炉炼铁主要产品是生铁,副产品是炉渣、高炉煤气及其带出的炉尘。 7、高炉炼铁其主体设备除了高炉本体以外,还包括炉后供料和炉顶装料系统、送风系统、煤气除尘系统、渣铁处理系统和喷吹系统等。 8、转炉炼钢原材料按性质分类,可分为金属料、非金属料和气体。金属料包括铁水、废钢、铁合金、直接还原铁及碳化铁,非金属料包括石灰、白云石、萤石、合成造渣剂,气体包括氧气、氮气和氩气等。按用途分类,可分为金属料、造渣剂、化渣剂、氧化剂、冷却剂和增碳剂等。 9、火法炼铜主要工艺步骤包括四个主要步骤,即造镏熔炼、铜镏吹炼、火法精练和电解精练。 10、从矿石中提取氧化铝的方法分为酸法和碱法两大类,酸法未能在工业中应用,碱法分为拜耳法、碱石灰烧结法和拜耳-烧结联合法,其中以拜耳法为主。 11、冶金工业废气治理方法分为冷凝法、吸收法、吸附法、燃烧法和催化转化法。 12、冶金工业固体废物对人类环境造成的危害主要表现在:侵占土地、污染土壤、污染水体和污染大气。 二、简答题 1、高炉炉渣有什么作用,它是如何形成的? ①渣铁之间进行合金元素的还原及脱硫反应,起着控制生铁成分的作用。比如,高碱度渣能促进脱硫反应,有利于锰的还原,从而提高生铁质量;SiO%含量高的炉渣促进Si的还原,从而控制生铁含Si量等。②炉渣的形成造成了高炉内的软熔带及滴落带,对炉内煤气流分布及炉料的下降都有很大的影响,因此,炉渣的性质和数量对高炉操作直接产生作用。③炉渣附着在炉墙上形成渣皮,起保护炉衬的作用。但是另一种情况下又可能侵蚀炉衬,起破坏性作用。因此,炉渣成分和性质直接影响高炉寿命。 形成原因:炼铁所用的铁矿石中金属铁的品位一般都不会太高,含有其它矿物,在炼铁的时候由于密度差异这些杂质会上浮,再通过渣铁分离,分离出的渣即为炉渣。
铜冶金 1.铜的生产方法:火法炼铜(主要炼铜方法),湿法炼铜 火法炼铜生产步骤主要包括:造锍熔炼,铜锍吹炼,火法精炼,电解精炼 2.造锍熔炼的基本原理:利用高温下,铜对硫的亲合力大于铁,而铁对氧的亲合力大于铜的特性,在高温及控制氧化气氛条件下,使铁等杂质金属逐步氧化后进入炉渣或烟尘而被除去, 而金属铜则富集在各种中间产物中,并逐步得到提纯。 3.造锍熔炼的目的:①把炉料中全部的铜富集在铜锍相,把脉石、氧化物及杂质汇集于熔渣相②铜锍相与熔渣相完全分离。 4.工艺原则:①炉料有相当数量的硫来形成铜锍②炉渣含二氧化硅接近饱和,铜锍和炉渣不致混溶 5.硫过量机理:当炉料中有足够的硫时,在高温下由于铜对硫的亲和力大于铁,而铁对氧的亲和力大于铜,故FeS能使铜硫化,FeS+Cu2O=FeO+Gu2S 6.SiO2机理:当熔炼体系中没有SiO2时,铜锍和炉渣结合成共价键的Gu-Fe-S-O相,铜锍与炉渣高度混熔。当有SiO2时,它与FeO反应形成离子型的炉渣相,2FeO+3SiO2=2Fe2++Si3O84-铜锍不与SiO2作用而保留为共价键Cu-Fe-S相。这样就使铜锍与炉渣明显分层。 7.铜锍品位的选择:铜锍中铜的质量分数称为铜锍品位。铜锍的品位并不是越高越好。太低会使后续吹炼时间拉长、费用增加;太高则使炉渣中的含铜量增加,产生浪费。(喷吹定律w(Gu)%/w[Gu]%=KGu,同在熔渣和铜锍两相之间的平衡浓度比是一个常数。)铜锍品味越高,铜在渣中损失越大。 8.铜锍成分:由Gu2S和FeS组成的合金,其中还含有Ni,Co,Pb和脉石成分以及2%-4%氧 9.在铜锍中还有一部分FeS被Fe3O4所取代,这也是实际铜锍含量比理论要低的原因,氧是铜锍中的有害成分,铜锍品位越低氧含量越高。 10.炉渣中化合物的性质:组成炉渣的氧化物可以分为酸性和碱性。酸性氧化物有SiO2,碱性氧化物有FeO,CaO,MgO,ZnO,MnO,BaO,中性氧化物Al2O3,它在酸性渣中呈碱性,碱性渣中呈酸性。 11.硅酸度:炉渣的酸碱性可以用硅酸度来表示。硅酸度是指炉渣中结合成SiO2的氧原子物质的量,n0(SiO2)与结合成碱性氧化物的氧原子物质的量n0(∑MeO)之比。酸性渣的硅酸度一般大于1,碱性渣一般小于1。 12.炉渣含铜损失:化学损失、物理损失、机械损失(占的比重大) 13.造锍熔炼:①传统方法:在鼓风炉、反射炉和电炉等传统冶金炉内进行。②悬浮熔炼,如奥托昆普闪速熔炼,熔池熔炼,如白银法※ 14.铜精矿的闪速炉熔炼:闪速熔炼是一种将具有巨大表面积的硫化铜精矿颗粒熔剂与氧气,富氧空气或预热空气一起喷入赤热的炉膛内,使炉料在漂浮状态下迅速氧化和熔化的熔炼方法。 15.炉渣贫化:①电炉贫化法:电路贫化利用电能加热熔融炉渣,并在还原剂的作用下将渣中Fe3O4还原成FeO,降低了熔融炉渣的黏度,以利于铜渣分离,与此同时,在硫化剂的洗涤下,使渣中的铜硫化成铜锍,并加以回收。②浮选贫化法③闪速炉直接弃渣法 16.铜锍的吹炼:吹炼的实质是在一定压力下,将空气中送到液体铜锍中,使铜锍中FeS氧化成FeO并与加入的石英或CaO熔剂造渣,Gu2S则与氧化生成的Gu2O发生相互反应而变成粗铜。第一周期(造渣期):除去熔锍中全部的铁以及与铁化合的锍。 第二周期(造铜期):进一步氧化,脱除残存的锍,生产金属铜的过程。 17.铜锍吹炼的温度热制度:吹炼低品位铜锍时,温度通常容易过高,而吹炼高品位铜锍时,则出现热量不足,因此铜锍品位控制以不超过50%-60%为限。
有色金属冶金学 Nonferrous Metals Metallurgy 课程编号:07310710 学分:3 学时:45 (其中:讲课学时:45 实验学时:0 上机学时:0)先修课程:无机化学、物理化学、冶金物理化学、传输原理、湿法冶金原理 适用专业:冶金工程材料成型及控制工程 教材:《有色金属冶金学》;邱竹贤主编;冶金工业出版社,2006 开课学院:材料科学与工程学院 一、课程的性质与任务 课程性质:必修课。 有色金属冶金是GB/T 13745-2009《学科分类与代码》中与冶金物理化学、钢铁冶金等并列的二级学科之一,学科代码45040。 本课程是冶金工程专业学生有色冶金方向的重要专业课。 通过本课程的教学,要求本科生掌握常用有色金属的冶炼工艺、原理、主体设备的构造和技术经济指标控制,使学生了解常用有色金属产品及其原料的性质、用途以及有色金属冶炼工艺的发展动态; 拓宽并提升学生在提取冶金及无机盐化工等领域的知识面和业务能力,为其今后从事或涉及有色金属生产技术或相关新产品开发,以及开展环境保护和资源综合利用工作奠定基础。 课程基本任务是: 1.掌握典型有色金属冶炼主要工艺及设备的原理与特点、冶炼方法与目的; 2.针对具体适用有色金属的冶炼要求,学习选择最优化的有色金属冶金工艺; 3.促进有色金属产品之高效、优质、低耗、环保的绿色制造理念的树立和新工艺新产品的开发。 二、课程的内容及要求 前言有色冶金基础知识 1.教学内容 (1)本课程的性质、研究对象与方法、目的、任务; (2)本课程的学习方法、授课计划、参考资料、考核要求; (3)本课程的发展及在冶金学科的地位,GB/T 13745-2009《学科分类与代码》; (4)有色冶金基础知识,金属分类及有色冶金单元过程。 2.基本要求
《冶金概论》课程教学大纲 开课单位:冶金工程教研室 课程负责人:吕俊杰 适用于本科金属材料工程专业 教学时数:32学时 一、课程概况 《冶金概论》课程是为金属材料工程专业学生开设的一门专业任选课。本课程的任务是:通过本课程教学,使金属材料工程专业的学生了解冶金工程中金属冶炼的基本理论与方法,冶金工业的基本工艺流程,为学生将来更好地发挥本专业的技术特长打下冶金行业知识基础。本课程对于金属材料工程专业学生拓展知识面,完善知识结构,成长为复合型人才有非常积极的意义。 本课程的先修课程主要有《高等数学》、《物理化学》、《冶金原理》、《冶金传输原理》、《金属学及热处理》等。 本课程的后修课程主要有《表面工程设备与设计》、《金材或表面设备与设计课程设计》、《金属基复合材料》等。 二、教学基本要求 本课程简要介绍了冶金工业概况,炼铁、炼钢、钢液炉外精炼、钢液浇注、轧钢、常见有色金属冶金及粉末冶金的基本原理和主要工艺,以及相应的冶金新工艺技术概况。重点介绍钢铁生产的基本原理、主要工艺及设备。注重理论与实践的结合,力求全面,实用。学生通过本课程的学习,可以了解和掌握钢铁冶金和有色金属冶金的基本原理及工艺,认识冶金工业通用设备。 三、教学内容及要求 1.绪论 教学内容:冶金的基本概念、冶金方法、主要冶金过程简介、冶金工业在国民经济中的地位、冶金工业发展趋势。 基本要求:了解冶金工业在国民经济中的地位与作用和冶金工业发展简史,掌握当前全球冶金工业生产概况。 重点:全球冶金工业生产概况。 难点:冶金工业发展简史。 2.高炉炼铁 教学内容:铁矿石和熔剂、高炉用燃料、高炉冶炼产品和技术经济指标、高炉冶炼基本原理、高炉及附属设备的结构和作用、高炉操作、铁水预处理、炼铁技术的发展。 基本要求:了解高炉炼铁原料、理解高炉冶炼基本原理和操作工艺,掌握高炉冶炼产品及主要技术经济指标。 重点:高炉炼铁原料和高炉产品。 难点:高炉炼铁基本原理。 3.炼钢 教学内容:炼钢基本原理、炼钢原料生产、氧气转炉炼钢技术、电炉炼钢技术、钢液炉外精炼技术、钢液浇铸技术、炼钢新技术。 基本要求:了解各种炼钢主要过程,理解炼钢基本原理,掌握各种炼钢技术的特点。 重点:炼钢技术的特点。 难点:炼钢基本原理。 4.轧钢 教学内容:轧钢概述、轧钢基本原理、轧钢主要设备、各种钢材的生产、轧钢产品标准和技术经济指标、轧钢新技术。
有色冶金学期末复习资料 I :名词解释 铝硅比:在氧化铝生产中评价铝土矿的质量即以铝土矿中氧化铝和氧化硅的质量比为标准。 电流效率:通常以铝的实际产量在理论产量中所占的百分数。 槽电压:阳极母线至阴极母线之间的电压降,它由与电解槽并联的直流电压来指示。 熔析法除铜:是基于在低温下铜及其砷化物和锑化物在铅水中的溶解度降低的原理。 极距:指阴阳两极之间的距离。 银锌壳:锌对银具有很大的亲和力,形成的化合物比重小,熔点高,且不溶于被锌饱和的铅液中,而以固体银锌壳浮于铅面,与铅分离。 II :解答题 1:拜耳法生产氧化铝的工艺流程及特点? 答:直接利用含有大量游离苛性碱的循环母液处理铝土矿,溶出其中氧化铝得到铝酸钠溶液,并用加氢氧化铝种子分解的方法,使铝酸钠溶液分解析出氢氧化铝结晶。种分母液经蒸发后返回用于熔出铝土矿。 特点:拜耳法比较简单,能耗低,产品质量高,成本低,但只限于处理较高品味的铝土矿(A/S 应大于7) 2:烧结发生产氧化铝的工艺流程及特点? 答:烧结发是在铝土矿中配入石灰石(或石灰),纯碱(含大量碳酸钠的碳分母液),在高温下烧结而得到含有固态铝酸钠的熟料,用水或稀碱溶液溶出熟料,得到铝酸钠溶液。经脱硅净化的铝酸钠溶液用碳酸化分解(向溶液中通入二氧化碳气)使溶液中的氧化铝成氢氧化铝结晶析出。碳分母液经蒸发后返回用于配制生料浆。 特点:烧结发工艺较复杂,能耗高,产品质量和成本不及拜耳法,但它可以处理低品位的铝土矿(A/S 比应大于3.5) 3为什么不能用中和水解的方法除去锌浸出液中的铜,镉,钴杂质? 答:α+2Zn =1 10-时,锌的溶解度线是在PH=5.96.即2)(OH Zn 沉淀的PH 比铜,镉,钴的氢氧化物沉淀PH 还低,所以用中和水解净化法不能将铜,镉,钴除去。 4铝土矿高压溶出时添加石灰的作用? 答:①消除含钛矿物的有害作用,显著提高32O Al 的溶出速度和溶出率; ②促进针铁矿转变为赤铁矿,使其中的氧化铝充分溶出,并使赤泥的沉降性能得到改善; ③活化一水硬铝石的溶出反应; ④生成水化石榴石,减少O Na 2损失,降低能耗。 5:粗铜火法精炼的目的和原理? 答:原理:铜中多数杂质对氧的亲和力都大于铜对氧的亲和力,且杂质氧化物在铜中的溶解度很小,当空气通入铜熔体时,杂质便优先氧化被除去。 目的:①除去粗铜的部分杂质; ②为电解精炼提供优质的铜阳极。 6:铜电解精炼和铜电积两者的电极反应有什么差别?
有色金属冶金 一、专业介绍 1、学科简介 有色金属冶金是冶金工程下的一个二级一门研究从矿石、二次资源等原料中提取金属或化合物,并制成具有一定使用性能和经济价值产品的工科技术学科。有色金属学科的研究对象主要是复杂的多相化学反应规律,以便能定量的确定反应的方向和限度,反应实际发生速率与影响因素,以及化学反应速率与相关的动量、热量、质量传递相互间的作用,在此基础上,进而对反应器进行优化设计和过程实现自动控制。其研究领域包括火法冶金、湿法冶金、电冶金、材料化学冶金、冶金分离过程。 2、培养目标 在冶金物理化学、计算化学、分离科学、化学反应工程学、材料学等方面具有坚实的理论基础和系统的专业知识。具有初步的从事有色金属的提取、资源再生综合利山、冶金过程“三废”治理及有色金属车产品开发等方面技术工作的能力。铰为熟练地掌握一门外国话,能阅读本专业的外文资料。硕士论文在理论上应有新见解,或在方法和技术上有所改进。能在生产企业、高等学校、科研机构从事本学科及相近学科的教学、科研、工程设计和生产管理等工作。 各招生单位研究方向、考试科目、课程设置等不尽相同,在此以不同学校举例说明: 3、研究方向(以东北大学为例)
01有色金属冶金新理论新技术 02有色金属资源生态化综合利用 03冶金过程自动化与冶金反应器 04特殊冶金(生物冶金、自蔓延技术)等 05先进材料制备技术 4、硕士研究生入学考试科目(以东北大学为例) ①101思想政治理论②201英语一或202俄语或203日语③301数学一④830冶金物理化学或831化工原理 5、课程设置(以昆明理工大学为例) 学位课: 自然辩证法、第一外语(基础部分)、冶金热力学、冶金动力学、数学物理方程 必修课: 科学社会主义理论与实践、现代冶金分析技术、数理统计及随机过程 选修课: 冶金新技术、湿法冶金、火法冶金、真空冶金、微波化学、冶金电化学、冶金反应工程学、粉体工程、计算冶金及模式识别应用、冶金传输原理、冶金熔体物理化学、金属分步结晶精炼导论、有色金属新材料、等离子体冶金、有色金属冶金学Ⅱ、萃取化学、提取冶金中的综合利用、生物冶金、络合物化学、高压浸出技术、流体力学、冶金过程数学模型、热力学数据库及其应用、微波加热在冶金及材料中