
物化复习重点在公式,技巧在分类。大类可分为:热力学基础理论(2、3两章),热力学应用(4、5、6),电化学(8、9、10),动力学(11、12),表面化学(13、14),统计热力学(7不重要)。
热力学基础理论这部分,一般就一题可以全部概括,求一个题(分好几问)的Q、W、△U、△S、△H、△G、△A,其中在算S时要设计可逆过程但计算时所用公式都是不用管是否可逆的
(注意成立条件和使用条件的区分)
,还要分清S
环境和S
体系
,求S
体系
一定是可逆过程,但S
环境
不是可逆是实际过程的
熵变,△U、△H、△G、△A一般只求一次,因为对于不同途径相同始、终态则变化数值相同,在求△U、△H、△G、△A时要注意其中是否经过相态的变化!化学反应的△U、△H的求法与无化学反应的求法不同。对于这块的证明题,要抓住基本定义、基本公式,还有Maxwell关系,
学会两个数学方法(第一全微分的性质(物化课本上册P455);第二是归一化关
系即()。
第二部分:热力学的应用重点就是化学势和相图的问题。化学势中掌握稀溶液的两个经验定律,以及稀溶液依数性的关联式:
(1.1)
vap m fus m
A A A
A
A b b f f
H H
P P V
1111
ln a
P R T T R T T RT
*
***
D D
-P -==(-)=(-)=
以及:
二组分相图中重点掌握(见南大课后习题解答那本书P228-P231)。还有
化学平衡那章掌握基本的就行了。
电化学部分:第8章在于计算迁移数以及使用稀释定律和德拜-休克尔公式。以
后的全部内容按物理化学解题指导的基本公式和内容提要复习就行了。
在动力学中有个小重点就是关于稳态近似法要搞透,山大老师喜欢出题。胶体了
解就行。
统计热力学记清楚分子的配分函数和平衡函数的统计热力学算法,还有一个就
是考虑简并度和不考虑简并度是q的算法。
有机分为五大题型:写化学反应式、合成、机理、推断、选择(有机化学的
理论部分(例如关于立体化学、碳正离子稳定性、碳负离子稳定性、化合物酸碱
性、熔沸点比较、共振结构问题(判断稳定性、判断共振结构是否正确等)、芳
香性及芳香性大小的判断))。
按化合物分烷烃和不饱和烃;卤代烃、醇、醚;芳香族化合物;醛、酮、羧
酸、羧酸衍生物;周环反应;重排。
中国农业大学研究生入学考试复习资料 《生物化学》重点大题 1.简述Chargaff 定律的主要内容。 答案:(1)不同物种生物的DNA 碱基组成不同,而同一生物不同组织、器官的DNA 碱基组成相同。(2)在一个生物个体中,DNA 的碱基组成并不随年龄、营养状况和环境变化而改变。 (3)几乎所有生物的DNA 中,嘌呤碱基的总分子数等于嘧啶碱基的总分子数,腺嘌呤(A)和胸腺嘧啶(T) 的分子数量相等,鸟嘌呤(G)和胞嘧啶(C)的分子数量相等,即A+G=T+C。这些重要的结论统称 为Chargaff 定律或碱基当量定律。 2.简述DNA 右手双螺旋结构模型的主要内容。 答案:DNA 右手双螺旋结构模型的主要特点如下: (1)DNA 双螺旋由两条反向平行的多核苷酸链构成,一条链的走向为5′→3′,另一条链的走向为3′→5′;两条链绕同一中心轴一圈一圈上升,呈右手双螺旋。 (2)由脱氧核糖和磷酸构成的骨架位于螺旋外侧,而碱基位于螺旋内侧。 (3)两条链间A 与T 或C 与G 配对形成碱基对平面,碱基对平面与螺旋的虚拟中心轴垂直。 (4)双螺旋每旋转一圈上升的垂直高度为3.4nm(即34?),需要10 个碱基对,螺旋直径是2.0nm。(5)双螺旋表面有两条深浅不同的凹沟,分别称为大沟和小沟。 3.简述DNA 的三级结构。 答案:在原核生物中,共价闭合的环状双螺旋DNA 分子,可再次旋转形成超螺旋,而且天然DNA 中多为负超螺旋。真核生物线粒体、叶绿体DNA 也是环形分子,能形成超螺旋结构。真核细胞核内染色体是DNA 高级结构的主要表现形式,由组蛋白H2A、H2B、H3、H4 各两分子形成组蛋白八聚体,DNA 双螺旋缠绕其上构成核小体,核小体再经多步旋转折叠形成棒状染色体,存在于细胞核中。 4.简述tRNA 的二级结构与功能的关系。 答案:已知的tRNA 都呈现三叶草形的二级结构,基本特征如下:(1)氨基酸臂,由7bp 组成,3′末端有-CCA-OH 结构,与氨基酸在此缩合成氨基酰-tRNA,起到转运氨基酸的作用;(2)二氢尿嘧啶环(DHU、I 环或D 环),由8~12 个核苷酸组成,以含有5,6-二氢尿嘧啶为特征;(3)反密码环,其环中部的三个碱基可与mRNA 的三联体密码子互补配对,在蛋白质合成过程中可把正确的氨基酸引入合成位点;(4)额外环,也叫可变环,通常由3~21 个核苷酸组成;(5)TψC 环,由7 个核苷酸组成环,和tRNA 与核糖体的结合有关。 5.简述真核生物mRNA 3′端polyA 尾巴的作用。 答案:真核生物mRNA 的3′端有一段多聚腺苷酸(即polyA)尾巴,长约20~300 个腺苷酸。该尾巴与mRNA 由细胞核向细胞质的移动有关,也与mRNA 的半衰期有关;研究发现,polyA 的长短与mRNA 寿命呈正相关,刚合成的mRNA 寿命较长,“老”的mRNA 寿命较短。 6.简述分子杂交的概念及应用。 答案:把不同来源的DNA(RNA)链放在同一溶液中进行热变性处理,退火时,它们之间某些序列互补的区域可以通过氢键重新形成局部的DNA-DNA 或DNA-RNA 双链,这一过程称为分子杂交,生成的双链称杂合双链。DNA 与DNA 的杂交叫做Southern 杂交,DNA 与RNA 杂交叫做Northern 杂交。 核酸杂交已被广泛应用于遗传病的产前诊断、致癌病原体的检测、癌基因的检测和诊断、亲子鉴定和动
前天刚刚复试结束,现在已经成功上岸,所以想趁着自己还有记忆,来介绍一下自己的学习经验和复试经历,以供后面的学弟学妹参考,让大家少走弯路,早日实现梦想。文笔不好请大家见谅,理工生真的是有什么说什么的。 复试 我也做了很多准备,大多也是参照了网上学长学姐的经验贴。 1.我报的是物化,所以只把物化书本看了2遍,把重点习题做了一遍,做习题的原因是单看书太无聊了,而且不动脑感觉有些东西你总想不起来,思路不像刚考初试那样活跃。 2.买了一本复旦用的物化实验书,网上买的二手10来块钱。每个方向都重点看了2个实验,比如热力学看了饱和蒸汽压的测量、气液相图绘制,动力学方向看了旋光法测蔗糖转化的反应速率等等,我总共看了8个左右。 3.了解之前联系的老师的研究方向,我这个真的做了大量工作,把老师实验室近一年发表的所有文章看了,把里面涉及到的仪器的原理啥的都弄懂,查了这个课题的前沿、国内外发展情况,就连老师获奖的新闻我都翻遍了。 4.所有谱学。分子光谱(包括紫外,红外,微波,拉曼)全部原理、应用,都看了3遍。能谱(AES、XPS、UPS、LEED)全部原理、应用,3遍。衍射谱(我只看了XRD)原理、应用。波谱(核磁共振、顺磁共振ESR)原理、应用,3遍。 5.注意观察一下复旦老师发文章喜欢发的期刊,查一下所属机构,影响因子。 6.我初试报了表面化学与催化方向,我查了这个方向的研究进程、现代表面化学的研究内容、以后的研究方向、国内外发展情况,查了一下历史上有哪位是搞这个方向而获得诺贝尔化学奖的科学家。 7.毕业设计(多了解一些,特别是往届的,老师超爱问)
8.英语口语,自我介绍我准备了两个版本,2分钟版和4分钟版。而且还提前练了半个月雅思,每天练习对话2小时。准备了15个日常生活的话题,后来练了几天,发现无论讲啥话题我都可以噼里啪啦讲一大堆了,就差不多了。而且我每天晚上洗澡,都很喜欢自己给自己想话题,然后对着淋浴头说个20分钟哈哈哈哈。 这里提醒大家,在复习备考的时候不要只顾闷头苦学,还要多多分析自己的专业情况,比如分数线、报录比,复试通知、复试流程等各个重要时间点都要重视起来,这些信息推荐以后查询鸿知复旦考研网,都有总结好,非常节省搜集整理信息的时间,建议大家加入收藏夹,经常访问查阅。有问题也可以咨询老师和学姐,人都挺好的,他们做复旦比较久了,资料和专业课的班也是信得过的,我有的同学是经过他们的培训的。 我今年复试的情况: 其实每个人问的都不一样,我这个只能作为参考。首先英语自我介绍,介绍完了,老师就说,你们快提问吧,中英文都可以,果不其然,一个老师用英语提问了,问我最近读过的文献(因为我自我介绍说读过一些文献),我就劈哩啪啦说了一下,另外一个老师又用英文问这个文献出自哪个期刊。后面的问题都是围绕我的毕业设计,问的原理好深啊,有些我都答不出来,然后我就回答了其他相近的方面。还问了光谱的原理,活化能怎么求,家庭主妇做饭为什么要点火(我从自由能、活化能方面答都没对),后来老师自己说了是自由基支链反应。好吧。。。反正整个过程还是比较愉悦的,因为我是比较爱笑的那种人,无论回答得出回答不出我都是在全程微笑,所以也比较放得开和老师交流。我只能说有些问题我能回答我就多说一点,不能回答我就说不知道。 好了,就写这么多了。欢迎各位学弟学妹来报考复旦。复旦是个很干净的地方,初试复试都很公平公正,没有任何歧视。大家如果还不知道怎么准备复试的,最好还是报一个鸿知复旦考研网的辅导班吧,由研究生学长学姐一对一辅导,可以让复习备考更有针对性,告别
傅献彩《物理化学》考研2021考研复习笔记和真题 第1章气体 1.1 复习笔记 【通关提要】本章通过气体分子运动模型,从微观角度了解分子的运动规律。本章重点在于了解气体分子的性质,如运动公式、速率分布、能量分布、碰撞频率等。在非理想气体中重点了解van der Waals方程及对比状态定律。 【知识框架】 【重点难点归纳】 一、气体分子动理论
1理想气体 理想气体:符合方程pV=nRT。 【补充】气体在低压及较高温度下更符合状态方程pV=nRT 2气体分子动理论的基本公式 (1)气体的根均方速率 式中,u称为气体的根均方速率; (3)气体压力和根均方速率的关系(根据气体分子动理论导出的基本方程式) 3几个经验定律(见表1-1-1) 表1-1-1 经验定律总结 二、理想气体的状态图 理想气体均表示曲面上且满足关系式:,该状态图也称为相图。(见图1-1-1和1-1-2)
图1-1-1 p-V坐标图上理想气体在不同温度下的等温线 图1-1-2 V-T坐标图上理想气体在不同压力下的等压线三、分子运动的速率分布 1Maxwell速率分布定律 分子速率分布曲线与温度的关系(见图1-1-3)
图1-1-3 分子速率分布曲线与温度的关系【关系推导】T2>T1,随着温度升高,最高点下移。 2分子速率的三个统计平均值比较(见表1-1-2) 表1-1-2 分子速率的三个统计平均值比较 四、分子平动能的分布 1分子能量处于E~(E+dE)之间的分子占总分子中的分数 能量分布函数f(E) 2在二维平面能量大于某定值E1的分子分数
3在三维空间能量大于某定值E1的分子分数 五、气体分子在重力场中的分布Boltzmann(玻耳兹曼)公式: 六、分子的碰撞频率和平均自由程 1平均自由程 2分子的互碰频率 3分子与器壁的碰撞频率 4分子隙流 隙流速度 七、实际气体
北京化工大学2011年研究生入学考试:物理化学 试题内容: 一、填空题(每空2分、共24分) 1、1mol理想气体经节流膨胀(即Joule-Tomson实验)压力自P1降低到P2,此过程的△A________0,△U______0 。(填>,=或<) 2、298K时,HCl(g)的标准摩尔生成焓△fHm=-92.31kJ/mol ,HCl(g)的无限稀释摩尔溶解焓(即1molHCl(g)溶于水形成无限稀薄溶液时的△H)为-75.13kJ/mol。若以b=b(θ)但仍遵守亨利定律的溶液作标准态,则HCl(aq)的标准摩尔生成焓△fHm(HCl,aq)=____ ___。 3、下图为Bi-Zn二组分体系的固液平衡相图, (1)A区的平衡相态为______, B区的平衡相态为________。 (2)527K时,纯Bi(s)和含93%Bi(质量百分数)的溶液成相平衡。若以纯Bi(s)作标准态,则上述溶液中Bi的活度为_________,活度系数为__________。(Bi和Zn的相对原子质量分别为209和65.39) 4、某原子基态与第一激发态的能级是非简并的,第一激发态的简并度为3,若其他能级可被忽略,且以基态作为能量的零点,298K时,此原子的电子配分函数qe=______。当体系平衡时,在此二能级上的粒子数之比N2/N1=___________。(玻尔兹曼常数k=1.38×10-23J/K)。 5、对大多数纯物质的液体来说,当温度升高时,其表面张力__________。 6、实验测得反应2A+B=C+D的速率方程式为r=k1[A][A][B],若反应物的起始浓度为[A]0=2[B]0,则速率方程式可写为:r=k2[A][A][A],k1与k2的关系为k1=_ _______k2。 7、在电池_____________________________中进行的反应是Ni(s)+H2O(l)→NiO(s)+H2(g) 二、选择填空题:(每题2分,共12分) 1、若理想气体反应O=∑νBB在T1~T2的温度区间内,各物质均无相变,且△Cp<0(△Cp=∑νBCp,B),则在此温度区间内,反应摩尔焓变△rHm随温度升高而(
2013年冶金物理化学考研试题
北京科技大学2013年硕士学位研究生入学考试试题 ======================================================================== ===================================== 试题编号:809 试题名称冶金物理化学(共7 页)适用专业:冶金工程、冶金工程(专业学位) 说明:所有答案必须写在答题纸上,做在试题或草稿纸上无效。 考试用具:无存储功能计算器。 ======================================================================== ===================================== 此试卷包含两部分:其中第一部分适用于冶金工程(不含生态学)考生,第二部分仅适用于生态学考生。 第一部分(适用于冶金工程<不含生态学>考生) 1、简要回答下列问题(第1-8小题每题7分,第9小题14分,共70分) 1)当铁液中组元i的浓度趋于零时,试推导以纯物质标准态的活度及活度系数与以1%标准态的活度及活度系数的关系。 2)对如下反应 (SiO2)+2[C]=[Si]+2CO (1) △G10=a1-b1T SiO2,(S)+2[C]=[Si]+2CO (2) △G20=a2-b2T 在T≤1873K时,讨论△G10与△G20的关系。 3)用热力学原理分析氧势图(Ellingham图)上,为什么标准状态下低位置的金属元素可以还原高位置的氧化物? 4)描述二元系规则溶液的活度系数的计算方法,并与Wagner模型计算进行对
南开大学物理化学专业考研大纲和复习经验 南开大学物理化学专业考研复习都是有依据可循的,考研学子关注事项流程为:考研报录比-大纲信息-参考书-资料-真题-复习经验-辅导-复试-导师。缺一不可,考研大纲会在九十月份发布,研友们不要着急,一定要耐心等待,可以参照去年的大纲先复习着,首先呢,南开大学物理化学专业下包含综合化学与物理化学(含结构化学),二者择其一。我个人的复习经验可以简单说一说,首先刚开始的时候,关注了一些考研公众号,在贴吧寻找经验,看到很多学长像我现在一样,分享着自己的考研经验,但是我很不擅长总结这种东西,一个理科生,原谅我吧。我会把该说的都说到。先列出大纲吧,再说一下我如何利用复习资料的,还有复习进度。 下面是南开大学物理化学专业综合化学考试大纲 一、考试目的 综合化学考试是为我校招收化学类、植物保护类专业的硕士研究生而设置的入学考试科目。 二、考试的性质与范围 本考试是测试考生化学水平的尺度参照性水平考试,考试范围包括本大纲规定的内容。 三、考试基本要求 要求考生比较系统地掌握在大学阶段在化学方面的基础理论,基本知识和基本技能,能综合运用所学知识分析问题、解决问题以及考查考生知识面的广度。 四、考试形式 本考试采取客观试题与主观试题相结合,单项技能测试与综合技能测试相结合的方法,强调考生运用化学基本原理解决问题的能力。 考试时间为180分钟,答题方式为闭卷考试(可以使用数学计算器)。 试卷满分150分,分四部分,其中无机化学40分,分析化学30分,有机化学40分,物理化学40分。 五、考试内容 本科目各部分考试内容,请对应参照科目无机化学、分析化学(不含仪器分析内容)、有机化学(化学学院)、物理化学(不含结构化学内容)的考试大纲。 下面是南开大学物理化学专业物理化学(含结构化学)考试大纲 一、考试目的本考试是化学学院全日制物理化学专业硕士学位研究生的入学资格考试之专业基础课。 二、考试的性质与范围本考试是测试考生物理化学(包括结构化学)水平的尺度参照性水平考试。考试范围包括本大纲规定的物理化学和结构化学内容。 三、考试基本要求 1.要求考生具备物理化学和结构化学相应的背景知识。 2.掌握物理化学和结构化学的基本原理,并能应用这些原理和思想方法处理、解决化学中的实际问题。 四、考试形式本考试采取客观试题与主观试题相结合,单项技能测试与综合技能测试相结合的方法,强调考生运用物理化学、结构化学基本原理解决问题的能力。试卷满分为150分,考试时间为180分钟。 五、考试内容本考试包括两个部分:物理化学(占70%)、结构化学(占30%)。
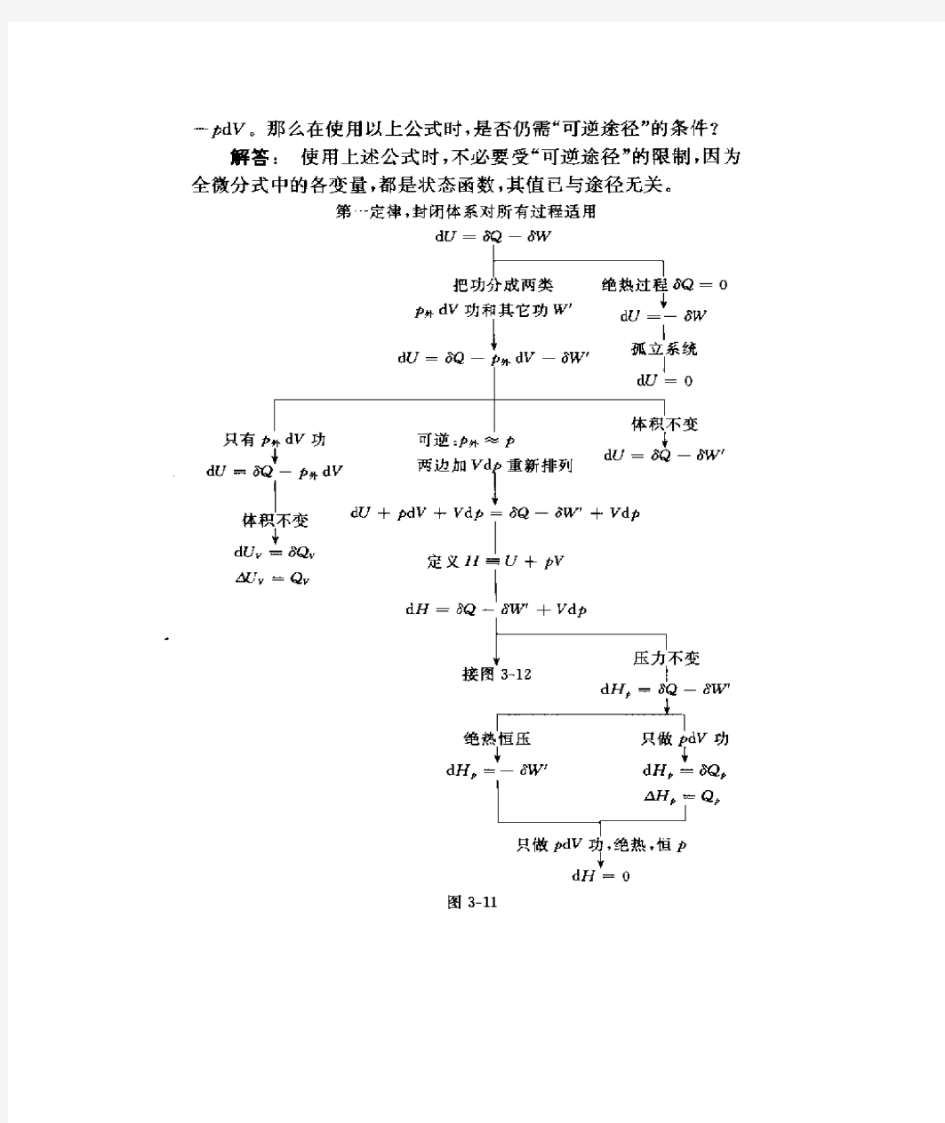
功:δW =δW e +δW f (1)膨胀功 δW e =p 外dV 膨胀功为正,压缩功为负。 (2)非膨胀功δW f =xdy 非膨胀功为广义力乘以广义位移。如δW (机械功)=fdL ,δW (电功)=EdQ ,δW (表面功)=rdA 。 热 Q :体系吸热为正,放热为负。 热力学第一定律: △U =Q —W 焓 H =U +pV 理想气体的内能和焓只是温度的单值函数。 热容 C =δQ/dT (1)等压热容:C p =δQ p /dT = (?H/?T )p (2)等容热容:C v =δQ v /dT = (?U/?T )v 常温下单原子分子:C v ,m =C v ,m t =3R/2 常温下双原子分子:C v ,m =C v ,m t +C v ,m r =5R/2 等压热容与等容热容之差: (1)任意体系 C p —C v =[p +(?U/?V )T ](?V/?T )p (2)理想气体 C p —C v =nR 理想气体绝热可逆过程方程: pV γ=常数 TV γ-1=常数 p 1-γT γ=常数 γ=C p / C v 理想气体绝热功:W =C v (T 1—T 2)=1 1 -γ(p 1V 1—p 2V 2) 理想气体多方可逆过程:W =1 nR -δ(T 1—T 2) 热机效率:η= 2 1 2T T T - 冷冻系数:β=-Q 1/W 可逆制冷机冷冻系数:β= 1 21 T T T - 焦汤系数: μ J -T =H p T ???? ????=-()p T C p H ?? 实际气体的ΔH 和ΔU : ΔU =dT T U V ??? ????+dV V U T ??? ???? ΔH =dT T H P ??? ????+dp p H T ? ??? ???? 化学反应的等压热效应与等容热效应的关系:Q p =Q V +ΔnRT 当反应进度 ξ=1mol 时, Δr H m =Δr U m +∑B B γRT 化学反应热效应与温度的关系:()()()dT B C T H T H 2 1 T T m p B 1m r 2m r ?∑??,+=γ
考研专业课之清华大学材料科学基础-物理化学(1) 第一讲清华大学材料系综合信息介绍 一.系专业信息 清华大学材料科学与工程系在全国学科排名前茅,研究生培养设有材料物理与化学、材料学(无机非金属材料、金属材料)、核燃料循环与材料等博士点和硕士点,并设有材料科学与工程博士后流动站。系中拥有一支学术造诣高,极富创造力而又为人师表的强大研究生导师队伍,关于各位导师的情况,在材料系主页https://www.doczj.com/doc/2117761209.html,/上有详细说明,有兴趣的同学不妨先了解一下。在硬件方面,材料系拥有各种先进的实验仪器设备,为进行材料的合成与加工、微观结构分析及性能特征研究创造了良好的条件。 此外,与国际学术的交流频繁,为准备出国留学的有志之士提供了很好的机会。我想一个人在优越的平台中,可以极大的提高其能力。我相信材料系可以给大家提供这个平台,同样,这也将会是大家施展才能的大舞台。 二.历年报考录取情况 作为材料专业的本科生,大家应该都知道清华材料系在全国举足轻重的地位,也正因为他的实力,使其成为全国材料系考研的热门。 由于她的特殊性,校内保研直博的占了相当大一部分的名额,导致其对外招生名额相比于其他学校,可以用极少来形容。一般来说,报名人数:录取人数≥10:1。录取人数上从06年的18个,到07年15个(最后录14个),再到08年14个(最后录16个),可以看出,官方公布的招生名额有递减的趋势,但最终录取人数可能会根据生源质量有所微调。比如07年由于数一难度较大,再加之专业课改革,使总体成绩偏低,成绩的偶然性偏大,生源质量有所降低,系里抱着清华研招宁缺毋滥的原则,从公布的15个减至14个。 招生人数少是少,但并不是没招。大家要报着必胜的信心去努力为自己的梦想拼搏。拥有自信,你就会是众多考研高手中的最强者。 订阅收藏考研专业课之清华大学材料科学基础-物理化学 三.出题老师情况
《物理化学》考研傅献彩版配套考研真题库 第一部分考研真题精选 一、选择题 1原电池在定温定压可逆条件下放电时,过程中与环境交换的热量在数值上与下列哪个量数值相等?()[北京科技大学2011研] A.Δr H m B.零 C.TΔr S m D.Δr G m 【答案】C查看答案 【解析】等温可逆过程,Q r=TΔr S m。 2采用对消法(或称补偿法)测定电池电动势时,需要选用一个标准电池。这种标准电池所具备的最基本条件是()。[首都师范大学2010研] A.电极反应的可逆性很大,常用做参比电极 B.电动势精确已知,与测量温度无关 C.电池可逆,电势具有热力学意义 D.高度可逆,电动势温度系数小,稳定 【答案】D查看答案 【解析】标准电池指测定电池电动势时,需要的电动势已知的并且稳定不变的辅助电池。其电池内的反应是可逆的,且与温度的关系很小。 3为延长建筑物的寿命和降低成本,最好不用下面哪种水来搅拌用于浇注钢筋的混凝土?()[中国科学技术大学2010研]
A.河水 B.超纯水 C.海水 D.去离子水 【答案】C查看答案 【解析】钢筋混泥土的主要成分是铁,海水中含有多种矿物质,会与铁形成原电池,而腐蚀钢筋。 4一贮水铁箱上被腐蚀了一个洞,今用一金属片焊接在洞外面以堵漏,为了延长铁箱的寿命,选用哪种金属片为好?()[中国科学技术大学2010研] A.镀锡铁 B.铁片 C.铜片 D.锌片 【答案】D查看答案 【解析】为了达到防腐蚀的目的,焊接的金属应该与铁构成原电池,且选择的金属片的活性要高于铁,所以为锌片。 5反应A+B→P符合Arrhenius公式,当使用催化剂时,其活化能降低了80kJ·mol -1,在室温(298K)下进行反应时,催化剂使其反应速率常数约提高了()倍。[中国科学技术大学2010研] A.2×105 B.1014 C.5000
考研《物理化学》考研重点考点归纳 第1章气体的pVT关系 1.1考点归纳 一、理想气体 理想气体是指在任何温度、压力下符合理想气体模型,或服从理想气体状态方程的气体。 1.理想气体模型的微观特征 (1)分子间无作用力; (2)分子本身不占有体积。 2.理想气体状态方程 或 式中,p、V、T、n的单位分别为Pa,m3,K和mol;称为气体的摩尔体积,单位为m3·mol-1;R称为摩尔气体常数,适用于所有气体,其值为 8.314472J·mol-1·K-1。 该方程适用于理想气体,近似地适用于低压的真实气体。 二、实际气体 1.实际气体的行为
在压力较高或温度较低时,实际气体与理想气体的偏差较大。用压缩因子(Z)衡量偏差的大小。 理想气体的,Z=1。对实际气体,若Z>1,则,表示同温、同压下,实际气体的体积大于按理想气体方程计算的结果。即实际气体的可压缩性比理想气体小。当Z<1时,情况则相反。 2.Boyle温度 若在温度T时,有,则称此温度T为Boyle温度TB。 3.van der waals方程式 式中,的单位为Pa·m6·mol-2;b的单位为m3·mol-1。和b都是只与气体的种类有关,而与温度无关的常数,称为范德华常数。 4.维利方程
式中,A、B、C、D称为第一、第二、第三Virial(维利)系数。 三、理想气体混合物 1.混合物的组成表示 (1)物质B的摩尔分数x或y定义为: 式中,表示混合气体总的物质的量。 一般用yB表示气体混合物的摩尔分数,用xB表示液体混合物的摩尔分数。 (2)物质B的体积分数定义为: 式中,表示在一定T、p下纯气体B的摩尔体积;为在一定T、p下混合之前各纯组分体积的总和。 (3)物质B的质量分数定义为:
A 卷 一、单项选择题(共30题,75分) 1.反应A(g)+B(g)?D(g)在固体催化剂下进行,在等温下达到吸附平衡时,覆盖度:q A = k A P A / (1+k A P A+k B P B) q A = k A P A /(1+k A P A+k B P B)当A是弱吸附,而B是强吸附时,反应速率为 A. r=KP A B. r=KP B C. r=K(P B/P A) D. r=K(P A/P B) 2.对于化学吸附,下列说法不正确的是 A. 吸附是单分子层 B. 吸附力来源于化学键力 C. 吸附热接近反应热 D. 吸附速度快,升高温度能降低吸附速度 3.晶体颗粒大小与其溶解度关系是,微小晶体的溶解度 A. 大于大块、大粒晶体 B. 小于小块、小粒晶体 C. 等于大块、大粒晶体 D. 与大块、大粒晶体溶解度的关系不好确定 4.固体吸附剂在溶液中的吸附量 A. 总是随浓度的增加而增加 B. 随溶解度的增加而增加 C. 随溶质极性的增加而增加 D. 能使固液表面自由能降低最多的溶质被吸附的量是最多 5.液体在毛细管中上升的高度与下列哪一个因素无关 A. 温度 B. 液体密度 C. 附加压力 D. 大气压力 6.一分散体系,在温度T每当高度升高4′10-2m时,体系浓度降低一半,则粒子在分散介质中的重量为 A. 0.02272 kT B. 17.33 kT C. 39.9 1 kT D. 0.02272/kT 7.下列有关冷光描述中,正确的是 A. 原子或分子吸收外界光变为激发分子,发出与原光源不同的光 B. 化学反应过程中产生的激发分子回到基态时发出的光 C. 切断电源后继续发出的光 D. 由物体反射回来的光 8.将含有表面活性剂的水溶液形成下列四种半径为R的液滴或气泡,受到附加压力最大的是 A. 在空气中形成的液滴 B. 在空气中吹成的气泡 C. 在溶液中吹出的气泡 D. 将此溶液滴入石蜡中形成液滴 9.将浓度为0.5 mol×dm-3的KI溶液和0.1 mol×dm-3的AgNO3溶液等体积混合后制的得AgI溶胶,下列三种电解质,其聚沉值由大到小的顺序为 A. FeCl3>MgSO4>K3Fe(CN)6 B. K3Fe(CN)6>MgSO4>FeCl3
2014年中国农业大学物理化学考研经验分享 因为现在离2015年的考研确实很近了,但是对于2016年的考试却似乎很遥远,所以我想分别对参加这两次考试的同学进行交流。哈哈,本人文采不好,说的全是大白话,请各位见谅,但是说的也全是大实情,不会浪费大家时间。 首先,对于2015年考研的同学,距离现在只有一个月了,我想说的是:身体第一!每年考研几乎都是全年最寒冷的时候,因此,在这样一个特殊加特殊的时期,保护好身体是第一位的。遥想当年自己考研,和我一起复习的一个战友,平时学的很猛,各种呕心沥血,以至于考前一个月的时候感冒了,打了半个月吊针,感冒好了之后,整个人都很不在状态,由于体力严重不支,基本每天7点就得上床睡觉了,几天后实在扛不住,又去医院打了ATP。最后考试结果大家也可想而知了。所以再次重申一遍,在这段时间身体是第一位的! 那么学习方面呢?很多同学一到现在就有一种临阵磨枪的感觉,依旧每天打题海战术,大量大量的做题,模拟题、仿真题,搞得天天头都大了,一直在接受新知识,其实我觉得已经没有必要了。我按科目说吧,政治和英语我就不说了,就说我们的专业课,化学和生理生化。先说化学,在这个时候,想必大家已经把新祥旭专业课的历年真题都做了一遍吧,我建议大家做完了一定要做一个系统的总结,总结一下有哪几种题型,考频高的有哪几种,固定题型有哪几种,然后把真题中考过的用到的公式、反应一定要掌握牢固,对于自己掌握的模棱两可的、不清楚的、一定要翻翻书把它确定下来,因为你现在不清不楚的,上了考场你就手软,不敢用。另外就是要给自己定几个必拿分的题型,难题偏题以及自己掌握不了的一概放过,不要再纠结了,把会做的做对,不会的果断放掉,这也是考场上的必备技能,一味的苦苦追求、琢磨你不会的,在现在就是浪费时间,而且会大大打击你的自信!对于生理生化,大家平时应该就是背的比较多吧,那现在我的经验就是翻着看,快速阅读,每天腾出2个小时,翻一遍,有自己总结的条理清楚地笔记是最好的,没有的话,只能翻课本了。但是不要再费劲的背了,就我个人经验,这个时候已经背不过来了,反而是每天翻看,效果更好。 对于2015年考研的同学,我认为这一个月,心里的调节也是很重要的,要端正自己的心态,不要再有后悔、还怕这些情绪了,因为自己已经确认了志愿,就只能在有限的时间内努力完成自己的目标,这才是一个成熟的做法,一味的后悔是没有用的,越后悔、你所害怕的越可能变成现实哦。所以,坚强起来,大家都一样,谁坚强了谁就赢了!在这个时期,另一个要摒弃的情绪就是急躁,有很多同学觉得自己怎么越学习,不会的东西反而越多了,其实这是一个正常的过程,因为你脑子里的知识多了,思考的多了,你需要的知识更多了,就觉得自己哪哪都不会了。这个时候,一定不要着急,要回归考试,再次看真题,以真题为向导,把你跑远的思路拉回来,不要想象的考试有多么可怕,自己的东西有多不够,也许是你挖得太深,反而得不偿失了。 最后,就像我自己当年考试的时候,往考场上一坐我就后悔了,觉得自己报中国农业大学是报高了,看着考场的竞争者就有一种不明觉厉的感觉。所以,大家坐在考场的那一刻,一定不要被考场严肃的气氛:什么监考老师的金属报警器、考场摄像头、信号频闭器、监考老师的各种恐吓….所吓倒,没什么大不了的,自己有不作弊,就什么都不怕,放正心态,深呼吸一口,只把它当作一次考试,千万别想什么:“考验我的时候到了….”这一类的,这都是给自己增加压力。深呼吸,平静的面对试卷吧,正常的发挥就好! 最最后,(哈哈,说了自己文采不好的),祝大家在考试中取的好成绩~
1.有一绝热的刚性密闭容器内抽成真空,通过阀门和大气隔离,当阀门打开 时,空气(可视为理想气体)进入容器,此时容器内气体的温度将: (A)升高 (B)降低 (c)不变 (D)不能确定 2.在标准压力P θ和383.15 K 时,水变为同温下的蒸气。则该相变过程中,下 列哪个关系式不能成立? (A) ΔG<0 (B) ΔH>0 (C)△S iso 物理化学复习题 1、简述物理吸附与化学吸附的区别? 2、溶胶是热力学不稳定体系,为什么能够相对稳定存在? 3、胶体的基本特性有哪些? 4、写出由FeCl3水解得到Fe(OH)3溶胶的胶团结构,已知稳定剂为FeCl3: 5、丁达尔现象引起的原因是什么? 6、什么叫做电泳?什么叫做电渗? 7、简述简单级数反应的分类,特点及半衰期。 8、HBL是指。 9、任一稳定纯单质在任何温度下的标准生成自由能() A 根据规定应为零 B 根据自由能定义应为零 C 根据规定不一定为零 D 根据自由能定义不一定为零 10、下列哪种情况可直接用dH=TdS+Vdp公式进行计算() A 363K的水蒸气在101.325kpa下凝结为水 B N2和H2混合气体向真空容器中突然膨胀(无NH3生成) C CO(g)进行绝热不可逆膨胀 D 电解质制备O2和H2 11、相同温度下,()的饱和蒸汽压最大。 A 空气中的小水滴 B 水平液面上 C 水中小气泡内 D 水中大气泡内 12、在50 0C时液体A的饱和蒸汽压是液体B的三倍,A,B形成理想溶液,液——气平衡 时在液相中A的物质的量分数为0.5,则在汽相中B的物质的量分数为() A 0.15 B 0.25 C 0.5 D0.65 13、克-克方程适用的体系是() A C金刚石<=>C石墨 B C10H8 (s)C10H8(g) C H2O( s ) = H2O( g ) D N2(g) + 3H2 = 2NH3(g) 14、离子独立定律适用于() A 强电解质 B 无限稀释溶液 C 弱电解质 D 摩尔浓度为1的溶液 15、体系经过某过程后,其焓变ΔH=Q P ,则该过程是() A 理想气体任何过程 B 理想气体等压过程 C 真是气体等压过程 D 封闭气体不做W’的等压过程 16、当理想气体反抗一定压力作绝热膨胀时,则( ) A 焓总是不变 B 内能总是增加 C 焓总是增加 D 内能总是减小 17、298K,石墨的标准摩尔生成焓Δf H298θ 0 。 18、加入表面活性剂后,是液体表面张力会。 19、完全互溶二组分体系的气液固相图中,如果P-X曲线上有最高点,则该点气相组成(Y A)和液相组成(X A)的关系是。 20、把一种盐AlCl3溶于水中形成不饱和的溶液,若该盐不发生水解,则该体系的组分数为。 21、液体中的气泡越小,饱和蒸汽压越,液滴越小,饱和蒸汽压越。 22、已知某化学反应速率常数为2×103s-1,则反应级数为;若为2×103dm3mol-1s-1,则反应级数为;若为2×103mol·m-3s-1,则反应级数为。 23、室温下水在一根粗细均匀的玻璃毛细管内将上升到高度h处,如将毛细管在h/2处折断,则水将沿壁升至,此时管中水表面的曲率半径将。 第一章 气体的pVT 关系 主要公式及使用条件 1. 理想气体状态方程式 nRT RT M m pV ==)/( 或 RT n V p pV ==)/(m 式中p ,V ,T 及n 单位分别为Pa ,m 3,K 及mol 。 m /V V n =称为气体的摩尔体积,其单位为m 3 · mol -1。 R =8.314510 J · mol -1 · K -1,称为摩尔气体常数。 此式适用于理想气体,近似地适用于低压的真实气体。 2. 气体混合物 (1) 组成 摩尔分数 y B (或x B ) = ∑A A B /n n 体积分数 / y B m,B B * =V ?∑* A V y A m,A 式中∑A A n 为混合气体总的物质的量。A m,* V 表示在一定T ,p 下纯气体A 的摩尔体 积。∑*A A m,A V y 为在一定T ,p 下混合之前各纯组分体积的总和。 (2) 摩尔质量 ∑∑∑===B B B B B B B mix //n M n m M y M 式中 ∑=B B m m 为混合气体的总质量,∑=B B n n 为混合气体总的物质的量。上述各 式适用于任意的气体混合物。 (3) V V p p n n y ///B B B B * === 式中p B 为气体B ,在混合的T ,V 条件下,单独存在时所产生的压力,称为B 的分压力。* B V 为B 气体在混合气体的T ,p 下,单独存在时所占的体积。 3. 道尔顿定律 p B = y B p ,∑=B B p p 上式适用于任意气体。对于理想气体 V RT n p /B B = 4. 阿马加分体积定律 V RT n V /B B =* 此式只适用于理想气体。 5. 范德华方程 RT b V V a p =-+))(/(m 2m nRT nb V V an p =-+))(/(22 式中a 的单位为Pa · m 6 · mol -2,b 的单位为m 3 · mol -1,a 和b 皆为只与气体的种类有关的常数,称为范德华常数。 此式适用于最高压力为几个MPa 的中压范围内实际气体p ,V ,T ,n 的相互计算。 6. 维里方程 ......)///1(3m 2m m m ++++=V D V C V B RT pV 及 ......)1(3'2''m ++++=p D p C p B RT pV 上式中的B ,C ,D,…..及B‘,C‘,D‘….分别称为第二、第三、第四…维里系数,它们皆是与气体种类、温度有关的物理量。 适用的最高压力为1MPa 至2MPa ,高压下仍不能使用。 7. 压缩因子的定义 )/()/(m RT pV nRT pV Z == Z 的量纲为一。压缩因子图可用于查找在任意条件下实际气体的压缩因子。但计算结果常产生较大的误差,只适用于近似计算。 第二章 热力学第一定律 主要公式及使用条件 1. 热力学第一定律的数学表示式 W Q U +=? 或 'a m b δδδ d δd U Q W Q p V W =+=-+ 规定系统吸热为正,放热为负。系统得功为正,对环境作功为负。式中 p amb 为环境的压力,W ‘为非体积功。上式适用于封闭体系的一切过程。 2. 焓的定义式 pV U H += 中国科学院研究生院 2009 年招收攻读硕士学位研究生入学统一考试试题 科目名称:物理化学(甲) 考生须知: 1. 本试卷满分为150 分,全部考试时间总计180 分钟。 2.所有答案必须写在答题纸上,写在试题纸上或草稿纸上一律无效。 3.可以使用不带储存功能的计算器。 下列一些基本常数供解题时参考: 普朗克常数 h=6.626×10 -34 J·S ;玻兹曼常数 k B=1.381 ×10 -23J·K -1 摩尔气体常数 R=8.314J·mol -1·K -1 ;法拉第常数 F=96500C ·mol -1 一、是非题(每小题 1 分,共 15 分)(判断下列各题是否正确,正确用“√”表示,错误用“×”表示) 1.某气体状态方程为 p=f(V)T,f(V)只是体积的函数,恒温下该气体的熵随体积V 的增加而增加。 2.在恒温恒压不做非体积功的情况下,△ H>0, △ S>0 的过程不一定能自发进行。 3.已知 X 和 Y 可构成固溶体。在X 中随着加入 Y 可使系统的熔点升高,则Y 在固溶体中的含量 比 Y 在液相中的含量低。 4.稀溶液的依数性是指在指定溶液的种类和数量后,其性质仅取决于所含溶质分子的数目,而与 溶质的本性无关。 5.在非理想液态混合物中,正规混合物的非理想性是完全由混合热效应引起的。 6.多孔硅胶具有强烈的吸水性能,这表明自由水分子的化学势较吸附于硅胶表面的水分子的化学 势为低。 7. 在一定温度下,分子的平动,振动及转动的能级间隔大小顺序为:振动能>转动能 > 平动能。 8.原电池的电动势等于构成电池的各相同的各个界面上所产生的电势差的代数和。 9.工业上用电解食盐水制造 NaOH 的反应为: 2NaCl+2H 2O 电解 2NaOH+H 2(g)+Cl 2(g), 阴极反应为:2NaCl+2e - 2Na+ + Cl 2(g)。 10. 碰撞理论中的阈能Ec 是与阿伦尼乌斯活化能Ea 在数值上必须相等,碰撞才是有效的。 11.假设晶体上被吸附的气体分子间无相互作用,则可把该气体系统视为定阈的独立子系统。 12. 在统计热力学中,零点能(基态分子的能量)的选择可影响Gibbs 函数 G 的值。 13.绝大多数液态物质的表面张力都是随着温度的升高而逐渐地趋于极大值。 科目名称:物理化学(甲)第1页共6页 厦大无机化学考研经验 现在说说我的考研复习时间安排吧,我是从2011年4月份开始复习无机化学上册,整个四月份都只看无机化学上册,只看书,每天花半天时间(3小时)去图书馆。我看书比较注重效率,也感觉自己那段时间效率比较高,所以就抓紧时间看(考研复习都有疲劳期,所以趁状态好的时候多复习点)。每次看书的时候只带课本和笔,本人不习惯用笔记本,看书期间遇到的问题或是重点我喜欢直接标注在书本上,我那本无机化学课本在最后反正是找不到一页没有注解的空白地方。我还有个习惯就是喜欢将书本上的重要公式或是非常重要的定义写在那一页的顶端或是下端,这样有助于复习时加深印象,翻到那一页就知道主要讲了什么内容。整个四月份我将无机化学上册看了一遍,当然有些难以理解的地方就多花了时间。我找的考研资料、考题考点解析、知识框架图及历年真题及答案解析等内容都是在百度文库找的,价格便宜,用起来很方便。我看书也是主要是以章节为单位,争取看一章能将那一章的知识有个了解,争取看懂。 看完这本书就给自己放了一个五一长假,然后就开始复习物理化学了,物理化学也注重看书,最好是复习厦大孙世刚那两本书,很全面,跟考试结合很紧密。物理化学是一项艰苦的工程,不仅难懂,还很难记住,感觉就是看不懂,看了后面就忘了前面,做题几乎没把握。不过这时不要灰心,始终要坚信难是对于所有人的,只要自己努力了,结果肯定不会差。物理化学需要一章节一章节的复习,然后做课后习题,这样有助于理解,重复看书,重复做题,吃透每章节的内容,只有这样才会在看后续章节时不会不知所云。复习物理化学花的时间就多了,两本物理化学书我是从5月份看到了八月底,当然这期间也有一些耽误,比如复习期末考试,暑假休息半个月,总的算来花了三个月把书本拉通看了一遍。最重要的是在这期间无机化学不能丢下,虽然不像四月份那样每天看,但是需要时常翻翻书,看一看比较难理解的章节,如原子结构和元素周期律,化学键理论和配位化学那几章,顺带做做题。这样到九月开学时几乎就把无机化学上册搞定了,物理化学也有了个大概的了解。对于这期间花在专业课上的时间应该每天不少于三小时吧,而且是连续的三小时,这样有助于系统复习。 九月开学后就要安排全程复习了,无论是公共课还是专业课,具体时间安排因人而异,自己感觉难的科目可以多安排点时间,复习顺利的科目少花点时间, 北京化工大学2000考研物理化学试题 (填空16分,选择题9分,计算5题75分共100分) 注意事项:答案写在答题纸上,101.325kPa ≈100kPa=p ,作图用铅笔。 一、填空题(16分) 1. 1mol 双原子理想气体由始态370K 、100kPa 分别经(1)等压过程,经(2)等容过程加热到 473K ,则(1),(2)两个过程下列物理量的关系是Q 1_____Q 2,W 1_____W 2,△H 1_____△H 2,△S 1_____△S 2。(填大于、小于或等于) 2. 200℃时,Ag 2O 的分解反应为:Ag 2O(s)→2Ag(s)+ 2 1 O 2(g) 己知200℃时固体Ag 2O 的分解压为137.8kPa 。今让1mol Ag 2O(s)在200℃分解达平衡,则该过程△G=_______,K =_________,反应过程系统与环境交换的功W=______(忽略固体体积,并设气体为理想气体。 3. 根据电池反应设计原电池。己知电池反应: AgCl(s)+I - (-I a )=AgI(s)+Cl - (-Cl a ) 所设计的原电池为__________________________________________。 4. 有理想气体反应: A(g)+2B(g)→C(g) 在等温和总压不变的条件下进行,若原料气中A 与B 的物质的量之比为1:2,达平衡时系统的组分数C=_______,自由度数f=_______。当温度一定时,增大压力则K _______(填增大、减小或不变),平衡将________移动(填向左、向右或不)。 5. 在一个锥形容器中,放入一滴液体,如下图所示。试画出接触角θ。因θ____900 (填大 于、小于或等于),则该液体对容器______润湿(填能或不能)。 6. 有(N 、E 、V)确定的理想气体,设分子的运动形式只有三个可及的能级,它们的能量和 简并度分别为: k 1 ε=0K ,g 1=1 k 2 ε=100K ,g 1=3 k 3 ε=300K ,g 1=5 (式中k 为玻尔兹曼常数) 当温度为200K 时,分子的配分函数值为_______。在某温度下,若kT i e ε- →1时,三个 能级上最可几分子数之比为_____________。(注:为i ε) 7. 请设计实验测定反应 C 6H 6(l)+ 2 15 O 2→6CO 2(g)+3H 2O(g) 的摩尔反应焓△r H m 。实验方法及理论依据是:___________________________________。 (不考虑用光谱或波谱方法,不要求写出实验步骤和实验装置)。物理化学复习题
物理化学考研公式复习
中科院考研真题2009物理化学甲
厦大无机化学考研经验
北京化工大学2000考研物理化学试题