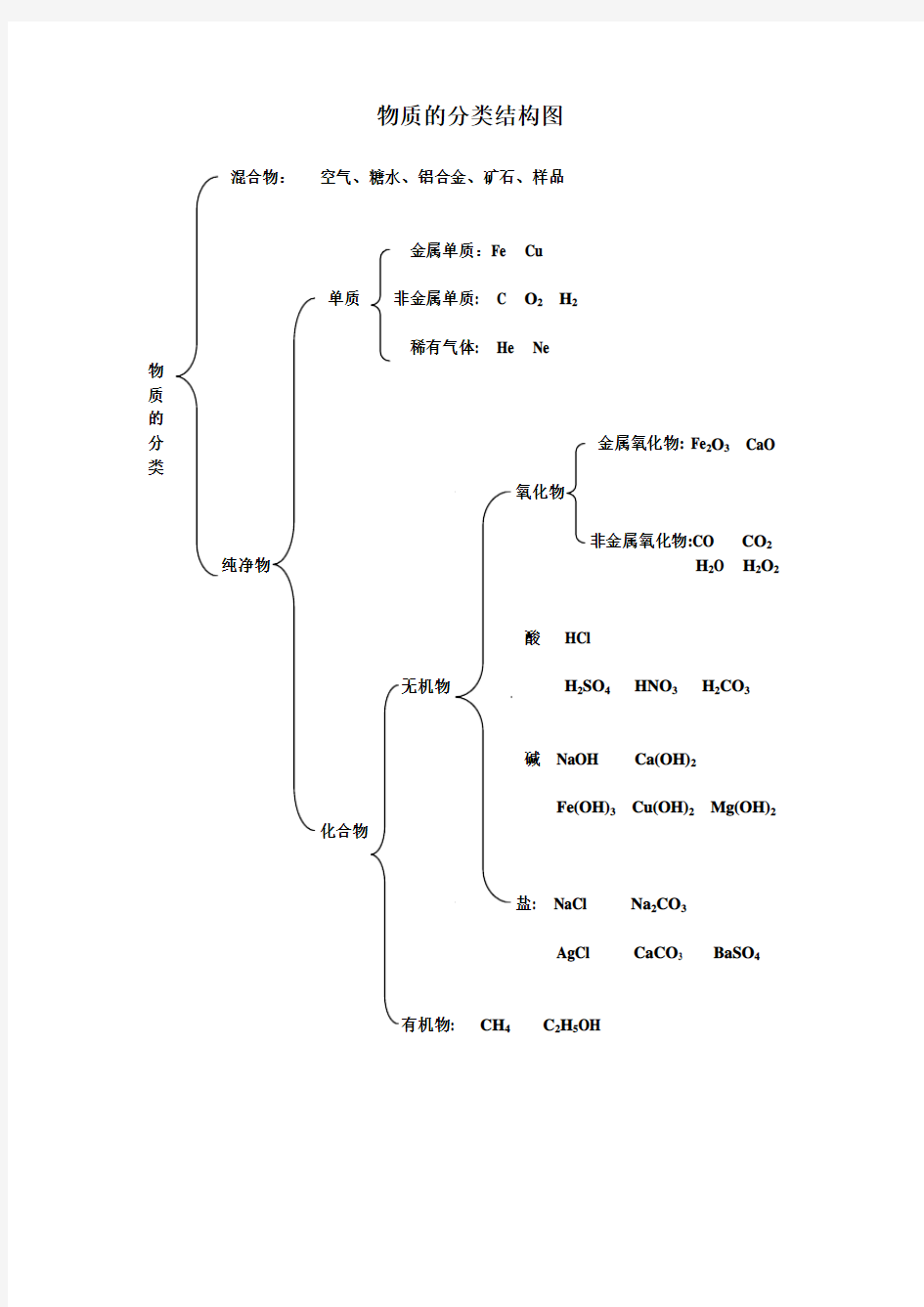
物质的分类结构图
混合物:空气、糖水、铝合金、矿石、样品
金属单质:Fe Cu
单质非金属单质: C O2H2
稀有气体: He Ne
物
质
的
分金属氧化物: Fe2O3CaO 类
氧化物
非金属氧化物:CO CO2纯净物H2O H2O2
酸HCl
无机物H2SO4HNO3H2CO3
碱NaOH Ca(OH)2
Fe(OH)3Cu(OH)2Mg(OH)2
化合物
盐: NaCl Na2CO3
AgCl CaCO3 BaSO4
有机物: CH4C2H5OH
第二章第一课时“第一节物质的分类”教案 【教学目标】 1.体验进行分类的目的及意义。 2.学会根据物质的组成和性质对物质进行分类。 【教学重点】 分类法的意义及常见化学物质及其变化的分类方法 【教学方法】 讨论、讲授 【教学过程设计】 【情景引入】 若要到“万福”商场买一部复读机,你如何以最快的速度找到它? 【思考与交流】 请根据以往的生活经验和社会知识,列举一些应用分类法的例子。【师生交流】 分类法在日常生活中的应用是非常普遍的,我们应该善于发现和学会使用,以提高我们工作和学习的效率。 【学生活动】 组织学生对八支笔进行分类活动 分类并没有唯一性,它会根据分类的标准不同而不同。 【点评】当分类的标准确定之后,同类中的事物在某些方面的相似性可以帮助我们做到举一反三;对于不同类的事物的了解我们有可能做到由此及彼。所以分类的方法是一种非常简单易行的科学方法,分类法的应用也是非常普遍的。 【过渡】 其实分类方法不但在生活和工作中经常碰到,在化学学习过程中也普遍存在, 一、简单分类法及其应用 【学生活动】案例1、连线: 【师生交流】 通过这个活动,可以看出对于Na2CO3如果从阳离子来看,可以与Na2SO4一起分为硫酸盐。若从阴离子的角度来看可以与K2CO3一起分为碳酸盐。因此可以说, 【点评】 一种分类方法所依据的标准有一定局限,所能提供的信息少,人们在认识事物时往往需要采用多种分类方法来弥补单一分类方法的不足。1、交叉分类法 【学生活动】 案例2、对下列化学反应进行分类: (1)硫在氧气里燃烧 (2)红磷在氧气里燃烧 (3)铁丝在氧气里燃烧 (4)铝箔在氧气里燃烧
(5)蜡烛在氧气里燃烧 案例3、见课本P21,图2-32、树状分类法 【点评】:树状分类法可以让我们把同类事物进行再分 【实践活动】 按照物质的组成和性质,对纯净物进行分类,仿照P21图2-3作出树状分类图,然后选择下列合适的物质填在物质类别上。 O2, Cu,H2SO4, Ba(OH)2,KNO3, CO2,空气,含镁60%的MgO 【小结】 在学习了分类的方法以后,大家就要学会对以前和将要学的化学知识进行及时的归纳和整理,学会对物质及其变化进行分类,并通过对各类物质的代表物质的研究来了解这类物质的性质,从而提高我们化学学习的效率。 【练习】 【课后作业】 1、通过查找资料或与同学合作,为石油加工后的产物或用途制作一张树状分类图或交叉分类图。 2、某学校要举行田径运动会,有高一、高二、高三3个年级的男生、女生参加,请你画出以高一男子组、高一女子组……的方法分组的树状分类图。 3、填表: 【课后阅读材料】“白马非马”的故事 【原文】公孙龙是战国时期平原君的食客。一天,他牵一匹白马出关被阻,公孙龙便以白马非马的命题与之辩论,守关的人辩不过他,公孙龙就牵着马出关去了。(或说,他还是不得出关。)公孙龙说,白马为非马者,言白所以名色,言马所以名形也;色非形,形非色也。夫言色则形不当与,言形则色不宜从,今合以为物,非也。如求白马于厩中,无有,而有骊色之马,然不可以应有白马也。不可以应有白马,则所求之马亡矣;亡则白马竟非马。 【大致意思】公孙龙是战国时期平原君的食客。据说,公孙龙有一次骑马过关,把关的人对他说:“法令规定马不许过。”公孙龙回答说:“我骑的是白马,白马不是马,这可是两回事啊。”公孙龙的“白马”有没有过关,我们不得而知。从常人的观点来看,守关的兵士八成认为公孙龙是在诡辩。 【评论】 冯友兰(我国著名新理学家、哲学家)认为《公孙龙子》里的《白马论》对“白马非马”进行了三点论证: 一是强调“马”、“白”、“白马”的内涵不同。“马”的内涵是一种动物,“白”的内涵是一种颜色,“白马”的内涵是一种动物加一种颜色。三者内涵各不相同,所以白马非马。 二是强调“马”、“白马”的外延的不同。“马”的外延包括一切马,不管其颜色的区别;“白马”的外延只包括白马,有颜色区别。外延不同,所以白马非马。三是强调“马”这个共相与“白马”这个共相的不同。马的共相,是一切马的本质属性,它不包涵颜色,仅只是“马作为马”。共性不同,“马作为马”与“白马作为白马”不同。所以白马非马。
组织?行行为学 第1讲 导论 组织?行行为学的研究?方法 组织?行行为学的理理论基础与发展 管理理者的技能和职能 当今管理理者所?面临的挑战 第2讲 ?心理理契约和承诺 “?心理理契约”的定义、重要性 违反?心理理契约的后果 员?工承诺的正?面作?用以及雇主应该如何?鼓励承诺 管理理?心理理契约的结缩模型价值观和职业价值观第3讲 了了解?自我 认识?人?口学变量量的差异能?力力和能?力力的培养 ?气质的差异 性格的重要性 了了解情商 第4讲 正确理理解他?人 知觉的概念归因理理论 常?见的社会知觉偏差 ?工作态度和态度的转变 第5讲 员?工学习和创造?力力 成?人学习的特点?网络时代的学习创造?力力的概念和理理论组织环境和创造?力力中国?人的创造?力力创造?力力的?黑暗?面 第6讲 激励理理论和应?用 激励的理理论 激励理理论的应?用 第7讲 群体和团队 群体概述团队及团队建设第8讲 问题解决与决策 问题解决决策定制模型 群体决策 群体决策的误区 第9讲 管理理沟通 帮你认识管理理中的沟通 帮你掌握管理理技能 沟通实战训练正确认识冲突 第10讲 领导理理论与管理理 领导理理论 领导与管理理者 新型领导理理论 量量?子管理理思想 第11讲 组织与组织?文化 组织的概念 影响组织结构设计因素 传统的组织结构新型的组织结构 现场研究、实验室研究、调查法、谈话法、个案研究模型、?自变量量、因变量量 技能:技术技能、?人际技能、概念技能基本职能:计划、组织、领导、控制 全球化多元化、知识型员?工、终身学习、授权、刺刺激创新和变?革、处理理?工作家庭冲突 定义:个?人和组织的互动作?用下所形成的信念,它关系到个?人和组织之间互惠的条款和条件。它代表了了员?工和雇主对彼此的期望。 这个概念来源于社会交换理理论,即在?人?民所参与的关系中,经济因素和社会职责都扮演着重要?角?色,但交换达到平衡时?人们感到最舒适。 ?心理理契约的破裂:由某?一?方没有完成被预期的职责所致,包括没有兑现承诺,或员?工和雇主对契约的理理解不不?一致。 产?生过激反应,如吃惊、?生?气、愤怒怒、怨恨、背叛和抗拒等员?工?工作满意度、绩效、承诺、出席率、?自愿努?力力程度、继续留留在组织?里里的意愿都减低 员?工承诺:对组织的情感依恋、认同、投?入程度、对组织?目标和价值观的信任和接受、为组织贡献?力力量量的意愿、留留在组织中的强烈烈愿望。 争取员?工承诺的有效?方式:阐明并交流组织的使?用,保障组织内的公正,创造社区氛围,?支持员?工?自身的发展 价值观:引导或激励态度与?行行为的信念和态度终极价值观 vs ?工具价值观 年年龄、性别、婚姻状况、?工作年年限、能?力力、?气质、性格 多?血质-王熙凤(表扬为主防微杜渐);胆汁质-张?飞(肯定成绩避开锋芒)粘液质-唐僧(多给?鼓励少批评);抑郁质-林林黛?玉(经常?鼓励多教?方法)根据员?工的?气质类型,采?用不不同的?方法和措施来激励员?工 性格是个体对现实的稳定态度和与之相应的习惯化了了的?行行为?方式 测试?方法:?自陈量量表法(呈现?一些问题让回答者根据?自身实际情况回答每个问题,然后根据回答问题情况判断性格特点);投射实验(呈现?非结构化的材料料,让回答者随意想象,根据回答来判断?人格特点)。 情商主要指准确的认知能?力力、评价能?力力、表达能?力力和对情绪及感觉的控制能?力力三个层次:对?自我的把握;对他?人的感知;与他?人的交往 个体对?自?己说在的环境赋予意义?而结识感觉印象的过程根据?人的外部特征对他的内?心状态所作的解释和推论 ?日常?生活中常?见的:选择性知觉、刻板印象、晕轮效应、对?比效应、?首因效应 态度是关于客观事物、?人和事件的评价性陈述?工作满意度;组织公?民?行行为(Organizational Citizenship Behavior,OCB) 以互惠为基础;以经验为基础;强调个?人应?用;个?人化且?自我导向化;学习与?生活结合 定义:指个体或者群体提出新颖?而且实?用的想法的能?力力具有创造?力力的领导:1、会圈?人才;2、爱做试验;3、能讲故事 认知主义激励理理论 过程型激励理理论 期望理理论公平理理论 ?马斯洛洛需求层次理理论(?生理理、安全、社会、?自尊、?自我实现需要) 爱尔德弗ERG理理论(?生存、关系、成?长需要)赫兹伯格双因素理理论(激励因素、保健因素) 群体是指有同?一?目标和?行行为规范并协同活动的?人群结合体是指对企业中的重?大问题,在领导的主持下通过集体充分讨论?而做出合理理决定的过程。 问题 ?小群?里里意识:以表?面?一致的压?力力阻碍了了不不同意?见的发表,是的不不能对问题和解决?方法做出符合实际的评价和分析。极端性转移:群体决策中更更容易易冒险或者保守的现象。 冲突的益处 减少?工作的枯燥感 增进?自我了了解 为了了回避冲突,可激发个?人做妥?工作冲突之化解可增进个?人声望和地位 凸显问题所在 促使决策者对问题进?行行深?入的思考 可导致创新或变?革 如何提?高沟通的有效性 了了解听众,选?用合适的语?言 跳动情绪注意?言?行行?一致 沟通态度重于沟通的内容 多采?用反馈技术 冲突的种类:建设性冲突 vs 破坏性冲突 魅?力力型领导 变?革性领导和交易易型领导 共享领导理理论服务型领导真诚型领导授权型领导 家?长式领导道德型领导辱虐型领导精神型领导包容型领导?自我牺牲型领导 谦卑?型领导 系统论的观点:组织是?一个复杂的开放的社会技术系统。?工作专?门化、部?门化、沟通或命令链、控制跨度、正规化、集权与分权 直线制结构;职能制结构;直线职能制;分部化结构;矩阵制结构;超事业部结构 团队结构;虚拟组织;?无边界组织;?女女性化组织;学习型组织组织?文化 指组织成员的共同价值观体系,它使得组织独具特?色区别于其他组织 功能和作?用:导向、凝聚、激励、约束、适?用、互动功能 对下属具有?非常深远和不不同寻常的影响 交易易型领导:指领导者以下属所需要的报酬来换取?自?己所期望的下属的努?力力与绩效 变?革型领导:通过让员?工意识到所承担任务的重要意义,激发下属?高层次需求,建?立互相信任的氛围,促使下属为组织的利利益牺牲?自?己的利利益,并超过原来预期的效果。 在?人治的氛围下,所显示出来的具有严明纪律律和权威、?父亲般的仁慈及道德廉洁性的领导?方式。 通过表率?行行为和?人际互动来表明在组织中什什么事合乎规范、恰当的?行行为,并通过双向沟通、强化和决策来激励下属道德?行行为的领导?方式。指下属感知到的管理理者持续表现的?言语或者?非?言语形式的,但不不包括肢体上解除的敌意?行行为。
高中化学:物质的组成、性质和分类知识点 考点1 物质的组成 1.元素——宏观概念,说明物质的宏观组成。 元素是质子数相同的一类原子的统称。质子数相同的微粒不一定是同一种元素,因为微粒的含义要比原子广泛。 2.分子、原子、离子——微观概念,说明物质的微观构成。 (1)分子是保持物质化学性质的一种微粒。(单原子分子、双原子分子、多原子分子) (2)原子是化学变化中的最小微粒。(不是构成物质的最小微粒) (3)离子是带电的原子或原子团。(基:中性原子团) 3.核素——具有一定数目的质子和一定数目的中子的一种原子 同位素——具有相同质子数和不同中子数的原子互称为同位素 同素异形体——同种元素形成的结构不同的单质 特别提醒: 1.离子与基团: 2.同位素与同素异形体: [知识规律] 物质到底是由分子、原子还是离子构成?这与物质所属的晶体类型有关。如金刚石(C)、晶体Si都属原子晶体,其晶体中只有原子;NaCl、KClO3属离子晶体,其晶体中只有阴阳离子;单质S、P4属分子晶体,它们是由原子形成分子,进而构成晶体的。具体地: (1)由分子构成的物质(分子晶体): ①非金属单质:如H2、X2、O2、O3、N2、P4、S、C60、稀有气体等 ②非金属氢化物:如HX、H2O、NH3、H2S等 ③酸酐:如SO2、CO2、SO3、P2O5、N2O5 等 ④酸类:如HClO4、HClO、H2SO4、H3PO4、H2SiO3等 ⑤有机物:如烃类、烃的衍生物、糖类、氨基酸等 ⑥其它:如NO、N2O4、Al2Cl6等 (2)由原子直接构成的物质(原子晶体):稀有气体、金刚石、晶体硅、二氧化硅、碳化硅、石墨(混合型晶体)等; (3)由阴阳离子构成的物质(离子晶体):绝大多数盐、强碱、低价金属氧化物。 (4)由阳离子和自由电子构成的物质(金属晶体):金属单质、合金
物质的分类 一、单质 按元素组成分为 1.金属单质 K钾、Ca钙、Na纳、Mg镁、Al铝、Zn锌、Fe铁、 Sn锡、Pb铅、Cu铜、Hg汞、Ag银、Pt铂、Au金 2.非金属单质 氢气H2、碳C、氮气N2、氧气O2、臭氧O3、氟气F2、硅Si、磷P、硫S、氯气Cl2、液溴Br2、碘I2、氦气He、氖气Ne、氩气Ar、 二、化合物 1.有机化合物 乙醇、甲烷、乙烷、乙烯、葡萄糖 2.无机化合物 三、氧化物 (1)按元素组成分为金属氧化物和非金属氧化物 1.金属氧化物 氧化钠Na2O、过氧化钠Na2O2、氧化钙CaO、氧化镁MgO、氧化铝Al2O3、氧化锌ZnO、氧化铁Fe2O3、氧化亚铁FeO、四氧化三铁Fe3O4、氧化铜CuO、氧化汞HgO、七氧化二锰Mn2O7 2.非金属氧化物 水H2O,过氧化氢H2O2、一氧化碳CO、二氧化碳CO2、一氧化氮NO、五氧化二氮N2O5、二氧化硅SiO2、五氧化二磷P2O5、二氧化硫SO2、三氧化硫SO3 (2)按照性质分为 碱性氧化物 酸性氧化物 不成盐氧化物 两性氧化物 过氧化物 1.碱性氧化物 大部分的金属氧化物为碱性氧化物,但有特例:过氧化钠Na2O2为过氧化物、氧化铝Al2O3为两性氧化物、七氧化二锰Mn2O7为酸性氧化物、四氧化三铁Fe3O4、 碱性氧化物有:氧化钠Na2O、氧化钙CaO、氧化镁MgO、氧化锌ZnO、氧化铁Fe2O3、氧化亚铁FeO、氧化铜CuO、氧化汞HgO、 碱性氧化物一定为金属氧化物,金属氧化物不一定为碱性氧化物 2.酸性氧化物 大部分的非金属氧化物为,但有特例:水H2O,一氧化碳CO、一氧化氮NO不是酸性氧化物,七氧化二锰Mn2O7虽然为金属氧化物但属于酸性氧化物、 非金属氧化物不一定为酸性氧化物 3.不成盐氧化物:一氧化碳CO、一氧化氮NO 4.两性氧化物:氧化铝Al2O3 5.过氧化物:过氧化氢H2O2、过氧化钠Na2O2 四、酸 中学常见的酸: 盐酸HCl、硫酸H2SO4、硝酸HNO3、碳酸H2CO3、磷酸H3PO4、次氯酸HClO、氯酸HClO3、高氯酸HClO4、亚硫酸H2SO3、硅酸H2SiO3、氢硫酸H2S、氢碘酸HI、氢溴酸HBr、氢氟酸HF、乙酸CH3COOH (1)依据组成分为含氧酸和无氧酸 1.含氧酸 硫酸H2SO4、硝酸HNO3、碳酸H2CO3、磷酸H3PO4、次氯酸HClO、氯酸HClO3、高氯酸HClO4、亚硫酸H2SO3、硅酸H2SiO3、乙酸CH3COOH 2.无氧酸
物质的组成、构成和分类 1,现有C、H、O、Na、Cu、S六种元素,从中选出相关元素组成下列类别物质的化学式:(每一类各写两例) ?单质_____________ ?酸_____________ ?碱_____________ ?盐_____________ ?氧化物____________?有机物_____________ 2、构成氧气的分子和构成液氧的分子具有( ) A、相同的性质 B、不同的性质 C、相同化学性质 D、不同化学性质 3、钾的相对原子质量较氩的相对原子质量小1,而核电荷数大1,由此可推断,一个钾原 子和一个氩原子所含中子数的关系是( ) A、钾的中子数比氩的中子数少1个 B、钾的中子数比氩的中子数少2个 C、钾的中子数等于氩的中子数 D、钾的中子数比氩的中子数多1个 4、下列关于物质组成的说法中正确的是( ) A、任何纯净物都是由一种元素组成的 B、一种元素只能组成一种单质 C、任何一种化合物都是由不同种元素组成的 D、任何物质都是由分子构成 5、有下列四组物质,每组均有一种与其它物质所属类别不同,请在下面的横线上填写这种 物质的名称: ①食醋、牛奶、加碘盐、水;②冰、干冰、氧化铁、铜绿; ③蛋白质、油脂、维生素、煤气;④纯碱、烧碱、食盐、石灰石 ①__________②__________③__________④__________ 6、进入21世纪,化合物已超过2000万种,其些物质由碳、氢、氧、钠中某些元素组成, 用上述元素,按要求各写出一种常见物质化学式: ①用于炼铁的气体且有可燃性的氧化物__________; ②“汽水”“雪碧”中含有的一种酸__________; ③能溶解蛋白质、油脂、纸张的工业原料的碱__________; ④家庭中常用作洗涤剂的纯碱是__________; ⑤可造人工雨雾的一种氧化物是__________; ⑥“西气东输”工程中将要输送的有机物是__________。 综合能力提升 1、下列关于原子、分子、离子的叙述正确的是( ) A、分子是化学变化中的最小微粒 B、离子在化学反应中不能再分 C、原子可以直接构成物质 D、分子中含有离子 2、能保持二氧化碳化学性质的微粒是( ) A、碳元素和氧元素 B、两个氧原子和一个碳原子 C、二氧化碳分子 D、二氧化碳分子中的电子数 3、由原子构成,且常温下呈液态的物质是( ) A、五氧化二磷 B、汞 C、硫酸 D、液氧 4、下列物质中由离子构成的是( ),由原子直接构成的物质是( ) A、铜 B、氯化钠 C、氯化氢 D、氩气 5、下列各组物质中按单质、化合物、混合物顺序排列的是( ) A、氧气、氧化镁、液态氧 B、铁、二氧化硫、石油 C、铜、二氧化锰、甲烷 D、磷、二氧化碳、水银 6、下列几组物质中,元素组成完全相同的是( )
物质的分类知识点及题型(含答案) 一、常见的分类方法:(1)交叉分类法:对物质以不同的标准进行分类。 举例 : Na 2CO 3 钠盐 Na 2SO 4 硫酸盐 NaCl 含氧酸盐 K 2SO 4 无氧酸盐 KHCO 3 氧化物 Na 2O 酸式盐 (2)树状分类法:对同类事物进行再分类的一种方法 举例 : (3)化学反应的分类: ?? ? ?? ????? ???? ??? ?????? ?还原反应氧化反应失氧根据反应中物质得氧或分解反应化合反应的多少根据反应前后物质种类 复分解反应置换反应类别根据反应物和生成物的化学反应 二、分散系及其分类: 1、几个概念 分散系:把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系,叫做分散系。 分散质:分散系由分散质和分散剂组成,前者属于被分散的物质,称作分散质; 分散剂:后者起容纳分散质的作用,称作分散剂。 2、分散系按照分散质或分散剂聚集状态不同分类,有9种类型。对比如下: 物质 混合物:NaCl 溶液 纯净物 金属单质:Cu Hg 非金属单质:S H 2 单质 化合物 碱:Ca(OH)2 NH 3·H 2O 盐:CaCO 3 酸:H 2SO 4 CH 3COOH 氧化物:CaO H 2O
3、当分散剂是水或其他液体时,如果按照分散质粒子的大小来分类,可以把分散系分为溶液、胶体和浊液。三种分散系的比较: 4、胶体及其性质 (1)定义:分散质粒子直径在1nm~100nm之间的分散系,叫胶体。 ②将烧杯中蒸馏水加热至沸腾; ③向沸水中滴加1~2mL FeCl3饱和溶液; ④继续煮沸至溶液呈红褐色,停止加热。 化学方程式:FeCl3+3H2O=Fe(OH)3(胶体)+3HCl (3)性质:当光束通过胶体时,由于胶体粒子对光线散射,而形成了一条光亮的“通路”,这种现象叫做丁达尔效应。
高中化学物质的分类及转化试题经典(1) 一、高中化学物质的分类及转化 1.X、Y、Z、W各代表一种物质,若X+Y=Z+W,则X和Y的反应不可能是( ) A.盐和盐的反应B.碱性氧化物和水的反应 C.酸与碱的反应D.酸性氧化物和碱的反应 【答案】B 【解析】 【详解】 A. 盐和盐反应能生成两种新盐,故A正确; B. 碱性氧化物和水的反应生成相应的碱,只生成一种物质,故B错误; C. 酸和碱反应生成盐和水,故C正确; D. 碱和酸性氧化物反应生成盐和水,故D正确; 故选:B. 【点睛】 根据题干提供的信息可以看出此反应为两种物质反应生成两种物质的反应,可以从具体的反应进行完成. 2.在给定条件下,下列选项所示的物质间转化均能实现的是() A.Fe(s) Fe2O3FeCl3(aq) B.CuO Cu(NO3)2(aq) Cu(NO3)2(s) C.SiO2(s) H2SiO3(s) Na2SiO3(aq) D.N2(g) NH3(g) NO(g) 【答案】D 【解析】 【分析】 【详解】 A.铁与水蒸汽反应生成四氧化三铁,故A不选; B.Cu(NO3)2(aq)加热要水解,产生氢氧化铜和硝酸,硝酸易挥发,水解平衡右移,得不到Cu(NO3)2(s),故B不选; C.二氧化硅不溶于水也不与水反应,故C不选; D.氮气与氢气合成氨气,氨气催化氧化生成NO,故D选; 故选D。 【点睛】 本题综合考查元素化合物知识,侧重于元素化合物知识的综合理解和运用的考查,注意相关基础知识的积累,易错点C,二氧化硅不溶于水也不与水反应。 3.下列各项操作中不发生先沉淀后溶解现象的是()
①向饱和碳酸钠溶液中通入过量CO 2②向Fe(OH)3胶体中逐滴滴入过量的H 2SO 4 ③向Ba(NO 3)2溶液中通入过量SO 2④向石灰水中通入过量CO 2 ⑤向硅酸钠溶液中滴入过量的盐酸. A .①②③ B .①②⑤ C .①②③⑤ D .①③⑤ 【答案】D 【解析】 【分析】 【详解】 ①中发生的反应是Na 2CO 3+CO 2+H 2O=2NaHCO 3,NaHCO 3比Na 2CO 3溶解度小但质量大,且反应中中消耗H 2O ,所以有沉淀析出且不溶解,符合;②向Fe(OH)3胶体中加入H 2SO 4首先发生胶体的聚沉,出现Fe(OH)3沉淀,H 2SO 4过量,Fe(OH)3与H 2SO 4反应而溶解,不符合;③硝酸钡溶液中通入二氧化硫,二氧化硫溶于水生成亚硫酸,酸性溶液中硝酸根离子具有强氧化性,能氧化亚硫酸为硫酸,溶液中生成硫酸钡沉淀,现象是只生成沉淀,③符合;④向澄清石灰水中通入过量的CO 2,先生成碳酸钙沉淀,后沉淀溶解生成碳酸氢钙溶液,反应现象是先沉淀后溶解,不符合;⑤向硅酸钠溶液中滴入过量的盐酸,发生反应Na 2SiO 3+2HCl=H 2SiO 3↓+2NaCl ,只生成白色沉淀,符合;答案选D 。 【点睛】 本题考查常见物质的的化学反应与现象。向溶液中加入某物质,先出现沉淀后沉淀溶解的总结如下: (1)向澄清石灰水中通入CO 2(SO 2)至过量。 (2)向Fe(OH)3胶体中加入硫酸至过量 (3)向可溶性铝盐中加入NaOH 溶液至过量 (4)向偏铝酸盐中加入盐酸至过量 4.下列说法正确的是( ) A .升高温度能提高活化分子的比例,从而加快反应速率 B .胶体和溶液的本质区别是有无丁达尔效应 C .将3FeCl 饱和溶液滴入NaOH 溶液中,可获得3Fe(OH)胶体 D .2CO 与2SiO 都属于酸性氧化物,都能与水反应生成相应的酸 【答案】A 【解析】 【分析】 【详解】 A .升高温度单位体积内活化分子总数增大,活化分子百分含量增大,发生有效碰撞的几率增大,反应速率加快,故A 正确; B .胶体和溶液的本质区别是分散质粒子的直径大小不同,胶体能产生丁达尔效应,溶液不能,可用丁达尔效应区分二者,但丁达尔效应不是本质区别,故B 错误; C .将3FeCl 饱和溶液滴入NaOH 溶液中,获得3Fe(OH)沉淀,制备3Fe(OH)胶体应将饱和
1、《六顶思考帽》作者:爱德华·德·波诺推荐理由:帮助员工变得更富有创造力,能轻易的集中或引导思维、对话或者会议。 2、《思维导图》作者:东尼·博赞推荐理由:思维导图可以应用于生活和工作的各个方面,包括学习、写作、沟通、演讲、管理、会议等,运用思维导图带来的学习能力和清晰的思维方式会改善人的诸多行为表现。 3、《笑着离开惠普》作者:高建华推荐理由:作者曾在中国惠普公司工作15 年,从助理工程师做到惠普决策委员会成员。在本书中作者用平淡、朴实的语言讲述着惠普的种种制度、文化。他甚至教我们实用的管理技巧。没有玄乎高深的理论,只有简单可行的方法。 4、《第五项修炼》作者:彼得·圣吉推荐理由:彼得·圣吉在研究中发现,要使企业茁壮成长,必须建立学习型组织,即将企业变成一种学习型的组织,并使得组织的人员全心投入学习,提升能力在本职岗位上获得成功。《第五项修炼》的五项修炼概括地说:自我超越、改善心智模式、建立共同愿景、团队学习、系统思考。 5、《契约精神》作者:汪中求推荐理由:改革开放前三十年,中国充满着“粗放增长”的机会未来中国三十年;中国必然建立具有“契约精神”的新商业文明。一部公务员、企业老板、员工的必读书。 6、《杜拉拉升职记》作者:可推荐理由:主人公是典型的中产阶级代表,没有背景,受过较好的教育,靠个人奋斗获取成功。对于职场新人来说,他的经历比名人传记更好用,对于新人快速了解办公室政治,融入团队有很好的指导意义,已经是职场新人与新员工培训必读本。 7、《人事第一》推荐理由:入门初级参考, 重点企业的文化建设和人力资
源的发展, 适合刚入门的人力资源们来看看。 8、《回归人本》作者:秋华推荐理由:系统的简述了每位经理人遇到的问题, 指明了人力资源的工作方向。 9、《管理的实践》作者:彼得·德鲁克推荐理由:《管理的实践》一书即以管理的本质切入——就管理者的角色、职务、功能的认知及其未来面临的挑战,有着精辟独到的见解,掀开了管理的奥秘与实务。本书以“管理企业、管理管理者、管理员工和工作”三项管理的任务,贯穿整本书的主轴和精髓,并以八个关键成果领域、三个经。《管理的实践》提供了观念、原则和工具,是一套极具系统化的管理知识。 10、《影响力》作者:罗伯特·西奥迪尼推荐理由:自出版以来,这本书就一直是最为畅销的书。由于它的影响,使得劝说成为一门科学。无论你是普通人还是为某一产品或事业、观点游说的人,这都是一本最最基本的书,是你理解人们心理的基石。 11、《没有任何借口》推荐理由:迅速地改变在精神力量的智慧书;西点军校“没有任何借口”理念最实用的解读版本;美国著名培训机构的员工培训经典教材;西方企业进行部素质训练的人性读本;一流企业提升凝聚力的核心价值。 12、《猎头局中局》推荐理由:其实猎头最能通俗的诠释该如何做一个合格的HR ,尤其是在修炼。 13、《牌桌阅人术》作者:(美)乔·纳瓦罗(美)马文·卡林斯推荐理由:扑克玩得好,三分靠运气,三分靠数学逻辑,还有四分就是靠诈唬。因此,高明的牌手在苦心钻研数学推理的同时,也不断从一次次的失败中吸取经验教
高中化学常见物质的分类 一、单质 按元素组成分为 1. 金属单质 K 钾、Ca 钙、Na 纳、Mg 镁、Al 铝、Zn 锌、Fe 铁、Sn 锡、Pb 铅、Cu 铜、Hg 汞、Ag 银、Pt 铂、Au 金 2. 非金属单质 氢气H 2、碳C 、氮气N 2、氧气O 2、臭氧O 3、氟气F 2、硅Si 、磷P 、硫S 、氯气Cl 2、液溴Br 2、碘I 2、氦气He 、氖气Ne 、氩气Ar 、 二、化合物 1. 有机化合物: 乙醇、甲烷、乙烷、乙烯、葡萄糖等 2. 无机化合物 三、氧化物 (1)按元素组成分为金属氧化物和非金属氧化物 1. 金属氧化物 氧化钠Na 2O 、过氧化钠Na 2O 2、氧化钙CaO 、氧化镁MgO 、氧化铝Al 2O 3、氧化锌ZnO 、氧化铁Fe 2O 3、氧化亚铁FeO 、四氧化三铁Fe 3O 4、氧化铜CuO 、氧化汞HgO 、七氧化二锰Mn 2O 7 2. 非金属氧化物 水H 2O ,过氧化氢H 2O 2、一氧化碳CO 、二氧化碳CO 2、一氧化氮NO 、五氧化二氮N 2O 5、二氧化硅SiO 2、五氧化二磷P 2O 5、二氧化硫SO 2、三氧化硫SO 3 (2)按照性质分为 碱性氧化物、酸性氧化物、不成盐氧化物、两性氧化物、过氧化物 1. 碱性氧化物 大部分的金属氧化物为碱性氧化物,但有特例:过氧化钠Na 2O 2为过氧化物、 氧化铝Al 2O 3为两性氧化物、七氧化二锰Mn 2O 7为酸性氧化物、四氧化三铁Fe 3O 4、 碱性氧化物有:氧化钠Na 2O 、氧化钙CaO 、氧化镁MgO 、氧化锌ZnO 、氧化铁Fe 2O 3、氧化亚铁FeO 、氧化铜CuO 、氧化汞HgO 、 碱性氧化物一定为金属氧化物,金属氧化物不一定为碱性氧化物 2. 酸性氧化物 大部分的非金属氧化物为,但有特例:水H 2O ,一氧化碳CO 、一氧化氮NO 不是酸性氧化物,七氧化二锰Mn 2O 7虽然为金属氧化物但属于酸性氧化物、 非金属氧化物不一定为酸性氧化物 3. 不成盐氧化物:——既不与酸反应也不与碱反应!如:一氧化碳CO 、一氧化氮NO ! 4. 两性氧化物:氧化铝Al 2O 3 5. 过氧化物:过氧化氢H 2O 2、过氧化钠Na 2O 2 四、酸 中学常见的酸:
课题:物质的分类(第一课时)教学设计 单位:XXXXXXXXXX 作者:XXXXXX
课题:物质的分类(第一课时)教学设计 单位:XXXXXXXXXXXXX 作者:XXXXXX 一、教材分析 本部分教学内容位于新课标人教版高中必修化学1第二章《化学物质及其变化》的第一节《物质的分类》。本章是高中化学阶段学生认识学科内容的第一章,是连接初中与高中化学的桥梁与纽带,起到了承上启下的重要作用,承上即帮助学生对九年义务教育的化学学习进行回忆性复习,启下即引导学生有效地开展高中阶段的学习,为学生学习后续课程打下坚实的基础。通过对本章节的学习,学生对科学的分类方法有了更深刻的认识,有利于发展自身科学素养。因此,本章在全书中占有特殊的地位,具有重要的功能,是整个高中化学的教学重点之一。 二、教学内容分析 人们想要对数以千万种的化学物质进行研究,认识它们的规律,就必须先将它们进行科学的分类。本章的基本线索就是对化学物质及其变化的分类。从分类这一知识点来说,学生在初中化学有过初步的学习,即纯净物的分类。本节是对物质的分类内容的细化,通过对“交叉法”“树状分类法”的提出与讲解,更进一步的使学生理解并掌握科学分类的方法,从而将其有效地应用于化学学习。 三、学情分析 本节的教学对象是刚上高一的学生,此时学生的特点是处于初中与高中学习的过渡期。在知识基础上,具有了一定的逻辑思维能力及认知能力,掌握了相当水平的化学知识如纯净物、混合物、酸、碱和盐的相关规律,初步了解物质分类的涵义及思想,具备了接收新知识的能力;在思想上,处于从直觉型思维向抽象思维过渡的时期,并未将分类法作为化学学习的基础。本节教学内容正是对初中化学知识的回顾与总结,以科学的分类法为引导,帮助学生形成分类观,开启高中化学学习新方向。 四、教学目标 教学目标的制定以课程标准对本部分的教学要求(能根据物质的组成和性质对物质进行分类)为主,结合本部分教学内容在教材中的地位作用及学情,制定如下: 1、知识与技能目标 (1)能根据物质的组成和性质对物质进行分类。
物质的分类
1.混合物:是由两种或两种以上的物质混合而成(或由不同种物质组成) 例如,空气,溶液(盐酸、澄清的石灰水、碘酒、矿泉水), 矿物(煤、石 油、天然气、铁矿石、石灰石),合金(生铁、钢) 注意:氧气和臭氧混合而成的物质是混合物,红磷和白磷混合也是混合物。纯净物、混合物与组成元素的种类无关。即一种元素组成的物质可能是纯净物也可能是混合物,多种元素组成的物质可能是纯净物或混合物。 2.纯净物:由一种物质组成的。 例如:水、 水银、 蓝矾(CuSO 4 ·5H 2 O)都是纯净物 冰与水混合是纯净物。 名称中有“某化某”“某酸某”的都是纯净物,是化合物。 注意:由同一种元素构成的物质不一定是纯净物(如O 2 、O 3 );具有相同组成(如最简式、分子式相同)的物质也不一定是纯净物。比如金刚石和石墨。 3.单质:由同种(或一种)元素组成的纯净物。例如:铁 氧气(液氧)、氢气、水银。 4.化合物:由不同种(两种或两种以上)元素组成的纯净物。名称中有“某化某”“某酸某”的是化合物。 5.有机物(有机化合物):含碳元素的化合物(除CO 、CO 2 和含碳酸根化合物外) 无机物:不含碳元素的化合物以及CO 、CO 2 和含碳酸根的化合物 6. 氧化物:由两种元素组成,其中一种是氧元素的化合物。 a.酸性氧化物:跟碱反应生成盐和水的氧化物。CO 2 ,SO 2 ,SO 3 大部分非金属氧化物都是酸性氧化物,跟水反应生成同价的含氧酸。 CO 2 + H 2O= H 2CO 3 SO 2 + H 2O= H 2SO 3 SO 3 + H 2O= H 2SO 4
b.碱性氧化物:跟酸反应生成盐和水的氧化物。CaO Na 2O MgO Fe 2 O 3 CuO 大部分金属氧化物都是碱性氧化物,BaO K 2O CaO Na 2 O溶于水立即跟水反 应生成相应的碱,其他碱性氧化物不溶于水,跟水不反应。 CaO+H2O=Ca(OH)2 BaO+H2O=Ca(OH)2 Na2O+H2O=2NaOH K2O+H2O=2KOH c.注意:CO和H2 O既不是酸性氧化物也不是碱性氧化物,是不成盐氧化物。 7.酸:电离时生成的阳离子全部是氢离子的化合物。酸溶液的pH值小于7 酸的名称中最后一个字是“酸”,通常化学式的第一种元素是“H ”,酸由氢和酸根离子组成紫色石蕊试液遇酸变红色,无色酚酞试液遇酸不变色 根据酸的组成,通常有以下两种分类方法: 酸的电离方程式:酸=nH++酸根离子n- a.根据酸分子电离所能生成的氢离子的个数分为:一元酸(HCl、HNO 3 )、二元 酸(H 2 SO 4 、H 2 S、H 2 CO 3 )和三元酸(H 3 PO 4 ) b.根据酸分子里有无氧原子分为: 含氧酸(H 2 SO 4 ,HNO 3 , H 3 PO 4 名称为:某酸) 无氧酸(HCl, H 2 S名称为:氢某酸) 鉴定酸(鉴定H+)的方法有:①加紫色石蕊试液变红色的是酸溶液;②加活泼金属Mg、Fe、Zn等有氢气放出 8.碱:电离时生成的阴离子全部是氢氧根离子的化合物。碱通常由金属离子和氢氧根离子构成 溶碱有五种:钾钙钠钡氨(KOH,Ca(OH) 2,NaOH, Ba(OH) 2 ,氨水)它们的溶液 无色。 有颜色的碱(不溶于水):红褐色的氢氧化铁(Fe(OH) 3 ↓ )、蓝色的氢氧化铜 (Cu(OH) 2 ↓) 其他固体碱是白色。碱的名称通常有“氢氧化某”,化学式的最后面是“OH”
高中化学物质的分类汇总 高中化学物质的分类知识点总结 1、物质的组成、性质和分类: (一)掌握基本概念 1. 分子 分子是能够独立存在并保持物质化学性质的一种微粒。 (1)分子同原子、离子一样是构成物质的基本微粒。 (2)按组成分子的原子个数可分为: 单原子分子:Ne 、C、 He 、Kr…… 双原子分子:H2 、O2、HCl、No…… 多原子分子:H2O、P4 、C6H12O6…… 2. 原子 原子是化学变化中的最小微粒,确切的说,化学反应中原子核不变,只有核外电子发生变化。 (1)原子是组成某些物质(如金刚石、晶体硅、二氧化硅等原子晶体)和分子的基本微粒。 (2)原子是由原子核(中子、质子)和核外电子组成的。 3. 离子 离子是指带电荷的原子或原子团。 (1)离子可分为阳离子和阴离子 阳离子:Li+、Na+、H+、NH4+…… 阴离子:Cl-、O2-、OH-、SO4-…… (2)存在离子的物质: ①离子化合物中:NaCl、CaCl2、CaSo4…… ②电解质溶液中:盐酸、氯化钠溶液中…… ③金属晶体中:钠、铁、钾、铜…… 4. 元素 元素是具有相同核电荷数的(即质子数)的同一类原子的总称。 (1)元素与物质、分子、原子的区别与联系;物质是由元素组成的(宏观看);物质是由原子、分子、或离子构成的(微观看)。 (2)某些元素可以形成不同的单质(性质、结构不同)同素异形体。(3)各元素在地壳中质量分数各不相同,占前五位的是:O、Si、Al、
Fe、Ga。 5. 同位素 同位素指同一元素不同核素之间互称同位素,即具有相同质子数不同中子数的同一类原子互称为同位素。如氢(H)有三种同位素:11H、 21H、31H(氕、氘、氚)。 6. 核素 核素是具有特定质量数、原子序数和核能态,而且其寿命足以被观察的一类原子。 (1)同种元素,可以有若干种不同的核素—同位素。 (2)同一种元素的各种核素尽管中子数不同,但他们质子数与电子数相同。核外电子排布相同,因而他们的化学性质几乎相同。 7. 原子团 原子团是指多个原子结合成的集体,在许多反应中,原子团作为一个集体参加反应。原子团有以下几种类型:根(如SO42-、OH-、CH3COO-等)、官能团(有机物分子中能反应物质特殊性质的原子团,如-OH、 -NO2、-COOH等)、游离基(又称自由基、具有不成价电子的原子团,如甲基游离基·CH3)。 8. 基 化合物中具有特殊性质的一部分原子或原子团,或化合物分子中去掉某些原子或原子团后剩下的原子团。 (1)有机物的官能团是决定物质主要性质的基,如醇的羟基(-OH)和羧酸的羧基(-COOH)。 (2)甲烷(CH4)分子中去掉一个氢原子后剩余部分(·CH3)含有未成对的价电子,称为甲基或甲基游离基,也包括单原子的游离基(·Cl)。 基(羟基):电中性,不能独立存在,只能和其他基或原子团相结合。根(氢氧根):带负电,能独立存在于溶液或离子化合物中。 9. 物理性质和化学性质 物理性质 (1)概念:(宏观)物质不需要发生化学变化就能表现出的性质。(2)实质:(微观)物质的分子组成和结构没有发生变化时所呈现的性质。 (3)物理性质一般包括:颜色、状态、气味、味道、密度、熔点、沸点、溶解性、导电性、导热性、延展性等。 化学性质
一、初中化学常见物质的分类 1、单质:非惰性气体一般由两个原子组成: F2,O2,H2,Cl2 2、惰性气体:一般由一个原子组成:He,Ne,Ar,Kr,Xe 3、化合物:氢化物居多:H2S,HCl,H3P,HF,HBr,HI 二、初中化学常见物质的颜色 (一)、固体的颜色 1、红色固体:铜,氧化铁 2、绿色固体:碱式碳酸铜 3、蓝色固体:氢氧化铜,硫酸铜晶体 4、紫黑色固体:高锰酸钾 5、淡黄色固体:硫磺 6、无色固体:冰,干冰,金刚石 7、银白色固体:银,铁,镁,铝,汞等金属 8、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭) 9、红褐色固体:氢氧化铁 10、白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜, 五氧化二磷,氧化镁 (二)、液体的颜色 11、无色液体:水,双氧水 12、蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液 13、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液 14、黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液 15、紫红色溶液:高锰酸钾溶液 16、紫色溶液:石蕊溶液 (三)、气体的颜色 17、红棕色气体:二氧化氮 18、黄绿色气体:氯气 19、无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢等气体。 三、初中化学敞口置于空气中质量改变的 (一)质量增加的 1、由于吸水而增加的:氢氧化钠固体,氯化钙,氯化镁,浓硫酸; 2、由于跟水反应而增加的:氧化钙、氧化钡、氧化钾、氧化钠,硫酸铜; 3、由于跟二氧化碳反应而增加的:氢氧化钠,氢氧化钾,氢氧化钡,氢氧化钙;(二)质量减少的 1、由于挥发而减少的:浓盐酸,浓硝酸,酒精,汽油,浓氨水; 2、由于风化而减少的:碳酸钠晶体。 四、初中化学物质的检验 (一)、气体的检验 1、氧气:带火星的木条放入瓶中,若木条复燃,则是氧气.
物质的分类 一、常见的分类方法 1.交叉分类法:对物质依据____________进行分类。 例: 2.树状分类法:对_______按照某种属性进行分类。如: 【思维拓展】冰水混合物为混合物这句话对吗?金刚石和石墨均是由碳元素组成的单质,因此金刚石和石墨混合在一起为混合物,这句话对吗? 例1.将下列各组物质按单质、氧化物、酸、碱、盐分类顺序排列,其中正确的是( ) A.银、干冰、硫酸、烧碱、食盐 B.碘酒、冰、盐酸、烧碱、食盐 C.氢气、二氧化硫、硝酸、烧碱、硝酸钾 D.铜、氧化铜、醋酸、石灰水、氯化铜 例2.如图表示的是纯净物、单质、化合物、含氧化合物、氧化物、碱之间的包含、不包含关系,若整个大圆圈代表纯净物,则下列选项中,能正确指出①、②、③、④、⑤所属物质类别的是( ) A .①单质、③化合物 B .②碱、⑤氧化物 C .②化合物、⑤含氧化合物 D .④含氧化合物、③氧化物 【易错警示】物质分类中的易错点小结 (1)概念间的关系——“并列”与“包含” ①并列关系:纯净物与混合物,单质与化合物,酸、碱、盐与氧化物。 ②包含关系:纯净物>化合物>氧化物。 (2)酸性氧化物和碱性氧化物的概念 ①酸性氧化物是与碱反应生成盐和水的氧化物; ②碱性氧化物是与酸反应生成盐和水的氧化物。 (3)酸的元数是酸电离出H +的个数,而不是分子中氢原子的个数,如醋酸是一元酸而不是四元酸。 二、分类法的应用——物质间的转化 金属→碱性氧化物→碱→盐 非金属→酸性氧化物→酸→盐 如:钙→氧化钙→氢氧化钙→碳酸钙 碳→二氧化碳→碳酸→碳酸钙 写出以上各步的化学方程式: 【思维拓展】碱和盐反应时符合什么条件才能发生?试举例说明。
《物质的分类(第一课时)》教学设计 一、教学分析 1.内容分析 本课时选自人教版必修1第2章第一节,属于典型的化学核心观念知识。第一章已经从化学研究手段学习了化学实验验观和定量分析观,这一章旨在从化学学科观念(元素观、分类观、转化观、离子反应观、氧化还原观)出发,引领学生后面进一步学习元素化合物知识。因此,本节内容的主要功能与价值在于: 1). 将已有较为零散的生活经验和知识和已有知识上升到较为系统的化学思想方法——元素观、分类观、转化观; 2).元素观、分类观可以帮助我们快速寻找、认识纷繁多样的化学物质; 3).分类观可以帮助我们高效学习、研究陌生物质的性质; 4).丰富对物质认识的角度,为元素化合物知识的学习提供重要视角。 2.课标及学情分析 课程目标:能根据物质的组成和性质对物质进行分类。 学生已有知识:1).对物质的初步分类; 2).生活中的分类及其作用(感性认识)。 学生已有能力:1).能利用分类法解决生活中的一些实际问题; 2).初步的分析、归纳、表达能力。 学生可能的发展障碍点:1).熟练地根据物质性质及组成对物质进行多角度分类; 2).元素观、分类观、转化观的形成和应用。 二、教学目标 (一)知识与技能 1. 了解树状分类法和交叉分类法; 2. 初步认识较为系统的核心分类; 3. 复习、整理酸类物质的通性。 (二)过程与方法(重难点) 1. 能从物质的组成和性质对物质进行多角度分类; 2. 熟悉从类别角度预测、学习物质性质的一般步骤; 3. 初步掌握不同类别物质间相互转化的方法。 (三)情感态度价值观 1.通过讨论活动,认识到分类的关键在于制定标准,制定标准的关键在于分析组成和性质差别; 2. 通过探究活动,体验从分类角度寻找、认识、研究物质性质的过程 三、教学策略 问题及任务驱动、小组合作、情境创设