第一章物质结构元素周期律
第一节元素周期表
知识回顾:
1、原子的结构:
肿f时示F
原子是由原子核和电子组成;原子核由质子和中子组成
原子的质量集中在原子核上,电子的质量很小,几乎可以忽略不计
一个质子带一个单位的正电荷,一个电子带一个单位的负电荷,中子不带电,所以原子对外显中性
2、元素的定义:具有相同核电荷数(质子数)的一类原子的总称
一、元素周期表的结构
1、原子序数
原子序数=核电荷数=质子数=核外电子数
2、周期
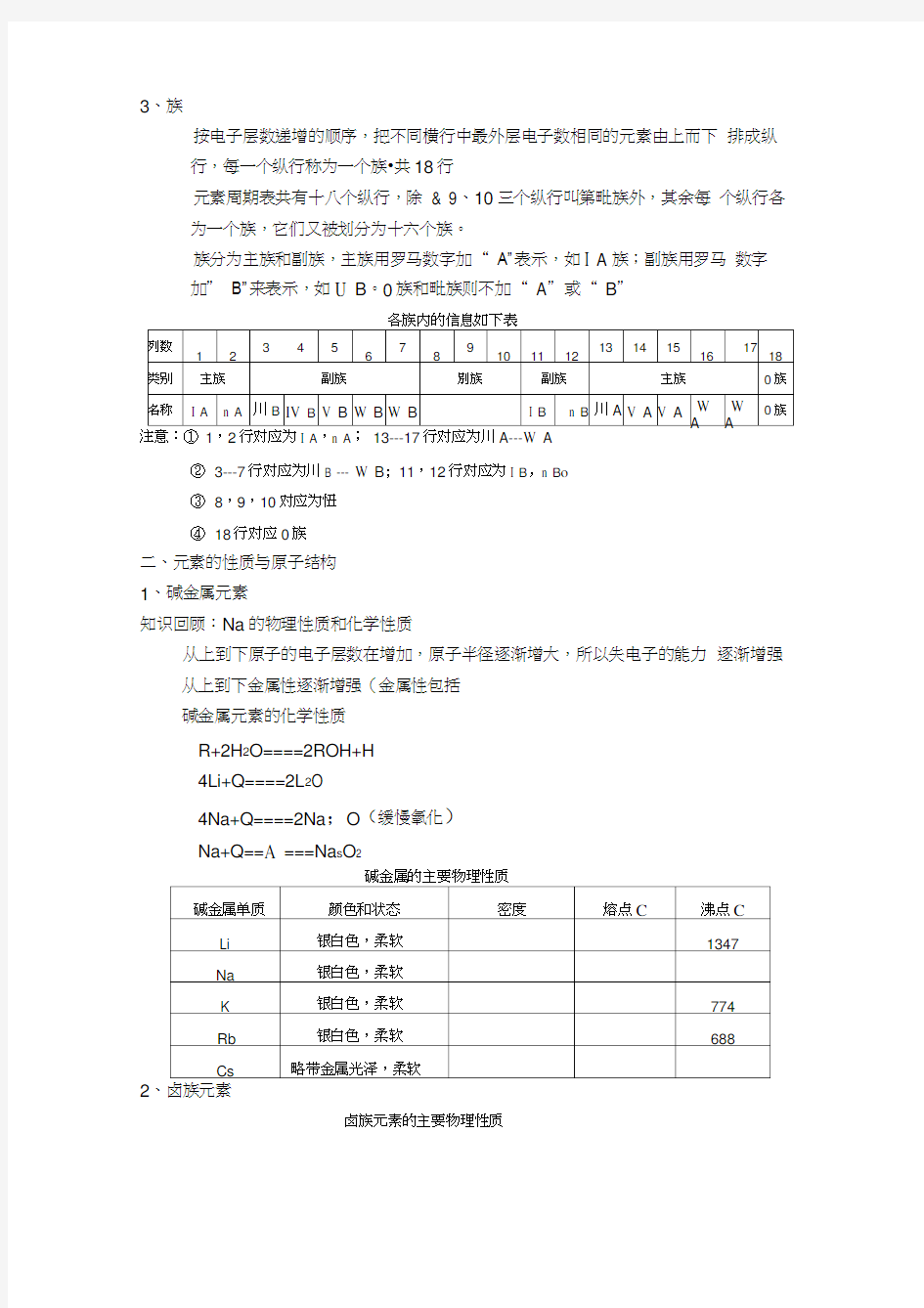
按原子序数递增的顺序,把电子层数相同的元素自左向右排成横行,每行叫做一个周期。
元素周期表共有七个周期,从上到下依次命名为第一周期、第二周期等
各周期内的信息表
3、族
按电子层数递增的顺序,把不同横行中最外层电子数相同的元素由上而下排成纵行,每一个纵行称为一个族?共18行
元素周期表共有十八个纵行,除& 9、10三个纵行叫第毗族外,其余每个纵行各为一个族,它们又被划分为十六个族。
族分为主族和副族,主族用罗马数字加“ A”表示,如I A族;副族用罗马数字
加” B”来表示,如U B。0族和毗族则不加“ A”或“ B”
注意:① 1,2行对应为I A,n A;13---17行对应为川A---A
②3---7行对应为川B --- W B; 11,12行对应为I B,n B o
③8,9,10对应为忸
④18行对应0族
二、元素的性质与原子结构
1、碱金属元素
知识回顾:Na的物理性质和化学性质
从上到下原子的电子层数在增加,原子半径逐渐增大,所以失电子的能力逐渐增强从上到下金属性逐渐增强(金属性包括
碱金属元素的化学性质
R+2H2O====2ROH+H
4Li+Q====2L2O
4Na+Q====2Na;O(缓慢氧化)
Na+Q==A ===Na s O2
2
卤族元素的主要物理性质
从上到下电子层数依次增加,原子半径依次增加,所以得电子的能力也依次减弱,即非金属性依次减弱(非金属性包括
单质溴是唯一在常温常压下呈液态的非金属单质
卤素的化学性质
X-+Ag+======Ag刈(AgCI为白色沉淀,AgBr为淡黄色沉淀,Agl为黄色沉淀)
X2+H2O=====HX+HXO
F2+H2O=====HF+O
Fe+C2=====2FeQ
Fe+2=====Fe2
、核素
1质量数
将原子核内所有质子和中子的相对质量取近似整数值相加,所得到的数值
叫质量数
质量数(A)=质子数(Z)+中子数(N)
2、核素
具有一定数目质子和一定数目中子的一种原子叫做核素
质子数相同而中子数不同的同一元素的不同原子互为同位素
当某种元素具有两种或两种以上天然、稳定的同位素时,无论是在单质还是在化合物里,任意一种同位素在该元素内所占的原子数目百分比都不变
4、同素异形体
指同种元素形成的不同单质,它们之间互称为同素异性体。
第二节元素周期律