
化学初中化学化学计算题练习题
一、中考化学计算题
1.某实验小组用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他决定利用该废液,测定Na2CO3溶液中溶质的质量分数。他将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如图所示。
(1)在加入Na2CO3溶液的过程中,开始时没有发现沉淀生成,说明滤液中的溶质有
________。
(2)计算Na2CO3溶液中溶质的质量分数________。(计算结果精确到0.1%)(反应的方程式:Na2CO3+CaCl2=CaCO3↓+2NaCl)
【答案】CaCl2、HCl 26.5%
【解析】
【分析】
碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠,稀盐酸和碳酸钠反应生成氯化钠和水和二氧化碳。
【详解】
(1)根据已知条件可知,开始时没有发现沉淀生成,说明滤液中除了CaCl2还有其他物质,由第一个实验可以推断,这种物质是稀盐酸。
(2)分析图意可知,有20g23
Na CO溶液与氯化钙溶液全部反应,生成5g碳酸钙沉淀,根据反应的化学方程式,设20gNa2CO3溶液中溶质的质量为x,
2323
Na CO+CaCl=CaCO+2NaCl
106100
x5g
↓
106x
=
1005g
x 5.3g
=
Na2CO3溶液中溶质的质量分数为
5.3g
25g-5g
100%26.5%
?=
答:Na2CO3溶液中溶质的质量分数为26.5%。【点睛】
开始时没有发现沉淀生成,说明滤液中除了CaCl2还有稀盐酸,
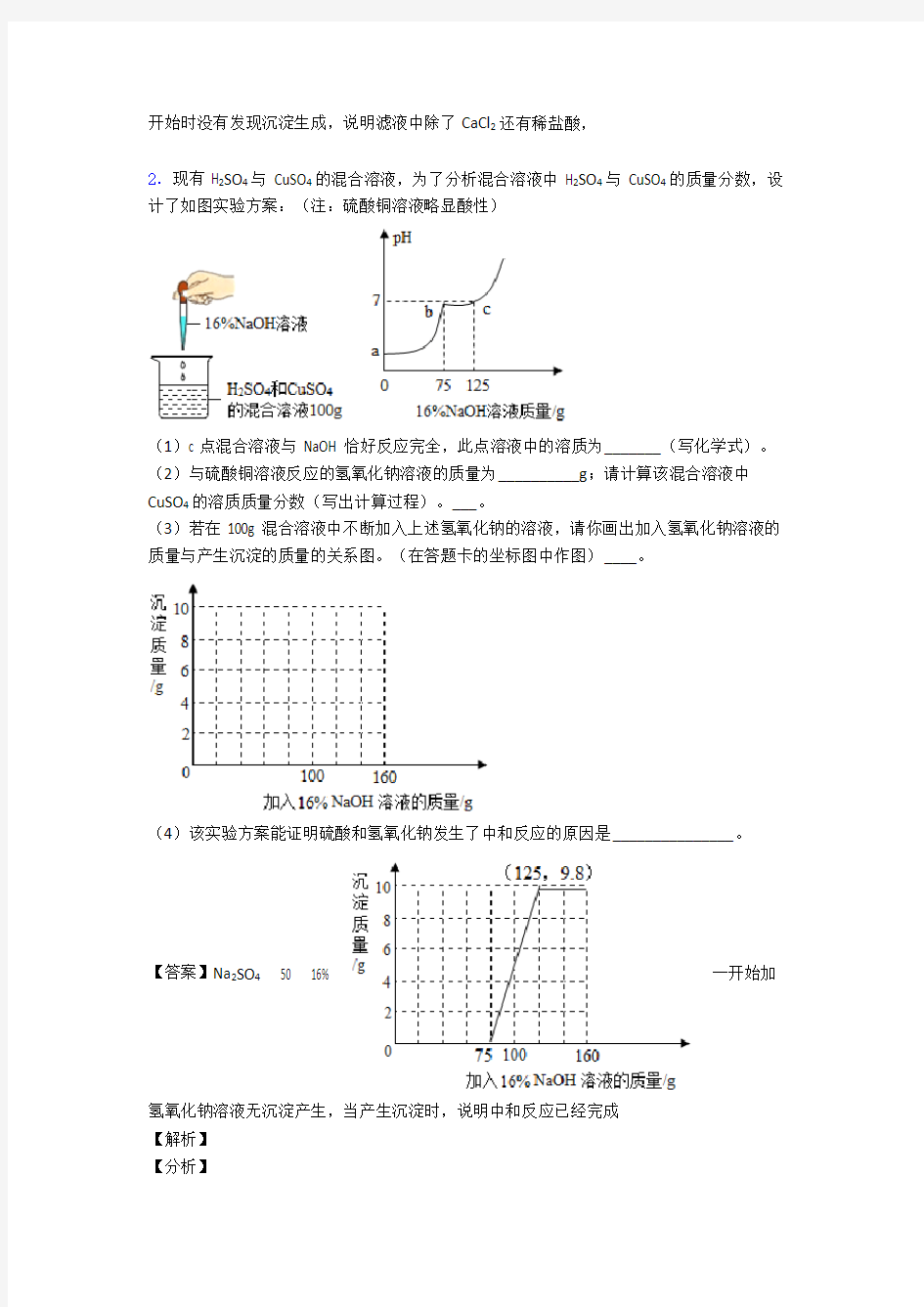
2.现有 H2SO4与 CuSO4的混合溶液,为了分析混合溶液中 H2SO4与 CuSO4的质量分数,设计了如图实验方案:(注:硫酸铜溶液略显酸性)
(1)c 点混合溶液与 NaOH 恰好反应完全,此点溶液中的溶质为_______(写化学式)。(2)与硫酸铜溶液反应的氢氧化钠溶液的质量为__________g;请计算该混合溶液中CuSO4的溶质质量分数(写出计算过程)。___。
(3)若在 100g 混合溶液中不断加入上述氢氧化钠的溶液,请你画出加入氢氧化钠溶液的质量与产生沉淀的质量的关系图。(在答题卡的坐标图中作图)____。
(4)该实验方案能证明硫酸和氢氧化钠发生了中和反应的原因是_______________。
【答案】Na2SO4 50 16% 一开始加
氢氧化钠溶液无沉淀产生,当产生沉淀时,说明中和反应已经完成
【解析】
【分析】
【详解】
(1)在c 点,混合溶液与NaOH 恰好反应完全,此点溶液中的溶质是Na 2SO 4; (2)由图乙中pH 的变化可以知道,与硫酸铜反应的氢氧化钠的质量为:125g-75g=50g ; 解:设该混合溶液中 CuSO 4的溶质质量分数为x 。氢氧化铜的质量为y 。
4224
CuSO +2NaOH ==Cu(OH)+Na SO 1608098
100g x
50g 16%
y
↓??
16080
98
=100g x 50g 16%y
=??
x=16% ;y=9.8g
答:该混合溶液中CuSO 4的溶质质量分数为16%。故填:16%
(3)若在100 g 混合溶液中不断加入上述氢氧化钠溶液,由图可知,一开始是氢氧化钠先与硫酸反应,当氢氧化钠加入到75g 时,氢氧化钠开始与硫酸铜反应,有沉淀产生,继续加入氢氧化钠,沉淀增加,当氢氧化钠加入到125g 时,硫酸铜已经反应完毕,产生氢氧化铜的质量由(2)得为9.8g 。故完全反应点的坐标为:(125,9.8);再继续加入氢氧化钠,沉淀不再增加;加入氢氧化钠溶液的质量与产生沉淀的质量的关系如图所示。
(4)由图可知,该实验方案证明硫酸和氢氧化钠发生了中和反应的现象是:一开始加氢氧化钠溶液无沉淀产生,当产生沉淀时,说明中和反应已经完成,故填:一开始加氢氧化钠溶液无沉淀产生,当产生沉淀时,说明中和反应已经完成 【点睛】
根据加入氢氧化钠后没有立即出现沉淀,说明加入的NaOH 溶液先跟其中的硫酸反应,后跟硫酸铜反应;右图中pH 的变化分析与硫酸铜反应的氢氧化钠的质量;再根据氢氧化钠与硫酸铜反应的方程式计算硫酸铜的质量、生成的沉淀的质量等,即可进行有关的计算;右图中pH 的变化分析在c 点混合溶液与NaOH 恰好反应完全,据此判断溶液中的溶质;根据上述数据作出加入氢氧化钠溶液的质量与产生沉淀质量的关系图。
3.将含有可溶性杂质的某氯化钠样品3g 溶于足量水中得到不饱和溶液,再向所得溶液中小心滴入200g 一定溶质的质量分数的AgNO 3溶液(杂质不与AgNO 3溶液反应)。实验过程中,生成沉淀的质量与滴入AgNO 3溶液的质量关系如图所示。试计算:
(1)恰好完全反应时生成沉淀质量为_______g;
(2)原硝酸银溶液中溶质的质量分数是多少?_______。(结果精确到0.1%)
【答案】(1)5.74克(2)3.4%
【解析】
试题分析:由图可知,恰好完全反应时生成沉淀质量为5.74g
设硝酸银溶液中硝酸银的质量为X
NaCl + AgNO3=== AgCl↓ + NaNO3
170 143.5
X 5.74g
列比例式得:170:143.5= X:5.74g 解得:X ="6.8" g
硝酸银溶液中硝酸银的质量分数为6.8g/200g×100% ="3.4%"
考点:溶质的质量分数根据化学方程式的计算
4.欲测定盐酸与氯化钙的混合溶液中氯化钙的质量分数,进行了如下实验:取混合溶液100g于锥形瓶中,向其中逐渐加入一定溶质质量分数的碳酸钠溶液(如图一),并不断测定锥形瓶中溶液的pH.反应过程中所得溶液的pH与锥形瓶中物质的总质量的关系如图二所示。
其中,当锥形瓶中溶液的质量增加至147.8g时,共消耗碳酸钠溶液的质量为50g。(忽略二氧化碳在水中溶解的量;氯化钙溶液显中性。)
(1)m点的数值是___。
(2)a﹣b段表示碳酸钠与混合溶液中的___反应。
(3)b点的溶质为___。
(4)参加反应的碳酸钠溶液的溶质的质量分数是___。(写出计算过程)
(5)请计算原混合溶液中CaCl2的质量分数为___。(写出计算过程)
【答案】7 HCl 氯化钠和氯化钙 10.6% 11.1% 【解析】 【详解】
反应开始是盐酸和碳酸钠反应,所以pH 值慢慢增大,当盐酸反应完毕,此时pH =7,然后氯化钙和碳酸钠反应,pH 保持不变,氯化钙反应完毕后由于碳酸钠溶液显碱性,所以pH 继续变大,所以m =7。a ﹣b 段表示碳酸钠与混合溶液中的 HCl 反应。b 点是盐酸和碳酸钠恰好完全反应,此时的溶质为生成的氯化钠和尚未参加反应的氯化钙。设参加反应的碳酸钠溶液的溶质质量分数为x ,当锥形瓶中溶液的质量增加至147.8g 时,共消耗碳酸钠溶液的质量为50g ,即消耗的碳酸钠的质量为50g ,而溶液质量变化量即生成二氧化碳的质量:100g+50g ﹣147.8g =2.2g
2322Na CO +2HCl =2NaCl +H O +CO 1064450g?x
2.2g
↑
10650=44 2.2g x
g
? 解得x =10.6%
由于与氯化钙反应的碳酸钠溶液的质量为247.8g ﹣147.8g =100g ,则消耗的碳酸钠的质量为100g×10.6%=10.6g
设原混合溶液中CaCl 2的质量分数为y 223
3CaCl Na CO CaCO 2N +=+111106100g y
1a l
6g
C 0.↓g
,解得y =11.1% 答:(1)m 点的数值是7。
(2)a ﹣b 段表示碳酸钠与混合溶液中的盐酸反应。 (3)b 点的溶质为氯化钠、氯化钙。
(4)参加反应的碳酸钠溶液的溶质的质量分数是10.6%。 (5)请计算原混合溶液中CaCl 2的质量分数为11.1%。 【点睛】
反应开始是盐酸和碳酸钠反应,当盐酸反应完毕,然后氯化钙和碳酸钠反应。化学方程式的计算,关键是根据化学反应方程式找出相关物质的质量关系,利用反应中物质的质量比不变进行列比例式计算,易错点是由质量比算数错误,所以这一步要仔细检查。
5.实验室有一瓶未知浓度的BaCl 2溶液,某同学取出150g 该溶液于烧杯中,向其中逐滴加入溶质质量分数为26.5%的Na 2CO 3溶液。反应过程中生成沉淀的质量与所用Na 2CO 3溶液质量的关系如图所示。已知:BaCl 2+Na 2CO 3=BaCO 3↓+2NaCl 。请计算:
(1)配制26.5%的Na2CO3溶液80g,需要Na2CO3固体___g。
(2)BaCl2溶液的溶质质量分数是____?(写出计算过程,结果保留到0.1%)
【答案】(1) 21.2g;(2)13.9%
【解析】
试题分析:(1)根据溶质质量分数计算的表达式:配制26.5%的Na2CO3溶液80g,需要Na2CO3固体质量=80g×26.5%=21.2g
(2)从图甲中获知,当BaCl2完全转化为沉淀时消耗Na2CO3溶液的质量为40g,再根据化学反应方程式:BaCl2+Na2CO3=BaCO3↓+2NaCl中Na2CO3与BaCl2的质量关系,可求出BaCl2的质量,进而可求解BaCl2溶液的溶质质量分数
解:设BaCl2的质量为x
BaCl2+Na2CO3=BaCO3↓+2NaCl
208106
x40g×26.5%
208∶106=X∶(40g×26.5%)
x=208×40g×26.5%/106=20.8g
该BaCl2溶液的溶质质量分数=(20.8g/150g)×100%=13.9%
答:该BaCl2溶液的溶质质量分数为13.9%
考点:溶质质量分数计算,根据化学方程式计算
6.化学兴趣小组欲用如图某胃药标签进行物质成分分析.取20片该药片研碎放入烧杯中,再向烧杯中滴加稀盐酸至恰好完全反应(药品中其他成分不溶于水,也不参加反应),共消耗稀盐酸25g,待反应生成的气体全部逸出,测得烧杯内物质的总质量为30.6g.
请计算:
(1)药品中碳酸氢钠的质量分数;
(2)反应后所得溶液中溶质的质量分数.(计算结果精确是0.1%)
【答案】(1)8.4%;(2)20.2%
【解析】
(1)每片0.5g,20片该药剂的质量为0.5g×20=10g.
由质量守恒定律,生成二氧化碳气体的质量为10g+25g-30.6g =4.4g.
(2)设参加反应的碳酸氢钠的质量为x,生成氯化钠的质量为y
NaHCO3+HCl=NaCl+H2O+CO2↑
84 44 58.5
x 4.4g y
84/x=44/4.4g x=8.4g
117/y=44/4.4g y=5.85g
胃药中NaHCO3的质量分数为8.4g/10g×100%=84%.
反应后烧杯中溶液的质量为8.4g+25g﹣4.4g=29g.
反应后所得溶液中溶质的质量分数=5.85g÷29g×100%≈20.2%
答:设参加反应的碳酸氢钠的质量为x,生成氯化钠的质量为y
7.某化学活动小组用稀盐酸对赤铁矿Fe2O3含量进行测定(杂质不与盐酸反应且不溶于水),得到一黄色残液。为防止直接排放造成环境污染,对其组成进一步进行探究。过滤该残液,取100 g滤液,向其中不断加入5%和氢氧化钠溶液,所得实验数据如下表:
(1)通过对上述实验数据的分析,该滤液中含有的溶质是_______(写化学式)。
(2)选择合理的数据,计算100 g滤液中溶质的质量(若有多种溶质,任选一种。结果精确到0.01g)。
【答案】
【小题1】(2分)HCl FeCl3(写化学式)
【小题2】设滤液中HCl 的质量为x,X="1.83" g;设滤液中FeCl3的质量为y,y="8.13" g 【解析】
刚开始没有产生沉淀,说明残夜中含有盐酸,氢氧化钠先和盐酸反应了,氯化铁是氧化铁和盐酸反应的产物,故溶液中一定含有的溶质为HCl FeCl3;可以根据一共生成的沉淀量5.35g就可以求出氯化铁了。
【小题2】(4分)方法一:
解:设滤液中HCl 的质量为x。
NaOH + HCl===NaCl + H2O
40 36.5
40 g×5% x
40/40 g×5%=36.5/x
X="1.83" g
方法二:
解:设滤液中FeCl3的质量为y。
3NaOH + FeCl3 ======3NaCl + Fe(OH)3↓
162.5 107
y 5.35 g
162.5/y="107/5.35" g
y="8.13" g
8.将6.5g石灰石样品投入到36.5g稀盐酸溶液中制取二氧化碳气体,恰好完全反应。反应后将溶液过滤、干燥,称量剩余固体残渣的质量为1.5g(提示:①石灰石样品中的杂质不溶于水,也不发生反应;②反应后生成的氯化钙完全溶解)。计算:
(1)该石灰石样品中碳酸钙的质量是多少?
(2)反应后所得溶液的溶质质量分数为多少?(计算结果保留一位小数)
【答案】解:(1)碳酸钙的质量:6.5g-1.5g=5g………………………………(1分)
(2)设反应后生成的氯化钙质量为x,生成的二氧化碳质量为y:
CaCO3+2HCl=CaCl2+CO2↑+H2O…………………(1分)
100 111 44
5g x y
=x=5.55g
=y=2.2g………………………………(1分)
反应后所得溶液质量为:5g+36.5g-2.2g=39.3g
反应后所得溶液的溶质质量分数为:×100%=14.1%………………(1分)
答:该石灰石样品中碳酸钙的质量为5克,反应后所得的溶液的溶质质量分数为
14.1%。………………………………………(设问和答共1分)
其它合理解答均可得分。
【解析】
分析:(1)由样品和剩余固体的质量即可求得该石灰石样品中碳酸钙的质量;
(2)由反应的碳酸钙的质量,根据反应方程式即可求得生成氯化钙和二氧化碳的质量;再
根据质量守恒定律即可求得反应后溶液的质量;最后根据溶质质量分数=溶质质量
溶液质量
×100%
即可求得反应后所得溶液的溶质质量分数.
解:(1)碳酸钙的质量:6.5g-1.5g=5g;
(2)设反应后生成的氯化钙质量为x,生成的二氧化碳质量为y:CaCO3+2HCl=CaCl2+CO2↑+H2O
100 111 44
5g x y
=x=5.55g
=y=2.2g
反应后所得溶液质量为:5g+36.5g-2.2g=39.3g;
反应后所得溶液的溶质质量分数为:×100%=14.1%;
答:该石灰石样品中碳酸钙的质量为5克,反应后所得的溶液的溶质质量分数为14.1%.点评:求反应后所得溶液的质量的计算是初中化学计算的一个重点内容,其方法一般是:所加入的所有物质的质量总和-生成气体的质量-生成沉淀的质量.
9.在人类历史发展过程中,金属元素的发现和使用深刻影响了我们的生活、生产等活动。(1)黄铜(为铜、锌合金)貌似黄金,有人以此冒充黄金行骗,我们称为“假黄金”
①真假黄金可用稀盐酸鉴别,理由是
②也可以“用火灼烧”的办法鉴别其真伪,如果是“假黄金”,观察到的现象是
(2)某研究小组取20 g的“假黄金”进行探究,先将“假黄金”置于烧杯中,然后向烧杯中慢慢加入稀硫酸使其充分反应,直至固体质量不再减少为止,产生的气体和滴加稀硫酸质量的关系曲线如图所示,根据所给信息回答以下问题:
①该“假黄金”中铜的质量是 g
②试通过计算求出所用稀硫酸中溶质的质量分数,
(写出计算过程,计算结果精确至0.1 g)
【答案】(1)①假黄金中金属锌可以和稀盐酸反应放出气体,而纯金不和稀盐酸反应②假黄金表面变黑
(2)①7克②20%
【解析】
试题分析:真假黄金可用稀盐酸鉴别,理由是假黄金中金属锌可以和稀盐酸反应放出气体,而纯金不和稀盐酸反应;也可以“用火灼烧”的办法鉴别其真伪,如果是“假黄金”,观察到的现象是假黄金表面变黑,因为假金中的铜会和氧气反应产生氧化铜,根据图示看产生了氢气的质量是0.4克,设需要锌的质量是X,所用稀硫酸中溶质的质量为Y,
Zn+H2SO4Zn SO4+H2↑
65 98 2
X Y 0.4克
列比例式得:65:X=98:Y=2:0.4克解得:X=13克 Y=19.6克
所以“假黄金”中铜的质量是=20克-13克=7克,所用稀硫酸中溶质的质量分数=19.6克/98克×100%=20%。
考点:根据化学方程式的计算溶质的质量分数金属的性质
10.有资料表明,氧化铜对氯酸钾(KClO3)的分解有催化作用.先将2.4g CuO与wg氯酸钾的混合物充分加热,使其不再产生气体后,残余固体经冷却、称量,质量为wg.然后将固体溶于21.3g水中,充分搅拌,过滤,得到滤液和黑色的滤渣.滤渣又经洗涤、烘干、称量,质量为2.4g.(注:不考虑每步实验过程中物质的损失;计算结果保留1位小数)(1)求生成的O2质量;
(2)求所得滤液的溶质质量分数.
【答案】(1)2.4g
(2)所得滤液的溶质质量分数14.9%.
【解析】
(1)根据质量守恒定律可知固体质量的减少量就是生成的氧气的质量,所以生成氧气的质量为:(2.4g+wg)﹣wg=2.4g;
(2)解:设生成2.4g氧气的同时生成氯化钾的质量为X,
2KClO32KCl+3O2↑
149 96
X 2.4g
X=3.725g
所得溶液总质量为:3.725g+21.3g=25.025g
所以所得滤液的溶质质量分数为:×100%=14.9%
答:所得滤液的溶质质量分数14.9%.
【点评】解答本题的关键是要知道固体质量的减少量就是生成氧气的质量,根据氧气的质量再进行计算即可.