
沉淀溶解平衡
【考纲要求】了解难溶电解质的沉淀溶解平衡及沉淀转化的本质。
【高考链接】
(11—26)(14分)0.80gCuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
(4)在0.10mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=________________mol·L-1(Kap[Cu(OH)2]=2.2×10-20)。
若在0.1mol·L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是_______________mol·L-1。
(13—10)银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故.根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器漫入该溶液中,一段时间后发现黑色会褪去。下列说法正确的是
A.处理过程中银器一直保持恒重
B.银器为正极,Ag2S被还原生成单质银
C.该过程中总反应为2Al + 3Ag2S = 6Ag + A12S3
D.黑色褪去的原因是黑色Ag2S转化为白色AgCl
(13—11)己知某溶液中含有C1-, Br-和CrO
4
2-,浓度均为0.010mo1·L-,向该
溶液中逐滴加入0.010mol·L-1的AgNO
3
溶液时,三种阴离子产生沉淀的先后顺序为
A.C1-、Br-、CrO
42- B. CrO
4
2-、Br-、C1-
C. Br-、C1-、CrO
42- D. Br-、CrO
4
2-、C1-
(14—11)溴酸银( AgBr03)溶解度随温度变化曲
线如图所示,下列说法错误的是
A、温度升高时溴酸银溶解速度加快
B、溴酸银的溶解是放热过程
C、60℃溴酸银的K
SP
约等于6 x 10-4
D、若硝酸钾中含有少里溴酸银,可用重结晶方
法提纯
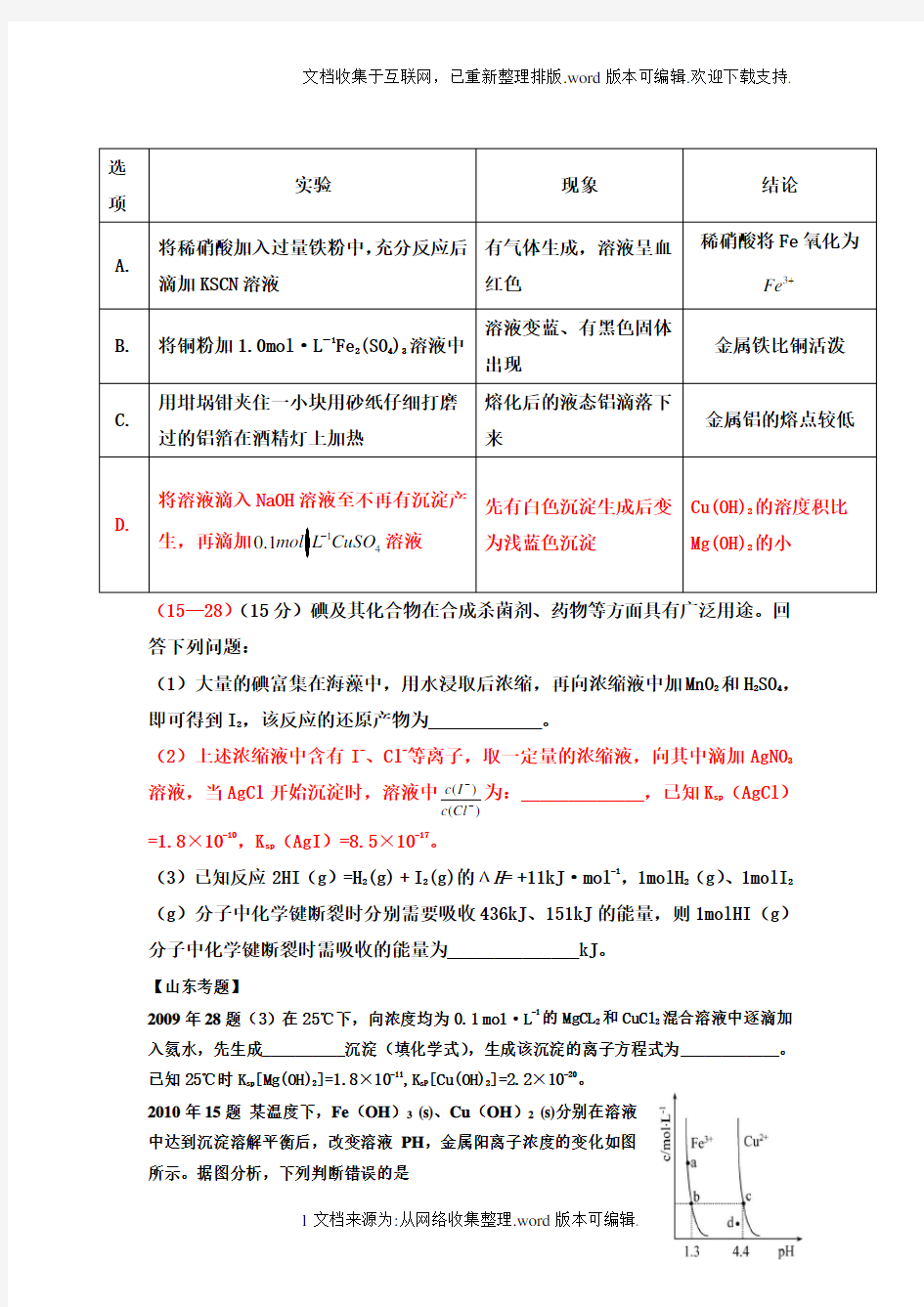
(15—10)下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
(15—28)(15分)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO 2和H 2SO 4,即可得到I 2,该反应的还原产物为____________。
(2)上述浓缩液中含有I -、Cl -等离子,取一定量的浓缩液,向其中滴加AgNO 3
溶液,当AgCl 开始沉淀时,溶液中)
()(--
Cl c I c 为:_____________,已知K sp (AgCl )
=1.8×10-10,K sp (AgI )=8.5×10-17。
(3)已知反应2HI (g )=H 2(g) + I 2(g)的ΔH = +11kJ·mol -1,1molH 2(g )、1molI 2(g )分子中化学键断裂时分别需要吸收436kJ 、151kJ 的能量,则1molHI (g )分子中化学键断裂时需吸收的能量为______________kJ 。
【山东考题】
2009年28题(3)在25℃下,向浓度均为0.1 mol ·L -1
的MgCL 2和CuCl 2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时K sp [Mg(OH)2]=1.8×10-11
,K sP [Cu(OH)2]=2.2×10-20
。 2010年15题 某温度下,Fe (OH )3 (s)、Cu (OH )2 (s)分别在溶液中达到沉淀溶解平衡后,改变溶液PH ,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
选项 实验 现象 结论
A.
将稀硝酸加入过量铁粉中,充分反应后滴加KSCN 溶液
有气体生成,溶液呈血红色
稀硝酸将Fe 氧化为
3Fe +
B. 将铜粉加1.0mol·L -1
Fe 2(SO 4)3溶液中
溶液变蓝、有黑色固体出现
金属铁比铜活泼
C. 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热
熔化后的液态铝滴落下来
金属铝的熔点较低
D.
将溶液滴入NaOH 溶液至不再有沉淀产生,再滴加140.1mol L CuSO -溶液
先有白色沉淀生成后变为浅蓝色沉淀
Cu(OH)2的溶度积比Mg(OH)2的小