
THANKS !!!
致力为企业和个人提供合同协议,策划案计划书,学习课件等等
打造全网一站式需求
欢迎您的下载,资料仅供参考
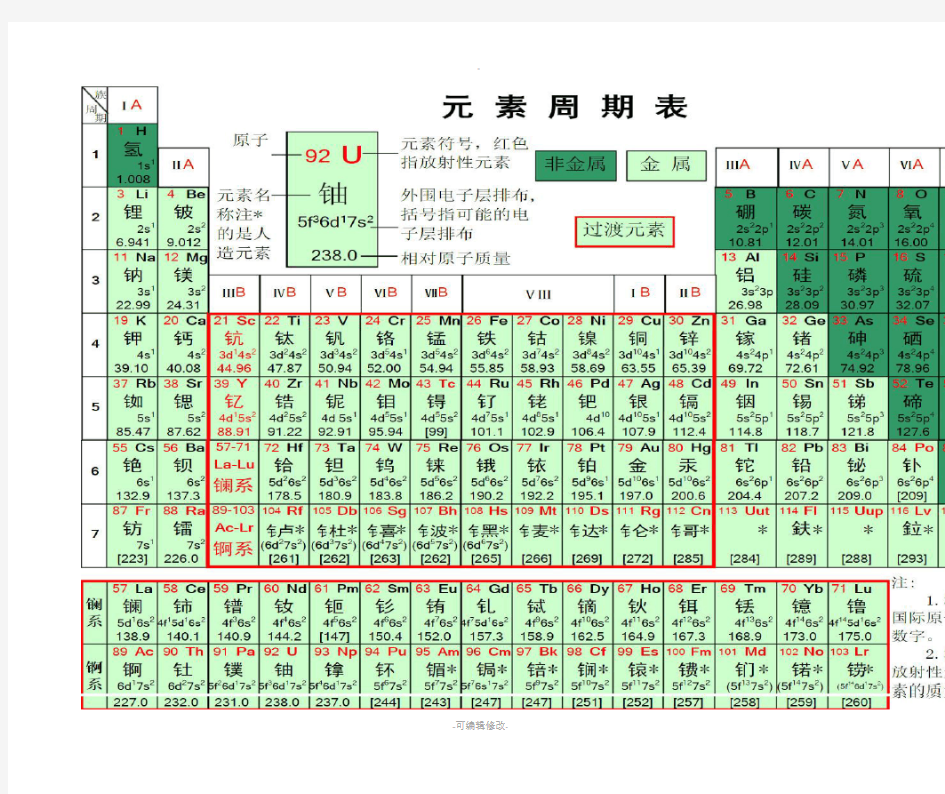
三、元素周期表有关背诵口诀 (1)元素周期表族背诵口诀 氢锂钠钾铷铯钫——请李娜加入私访 铍镁钙锶钡镭——媲美盖茨被雷 硼铝镓铟铊——碰女嫁音他 碳硅锗锡铅——探归者西迁 氮磷砷锑铋——蛋临身体闭 氧硫硒碲钋——养牛西蹄扑 氟氯溴碘砹——父女绣点爱 氦氖氩氪氙氡——害耐亚克先动 (2)元素周期表原子序数背诵口诀 从前,有一个富裕人家,用鲤鱼皮捧碳,煮熟鸡蛋供养着有福气的奶妈,这家有个很美丽的女儿,叫桂林,不过她有两颗绿色的大门牙(哇,太恐怖了吧),后来只能嫁给了一个叫康太的反革命。刚嫁入门的那天,就被小姑子号称“铁姑”狠狠地捏了一把,新娘一生气,当时就休克了。 这下不得了,娘家要上告了。铁姑的老爸和她的哥哥夜入县太爷府,把大印假偷走一直往西跑,跑到一个仙人住的地方。 这里风景优美:彩色贝壳蓝蓝的河,一只乌鸦用一缕长长的白巾牵来一只鹅,因为它们不喜欢冬天,所以要去南方,一路上还相互提醒:南方多雨,要注意防雷啊。 在来把这个故事浓缩一下: 第一周期:氢氦 ---- 侵害 第二周期:锂铍硼碳氮氧氟氖 ---- 鲤皮捧碳蛋养福奶 第三周期:钠镁铝硅磷硫氯氩 ---- 那美女桂林留绿牙(那美女鬼流露绿牙)(那美女归你) 第四周期:钾钙钪钛钒铬锰 ---- 嫁改康太反革命 铁钴镍铜锌镓锗 ---- 铁姑捏痛新嫁者 砷硒溴氪 ---- 生气休克 第五周期:铷锶钇锆铌 ---- 如此一告你钼锝钌 ---- 不得了 铑钯银镉铟锡锑(tī) ---- 老把银哥印西堤 碲碘氙 ---- 地点仙 第六周期:铯钡镧系铪(hā)----(彩)色贝(壳)蓝(色)河 钽钨铼锇 ---- 但(见)乌(鸦)(引)来鹅 铱铂(bó)金汞铊铅 ---- 一白巾供它牵 铋钋(pō)砹氡 ---- 必不爱冬(天) 第七周期:钫(fāng)镭锕系 ---- 防雷啊! (3)化合价背诵口诀 1. 一价氢氯钾钠银二价氧钙钡镁锌 三铝四硅五价磷二三铁、二四碳 一至五价都有氮铜汞二价最常见 2. 正一铜氢钾钠银正二铜镁钙钡锌 三铝四硅四六硫二四五氮三五磷 一五七氯二三铁二四六七锰为正 碳有正四与正二再把负价牢记心 负一溴碘与氟氯负二氧硫三氮磷 3. 正一氢银和钾钠正二钙镁钡锌汞和铜 铝正三硅正四亚铁正二铁正三 氯在最后负一价氧硫最后负二价 四、元素周期表规律 以下规律不适用于稀有气体。 一、原子半径 同一周期,从左到右,随着原子序数的递增,元素原子半径递减; 同一族中,从上到下,随着原子序数的递增,元素原子半径递增。 二、主要化合价(最高正化合价和最低负化合价)
精品
精品
周期一:1氢qīng 2氦hài 周期二:3锂lǐ4铍pí5硼péng 6碳tàn 7氮dàn 8氧yǎng 9氟fǔ10氖nǎi 周期三:11钠nà12镁měi 13铝lǚ14硅guí15磷lín 16硫liú17氯lǜ18氩yà 周期四:19钾jiǎ20钙gài 21钪kàng 22钛tài 23钒fán 24铬gè25锰měng 26铁tiě27钴gǔ28镍niè29铜tóng 30锌xīn 31镓jiā32锗zhě33砷shēn 34硒xī35溴xiù36氪kè 周期五:37铷rú38锶sī39钇yǐ40锆gào 41铌ní42钼mù43锝dé44钌liǎo 45铑lǎo 46钯bǎ47银yín 48镉gé49铟yīn 50锡xī51锑tī52碲dì53碘diǎn 54氙xiān 周期六:55铯sè56钡bèi 57-71镧系lán 72铪hā73钽tǎn 74钨wū75铼lái 76锇é77铱yī78铂bó79金jīn 80汞gǒng 81铊tā82铅qiān 83铋bì84钋pō85砹ài 86氡dōng 周期七:87钫fāng 88镭léi 89-103锕系ā104钅卢lú105钅杜dù106钅喜xǐ107钅波bō108钅黑hēi 109钅麦mài 镧系:57镧áln 58铈shí59镨pǔ60钕nǚ61钷pǒ62钐shān 63铕yǒu 64钆gá65铽tè66镝dí67钬huǒ68铒ěr 69铥diū70镱yì71镥lǔ 锕系:89锕ā90钍tǔ91镤pú92铀yóu 93镎ná94钚bù95镅měi 96锔jū97锫péi 98锎kāi 99锿āi 100镄fèi 101钔mén 102锘nuò103铹láo 精品
化学元素周期表 现代化学的元素周期律是1869年俄国科学家门捷列夫(Dmitri Mendeleev)首创的,他将当时已知的63种元素依原子量大小并以表的形式排列,把有相似化学性质的元素放在同一行,就是元素周期表的雏形。利用周期表,门捷列夫成功的预测当时尚未发现的元素的特性(镓、钪、锗)。1913年英国科学家莫色勒利用阴极射线撞击金属产生X射线,发现原子序越大,X射线的频率就越高,因此他认为核的正电荷决定了元素的化学性质,并把元素依照核内正电荷(即质子数或原子序)排列,经过多年修订后才成为当代的周期表。 在周期表中,元素是以元素的原子序排列,最小的排行最先。表中一横行称为一个周期,一列称为一个族。 元素 名称氢 元素符号H原子 序数 1 相对原子质量 (12C = 12.0000) 1.00797 英文名称Hydrogen 原子结构原子半径/?:0.79 原子体积/cm3/mol: 14.4共价半径/?: 0.32 电子构型: 1s1离子半径/?: 0.012 氧化态:Ⅰ 电 子 模 型
氢是元素周期表中的第一号元素,元素名来源于希腊文,原意是“水素”。氢是由英国化学家卡文迪许在1766年发现,称之为可燃空气,并证明它在空气中燃烧生成水。1787年法国化学家拉瓦锡证明氢是一种单质并命名。氢在地壳中的丰度很高,按原子组成占15.4%,但重量仅占1%。在宇宙中,氢是最丰富的元素。在地球上氢主要以化和态存在于水和有机物中。有三种同位素:氕、氘、氚。 氢在通常条件下为无色、无味的气体;气体分子由双原子组成;熔点 -259.14°C,沸点-252.8°C,临界温度33.19K,临界压力12.98大气压,气体密度0.0899克/升;水溶解度21.4厘米3/千克水(0°C),稍溶于有机溶剂。 在常温下,氢比较不活泼,但可用合适的催化剂使之活化。在高温下,氢是高度活泼的。除稀有气体元素外,几乎所有的元素都能与氢生成化合物。非金属元素的氢化物通常称为某化氢,如卤化氢、硫化氢等;金属元素的氢化物称为金属氢化物,如氢化锂、氢化钙等。 氢是重要的工业原料,又是未来的能源。
化学元素周期表读音和记忆 氢(qīng)氦(hài) 锂(lǐ)铍(pí)硼(péng) 碳(tàn) 氮(dàn) 氧(yǎng)氟(fú)氖(nǎi) 钠(nà)镁(měi)铝(lǚ)硅(guī)磷(lín) 硫(liú)氯(lǜ)氩(yà)钾(jiǎ) 钙(gài) 钪(kàng)钛(tài)钒(fán)铬(gè)锰(měng) 铁(tiě) 钴(gǔ) 镍(niè) 铜(tóng) 锌(xīn) 镓(jiā) 锗(zhě) 砷(shēn) 硒(xī) 溴(xiù) 氪(kè) 铷(rú) 锶(sī) 钇(yǐ) 锆(gào) 铌(ní) 钼(mù) 锝(dé) 钌(liǎo) 铑(lǎo) 钯(pá) 银(yín) 镉(gé) 铟(yīn) 锡(xī) 锑(tī) 碲(dì) 碘(diǎn) 氙(xiān) 铯(sè) 钡(bèi) 镧(lán) 铪(hā) 钽(tǎn) 钨(wū) 铼(lái) 锇(é) 铱(yī) 铂(bó) 金(jīn) 汞(gǒng) 铊(tā) 铅(qiān) 铋(bì) 针(pō) 砹(ài) 氡(dōng) 钫(fāng) 镭(léi) 锕(ā) 钅卢(lú) 钅杜(dù) 钅喜(xǐ) 钅波(bō) 钅黑(hēi) 钅麦(mài) 钅达(dá) 钅仑(lún) 镧(lán) 铈(shì) 镨(pǔ) 钕(nǚ) 钷(pǒ) 钐(shān) 铓(yǒu) 钆(gá) 铽(tè) 镝(dí) 钬(huǒ) 铒(ěr) 铥(diū) 镱(yì) 镥(lǔ) 锕(ā) 钍(tǔ) 镤(pú) 铀(yóu) 镎(ná) 钚(bù) 镅(méi) 锔(jū) 锫(péi) 锎(kāi) 锿(āi) 镄(fèi) 钔(mén) 锘(nuò) 铹(láo) (一) N 氮 O 氧 S 硫,C 碳 P 磷金 Au;K 钾 I 碘 Al 铝,钨的符号 W。…… (二) H He Li Be B (氢氦锂铍硼)
Fabrication of Au nanoparticle @mSiO 2@Y 2O 3:Eu nanocomposites with enhanced ?uorescence Huiqin Li a ,b ,Jianmiao Kang a ,Jianhui Yang a ,*,Biao Wu a ,** a Key Laboratory of Synthetic and Natural Functional Molecule Chemistry (Ministry of Education),Shaanxi Key Laboratory of Physico-Inorganic Chemistry,College of Chemistry &Materials Science,Northwest University,Xi'an,710069,PR China b College of Chemistry &Chemical Engineering,Baoji University of Arts &Sciences,Baoji,721013,PR China a r t i c l e i n f o Article history: Received 8January 2016Received in revised form 26February 2016 Accepted 29February 2016Available online 2March 2016Keywords: Nanofabrications Mesoporous silica coating Core-spacer-shell structure Luminescence properties Metal enhanced ?uorescence a b s t r a c t Herein,Au nanoparticle @mSiO 2@Y 2O 3:Eu nanocomposites are synthesized through layer-by-layer assembly technology.Au nanoparticle @mSiO 2core e shell nanospheres were prepared at ?rst in the presence of CTAB in aqueous solution system by the modi ?ed one-pot method.A chemical precipitation method and a succeeding calcination process were adopted to the growth of Y 2O 3:Eu shells on the surfaces of Au na-noparticle @mSiO 2core e shell nanospheres.The structure,morphology and composition of the nano-composites were con ?rmed by XRD,TEM and UV e vis absorption spectrum.The prepared Au nanoparticle @mSiO 2@Y 2O 3:Eu nanocomposites have showed the emission intensity enhances to 6.23times at 30nm thickness of the silica spacer between the core of Au nanoparticle and the shell of Y 2O 3:Eu.According to the observations of ?uorescent lifetime and the modeling of local electric ?eld,the metal-enhanced and quenched ?uorescence is closely related with the enhancement of excitation and radiative decay rate and the quenching by NRET comes as a result of competition between the distance-dependent mechanisms.This kind of multifunctional inorganic material will be widely used in elec-tronics,biology and medical drug loading,etc. ?2016Elsevier B.V.All rights reserved. 1.Introduction Multifunctional inorganic nanoparticles with optical,electrical,magnetic,thermal and other unique characteristics exert the ad-vantages in biological imaging markers,disease diagnosis,laser imaging,optical waveguide,medical chemical detection,etc [1e 6].Some studies pay close attention to noble metal nanoparticles because of its biocompatibility and better chemical stability which are widely used in the biological,chemical sensors,drug carrier,light hyperthermia drug,biological imaging,etc [7e 12].Multi-functional nanoparticles could be obtained by means of physical adsorption,chemical bonding or the layer-by-layer assembly technology. Fluorescence has become an important means of detection in electronics,biology and medicine [13e 16].Luminescent nano-particles have been developed and used widely as the next gener-ation of ?https://www.doczj.com/doc/1c4568982.html,nthanide luminescent is widely used in the research of advanced materials due to its narrow spectra,large Stokes shifts and long lifetimes [17e 19].However,the luminous ef ?ciency of lanthanides is relatively lower leading to its limited application in many ?elds.Metal nanomaterials with surface plasmon resonance are well known to exhibit unique optical properties,which could achieve metal surface ?uorescence enhancement effect in pace with the changes of surface electro-magnetic ?eld subjected to external excitation.A few of studies are pointed at the surface electromagnetic ?eld of metal nanoparticles through the ?nite difference time domain (FDTD)method [20,21].Some of studies have con ?rmed the metal enhanced ?uorescence [22e 25],for example,a range of ?uorophore-doped metal core/silica shell nanocomposites [26e 28].Trivalent-europium (Eu 3t)is used widely for the crystal materials research because the energy level transition of Eu 3tis sensitive when the surrounding magnetic ?eld changes [25,29e 31].Deng et al.[32]reported on the ?uores-cence intensity of BHHCT-Eu-DPBT doped Ag@SiO 2nano-composites varied with the diameter of Ag nanoparticles and the spacer thickness of SiO 2.Zhang et al.[33]studied the metal-enhanced ?uorescence in silica core/silver shell encapsulated with Eu complex.The results revealed that the emission intensity was signi ?cantly enhanced at 20e 30nm of Ag layer thickness with shortened lifetime.In other words,?uorescence enhancement can be achieved through adjusting the interaction between metal *Corresponding author.**Corresponding author. E-mail addresses:jianhui@https://www.doczj.com/doc/1c4568982.html, (J.Yang),wubiao@https://www.doczj.com/doc/1c4568982.html, (B. Wu).Contents lists available at ScienceDirect Journal of Alloys and Compounds jou rna l homepage: https://www.doczj.com/doc/1c4568982.html,/locate/jalcom https://www.doczj.com/doc/1c4568982.html,/10.1016/j.jallcom.2016.02.263 0925-8388/?2016Elsevier B.V.All rights reserved. Journal of Alloys and Compounds 673(2016)283e 288
元素周期表各原子结 构示意图 第1周期 [1] K 氢1 [2] He 氦2 第2周期 [3] Li 锂2 1 [4] Be 铍2 2 [5] B 硼2 3 [6] C 碳2 4 [8] O 氧2 6 [9] F 氟2 7 [10]Ne 氖2 8 第3周期 [11]Na 钠2 8 1 [12]Mg 镁2 8 2 [13]Al 铝2 8 3 [14]Si 硅2 8 4 [15] P 磷2 8 5 [16] S 硫2 8 6 [17]Cl 氯2 8 7 [18]Ar 氩2 8 8 第4周期 [19]K 钾2 8 8 1 [20]Ca 钙2 8 8 2 [21]Sc 钪2 8 9 2 [22]Ti 钛2 8 10 2 [23]V 钒2 8 11 2 [24]Cr 铬2 8 13 1 [25]Mn 锰2 8 13 2 [26]Fe 铁2 8 14 2 [27]Co 钴2 8 15 2 [28]Ni 镍2 8 16 2 [29]Cu 铜2 8 18 1 [30]Zn 锌2 8 18 2 [31]Ga 镓2 8 18 3 [32]Ge 锗2 8 18 4 [33]As 砷2 8 18 5 [34]Se 硒2 8 18 6 [35]Br 溴2 8 18 7 [36]Kr 氪2 8 18 8 第5周期 [37]Rb 铷2 8 18 8 1 [38]Sr 锶2 8 18 8 2 [40]Zr 锆2 8 18 10 2 [41]Nb 铌2 8 18 12 1 [42]Mo 钼2 8 18 13 1 [43]Tc 锝2 8 18 13 2 [44]Ru 钌2 8 18 15 1 [45]Rh 铑2 8 18 16 1 [46]Pd 钯2 8 18 18 [47]Ag 银2 8 18 18 1 [48]Cd 镉2 8 18 18 2 [49]In 铟2 8 18 18 3 [50]Sn 锡2 8 18 18 4 [51]Sb 锑2 8 18 18 5 [52]Te 碲2 8 18 18 6 [53]I 碘2 8 18 18 7 [54]Xe 氙2 8 18 18 8 第6周期 [55]Cs 铯2 8 18 18 8 1 [56]Ba 钡2 8 18 18 8 2 [57]La 镧2 8 18 18 9 2 [58]Ce 铈2 8 18 19 9 2 [59]Pr 镨2 8 18 21 8 2 [60]Nd 钕2 8 18 22 8 2 [61]Pm 钷2 8 18 23 8 2 [62]Sm 钐2 8 18 24 8 2 [63]Eu 铕2 8 18 25 8 2 [64]Gd 钆2 8 18 25 9 2 [65]Tb 铽2 8 18 27 8 2 [66]Dy 镝2 8 18 28 8 2 [67]Ho 钬2 8 18 29 8 2 [68]Er 铒2 8 18 30 8 2 [69]Tm 铥2 8 18 31 8 2 [70]Yb 镱2 8 18 32 8 2 [71]Lu 镥2 8 18 32 9 2 [72]Hf 铪2 8 18 32 10 2 [73]Ta 钽2 8 18 32 11 2 [74]W 钨2 8 18 32 12 2 [75]Re 铼2 8 18 32 13 2 [76]Os 锇2 8 18 32 14 2 [77]Ir 铱2 8 18 32 15 2 [78]Pt 铂2 8 18 32 17 1 [79]Au 金2 8 18 32 18 1 [81]Tl 铊2 8 18 32 18 3 [82]Pb 铅2 8 18 32 18 4 [83]Bi 铋2 8 18 32 18 5 [84]Po 钋2 8 18 32 18 6 [85]A 砹2 8 18 32 18 7 [86]Rn 氡2 8 18 32 18 8 第7周期 [87]Pr 钫2 8 18 32 18 8 1 [88]Ra 镭2 8 18 32 18 8 2 [89]Ac 锕2 8 18 32 18 9 2 [90]Th 钍2 8 18 32 18 10 2 [91]Pa 镤2 8 18 32 20 9 2 [92]U 铀2 8 18 32 21 9 2 [93]Np 镎2 8 18 32 22 9 2 [94]Pu 钚2 8 18 32 24 8 2 [95]Am 镅*2 8 18 32 25 8 2 [96]Cm 锔*2 8 18 32 25 9 2 [97]Bk 锫*2 8 18 32 27 8 2 [98]Cf 锎*2 8 18 32 28 8 2 [99]Es 锿*2 8 18 32 29 8 2 [100]Fm 镄* 2 8 18 32 30 8 2 [101]Md 钔* 2 8 18 32 31 8 2 [102]No 锘* 2 8 18 32 32 8 2 [103]Lr 铹* 2 8 18 32 32 9 2 [104]Rf* [105]Db* [106]Sg* [107]Bh* [108]Hs* [109]Mt* [110]Ds* [111]Rg* [112]Uub* 104-112号暂未列出 57-71号为镧系元素 89-103号为锕系元素 红色(深红色)为放射性元素 带*号为人造元素
化学元素周期表读音和记忆氢(qīng)氦(hài)锂(lǐ)铍(pí)硼(péng) 碳(tàn)氮(dàn)氧(yǎng)氟(fú)氖(nǎi) 钠(nà)镁(měi)铝(lǚ)硅(guī)磷(lín) 硫(liú)氯(lǜ)氩(yà)钾(jiǎ)钙(gài) 钪(kàng)钛(tài)钒(fán)铬(gè)锰(měng) 铁(tiě)钴(gǔ)镍(niè)铜(tóng)锌(xīn) 镓(jiā)锗(zhě)砷(shēn)硒(xī)溴(xiù) 氪(kè)铷(rú)锶(sī)钇(yǐ)锆(gào) 铌(ní)钼(mù)锝(dé)钌(liǎo)铑(lǎo) 钯(pá)银(yín)镉(gé)铟(yīn)锡(xī) 锑(tī)碲(dì)碘(diǎn)氙(xiān)铯(sè) 钡(bèi)镧(lán)铪(hā)钽(tǎn)钨(wū) 铼(lái)锇(é)铱(yī)铂(bó)金(jīn) 汞(gǒng)铊(tā)铅(qiān)铋(bì)针(pō) 砹(ài)氡(dōng)钫(fāng)镭(léi)锕(ā) 钅卢(lú)钅杜(dù)钅喜(xǐ)钅波(bō)钅黑(hēi) 钅麦(mài)钅达(dá)钅仑(lún)镧(lán)铈(shì) 镨(pǔ)钕(nǚ)钷(pǒ)钐(shān)铓(yǒu) 钆(gá)铽(tè)镝(dí)钬(huǒ)铒(ěr) 铥(diū)镱(yì)镥(lǔ)锕(ā)钍(tǔ)
镤(pú)铀(yóu)镎(ná)钚(bù)镅(méi) 锔(jū)锫(péi)锎(kāi)锿(āi)镄(fèi) 钔(mén)锘(nuò)铹(láo) (一) N氮O氧S硫,C碳P磷金Au;K钾I碘Al铝,钨的符号W。…… (二) H He Li Be B (氢氦锂铍硼)1C N O F Ne (碳氮氧氟氖) Na Mg Al Si P (钠镁铝硅磷) S Cl Ar K Ca (硫氯氩钾钙) 五个背,比较顺口。 (三) 化合价: 一价请驴脚拿银,(一价氢氯钾钠银) 二价羊盖美背心。(二价氧钙镁钡锌) 一价钾钠氢氯银,二价氧钙钡镁锌; 三铝四硅五价磷,二三铁、二四碳; 一至五价都有氮,铜汞二价最常见。 正一铜氢钾钠银,正二铜镁钙钡锌; 三铝四硅四六硫,二四五氮三五磷; 一五七氯二三铁,二四六七锰为正; 碳有正四与正二,再把负价牢记心;
元素周期表 元素周期表是1869年俄国科学家门捷列夫(Dmitri Mendeleev)首创的,后来又经过多名科学家多年的修订才形成当代的周期表。元素周期表中共有118种元素。每一种元素都有一个编号,大小恰好等于该元素原子的核内电子数目,这个编号称为原子序数。 原子的核外电子排布和性质有明显的规律性,科学家们是按原子序数递增排列,将电子层数相同的元素放在同一行,将最外层电子数相同的元素放在同一列。 元素周期表有7个周期,16个族。每一个横行叫作一个周期,每一个纵行叫作一个族。这7个周期又可分成短周期(1、2、3)、长周期(4、5、6)和不完全周期(7)。共有16个族,又分为7个主族(ⅠA-ⅦA),7个副族(ⅠB-ⅦB),一个第ⅧB族,一个零族。 元素在周期表中的位置不仅反映了元素的原子结构,也显示了元
素性质的递变规律和元素之间的内在联系。 同一周期内,从左到右,元素核外电子层数相同,最外层电子数依次递增,原子半径递减(零族元素除外)。失电子能力逐渐减弱,获电子能力逐渐增强,金属性逐渐减弱,非金属性逐渐增强。元素的最高正氧化数从左到右递增(没有正价的除外),最低负氧化数从左到右递增(第一周期除外,第二周期的O、F元素除外)。 同一族中,由上而下,最外层电子数相同,核外电子层数逐渐增多,原子序数递增,元素金属性递增,非金属性递减。 元素周期表的意义重大,科学家正是用此来寻找新型元素及化合物。 ●排列规则: 化学元素周期表是根据原子序数从小至大排序的,化学元素列表大体呈长方形,某些元素周期表中留有空格,使特性相近的元素归在同一族中,如碱金属元素,碱土金属,卤族元素,稀有气体等,这是周期表中形成的元素分区,且分有七主族,七副族,VIII族,0族 ●元素性质口诀: 我是氢,我最轻,火箭靠我运卫星;我是氦,我无赖,得失电子我最菜; 我是锂,密度低,遇水遇酸把泡起;我是铍,耍赖皮,虽是金属难电离; 我是硼,电子穷,我和本族大不同;我是碳,反应慢,既能成链又成环;