
第11章ds区元素
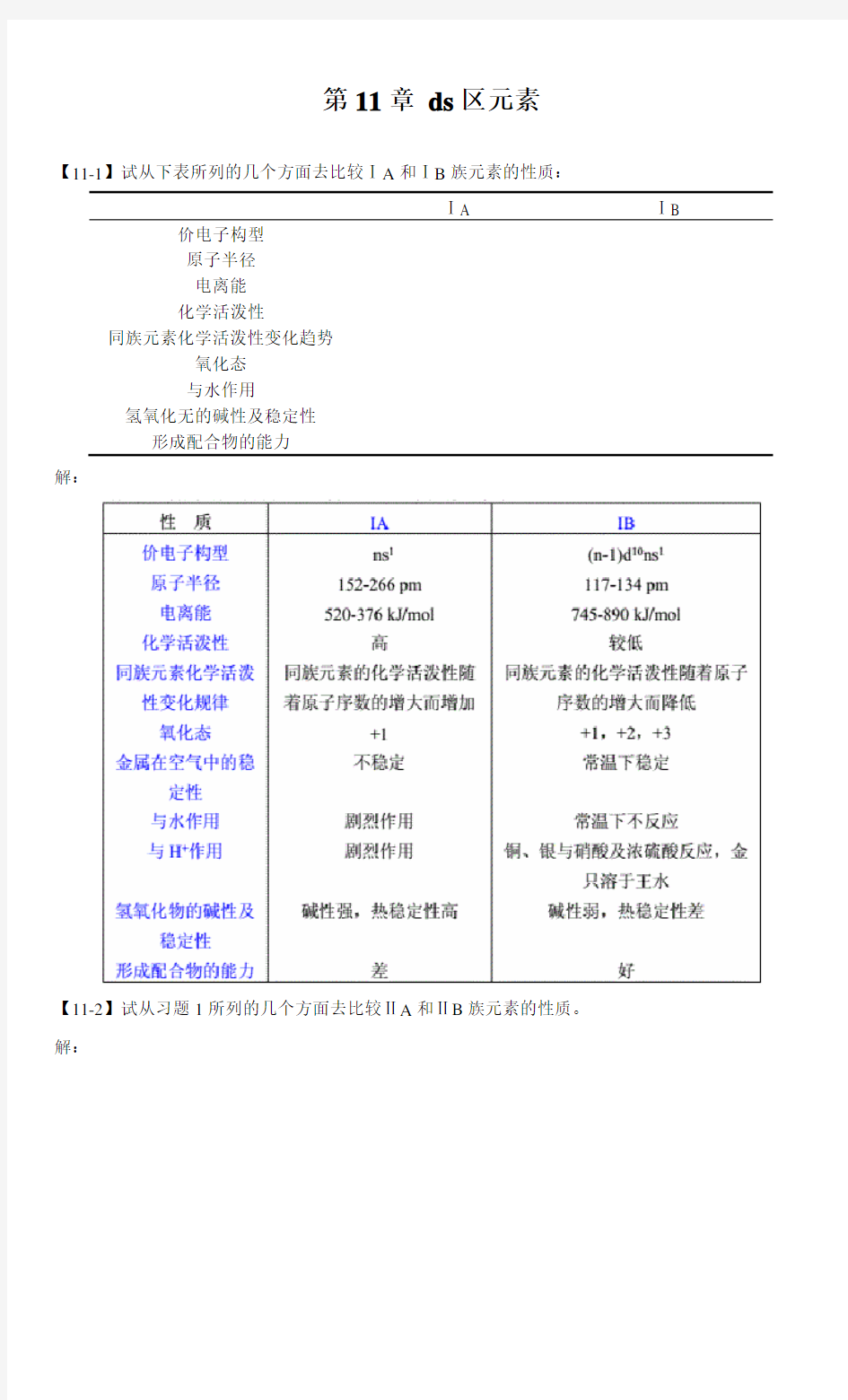
【11-1】试从下表所列的几个方面去比较ⅠA和ⅠB族元素的性质:
ⅠA ⅠB 价电子构型
原子半径
电离能
化学活泼性
同族元素化学活泼性变化趋势
氧化态
与水作用
氢氧化无的碱性及稳定性
形成配合物的能力
解:
【11-2】试从习题1所列的几个方面去比较ⅡA和ⅡB族元素的性质。
解:
ⅡA (碱金属)和ⅡB (铜族)族元素原子最外层只有一个电子,但铜族元素原子次外层为18电子,ⅠA 原子次外层为8个电子。由于18电子结构的屏蔽效应小于8电子结构,使铜族元素原子有效核电荷数大,因而对最外层的一个s 电子吸引比碱金属强;原子半径、离子半径小而电离能大,金属活动性弱。
【11-3】解释下列现象并写出反应式: (1)埋在湿土中的铜线变绿。 (2)银器在含H 2S 的空气中发黑。
(3)金不溶于浓HCl 或HNO 3中,却溶于此两种酸的混合液中。
解:
(2) 4Ag + 2H 2S + O 2 === 2Ag 2S(黑色) + 2H 2O
3. (1) 2Cu + O 2 + CO 2 + H 2O === Cu 2(OH)2CO 3(绿色)(3) Au + 4HCl + HNO 3 === H[AuCl 4] + NO ↑ + 2H 2O
【11-4】以CuSO 4为原料制取下列物质: [Cu(NH 3)4]2+ Cu(OH)2
CuO
Cu 2O
Na 2[Cu(OH)4]
CuI
解:
CuSO 4 + 4NH 3 === [Cu(NH 3)4]SO 4
CuSO 4 +2 NaOH === Cu(OH)2↓ + H 2O
Cu(OH)2 + 2NaOH === Na 2[Cu(OH)4]2CuSO 4 + 4KI === 2CuI ↓ + I 2 + K 2SO 44CuO === 2Cu 2O + O 2
Cu(OH)2 === CuO + H 2O
△
△
4.
【11-5】以Hg(NO3)2为原料制取下列物质:
HgO HgCl2Hg2Cl2Hg2(NO3)2K2[HgI4]
解:
5. Hg(NO3)2 + 2NaOH- === HgO↓(黄色) + 2NaNO3 + H2O
HgO + 2HCl === HgCl2 + H2O
HgCl2 + Hg === Hg2Cl2
Hg(NO3)2 + Hg === Hg2(NO3)2
Hg(NO3)2+ 4KI === K2[HgI4]
【11-6】用适当的方法区别下列物质:
(1)镁盐和锌盐(2)AgCl和Hg2Cl2
(3)升汞和甘汞(4)锌盐和铝盐
解:(1)加入NaOH溶液,出现白色沉淀,随后又溶解的是锌盐,不溶解的是镁盐。
(2)分别取三种盐放入试管中,向各试管中加入氨水放置一断时间,有黑色沉淀出现的是Hg2Cl2,溶解得到无色溶液的氯化银反应如下:
Hg2Cl2+2NH3 == HgNH2Cl↓+NH4Cl+Hg↓
AgCl+2NH3 == 〔Ag(NH3)2〕+ + Cl-
(3)加入KI溶液,出现黄绿色沉淀的是甘汞,溶解成无色溶液的是升汞。
Hg2Cl2 + 2I- == Hg2I2↓ + 2Cl-
HgCl2+4I- == 〔HgI4〕2-+2Cl-
(4)加入氨水,出现白色沉淀,随后又溶解的是锌盐,不溶解的是铝盐。
【11-7】Cu和Zn能否分别与稀HCl溶液,浓H2SO4溶液,浓HNO3溶液及NaOH溶液反应?若能反应,试写出反应式。
解:
7. 3Cu + 8HNO3(稀) === 3Cu(NO3)2 + 3NO↑ + 4H2O
Cu + 4HNO3(浓) === Cu(NO3)2 + 2NO2↑ + 2H2O
Cu + 2 H2SO4(浓) === CuSO4 + SO2↑ + 2H2O
3Cu+ 8HNO3(稀) === 3Cu(NO3)2 + 2NO↑+ 4H2O
Zn + 2HCl(稀) === ZnCl2 + H2↑
4Zn + 10HNO3(稀) === 4Zn(NO3)2 + N2O↑ + 5H2O
Zn+HNO3(浓) === Zn(NO3)2+NO2↑+H2O
Zn + 2NaOH + 2H2O === Na2Zn(OH)4 + H2↑
【11-8】碱能否分别与Cu2+、Ag+、Zn2+、Hg2+和Hg22+反应?若能反应,试指出反应产物及现象。
解:
Hg 22+ +2OH - ===Hg ↓+HgO ↓+H 2O Hg 2+ + 2OH - === HgO ↓ (黄色) + H 2O 8. Cu 2++2OH - === Cu(OH)2↓ 2Ag + + 2OH - === Ag 2O ↓(黑色) + 2H 2O Zn 2+ + 2OH - === Zn(OH)2↓(白色)(蓝)
【11-9】氨水能否分别与Cu 2+、Ag +、Zn 2+、Hg 2+和Hg 22+反应?若能反应,试指出产物及现象。 解:
Zn 2+ + 4NH 3 === [Zn(NH 3)4]2+ (无色)
Hg 2Cl 2 + 2NH 3 === Hg(NH 2)Cl ↓ + Hg ↓(黑色) + NH 4Cl (观察为灰色)HgCl 2 + 2NH 3 === Hg(NH 2)Cl ↓(白色) + NH 4Cl
9. Cu 2+ + 4NH 3 === [Cu(NH 3)4]2+ (蓝色) Ag + + 4NH 3 === [Ag(NH 3)4]+ (无色)
【11-10】I -能否分别与Cu 2+、Ag +、Zn 2+、Hg 2+和Hg 22+反应?若能反应,试指出产物及现象。 解:
0. 2Cu 2+ + 4I - === 2CuI ↓(白色) + I 2
Ag + + I - === AgI ↓(黄色)2I-
HgI 42-(无色)Hg 22+ + === Hg I ↓(淡绿色)
Hg 2+ + 2I - === HgI 2(血红色)2I-HgI 42- + Hg ↓ 0. 2Cu 2+ + 4I - === 2CuI ↓(白色) + I 2 Ag + + I - === AgI ↓(黄色)2I-HgI 42-(无色)Hg 22+ + === Hg I ↓(淡绿色)Hg 2+ + 2I - === HgI 2(血红色)
2I-HgI 42- + Hg ↓
【11-11】完成下列反应方程式: (1)2HgCl 2 + SnCl 2
(2)Cu(OH)2+C 6H 12O 6
(3)HgS + 12 HCl + 2 HNO 3 (4)AgBr + 2Na 2S 2O 3 (5)Hg 2Cl 2 + H 2S (6)Cu 2O + H 2SO 4
解:
1. HgCl 2 + SnCl 2 === Hg + SnCl 4
2Cu(OH)2 + C 6H 12O 6 === Cu 2O + C 6H 12O 7 + 2H 2O
3HgS + 12HCl + 2HNO 3 === 3H 2[HgCl 4] + 3S +2NO + 4H 2O AgBr + 2Na 2S 2O 3(过量) === Na 3[Ag(S 2O 3)2] + NaBr Hg 2Cl 2 + H 2S === Hg + HgS + 2HCl Cu 2O + H 2SO 4 === CuSO 4 + Cu + H 2O
【11-12】找出实现下列变化所需的物质,并写出反应方程式:
解:
△
△
12. (1) Zn + OH - + H 2O === [Zn(OH)4]2- + H 2↑ [Zn(OH)4]2- + 4H + === Zn 2+ + 4H 2O Zn 2+ + 4NH 3 === [Zn(NH 3)4]2+
[Zn(NH 3)4]2+ + S 2- === ZnS ↓ + 4NH 3
Cu(OH)2 === CuO + H 2O
CuO + 2HCl === CuCl 2 + H 2O
CuCl 2 + Cu + 2HCl(浓) === 2[CuCl 2]- + 2H +
(2) Cu + 2H 2SO 4(浓) === CuSO 4 + SO 2↑ + 2H 2O CuSO 4 + 2NaOH === Cu(OH)2↓ + Na 2SO 4
[CuCl 2]- === CuCl ↓ + Cl -稀释
【11-13】试用简便方法将下列混合离子分离: (1)Ag+ 和 Cu2+
(2)Zn2+和Mg2+
(3)Zn2+ 和 Al3+
(4)Hg2+ 和 Hg22+
解:
Cu 2+
Ag +
HCl
Cu 2+AgCl
↓
13. (1)(2)Zn
2+
Mg 2+过量NaOH [Zn(OH)4]2-Mg(OH)2↓
(3)Zn 2+
Al 3+ 3.2[Zn(NH 3)4]2+Al(OH)3↓(4) Hg
2+ Hg 2
2+
Hg 2+Hg 2Cl 2↓
【11-14】试将Cu
2+、Ag +、Zn 2+及Hg 2+混合离子分类。 解:
Cu 2+
Ag +Zn 2+Hg 2+
AgCl ↓Cu 2+Zn 2+Hg 2+
Hg(NH 2)Cl ↓Cu(NH 3)42+Zn(NH 3)42+
CuS ↓Zn 2+
Cl -过量NH 3
H +(0.3M),H 2
S
15.
【11-15】利用配位反应分别将下列物质溶解,并写出有关的反应方程式。 CuCl
Cu(OH)2
Ag 2O
AgBr
AgI
Zn(OH)2
HgI 2
解:
Ag 2O + 4NH 3H 2O === 2[Ag(NH 3)2]+ + OH - + 3H 2O Cu(OH)2 + 2OH - (6M) === [Cu(OH)4]2-Zn(OH)2 + 2OH - === [Zn(OH)4]2-AgBr + S 2O 32- === [Ag(S 2O 3)2]3- + Br -HgI 2 + 2I - === [HgI 4]2-CuI + I -(饱和) === [CuI 2]-
16.
【11-16】有一白色硫酸盐A ,溶于水得蓝色溶液。在此溶液中加入NaOH 得浅蓝色沉淀,加热B 变成黑色物质C 。C 可熔于H 2SO 4,在所得的熔于中逐渐加入KI ,先有棕色沉淀D 析出,后又变成红棕色溶液E 和白色沉淀F 。问A 、B 、C 、D 、E 、F 各为何物?写出有关反应式。
解:
7. A: CuSO 4; B: Cu(OH)2; C: CuO; D: I 2 + CuI; E: KI 3; F: CuI CuSO 4 + 2NaOH === Cu(OH)2↓ + Na 2SO 4 Cu(OH)2 === CuO + H 2O
CuO + H 2SO 4 === CuSO 4 + H 2O
2CuSO 4 + 4KI === 2K 2SO 4 + 2CuI ↓ + I 2↓ 2KI + 3I 2 === 2KI 3
【11-17】解释下列现象:
(1)当SO 2通入CuSO 4和NaCl 的浓溶液中,析出白色沉淀。
(2)在AgNO 3溶液中滴加KCN 溶液时,先生成白色沉淀而后溶解,再加入NaCl 溶液时无沉淀生成,但加入少许NaS 溶液时就析出黑色沉淀。
(3)HgC 2O 4 难溶于水,但可溶于NaCl 溶液中。
(4)在Hg 2(NO 3)2 溶液中通H 2S 时,有黑色的金属汞析出。
(5)银可置换HI 溶液中的氢,为什么却不能置换酸性更强的HClO 4溶液中的氢? 解:
8. (1) 2CuSO 4 + SO 2 + 2NaCl + 2H 2O === 2CuCl ↓(白色) + Na 2SO 4 + 2H 2SO 4 (2) Ag + + CN - === AgCN ↓(白色) AgCN + CN - === Ag(CN)2 AgCN + Cl - === 不反应
2Ag(CN)2- + S 2- === Ag 2S ↓ + 4CN - (3) HgC 2O 4 + 2Cl - === HgCl 2 + C 2O 42- (HgCL 2为弱电解质) 或HgC 2O 4 + 4Cl - === [HgCl 4]2- + C 2O 42- (4) Hg 2(NO 3)2 + H 2S === HgS ↓ + Hg ↓+ 2HNO 3
(5)Ag +遇I -会生成AgI 沉淀,由于Ag + 浓度降低而造成)/Ag Ag (+
?降低
V ]152.0)AgI/Ag ([Θ=?,所以Ag 可与KI 溶液反应,Ag +与ClO 4-之间无反应,ClO 4-的存在不会
改变)/Ag Ag (+
?,因其电极电势较高V 799.0)/Ag Ag ([Θ
=+
?,所以Ag 不会与强酸溶液反应。
【11-18】回答下列问题:
(1)CuSO4是杀虫剂,为什么要和石灰乳混用?
(2)废定影液可加Na2S 溶液再生。若Na2S 过量,则在用再生的定影液时,相片出现发花现象。
(3)锌是最重要的微量生命元素之一,是生物体内多种酶的组成元素。ZnCO3和ZnO亦可用于药膏,促进伤口愈合。为什么在炼锌厂附近却会造成严重的环境污染?
解:(1)CuSO4呈酸性,对植物有伤害,加入石灰乳可中和其
(2) 再生反应:2Ag(S2O3)23- + S2- === Ag2S + 4S2O32-
若Na2S过量:2AgBr(相片上) === Ag2S(相片上) + 2Br-
(3)因镉和锌在自然界中常共生在一起,炼锌厂的污染是镉污染。
第12章 S区元素(第一套) 一、单选题 1. 重晶石的化学式是 (A) BaCO3 , (B) BaSO4 , (C) Na2SO4 , (D) Na2CO3 2. 下列碳酸盐,溶解度最小的是 (A) NaHCO3 , (B) Na2CO3 , (C) Li2CO3 , (D) K2CO3 3. NaNO3受热分解的产物是 (A)Na2O,NO2,O2;(B)NaNO2,O2; (C)NaNO2,NO2,O2;(D)Na2O,NO,O2。 4. 下列哪对元素的化学性质最相似 (A) Be 和Mg (B) Mg 和Al (C) Li 和Be (D) Be 和Al 5. 下列元素中第一电离能最小的是 (A) Li (B) Be (C) Na (D) Mg 6. 下列最稳定的氮化物是 (A) Li3N (B) Na3N (C) K3N (D) Ba3N2 7. 下列水合离子生成时放出热量最少的是 (A) Li+ (B) Na+ (C) K+ (D) Mg2+ 8. 下列最稳定的过氧化物是 (A) Li2O2 (B) Na2O2 (C) K2O2 (D) Rb2O2
9. 下列化合物中键的离子性最小的是 (A) LiCl (B) NaCl (C) KCl (D) BaCl2 10. 下列碳酸盐中热稳定性最差的是 (A) BaCO3 (B) CaCO3 (C) K2CO3 (D) Na2CO3 11. 下列化合物中具有磁性的是 (A) Na2O2 (B) SrO (C) KO2 (D) BaO2 12. 关于s 区元素的性质下列叙述中不正确的是 (A) 由于s 区元素的电负性小,所以都形成典型的离子型化合物 (B) 在s 区元素中,Be、 Mg 因表面形成致密的氧化物保护膜而对水较稳定 (C) s 区元素的单质都有很强的还原性 (D) 除Be、 Mg 外,其他s 区元素的硝酸盐或氯酸盐都可做焰火材料 13. 关于Mg , Ca , Sr , Ba 及其化合物的性质下列叙述中不正确的是 (A) 单质都可以在氮气中燃烧生成氮化物M3N2 (B) 单质都易与水水蒸气反应得到氢气 (C) M(HCO3)2在水中的溶解度大MCO3的溶解度 (D) 这些元素几乎总是生成+2 价离子 二、是非题(判断下列各项叙述是否正确,对的在括号中填“√”错的填“×”) 1. 因为氢可以形成H+,所以可以把它划分为碱金属
第二十二章ds区金属课后习题参考答案 4解:取一定量混合物配成溶液后,滴加入过量的HCl使Ag+完全沉淀后,离心分离。沉淀用稀HNO3加热溶解即得AgNO3溶液.滤液中含有硝酸铜. 5解:溶液中含Cu2+为5/63.55=0.0787mol/L 对于反应: Cu2+ + H2S == CuS↓+ 2H+ K平=[H+]2/[Cu2+][H2S]= [H+]2[S2-]/[Cu2+][S2-][H2S]=K a1K a2/K sp =5.7×10-8×1.2×10-15/1.27×10-36=5.386×1013 设达到平衡时,溶液中[Cu2+]=x mol/L 代入平衡常数表达式得: (0.2+2×0.0787)2/x×0.1= 5.386×1013 ∴x=2.37×10-14(mol/L)= 1.51×10-12mg/ml 6解:(1) 2Cu + O2 + H2O + CO2 == Cu(OH)2·CuCO3 (2) Au + 4HCl + HNO3 == HAuCl4 + NO + 2H2O (3) CuCl42-(黄棕) + 4H2O == [Cu(H2O)4] 2+(蓝) + 4Cl- (4) CuCl42- + SO2 + 2H2O == 2CuCl + SO42- + 6Cl- + 4H+ (5) Ag+ + CN- == AgCN(白)↓AgCN + CN- == Ag(CN)2- Ag(CN)2- + Cl-→不反应2Ag(CN)2- + S2- == Ag2S↓+ 4CN- (6) 2CuCl2·2H2O == Cu(OH)2·CuCl2 + 2HCl↑ 7解:A:CuO;B:CuCl2+Cu(H2O)42+;C:HCuCl2;D:CuCl;E:Cu(NH3)2+;F:Cu(NH3)42+;G:Cu(CN)43-;H:Cu;I:Cu2+;J:Cu(OH)2. 2CuO + 4HCl + 2H2O==CuCl42- + Cu(H2O)42+CuCl2 + Cu + 2HCl == 2HCuCl2 HCuCl2HCl + CuCl↓CuCl + 2NH3 == [Cu(NH3)2]Cl 2[Cu(NH3)2]+ + 4 NH3·H2O + 1/2O2 == 2[Cu(NH3)4]2+ + 2OH- + 3H2O 2[Cu(NH3)4]2+ + 10CN- == 2[Cu(CN)4]3- + (CN)2↑+ 8NH3 2[Cu(CN)4]3- + Zn == 2Cu + [Zn(CN)4]2- + 4CN- 3Cu + 8HNO3(稀) == 3Cu(NO3)2 + 2NO↑+ 4H2O Cu2+ + 2OH- == Cu(OH)2↓Cu(OH)2CuO + H2O 8解:(1) 已知ψθ(Cu2+/Cu)=0.345V; ψθ(Fe2+/Fe)= -0.440V; ψθ(Fe3+/Fe2+)=0.770V. 因ψθ(Cu2+/Cu)>ψθ(Fe2+/Fe), 则Cu2+可把Fe氧化,反应: Fe + Cu2+ == Cu + Fe2+ . 而ψθ(Fe3+/Fe2+)>ψθ(Cu2+/Cu),所以Cu又能使Fe3+还原为Fe2+,反应: Cu+2Fe3+==Cu2++2Fe2+. (2) 用浓ZnCl2处理表面是为了除去金属表面的氧化物,同时又不损害金属表面,且高温下水分蒸发后,熔化的盐覆盖在金属表面防止其氧化,可保证金属与金属的直接接触.反应式如下: ZnCl2 + H2O == H[ZnCl2(OH)] FeO + H[ZnCl2(OH)] == Fe[ZnCl2(OH)]2 + H2O (3) HgS由于溶解度非常小,所以不溶于HCl,HNO3中.(NH4)2S中虽然含有S2-,但由于其水解较严重,导致自由的[S2-]大大低于同浓度的Na2S溶液,所以HgS在(NH4)2S中不溶. HgS溶于浓的Na2S溶液中是因为可形成HgS22-配离子的缘故. (4) HgC2O4因Ksp小难溶于水,但在Cl-中因形成配离子HgCl42-而溶解. HgC2O4 + 4Cl- == HgCl42- + C2O42- (5) 在Cl-存在时,Hg2+可形成稳定的HgCl42-配离子,这时加入NH3水也不能使HgCl42-转化为HgNH2Cl. 9解:反应的△rGθ=△f Gθ(Ag+,aq)+△f Gθ(Cl-,aq)-△f Gθ(AgCl,s) =77.11-131.17+109.72= 55.66(kJ/mol) 由△rGθ=-RTlnK得: lnK=-△rGθ/RT= -55.66×103/8.314×298 = -22.47 K=1.75×10-10 而K=Ksp 则AgCl的Ksp为1.75×10-10.
1ds区元素 1.1 本章学习要求 (1)掌握铜和银的重要化合物的性质,Cu(Ⅰ)和Cu(Ⅱ)的相互转化。 (2)掌握锌和汞的重要化合物的性质,Hg(Ⅰ)和Hg(Ⅱ)的相互转化。 (3)了解镉的重要化合物性质。 (4)了解含汞、镉废水的处理。 ds区元素包括铜族元素(铜、银、金)和锌族元素(锌、镉、汞)。这两族元素原子的价电子构型与其它过渡元素有所不同,为(n-1)d10n s1~2。由于它们的次外层d能级有10个电子(全满结构),而最外层的电子构型又和s区相同,所以称为ds区。 1.2 铜族元素通性和单质 1.2.1概述 ⅠB族元素包括铜(Cu)、银(Ag)、金(Au)三种元素,通常称为铜族元素。铜族元素原子的价电子构型为(n-1)d10n s1。最外层与碱金属相似,只有1个电子,而次外层却有18个电子(碱金属有8个电子)。因此与同周期的ⅠA族元素相比,铜族元素原子作用在最外层电子上的有效核电荷较多,最外层的s电子受原子核的吸引比碱金属元素原子要强得多,所以铜族元素的电离能比同周期碱金属元素显著增大,原子半径也显著减小,铜族元素单质都是不活泼的重金属,而相应的碱金属元素的单质都是活泼的轻金属。 表 1.2-1 碱金属与铜族元素比较 自然界的铜、银主要以硫化矿存在,如辉铜矿(Cu2S),黄铜矿(CuFe S2),孔
雀石[Cu2(OH)2C O3]等;银有闪银矿(Ag2S);金主要以单质形式分散在岩石或沙砾中,我国江南、甘肃、云南、新疆、山东和黑龙江等省都蕴藏着丰富的铜矿和金矿。 铜族元素密度较大,熔点和沸点较高,硬度较小,导电性好,延展性好,尤其是金。1克金可抽3公里长的金丝,可压成0.1微米的金箔,500张的总厚度比头发的直径还薄些。金易生成合金,尤其是生成汞齐。铜是宝贵的工业材料,它的导电能力虽然次于银,但比银便宜得多。目前世界上一半以上的铜用在电器、电机和电讯工业上。铜的合金如黄铜(Cu-Zn)、青铜(Cu-Sn)等在精密仪器、航天工业方面都有广泛的应用。 银的导电、传热性居于各种金属之首,用于高级计算器及精密电子仪表中。自20世纪70年代以来,金在工业上的用途已经超过制造首饰和货币。 铜是许多动植物体内所必须的微量元素之一。铜和银的单质及可溶性化合物都有杀菌能力,银作为杀菌药剂更具奇特功效。 1.2.2与空气的反应 Cu在常温下不与干燥的空气中的O2反应,加热时生成CuO: 2Cu+O2(空气)→2CuO(黑色) Cu在常温下与潮湿的空气反应: 2Cu+O2+H2O+C O2→Cu(OH)2·CuC O3(铜绿) Au、Ag加热时也不与空气中的O2反应。银与硫具有较强的亲和作用,和含有H2S的空气接触逐渐变暗: 4Ag+2H2S+O2→2Ag2S(黑色)+2H2O 1.2.3与酸的反应 铜族元素不能从非氧化性稀酸中置换出氢气,铜在加热的条件下能与浓硫酸反应,可以溶于硝酸,银能溶于硝酸,金只能溶于王水。 1.2.4络合反应 铜、银、金都易形成配合物。湿法冶金(用氰化物从Ag、Au的硫化物矿或砂金中提取银和金)就是利用这一性质。例如: 2Ag2S+10NaCN+O2+2H2O→4Na[Ag(CN)2]+4NaOH+2NaCNS
第9章 s 区元素 【9-1】试说明碱金属和碱土金属在同一族从上到下,同一周期从左到右下列性质递变的情况:(1)离子半径, (2)电离能,(3)离子水和能。并解释原因。 解:(1)碱金属和碱土金属从上到下离子半径增大,这是因为随着主量子数的增加,外层电子在核外出现概率最大的距离明显增加;在同一周期中,从左到右离子半径减小,这是因为随着核电荷的增加,核对于核外电子的吸引力(即有效核电荷)增强的缘故。 (2)碱金属和碱土金属从上到下电离能减小,是因为随着原子半径的增加,原子核对外层电子的束缚力减小;在同一周期中,从左到右电离能增大,这是因为随着有效核电荷的增加,和对外层电子的束缚力增加的缘故。 (3)碱金属和碱土金属从上到下水合能减小,这是因为随着原子序数增加,离子半径增加,正离子与水分子相互作用力减小的缘故。。在同一周期中,从左到右水合能增加,碱土金属离子在水溶液中,均为正二价离子,所以电荷高于正一价碱金属离子的缘故。 【9-2】锂、钠、钾在氧气中燃烧生成何种氧化物?这些氧化物与水反应情况如何?以化学方程式来说明。 解:分别生成Li 2O 、Na 2O 2、KO 2 ; 【9-3】写出下列反应方程式: (1)Al 溶于NaOH 溶液中 (2)Ba(NO 3)2加热分解 (3)Na 2O 2+CO 2 (4)CaH 2+H 2O (5)Na 2O 2+Cr 2O 3 (6)K+KNO 3 解:(1) 2Al + 2NaOH + 6H 2O = 2NaAl(OH)4 + 3H 2↑(2)Ba(NO 3)2 = Ba(NO 2)2 + O 2↑(3) 2Na 2O 2 + 2CO 2 =2NaCO 3 + O 2(4) CaH 2 + 2H 2O =Ca(OH)2 + 2H 2↑(5) 3Na 2O 2 + Cr 2O 3 = 2Na 2CrO 4 + Na 2O (6) 10K + 2KNO 3 = 6K 2O + N 2↑ 【9-4】比较下列性之的大小: (1)溶解度:CsI ,LiI ,CsF ,LiF ,LiClO 4,KClO 4 (2)碱性的强弱:Be(OH)2, Mg(OH)2,Ca(OH)2, NaOH (3)分解温度:Na 2CO 3,NaHCO 3,MgCO 3, K2CO 3 (4)水和能:Na +, K +,Mg 2+,Be 2+ 解:(1)溶解度:CsI
第十二章ds区元素 12.1 铜族元素 (1) 12.2 锌族元素 (10) 12.1 铜族元素 12.1.1 铜族元素通性 铜族元素 1.铜族元素通性 铜族元素的氧化态有+1,+2,+3三种,这是由于铜族元素最外层ns电子和次外层(n-1)d电子能量相差不大。有人认为在本族元素中,元素第二电离能与第一电离能的差值越小,它的常见氧化值就越高。 对于Cu、Ag、Au,Δ(I2-I1)Au < Δ(I2-I1)Cu < Δ(I2-I1)Ag 所以常见氧化态物+3,+2,+1。 铜、银、金的标准电势图如下所示: 12.1.2 铜族元素金属单质 2.铜族元素金属单质 (1).物理性质 铜和金是所有金属中仅有的呈现特殊颜色的二种金属,铜族元素的熔点、沸点、硬度均比相应的碱金属高。这可能与d电子也参与形成金属键有关。由于铜族金属均是面心立方晶体(如下图),它们不仅堆积最密而且存在较多可以滑动的高密度原子层,因而比相应的
碱金属(多为体心立方晶体)密度高得多,且有很好的延展性,其中以金最佳。铜族元素的导电性和传热性在所有金属中都是最好的,银占首位,铜次之。 (2).化学性质 铜族元素的化学活性远较碱金属低,并按Cu--Ag--Au的顺序递减。 在潮湿的空气中放久后,铜表面会慢慢生成一层铜绿。铜绿可防止金属进一步腐蚀,其组成是可变的。银和金不会发生该反应。 空气中如含有H2S气体与银接触后,银的表面上很快生成一层Ag2S的黑色薄膜而使银失去银白色光泽。() 在电位序中,铜族元素都在氢以后,所以不能置换稀酸中的氢。但当有空气存在时,铜可缓慢溶解于这些稀酸中: 浓盐酸在加热时也能与铜反应,这是因为Cl-和Cu+形成了较稳定的配离子[CuCl4]3-,使Cu == Cu++e-的平衡向右移动: 铜易为HNO3、热浓硫酸等氧化性酸氧化而溶解 银与酸的反应与铜相似,但更困难一些;而金只能溶解在王水中:
第11章ds区元素 【11-1】试从下表所列的几个方面去比较ⅠA和ⅠB族元素的性质: ⅠA ⅠB 价电子构型 原子半径 电离能 化学活泼性 同族元素化学活泼性变化趋势 氧化态 与水作用 氢氧化无的碱性及稳定性 形成配合物的能力 解: 【11-2】试从习题1所列的几个方面去比较ⅡA和ⅡB族元素的性质。 解:
ⅡA (碱金属)和ⅡB (铜族)族元素原子最外层只有一个电子,但铜族元素原子次外层为18电子,ⅠA 原子次外层为8个电子。由于18电子结构的屏蔽效应小于8电子结构,使铜族元素原子有效核电荷数大,因而对最外层的一个s 电子吸引比碱金属强;原子半径、离子半径小而电离能大,金属活动性弱。 【11-3】解释下列现象并写出反应式: (1)埋在湿土中的铜线变绿。 (2)银器在含H 2S 的空气中发黑。 (3)金不溶于浓HCl 或HNO 3中,却溶于此两种酸的混合液中。 解: (2) 4Ag + 2H 2S + O 2 === 2Ag 2S(黑色) + 2H 2O 3. (1) 2Cu + O 2 + CO 2 + H 2O === Cu 2(OH)2CO 3(绿色)(3) Au + 4HCl + HNO 3 === H[AuCl 4] + NO ↑ + 2H 2O 【11-4】以CuSO 4为原料制取下列物质: [Cu(NH 3)4]2+ Cu(OH)2 CuO Cu 2O Na 2[Cu(OH)4] CuI 解: CuSO 4 + 4NH 3 === [Cu(NH 3)4]SO 4 CuSO 4 +2 NaOH === Cu(OH)2↓ + H 2O Cu(OH)2 + 2NaOH === Na 2[Cu(OH)4]2CuSO 4 + 4KI === 2CuI ↓ + I 2 + K 2SO 44CuO === 2Cu 2O + O 2 Cu(OH)2 === CuO + H 2O △ △ 4.
第十二章s区元素 教学重点:1.氢的物理和化学性质; 2.碱金属的钠与钾,碱土金属的镁、钙、钡的性质。 3.其氢氧化物的溶解性和碱性。 4.碱金属和碱土金属盐类的一些重要性质。 第一节氢 一、物理性质 氢(hydrogen)是太阳大气的主要成分,如果以原子百分数计,氢占81.75%,氢是太阳发生热核反应的主要原料。是供给地球上生物生存的最大能源。 氢在地壳(包括大气、水、岩石圈)中的含量,若以原子百分数计占17%,若以质量百分数计约占1%。氢虽存在量不大,但分布却十分广泛。自然界中,氢主要以化合态存在,如在水中、有机物中、生物体中等,仅只在天然气等少数物质中有少量单质氢存在。 已知氢有三种同位素,自然界 氢或氕(用11H或H表示)99.98% 重氢或氘(deuterium)(用21H或D表示)0.02% 氚(tritium)(用31H或T表示)107个普通氢原子才有1个氚原子 氢的同位素之间由于电子结构相同,故化学性质基本相同,但是它们的原子质量相差较大,从而引起物理性质上的差异。 如:H2的沸点为20.4K,熔点为14.0K D2的沸点为23.5K,熔点为18.65K 氘的重要性在于它与原子反应堆中的重水有关,并广泛地应用于反应机理的研究和光谱分析。氚的重要性在于和核聚变反应有关,也可用作示踪原子(tracer element)。 单质氢是以双原子分子形式存在,它是一种无色无嗅的气体,是空气密度的1/14.38,是所有气体中密度最低的。用它的密度小的性质,可以填充氢气球,但有易于着火的缺点。 如将氢气进行深度冷冻并加压,氢气可转变成液体,利用液态氢的低温,可以将除氢以外的其它气体变成固体,在14.0K时可转变为透明固体。 氢在水中微微溶解,273K时1体积水仅能溶解0.02体积的氢气,但氢气可被某些金属(如镍、钯、铂)吸附,如室温时1体积细钯粉,大约吸收900 233
第十五章 ds区元素 问答题 1.将某金属的氨配合物无色溶液暴露于空气中,则迅速变成蓝色溶液A.向A中 加入NaCN时,蓝色消失生成溶液B,向B中加入锌粉则生成红棕色沉淀C,C 不溶于碱和非氧化性酸.可溶于热硝酸生成蓝色溶液D, 当逐滴加入NaOH溶液于D时,则生成蓝色胶状沉淀E,过滤强热得黑色金属氧化物,判断A,B,C,D.E各为何物。(用化学式表示) 2.在氯化汞溶液中,通入气体A,产生白色沉淀B,将B过滤,在所得滤液中加入 氯化钡溶液产生白色沉淀C,其不溶于硝酸,将白色沉淀B转入氯化钠溶液产生黑色沉淀D.将D在空气中加热转化为红色固体物质E.判断A,B,C,D,E各为何物。 3.含有ⅠA和ⅠB两种离子的混合液,向其中加入氯化钠溶液产生白色沉淀A, 过滤分离后,向A中加入氨水部分溶解为无色溶液B,往其中加硝酸产生白色沉淀C,而部分沉淀A加氨水后转化为灰黑色沉淀D.将D溶于硝酸形成无色溶液,往此溶液中加入KI产生桔红色沉淀E. A, B,C,D,E各为何物。 一种白色混合物,加水部分溶解为氯化物溶液A,不溶部分B仍为白色. 往A中滴加SnCl2先产生白色沉淀C,而后产生灰黑色沉淀D,往A溶液中加入氨水生成白色沉淀E,而往不溶物B中, 加入氨水则B溶解为无色溶液F,再加入硝酸而B重现. A,B,C,D,E,F各为何物。 4. 为什么cu(II)在水溶液中比在cu(I)更稳定,Ag(I)比较稳定,Au易于形成+III氧化态化合物? 5. 用反应方程式说明下列现象? (1)铜器在潮湿空气中慢慢生成一层绿色的铜锈; (2)金溶于王水; (3)在CuCl 2 浓溶液中逐渐加水稀释时,溶液颜色由黄棕色经绿色而变为蓝色; (4)当SO 2通入CuSO 4 与NaCl浓溶液中时析出白色沉淀; (5)往AgNO 3 溶液中滴加KCN溶液时,先生成白色沉淀而后溶解,再加入NaCl 溶液时,并无AgCl沉淀生成,但加入少量Na 2S溶液时却有黑色Ag 2 S沉淀析出; (6)热分解CuCl 2·2H 2 O时得不到无水CuCl 2
习题 一、选择题 1.下列金属中,最不活泼的是()(吉林大学《无机化学例题与习题》) A.Cu B. Ag C. Zn D.Hg 2.与银反应能置换出氢气的的稀酸是()(吉林大学《无机化学例题与习题》) A. 硫酸 B. 盐酸 C. 硝酸 D.氢碘酸 3.为除去铜粉中少量氧化铜,应采取的操作是()(吉林大学《无机化学例题与习题》) A. 浓盐酸洗 B. KCN溶液洗 C. 稀硝酸洗 D. 稀硫酸洗 4.下列化合物,在硝酸和氨水中都能溶解的是()(吉林大学《无机化学例题与习题》) A. AgCl B. Ag2CrO4 C.HgCl2 D. CuS 5.下列化合物中颜色最浅的是()(吉林大学《无机化学例题与习题》) A. Ag3PO4 B.CuI C.AuCl D. HgO 6.下列化合物中,在氨水、盐酸、氢氧化钠溶液中均不溶解的好是( ) (吉林大学《无机化学例题与习题》) A. ZnCl2 B. CuCl2 C. Hg2Cl2 D. AgCl 7.关于CuCl2性质的叙述,错误的是()(吴成鉴《无机化学学习指导》) A.是离子型化合物 B.是链状结构 C. 与HCl反应可生成配合物 D. 不论晶体还是水溶液均有颜色 8.向CuSO4入氨水的过程中,可能得到()(吴成鉴《无机化学学习指导》) A. Cu(OH)2. B.Cu2(OH)2SO4 C. [Cu(NH3)4]2+ D.[Cu(H2O)4]2+ 9.下列物质不能产生黑色物质的是( ) (吴成鉴《无机化学学习指导》) A.Cu在干燥的空气中加热至773K B. Ag与含H2S的空气接触 C. AgBr见光 D. ZnO在H2S气流中加热 10.往含有Ag+、Cd2+、Al3+、Hg22+的溶液中滴加稀盐酸能析出沉淀的是()(吴成鉴《无机化学学习指导》) A.Al3+和Cd2+ B.Ag+和Hg22+ C.Ag+和Cd2+D只有.Ag+ 11. 能区分Zn2+和Al3+的下列试剂是()(吴成鉴《无机化学学习指导》) A. NaOH B. HCl C. Na2CO3 D. NH3.H2O
第十五章 s区元素 一、教学基本要求 1. 了解s区元素的物理性质和化学性质,能解释碱金属与水、醇和液氨反应的不同; 2. 了解主要元素的矿物资源及单质的制备方法,特别注意钾和钠制备方法的不同; 3. 了解s区元素的氢化物、氧化物、氢氧化物的性质,特别注意氢氧化物的碱性变化 规律; 4. 了解s区元素的重要盐类化合物,特别注意盐类溶解性的热力学解释; 5. 会用离子极化理论解释碳酸盐分解规律; 6. 了解对角线规则和锂、铍的特殊性。 二、要点 1. 汞齐(amalgam ) 又称汞合金,汞的特性之一是能溶解除铁以外的许多金属而生成汞齐。汞与一种 或几种金属形成汞齐时,含汞少时是固体,含汞多时是液体。天然的有金汞齐,银 汞齐,人工制备的有:钠汞齐、钾汞齐、锌汞齐、锡汞齐、铅汞齐等。 2. 熔盐电解法(Molten-salt electrolysis) 指以熔融态盐类为原料的电解方法,常用于制备不能由水溶液中制备的金属,如碱金属、碱土金属以及钍、钽混合稀土金属的生产。有时为降低熔体的熔点,节 省电能,须加入一定量的助熔剂。 3. 热还原法(Thermo-deoxidization) 用化学活性较强的金属,将被还原的金属从其化合物中置换出来,以制备金属或其 合金的方法。 4. 冠醚(Crown ether) 分子结构类似皇冠的“大环多醚”。最常用的有18-冠-6 (如下图中的a)、二环己基 -18-冠-6及二苯基18-冠-6等。冠醚对K+、Na+及其他阳离子有很强的选择性络合 ,F- ),提 K + X- 表示( X=MnO 4高了裸阴离子的活性。冠醚在有机合成中常用作“相转移反应的催化剂”。 5.穴醚(Cryptant) 分子结构类似地穴的“大环多醚”。穴醚几乎能够实现对K+和Na+离子的完全 分离,选择性可高达105:1。如下图中的(b) (c)所示。 (a) (b) (c)
实验二十一ds区金属 一、实验目的 1、掌握铜、银、锌、镉、汞氧化物或氢氧化物的酸碱性,硫化物的溶解性; 2、掌握Cu (Ⅰ)、Cu (Ⅱ)重要化合物的性质及相互转化条件; 3、试验铜、银、锌、镉、汞的配位能力以及亚汞离子和汞离子的转化。 二、实验内容 (一)、铜、银、锌、镉、汞氢氧化物或氧化物的生成和性质: 1 、铜、锌、镉氢氧化物的生成和性质 (1)Ag2O的生成和性质: Ag++OH-===AgOH↓白色→Ag2O+H2O Ag2O+2HNO3===2AgNO3+H2O Ag2O+2NH3.H2O==2[Ag(NH3)2]++2OH-+H2O Ag2O微溶于水,溶液呈微碱性。它的△f H m﹩很小,不稳定,加热易分解,具有氧化性。 (2)HgO的生成和性质 Hg2++2OH-==Hg(OH)2==HgO↓+H2O HgO+2HNO3==Hg(NO3)2+H2O HgO+NaOH(40℅)-----不溶 HgO 有黄色和红色变体,结构相同,颜色差别完全是由于其颗粒的大小不同所致,黄色HgO晶粒较细小,红色颗粒较大。 (二)、铜、银、锌、镉、汞硫化物的生成和溶解
说明: 1.生成的CdS中,个别学生得到的沉淀是黄色中夹有白色沉淀,有可能是CdS晶形不一样,或有可能是生成Cd(OH)2白色沉淀。补充:CdS沉淀颜色变化与溶液的酸度及温度有很大关系。在冷氨性、中性或弱酸性溶液中,其沉淀为淡黄;若H+浓度增大,则沉淀将加变为深黄色。 2.在Hg(NO3)2中加入Na2S,开始生成白色沉淀,再加Na2S后变黑。对白色沉淀再加热也不会再变化。个别学生得到白中带有黄色的沉淀。 在中性或酸性汞盐溶液中加入S2-,即首先形成一个白色的复合物(HgCl2·2HgS):3Hg2++2Cl-+2S2-====HgCl2·2HgS 若再加S2-,则白色沉淀→ 黄色→ 棕色→ 黑色: 2HgCl·2HgS+S2-====3HgS+2Cl- 此沉淀不溶与其它,只溶于王水、Na2S。 将HgS与稀HNO3长时煮沸使之转变为一白色化合物,浓HNO3也有相同作用。HgS在浓HNO3中长时煮沸才溶: 5HgS+8NO3-+8H+=====3Hg(NO3)2·2HgS+3S+2NO+4H2O (三)、铜、银、锌、汞的配合物 1、氨合物的生成 1)CuSO4+NH3?H2O====Cu2(OH)2SO4(浅蓝色)+(NH4)2SO4 Cu2(OH)2SO4+8NH3====2[Cu(NH3)4]2++SO42-+2OH- 2)2Ag++2NH3.H2O====Ag2O+2NH4++H2O Ag2O+2NH3.H2O====2Ag(NH3)2++2OH-+H2O 3)Zn2++NH3H2O====Zn(OH)2+2NH4+ Zn(OH)2+4NH3H2O====[Zn(NH3)4]2++2OH-+4H2O
《元素化学》 第1章 《S 区元素》自测题 班级:应用化学1201B 姓名: 学号: 得分: 一、选择题(75分) 1 在下列性质中,碱金属比碱土金属高(或大)的是 ( ) A. 熔点 B. 沸点 C. 硬度 D. 半径 2 下列性质中,碱金属和碱土金属都不具有的是 ( ) A. 与水剧烈反应 B. 与酸反应 C. 与碱反应 D. 与强还原剂反应 3ⅠA,ⅡA 族元素的电离势,电负性和M 2分子中共价键的强度随着原子序数的增加而 ( ) A. 逐渐增大 B. 逐渐减小 C. 无法推测 D. 变化不大 4 下列原子中哪一种原子第一电离势最大 ( ) A. Na B. Li C. Be D. Mg 5 碱土金属与碱金属相比较,碱土金属比相邻的碱金属多一个电子,即增加了一个 单位的核电荷,所以 ( ) A. 碱土金属原子半径比相邻的碱金属大些 B. 电离势大 C. 较易失去第一个电子 D. 比碱金属更活泼 6 下列元素中形成化合物时,共价倾向最小的是 ( ) A. Be B. Li C. Ba D. Cs 7 最轻的金属是以下金属中的 ( ) A. Be B. Li C. Na D. Mg 8 下列金属单质不能保存在煤油里的是 ( ) A. Li B. Na C. K D. Rb 9 金属钠应保存在 ( ) A. 酒精中 B. 液氨中 C. 煤油中 D. 空气中 10 下列金属单质表现两性的是 ( ) A. Li B. Mg C. Ba D. Be 11 因为E ?(Na +/Na) 第11章 ds区元素 【11-1】试从下表所列的几个方面去比较ⅠA和ⅠB族元素的性质: ⅠA ⅠB 价电子构型 原子半径 电离能 化学活泼性 同族元素化学活泼性变化趋势 氧化态 与水作用 氢氧化无的碱性及稳定性 形成配合物的能力 解: 【11-2】试从习题1所列的几个方面去比较ⅡA和ⅡB族元素的性质。 解: ⅡA(碱金属)和ⅡB(铜族)族元素原子最外层只有一个电子,但铜族元素原子次外层为18电子,ⅠA原子次外层为8个电子。由于18电子结构的屏蔽效应小于8电子结构,使铜族元素原子有效核电荷数大,因而对最外层的一个s电子吸引比碱金属强;原子半径、离子半径小而电离能大,金属活动性弱。 【11-3】解释下列现象并写出反应式: (1)埋在湿土中的铜线变绿。 (2)银器在含H2S的空气中发黑。 (3)金不溶于浓HCl或HNO3中,却溶于此两种酸的混合液中。 解: 3. (1) 2Cu+ O2 + CO2 + H2O === Cu2(OH)2CO3(绿色) (2) 4Ag + 2H2S + O2 === 2Ag2S(黑色) + 2H2O (3) Au + 4HCl + HNO3 === H[AuCl4] + NO↑ + 2H2O 【11-4】以CuSO4为原料制取下列物质: [Cu(NH3)4]2+Cu(OH)2CuO Cu2O Na2[Cu(OH)4] CuI 解: CuSO 4 + 4NH 3 === [Cu(NH 3)4]SO 4 CuSO 4 +2 NaOH === Cu(OH)2↓ + H 2O Cu(OH)2 + 2NaOH === Na 2[Cu(OH)4]2CuSO 4 + 4KI === 2CuI ↓ + I 2 + K 2SO 44CuO === 2Cu 2O + O 2 Cu(OH)2 === CuO + H 2O △ △ 4. 【11-5】以Hg(NO3)2为原料制取下列物质: HgO HgCl 2 Hg 2Cl 2 Hg 2(NO 3)2 K 2[HgI 4] 解: Hg(NO 3)2+ 4KI === K 2[HgI 4] Hg(NO 3)2 + Hg === Hg 2(NO 3)25. Hg(NO 3)2 + 2NaOH - === HgO ↓(黄色) + 2NaNO 3 + H 2O HgO + 2HCl === HgCl 2 + H 2O HgCl 2 + Hg === Hg 2Cl 2 【11-6】用适当的方法区别下列物质: (1)镁盐和锌盐 (2)AgCl 和Hg 2Cl 2 (3)升汞和甘汞 (4)锌盐和铝盐 解:(1)加入NaOH 溶液,出现白色沉淀,随后又溶解的是锌盐,不溶解的是镁盐。 (2)分别取三种盐放入试管中,向各试管中加入氨水放置一断时间,有黑色沉淀出现的是Hg 2Cl 2 , 溶解得到无色溶液的氯化银反应如下: Hg 2Cl 2+2NH 3 == HgNH 2Cl ↓+NH 4Cl+Hg ↓ AgCl+2NH 3 == 〔Ag(NH 3)2〕+ + Cl - (3)加入KI 溶液,出现黄绿色沉淀的是甘汞,溶解成无色溶液的是升汞。 Hg 2Cl 2 + 2I - == Hg 2I 2↓ + 2Cl - HgCl 2+4I - == 〔HgI 4〕2-+2Cl - (4)加入氨水,出现白色沉淀,随后又溶解的是锌盐,不溶解的是铝盐。 【11-7】Cu 和Zn 能否分别与稀HCl 溶液,浓H2SO4溶液,浓HNO3溶液及NaOH 溶液反应?若能反应,试写出反应式。 解: 第18章d s 区金属 18.l 为什么C u(II)在水溶液中比Cu(I)更稳定,Ag(I)比Ag(II)稳定,Au 易形成+III 氧化态化合物? 解:(1)Cu 2+离子半径比Cu +离子的小,而电荷又多一倍,所以Cu 2+的溶剂化作用要比Cu + 的强得多;Cu 2+的水化能(-2121kJ ·mol -1)已超过铜的第二电离能。所以Cu 2+在水溶液中比C u +稳足。 (2)Ag 2+和Ag +的离子半径都较大,其水化能相应就小,而且银的第二电离能又比铜的第 二电离能大,因此Ag +比较稳定。 (3)金的离子半径明显比银的大,金的第3个电子比较容易失去,再加上d 8离子的平面 正方形结构具有较高的晶体场稳定化能,这就使得金容易形成+Ⅲ氧化态。 18.2 简述:(1)怎样从闪锌矿冶炼金属锌?(2)怎样从辰砂制金属汞? 解:(1)闪锌矿通过浮选法得到含有40%~60%ZnS 的精矿石,焙烧使其转化为ZnO ,再将ZnO 和焦炭混合在鼓风炉中加热至1373~1573K ,使Zn 以蒸气逸出,冷凝得到纯度为99%的锌 粉: 2ZnS+3O 2========= 2ZnO+2SO 2 2 C+O 2=======2CO ZnO+CO =======Zn(g)+CO 2↓ (2)辰砂中制金属汞 辰砂碎石经粉碎,浮选富集之后,在空气在中焙烧或与石灰共热,然后使汞蒸馏出来。 HgS+ O 2=======Hg+ SO 2↑ 4HgS+4CaO ====== 4Hg+3CaS+CaSO 4 18.3电解法精炼铜的过程中,粗铜(阳极)中的铜溶解,纯铜在阴极上沉积出来,但粗铜中的A g 、 Au 、Pt 等杂质则不溶解而沉于电解槽底部形成阳极泥,Ni 、Fe 、Zn 等杂质与铜一起溶解,但并不在阴极上沉积出来,为什么? 解:因电解过程是一个氧化还原的过程,从下面各金属离子电对的电极电势可以看出:Cu 2+ 的氧化能力大于Ni 2+、Fe 2+、Zn 2+而小于A g +、Au 3+、Pt 2+,所以在电解过程中,Ni 、Fe 、Zn 失去电子转入溶液中,而Ag 、Au 、Pt 沉入阳极底部。 φM 2+/ M : Cu : 0.342 V , Ni :-0.257V ,Fe :-0.44V ,Zn :-0.762 V ,Ag+:0.78 V , Au 3+:1.498V ,Pt :1.2V 18.4 有一份硝酸铜和硝酸银的混合物,试设计一个分离它们的方案。 解:根据AgNO 3和Cu(NO 3)2的热分解温度不同分离 2AgNO 3====== 2Ag +2 NO 2↑+O 2 Cu(NO 3)2=====2CuO+4NO 2↑+ O 2↑ 控制温度在472~712 K 之间加热,然后溶解过滤出CuO ,将滤液重结晶便得到纯的硝酸银;将CuO 溶于稀硝酸再结晶便得到硝酸铜。 18.5 lmL 0.2 mol ·dm -3HCl 溶液中含有Cu 2+5mg ,若在室温及101.325kPa 下通入H 2S 气体至 饱和,析出CuS 沉淀,问达到平衡时,溶液中残留的Cu 2+浓度(mg ·mL -1)为多少? 解:K sp(CuS)=1.27×10-36 H 2S : K a 1=5. 7×10-8 K a 2=1. 2×10-15 由于CuS 的K sp 很小,可以认为Cu 2+完全生成CuS Cu 2++H 2S====Cu S ↓+2H + H 2S====2H ++ S 2- [S 2-]= 焙烧 712K 472K K a 1·K a 2 [H 2S] [H +] 第11章习题解答第11章(03525)重水是由H和18O组成的水。.() 解:错 第11章(03526)氢在自然界中主要以单质形式存在。() 解:错 第11章(03527)由于H2是双原子分子,所以H2比He的扩散速率小。.()解:错 第11章(03528)氢气是最轻的单质,所以它的熔点和沸点在所有单质中最低。.() 解:错 第11章(03529)因为氢分子的极化率大于氦分子的极化率,所以氢的熔点比氦高。.() 解:对 第11章(03530)常温下H2的化学性质不很活泼,其原因之一是H-H键键能较大。() 解:对 第11章(03531)实验室所用氢气钢瓶应放在室外,这是因为氢气.()。 (A)密度小;(B)扩散快;(C)易燃易爆;(D)导热性好。 解:C 第11章(03532)水煤气的主要成分是.()。 (A)CO和N2;(B)CO和O2;(C)CO和H2;(D)CO2和H2O。 解:C 第11章(03533)下列氢气制法中,工业上不常采用的是.()。 (A)电解法;(B)水煤气法;(C)甲烷转化法;(D)活泼金属与酸反应。解:D 第11章(03534)下列反应方程式中,不适用于工业制氢的是()。 (A)H2O(电解)→H2+O2; (B)Zn+H2SO4→ZnSO4+H2; (C)C+H2O(g)? ?CO+H2; ?→ (D)CH4+H2O(g)?,Ni,Co ?→ ????CO+H2。 解:B 第11章(03539)在某些工厂用氢气做冷却剂,这是因为氢气.()。 (A)密度小;(B)扩散快;(C)易燃易爆;(D)导热性好。 解:D 第11章(03535)下列氢气制法中,工业上不常采用的是.()。(A)电解法;(B)水煤气法;(C)甲烷转化法;(D)碱金属氢化物与水反应。解:D 第11章(03536)下列分子或离子不能存在的是.()。 (A)H2;(B)H2+;(C)H22+;(D)H-。 解:C 第11章(03537)下列原子、离子和分子中属于反磁性的是.()。(A)H;(B)H2;(C)H2+;(D)H2-。 解:B 第11章(03538)氢在周期表中的位置应是.()。 (A)ⅠA族;(B)ⅦA族;(C)ⅣA族;(D)特殊的位置。 第二十章S区金属(碱金属与碱土金属) 总体目标: 1.掌握碱金属、碱土金属单质的性质,了解其性质、存在、制备及用途之间的关系 2.掌握碱金属、碱土金属氧化物的类型及重要氧化物的性质及用途 3.掌握碱金属、碱土金属氢氧化物溶解性和碱性的变化规律 4.掌握碱金属、碱土金属盐类的性质;认识锂和镁的相似性 各节目标: 第一节金属单质 1.了解碱金属和碱土金属单质的物理性质,包括颜色、状态、熔点、沸点、硬度、密度、导电性 2.掌握碱金属和碱土金属单质的化学性质,主要包括:①与水的反应②与非金属的反应(O2、Cl2、N2、H2等等)③与液氨的反应④与其他物质反应 3.了解碱金属和碱土金属的存在、熔盐电解法和热还原法制备方法及用途 第二节含氧化合物 1.掌握碱金属、碱土金属氧化物的类型,包括普通氧化物、过氧化物、超氧化物和臭氧化物及一些重要氧化物的性质和用途 2.掌握碱金属、碱土金属氢氧化物在同族从上到下溶解性增大及随离子半径的增大碱性增强的变化规律 第三节盐类 1.掌握碱金属、碱土金属重要盐类的热稳定性和溶解性的变化规律及用途 2.认识锂和镁的相似性,掌握它们的特性 Ⅱ习题 一选择题 ⒈下列氮化物中最稳定的是()(吉林大学《无机化学例题与习题》) A. Li3N B. Na3N C. K3N D. Ba3N2 ⒉已知一碱金属含氧化合物,遇水、遇CO2均可放出氧气,在过量氧气中加此 碱金属,可直接生成该含氧化合物,此氧化物之阴离子具有抗磁性,此物质为() A.正常氧化物 B.过氧化物 C.超氧化物 D.臭氧化物 ⒊超氧离子-2O ,过氧离子-22O 与氧分子O 2相比较,稳定性低的原因是( ) A. -2O 、-22O 反键轨道上的电子比O 2的少,从而它们的键级小 B. -2O 、-22O 反键轨道上的电子比O 2的少,从而它们的键级大 C. -2O 、-22O 反键轨道上的电子比O 2的多,从而它们的键级小 D. -2O 、-22O 反键轨道上的电子比O 2的多,从而它们的键级大 ⒋电解熔融盐制金属钠所用的原料是氯化钠和氯化钙的混合物,在电解过程中阴极析出的是钠而不是钙,这是因为( ) A.)/()/(200Ca Ca Na Na ++>??,钠应先析出 B.还原一个钙离子需要2个电子,而还原一个钠离子只需一个电子, C.在高温熔融条件下,金属钠的析出电位比金属钙低 D.析出钙的耗电量大于析出钠的耗电量 ⒌已知)/()/(00Na Na Li Li ++>??,这是由于( ) A.锂的电离能大于钾、钠 B.锂与水的反应速度较钾、钠与水的更为强烈 C.锂与水的反应速度较钾、钠与水的更为缓慢 D.Li 的水化能大于Na +和K +的水化能 ⒍碱金属氢氧化物的溶解度较碱土金属氢氧化物为大,这是由于( ) A.它们的氢氧化物碱性强 B.它们的氢氧化物电离度大 C.碱金属离子的离子势大 D.碱金属离子的电离势小 ⒎锂和镁性质上的相似性是由于( ) A.锂、镁的离子极化能力相似 B.锂、镁的离子变形性相似 C.两者离子均为8电子层构型 D.两者离子半径相近、离子电荷相同 ⒏下列硫酸盐中热稳定性最高者是( ) A. Fe 2(SO 4)3 B. K 2SO 4 C. BeSO 4 D. MgSO 4 ⒐用金属钠在高温下能把KCl 中的K 还原出来,原因是( ) A.金属钠比金属钾更活泼第11章-ds区元素
北师大无机化学四版习题答案18章ds区金属
第11章s区元素和稀有元素习题集解答
第二十章 S区金属(碱金属与碱土金属)