无机化学(人卫版)_配位平衡与配位滴定法
- 格式:ppt
- 大小:628.50 KB
- 文档页数:76




配位平衡与配位滴定法第八章配位平衡与配位滴定法(Coordination Equilibrium and Complexometic Titration)本章目标1.掌握配位化合物的定义、组成、命名和分类。
2掌握配位平衡和配位平衡常数的意义及其有关计算,理解配位平衡的移动及与其他平衡的关系。
3.了解螯合物及其特点。
4.了解EDTA与金属离子配合物的特点及其稳定性5.理解配位滴定的基本原理,配位滴定所允许的最低pH值和酸效应曲线,6.了解金属指示剂作用原理及应用7.掌握配位滴定的应用配位化合物(coordination compound)简称配合物,是组成复杂、应用广泛的一类化合物。
最早报道的配合物是1704年由德国涂料工人迪士巴赫在研制美术涂料时合成的,叫普鲁士蓝KFe[Fe(CN)6]。
19世纪上半叶,又陆续发现一些重要的配合物,由于当时还不能确定结构,这些物质通常以发现者的名字命名。
直到19世纪90年代,瑞典化学家Werner提出了配位理论,才对配合物的结构和某些性质给予了满意的解释,从而奠定了配位化合物的基础。
20世纪60年代以来,配合物的研究发展很快,已形成独立的学科。
配位反应已渗透到生物化学、有机化学、分析化学、催化动力学、生命科学等领域中去。
在生产实践、分析科学、功能材料和药物制造等方面有重要的实用价值和理论基础。
本章从配合物的基本概念出发,介绍其组成、结构、在溶液中的平衡和在滴定分析中的应用。
8.1 配合物的组成与命名8.1.1 配合物的定义通常把由一个简单正离子(或原子)和一定数目的阴离子或中性分子以配位键相结合形成的复杂离子(或分子)称为配位单元,含有配位单元的复杂化合物称为配合物。
这些化合物与简单的化合物区别在于分子中含有配位单元。
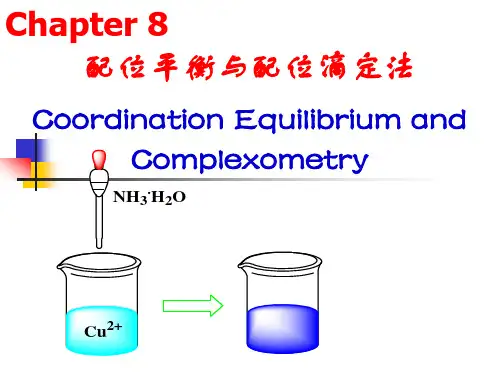
例如将Cu(NH3)4]SO4晶体溶于水中,溶液中除了含有[Cu (NH3)4]2+和SO42-,几乎检查不出有Cu2+和NH3的存在。
分析其结构,在[Cu(NH3)4]2+中,每个氨分子中的氮原子,提供一对孤对电子,填入Cu2+的空轨道,形成四个配位键。
第九章 配位平衡和配位滴定分析一、本章要点1. 了解配合物的定义、组成和结构特点。
2. 理解配合物价键理论的主要观点,并解释一些配合物的结构和性质。
3. 理解配位平衡常数的意义及其有关的计算。
4. 了解螯合物EDTA 的特点及其应用。
5. 了解溶液中各级配合物的分布,掌握副反应系数,即酸效应、酸效应系数和配位效应、配位效应系数和条件稳定常数的基本概念。
6. 掌握条件稳定常数与绝对稳定常数、酸效应系数、配位效应系数的关系。
7. 掌握配位滴定的基本原理,影响配位滴定曲线突跃大小的因素、直接准确滴定的条件及配位滴定的适宜酸度范围。
8. 掌握金属指示剂的作用原理、金属指示剂的选择依据,常用的铬黑T 和钙指示剂的使用。
了解金属指示剂的封闭和僵化现象及消除原理。
9. 掌握干扰离子的判断条件,控制溶液的酸度排除干扰离子和利用掩蔽法、解蔽法提高选择性的方法。
10. 掌握EDTA 标准溶液的配制与标定以及配位滴定法的应用。
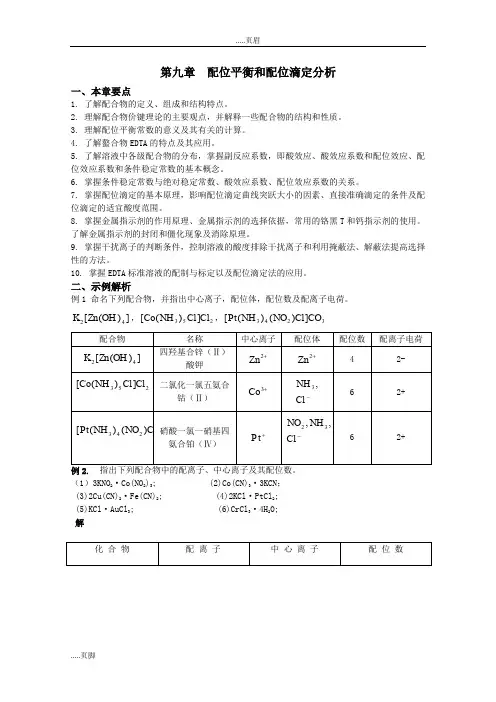
二、示例解析例1 命名下列配合物,并指出中心离子,配位体,配位数及配离子电荷。
])([42OH Zn K ,253])([Cl Cl NH Co ,3243])()([CO Cl NO NH Pt例2. 指出下列配合物中的配离子、中心离子及其配位数。
(1)3KNO 2·Co(NO 2)3; (2)Co(CN)3·3KCN ; (3)2Cu(CN)2·Fe(CN)2; (4)2KCl ·PtCl 2; (5)KCl ·AuCl 3; (6)CrCl 3·4H 2O; 解例3. 命名下列配合物,并指出配离子和中心离子的电荷。
(1)[Cu(NH3)4](OH)2; (2)[CoCl(NO2)(NH3)4]+;(3)K3[Co(NO2)6]; (4)[CrBr2(H2O)4]Br·2H2O;(5)[Cr(OH)(C2O4)(en)(H2O)].例4. 已知有两种钴的配合物,它们具有相同的分子式Co(NH3)5BrSO4,其间区别在于第一种配合物的溶液中加BaSO4产生沉淀,加AgNO3时不产生AgBr沉淀,而第二种配合物与此相反。



第五章配位滴定法1.基本概念稳定常数:为一定温度时金属离子与EDTA配合物的形成常数,以KMY表示,此值越大,配合物越稳定。
逐级稳定常数和累积稳定常数:逐级稳定常数是指金属离子与其它配位剂L逐级形成MLn型配位化合物的各级形成常数。
将逐级稳定常数相乘,得到累积稳定常数。
副反应系数:表示各种型体的总浓度与能参加主反应的平衡浓度之比。
它是分布系数的倒数。
配位剂的副反应系数主要表现为酸效应系数αY(H)和共存离子效应αY(N)系数。
金属离子的副反应系数以αM表示,主要是溶液中除EDTA外的其他配位剂和羟基的影响。
金属指示剂:一种能与金属离子生成有色配合物的有机染料显色剂,来指示滴定过程中金属离子浓度的变化。
金属指示剂必须具备的条件:金属指示剂与金属离子生成的配合物颜色应与指示剂本身的颜色有明显区别。
金属指示剂与金属配合物(MIn)的稳定性应比金属-EDTA配合物(MY)的稳定性低。
一般要求K MY'>K MIn'>102。
最高酸度:在配位滴定的条件下,溶液酸度的最高限度。
最低酸度:金属离子发生水解的酸度。
封闭现象:某些金属离子与指示剂生成极稳定的配合物,过量的EDTA不能将其从MIn中夺取出来,以致于在计量点附近指示剂也不变色或变色不敏锐的现象。
2.基本原理(1)配位滴定法:EDTA与大多数金属离子能形成稳定配位化合物,此类配合物不仅稳定性高,且反应速度快,一般情况下,其配位比为1:1,配合物多为无色。
所以目前常用的配位滴定法就是EDTA滴定,常被用于金属离子的定量分析。
(2)准确滴定的条件:在配位滴定中,若化学计量点和指示剂的变色点ΔpM'=±0.2,将lgC×K MY'≥6 或C×K MY'≥106作为能进行准确滴定的条件,此时的终点误差在0.1%左右。
(3)酸度的控制:在配位滴定中,由于酸度对金属离子、EDTA和指示剂都可能产生影响,所以必须控制溶液的酸度,需要考虑的有:满足条件稳定常数38时的最高酸度;金属离子水解最低酸度;指示剂所处的最佳酸度等。

