2011年高考化学一轮复习专题03 溶液、胶体、分散系(课件)
- 格式:ppt
- 大小:530.50 KB
- 文档页数:28




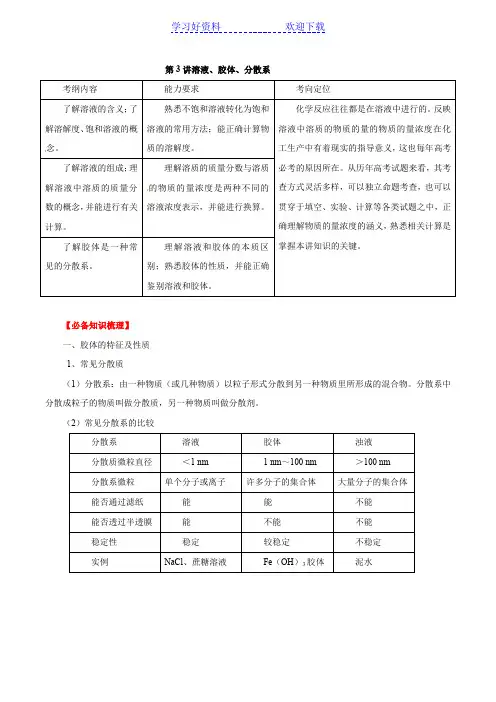
第3讲溶液、胶体、分散系【必备知识梳理】一、胶体的特征及性质1、常见分散质(1)分散系:由一种物质(或几种物质)以粒子形式分散到另一种物质里所形成的混合物。
分散系中分散成粒子的物质叫做分散质,另一种物质叫做分散剂。
(2)常见分散系的比较2.胶体的分类:3.胶体的制备和精制(1)物理方法:研磨(如制豆浆、研墨),搅拌(如制蛋白胶体)。
(2)水解法:如向20ml 沸蒸馏水中加入1~2毫升的FeCl 3溶液,搅拌,继续煮沸,可以水解得到Fe(OH)3胶体:Fe 3++3H 2O=Fe(OH)3+3H +(3)复分解法:向10毫升的0.01mol/L 的KI 溶液中,滴入8~10滴0.01mol/L 的AgNO 3溶液,振荡,可得AgI 胶体:Ag ++I -=AgI (胶体)在一只大试管里加入5~10毫升的1mol/L 的HCl ,加入1ml 水玻璃(Na 2SiO 3溶液),可得硅酸(H 4SiO 4)胶体:SiO 32—+2H ++2H 2O=H 4SiO 4(胶体)(4)胶体的精制:把混有分子或离子杂质的胶体装入半透膜袋里,并把整个袋放在溶剂中,从而使离子或分子从胶体里面分离的操作叫做渗析。
渗析可以精制胶体,但胶体仍为混合物。
4.胶体的性质(1)丁达尔效应——当一束平行强光通过肉眼看来完全透明的溶液,从垂直于光束的方向,可以观察到有一条光亮的通路,这种现象称为“丁达尔效应”。
丁达尔效应是粒子对光散射的结果。
(2)布朗运动——在胶体溶液中,胶体颗粒不断地进行无规则的热运动,称为“布朗运动”。
布朗运动是胶体稳定存在的原因之一。
(3)电泳现象——在外加电场的作用下,胶体的微粒在分散剂里向阴阳两极做定向移动的现象。
电泳只是胶粒定向地向电极运动,并没有凝聚而沉淀。
电泳的原因:胶粒带有电荷(胶粒的表面积很大,吸附能力很强,能选择性的吸附溶液中的离子而带有电荷,但整个溶液呈电中性)。
胶粒微粒带电规律:金属氧化物、金属氢氧化物胶粒吸附阳离子而带正电荷,如Al(OH)3、Fe(OH)3胶体;非金属氧化物、金属硫化物、硅酸及土壤,如H 2SiO 3、As 2S 3胶体吸附阴离子而带有负电荷;淀粉胶粒不带电。


