
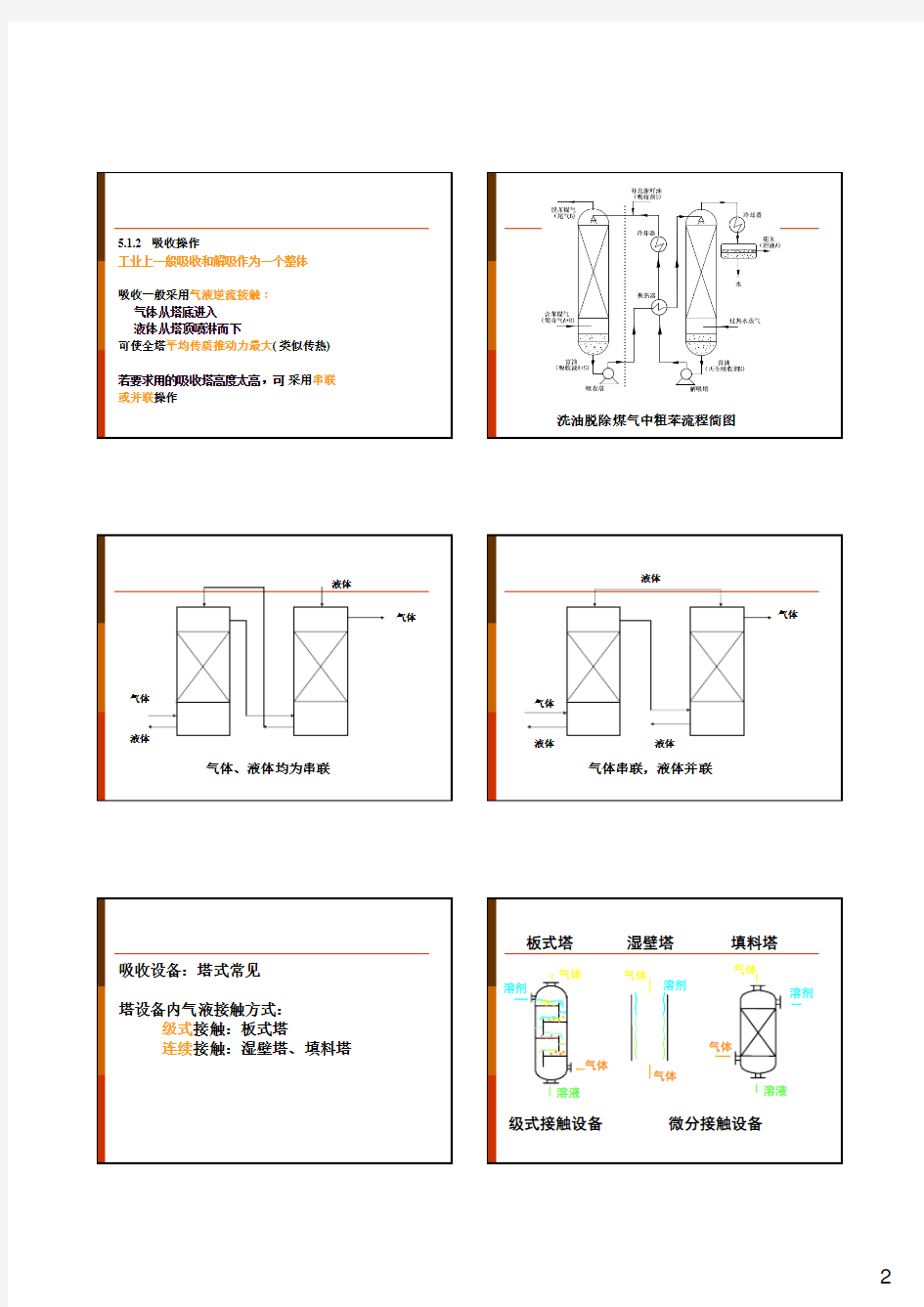
洗油脱除煤气中粗苯流程简图
液体
SO2在水中的溶解度曲线氨在水中的溶解度曲线
《常温下食盐在水中的溶解度》教学设计 广西桂林市中华小学葛琳一、教学背景、教学课题、教材分析及教学方法: 在教学创新设计中,我选取的教学内容是新版教科版科学四年级上册第二单元“溶解”的第六课《常温状态下100毫升水能溶解多少克食盐》。为了适应六年级学生的教学,对原内容进行了改进和拓展,增加了学习的难度和学习要求。原教材的主要内容是指导学生制定“100毫升水能溶解多少克食盐”的研究计划并展开实验,同时获得“一定量的水只能溶解一定量的食盐”的认识。本单元围绕“溶解”这一研究主题,以食盐和水作为主要的观察研究材料按问题顺序编排起来。本课是在学生加深了对溶解的认识和理解上,已经经历了“问题—假设---验证---证实”的科学探究活动过程的基础上来学习的。 在四年级的教学中,教材对学生的教学目标高度降低,只要求学生了解等量的常温状态下100毫升水溶解食盐的份数,对具体溶解克数的数字并没有作要求,考虑到五、六年级的学生在智力和能力上已经比四年级的学生提高了不少,所以必须对原教学要求作出必要的修改,要在规定的时间内自己设计出适合自己操作的研究计划并探究出精确的数值。本节课无论是实验设计还是实验操作,对学生而言都是很好的锻炼。 二、教学目标 1、科学知识: 通过经历实验研究活动,使学生获得“一定量的水只能溶解一定量的食盐”的认识。2、科学探究: 初步感知和经历探究实验的方法和步骤,在实验研究的设计过程中,让学生感受到科学的严谨,激发学生创新的思维,培养学生的实验动手能力。 3、情感态度和价值观: 在科学探究过程中,培养乐于探究、注重科学事实、敢于挑战权威、乐于合作与交流的意识。 三、教学重点: 针对“100毫升水能溶解多少克食盐”这一问题自主进行研究,初步感知和经历探究性实验的方法和步骤。 教学难点: ①、如何对加入的盐准确计量。 ②、食盐怎样才算不能溶解了 四、教学准备 1、学生材料:食盐、小勺、筷子、烧杯、量筒、牙签、实验记录表(每组一份)。 2、教师准备:食盐、小勺、玻璃棒、量杯、牙签、电子秤(天平)、量筒、实验记录表(每组一份) 五、教学过程: 1、提出问题,引入课题。
乙二醇溶液的冰点测定实验
一、实验目的:测定不同浓度的乙二醇溶液的冰点 二、仪器试剂:乙二醇(分析纯),高低温试验箱,电子天平,100ml容量 瓶,量筒 三、实验步骤: 1、配置溶液:用100ml量筒分别量取25ml,30ml,40ml,50ml,55ml的乙 二醇(分析纯),用100ml的容量瓶定容。配置成体积浓度分别为25%,30%,40%,50%,55%的乙二醇溶液。 2、用电子天平称量配置溶液的质量。结果如下表: 浓度(体积) 质量/g 25% 103.4270 30% 103.9378 40% 105.2428 50% 54.2414 55% 106.8160 3、通过查阅资料可知不同浓度的乙二醇溶液冰点如下表: 体积分数,%冰点/℃体积分数,%冰点/℃体积分数,%冰点/℃ 0.00.027.7-14.141.5-26.4 4.4-1.428.7-14.842.5-27.5 8.9-3.229.6-15.443.5-28.8 13.6-5.430.6-16.244.5-29.8 18.1-7.831.6-17.045.5-31.1 19.2-8.432.6-17.946.5-32.6 20.1-8.933.5-18.647.6-33.8 21.0-9.534.5-19.448.6-35.1 22.0-10.235.5-20.349.6-36.4 22.9-10.736.5-21.350.6-37.9 23.9-11.437.5-22.351.6-39.3 24.8-12.038.5-23.252.7-41.1 25.8-12.739.5-24.353.7-42.6 26.7-13.340.5-25.354.7-44.2 4、将几种溶液置于高低温试验箱中,以上表中的冰点为依据,分别在不同温 度下维持一段时间,观察现象。
离子色谱测定一、二、三乙二醇中无机氯的含量 2012-11-13 建立了一种测定一、二、三乙二醇中无机氯含量的离子色谱方法。将样品用二次去离子水以1:1的比例进行稀释,以3.6mmol/L的碳酸钠作为淋洗液,经阴离子交换色谱柱进行分离,采用电导检测器测定氯离子。结果表明:氯离子含量在0.02~0.4mg/kg范围内,方法的线性关系良好(相关系数为0.9999),加标回收率在97.0%~102.8%之间,方法的日内相对标准偏差小于2%,日间相对标准偏差小于3%。方法简便、稳定性好,可实现对一、二、三乙二醇中无机氯含量的快速和准确测定。 关键词:离子色谱法;一、二、三乙二醇;氯离子 乙二醇(ethyleneglycol)又名“甘醇”、“1,2-亚乙基二醇”,简称EG,乙二醇存在三个种类:乙二醇(MEG)、二乙二醇(DEG)和三乙二醇(TEG)。乙二醇用于配制发动机的抗冻剂,还用于工业冷量的输送,一般称呼为载冷剂。抗冻剂和载冷剂中过量的氯离子存在会对设备产生腐蚀而使之发生渗漏,影响发动机及工业设备的寿命,因此有必要对乙二醇中的氯离子含量进行测定,实现对乙二醇进行质量控制。 1实验部分 1.1仪器与试剂 离子色谱仪;超纯水机; 移液管1mL和2mL,一次性1mL注射器,50mL容量瓶,100mL容量瓶。 Na2CO3基准试剂,,NaOH优级纯,NaCl基准试剂。 1.2色谱条件 阴离子分析柱(4×250mm)及其WY-AG-1保护柱(4×50mm),电导检测器,阴离子抑制器,抑制电流40mA,淋洗液:3.6mmol/LNa2CO3溶液,流速0.8mL/min,样品环100μL,柱温45℃,检测
2-1 三元水盐系溶解度测定 (设计性实验) 第一部分设计性实验教学大纲 实验课程名称:专业实验(化学工程与工艺) 实验项目名称:三元水盐系溶解度测定 实验类型:设计性实验 实验类别:基础口专业基础口专业空 实验学时:4-6 一、实验目的 1、自行设计实验方案、实验步骤,学习三元水盐体系液固相平衡数据的测定方法。 2、通过绘制NaCI-NH4CI-H2O 三元体系等温相图,学会相图的绘制与应用; 3、复习液固相平衡知识,训练恒温、取样、称量、分析等基本操作技术。 二、预习与参考 1、陈钟秀、顾飞燕、胡望明编,化工热力学(第二版),北京: 化学工业出版社,2001年 2、牛自得、程芳琴主编,水盐体系相图及其应用,天津:天津大学出版社,2002年。 3、青岛科技大学化工实验中心编,化学工程与工艺专业实验,2003 年 4、杭州大学化学系分析化学教研室编,分析化学手册(第二版) 第二分册,北京:化学工业出版社,1997年 三、设计指标 以二元系统的溶解度数据为基础,在所设定的温度下,设计NaCI-NH 4CI-H 2O三元水盐体系合理的原始构成和实验步骤,进行实验,获得实验温度下的液固平衡数据,通过分析、计算,用所得数据绘制出NaCI-NH 4CI-H2O三元体系等温相图。 四、实验要求(设计要求) 自行设计实验方案和原始数据,包括流程、实验步骤,分析方法等, 达到实验目的五、实验(设计)仪器设备和材料清单水浴恒温震荡装置,
酸、碱滴定装置,玻璃仪器;电子天平,分析天平,氯化钠,氯化铵,氢氧化钠、硝酸银标准溶液,甲醛溶液,蒸馏水,指示剂。 六、调试及结果测试原始数据和实验方案经指导教师审核后,自行调试。 利用提供的玻璃仪器和试剂自行分析。 七、实验报告要求要求有实验目的、实验原理、实验方案和步骤、实验数据记录,对实验数据进行处理,计算液固亮相的组成,绘制出相图,并对所得的实验结果进行讨论(包括方案的合理性、误差分析、成败原因等) 八、思考题 1、本实验条件下的结果与标准值有何差异,为什么? 2、取样操作不 当,会产生那些可能情况?
·分析测试· 分光光度法测定微量氯离子的研究与应用 STUDY AND APPLICATION OF SPECTROPHOTOMETRIC METHOD FOR DETERMINATION OF MICRO CHLORION 1 前言 含有有机物工艺水中氯离子的测定, 是化工生产中常用的分析指标,其含量的高低,对生产的稳定性、生产过程参数的调节至关重要。目前,含有有机物工艺水中的氯离子的测定方法有硝酸银滴定法、汞量滴定法、比色法、离子选择电极法等。这些方法各有利弊,在生产中直接应用有一定的难度。分光光度法以其灵敏度高,选择性好,操作简单等优点广泛用于各种微量以及痕量组分的分析。由于氯化银沉淀不稳定, 直接应用分光光度法测定结 果不理想。笔者通过研究氯化银沉淀在明胶- 乙醇水溶液中的稳定性。建立了一种新的测定微量氯离子的分光光度法,并应用到有机物工艺水中微量氯离子的测定,结果令人满意。线性范围为0~6 mg/ L , 方法的标准偏差为01108 , 变异系数为01026 。回收率为101 %~105 %。 2 实验部分 211 试剂 明胶- 乙醇水溶液: 称取011250 g 明胶, 溶于100 ml 水中, 取其20mL 明胶溶液+ 30 mL 乙醇, 放于100 mL 容量瓶中,用水稀释到满刻度。硝酸溶液:1 + 2 。氯标准溶液:012 mg/ mL 。称取116439 (称准至010002 g) 氯化钠溶解后,全部转移到1000 mL 容量瓶中,用水稀释至满刻度,摇匀,取此
溶液50 mL 稀释到250 mL 。硝酸银溶液:20 g/ L 。称取2 g 硝酸银于100 mL 容量瓶中, 用无氯化物水稀释到刻度。 212 仪器 3 运行效果 根据该厂污水处理场的实际情况, 在两间浮选池上各装一套溶气设备,经过试运行,在认为设备运行正常的情况下,进行了检验和验收,结果如下: (1) 污水泵、循环加气泵及电机运行平稳, 无振动和异常声音。 (2) 污水泵和循环加气泵压力均在013~0134MPa 之间。 (3) 气泡微细。 (4) 截止目前射流加压溶气设备运行情况良好,除油效果显著,提高了污水处理的质量。 4 结论 (1)JDAF - Ⅱ型射流加压溶气设备应用效果良好,运行稳定,操作简单,根除了释放器堵塞现象,减轻了操作人员的劳动强度。 (2) 该设备采用内循环式,所需的溶解空气经循环射流器和真空进气阀自吸气作用完成, 毋需空气压缩机供给,因此减轻了噪声污染。 (3) 除油效果显著。浮选出水含油由原来的6018 %提高到现在的7310 % , 浮选出水含油量可控制在20 mg/ L 以下。 (4) 自动化程度高。该设备自动调整溶气罐内气液平衡,无需人工控制。 一般实验室仪器及7550 紫外可见分光光度计。 213 测定步骤 于100 mL 比色管中,依次加入氯标准溶液、水、明胶- 乙醇水溶液、硝酸溶液,混匀后再加
下列物质不同温度(℃)时每100克水中的最大溶解克数 温度 0 10 20 25 30 40 50 60 70 80 90 100 物质 硫酸钾 7.4 10.2 11.1 13.0 14.8 16.6 18.2 19.8 21.4 22.4 24.1 硫酸钠 4.5 9.6 19.527.9 40.8 48.4 46.7 45.3 44.1 43.7 42.9 42.3 硫酸铵 70.1 72.7 75.4 76.9 78.1 81.2 84.3 87.4 90.7594.1 98.05102.0硫酸氢钠 5.028.6 100.0硫酸钡 0.12 0.2 0.24 0.29 0.31 0.42 0.46 0.43 0.4 0.4 0.41 硫酸钙 0.18 0.19 0.21 0.21 0.2 0.2 0.16 氢氧化钙 0.18 0.17 0.16 0.15 0.14 0.11 0.09 0.07 氯化钠 35.7 35.8 36.0 36.3 36.6 37.0 37.3 37.8 38.4 39.0 39.8 氯化钾 28.0 31.2 34.4 37.4 40.3 42.8 45.8 48.1 51.1 54.0 56.0 氯化铵 29.4 33.3 37.2 41.4 45.8 50.4 55.2 60.2 65.6 71.3 77.3 碳酸钠 7.0 12.2 21.8 29.4 39.7 48.8 47.3 46.4 46.2 45.8 45.7 45.5 碳酸钾 107.0 109.0111.0114.0117.0126.0139.0156.0碳酸铵 100.0 碳酸氢钾 22.5 27.4 33.7 39.9 47.5 65.6 碳酸氢铵 11.9 16.1 21.7 24.8 28.4 36.6 59.2 109.0 碳酸氢钠 6.9 8.15 9.6 10.3511.1 12.7 14.45 16.4 20.2 24.3 碳酸氢钙 0.16 0.17 0.17 0.18 0.18 0.18 碳酸钙 8.1 7.0 6.5 5.2 4.4 3.8 碳酸钡 1.7 2.3 2.4 6.5 甘氨酸14.1818.0422.5227.5933.1639.145.2651.3957.2762.6267.17 IDA 2.6 3.3 4.04 6.089.7312.9616.5823.8132.2152.0
1、方法提要(乙二醇法测定游离CaO) 用乙二醇—乙醇(2+1)溶液,在温度100-110度下,萃取样品中的游离氧化钙,能在工作2-3分钟萃取完全,不经过滤,以酚酞为指示剂,用苯甲酸无水乙醇标准溶液直接滴定溶液中的乙二醇钙。2、方法原理 游离氧化钙与乙二醇在无水乙醇溶液中,当温度100-110度时,反映生成乙二醇钙,使酚酞指示剂呈红色,然后用苯甲酸无水乙醇标准溶液滴定至红色消失。 根据滴定乙二醇钙时,消耗的苯甲酸无水乙醇标准溶液的休积及对氧-化钙的滴定度,求得样品中游离氧化钙的百分含量。3、试剂 (1)乙二醇:分析醇(不需要脱水)(2)无水乙醇:含量不低于99。5%;(3)碳酸钙;高纯试剂或基准试剂; (4)0.1N氢氧化钠无水乙醇溶液:将0.2克(约两粒)氢氧化钠溶于50ml无水乙醇溶液中,切勿长时间高温加热,用平头玻璃棒 边加热边压碎; (5)乙二醇—乙醇(2+1)溶液:将1000ml乙二醇与500ml无水乙醇混合,再加入0.2g酚酞,摇匀,用0.1N氢氧化钠无水乙醇溶液中和呈微红色,贮存于干燥的玻璃瓶中,现用现配,并有防潮措施;(6)0.1N苯甲酸无水乙醇标准溶液:称12.2g苯甲酸(事先在硅胶干燥24小时以后)溶于少量无水乙醇中,然后转移到1000ml容量瓶中,用无水乙醇冲至刻度,摇匀;4、滴定度的标定方法: 准确称取40mg氧化钙(将90mg碳酸钙在950-1000度以下烧至恒重)置于干燥的250ml锥形瓶中,加入30ml乙二醇—乙醇(2+1)溶液,放入一枚搅拌子,装上小型冷凝管,置于游离氧化钙测定仪上,开启仪器电源开关,并将循环泵正常工作后,轻触定时显示器的上升、下降键预置到三分钟显示(03),以较低的转速搅拌溶液,同时升温,电压表指针打在100-150V左右的位置上,当冷凝下的乙醇开始滴下时,轻按启动键,此时启动键的发光管闪灭,随即降温,电压表指示在100V左右,稍增大转速,当听到音响报时信号时,萃取完毕,按启动键消除报警。取下锥形瓶,用苯甲酸无水乙醇标准溶液滴定至红色消失,记下滴定的体积。重复操作加热,煮沸3分种,再滴定,到红色不再出现为止,记下第二次滴定的体积,关闭仪器总电源开关。苯甲酸无水乙醇标准溶液对氧化钠的滴定度按下式计算:M×100 TCaO= ————
中华人民共和国国家标准 工业用乙二醇酸度的测定滴定法GB/T 14571.1-93 Ethylene glycol for industrial use- Determination of acidity-Titrimetric method 1 主题内容与适用范围 本标准规定了工业用乙二醇酸度的测定方法。 本方法适用于工业用乙二醇酸度的测定,其最小检测浓度为0.000 2%。 2 引用标准 GB 601 化学试剂滴定分析(容量分析)用标准溶液的制备 GB 603 化学试剂试验方法中所用制剂及制品的制备 GB/T 6680 液体化工产品采样通则 3 方法原理 试祥中的酸性物质用氢氧化钠标准滴定溶液滴定至酚酞指示剂变微红色,反应式如下: 4 仪器与试剂 4.1锥形瓶:容积500 mL,带开口磨口塞和氮气吹管,如图。 4.2 量筒:100 mL。 4.3 碱式滴定管:容积5 mL,分度为0.02 mL。 4.4 氢氧化钠标准滴定溶液:c(NaOH)=0.01 mol/L,按GB 601—88配制。 4.5 酚酞指示液(10 g/L):按GB 603-88配制。 4.6 氮气:纯度≥99.9%。 5 测定步骤 以30 0~500m L/min的流速向500m L锥形瓶(4.1)内通入氮气约5m in,在通氮条件下用量筒量取100 mL蒸馏水倾入锥形瓶内,加人0.2~0.3 mL(约5~6滴)酚酞指示液(4.5),用氢
氧化钠标准滴定溶液(4.4)滴定至溶液呈微红色并保持15s 不褪色为终点(不计体积)。称取乙二醇试样约50 g(精确至0.000 5 g),加人锥形瓶中混匀,继续在通氮条件下再用氢氧化钠标准滴定溶液滴定至终点。 6 计算和报告 乙二醇的酸度(以乙酸计)按下式计算: 1000601.0???=m c V X 式中:X ——乙二醇的酸度,% (m/m); V ——滴定试样所消耗的氢氧化钠标准滴定溶液的体积,mL ; c ——氢氧化钠标准滴定溶液的浓度,mol/L ; m ——试样的质量,g ; 0.0601——与1.00 m L 氢氧化钠标准滴定溶液〔c(NaOH)=1.000 mol/L 〕相当的,以克表示的乙酸的质量。 报告两次重复测定结果的算术平均值。分析结果应精确至0.0001 %。重复性为:两次重复测定结果的差值不大于0.000 3%(95%置信水平)。 附加说明: 本标准由中国石油化工总公司提出。 本标准由全国石油化学标准化分技术委员会归口。 本标准由北京燕山石油化工公司化工一厂负责起草。 本标准主要起草人吕兰景、梁淑云、孙小红。
100毫升水能溶解多少克食盐 南沙小学成荣 【教材分析】: 这一课其实是研究常温下食盐在水里的溶解度。这一课中,学生将根据问题制定简单的研究计划,并通过对TOO毫升水能溶解儿克食盐”这一问题的自主研究活动,初步感知和经历探究性实验的方法和步骤,同时获得“溶解度”和“饱和溶液”的前概念。 【教学目标】: 1.设计TOO毫升水能溶解多少克食盐”的实验,经历简单的探究性实验过程。 2.严格按规范进行实验操作,实事求是地记录。 【教学难点】: 经历设计简单的探究实验的活动过程。 【教学准备】: 演示实验用:食盐、塑料小勺、筷子、烧杯、水。 分组实验材料:食盐1小瓶备用、(亦可每包2克的食盐10包)、筷子1、盛50ml水的烧杯1、水槽1、天平1。 【教学过程】: 一、引入问题3, 1.老师桌上有盐、烧杯、水、勺子、筷子,猜猜看,能用这些材料做什么实验? 2.谁愿意和老师合作?(出示一杯清水,请一学生放一平勺盐,教师搅拌)大家看到盐怎么样了?再往杯中放一平勺盐乂会怎样? 3.提问:如果不停地往这杯200ml水里放盐,不停地搅拌,盐会不断地溶解吗?(板书课题:100毫升水能溶解多少克食盐) 4.由于时间的关系,我们先50ml水来做实验。(在课题一杯后加上50ml) 二、制定一杯水50ml水里能溶解多少食盐的研究计划20' 1.请你推测一下,这杯50ml的水里能溶解多少食盐? 2.学生猜测:2勺、3勺、5勺. 3.组织学生讨论:想知道谁的猜测正确,该怎么做呢? 4.组织学牛汇报,完善研究计划。(建议用以下形式衣达研究计划) 研究计划
5.关键性提问:(边交流边完成以上研究计划) 1)?勺盐怎么算?(满满一勺,用尺平刮一下) 2)第一勺加进去以后,什么时候加第二勺?加到什么时候不要加了呢?(等溶解后再加第二勺,直到不能溶解为止。) 3)要判断是否溶解是在搅拌时观察还是搅拌后等一下再观察呢? 4)?共溶解几勺怎么算?(如果放到第7勺没有溶解算6勺) 5)根据大家讨论,我们制定了这份计划,计划中哪些地方制定得还不够完善,可以提出来修改。 三、分组实验5, 1.学生根据研究计划,开展研究活动。(提醒做好研究记录) 2.分组实验,教师巡视指导。 四、交流和分析研究结果8, 1.汇报实验数据。出示一张大表收集学生数据,如下: 勺数组别6勺7勺8勺9勺10勺11勺12勺13勺14勺 14勺 以上 第1组第2组
检验项目的相关测试程序如下: 色度的测定 本测定方法等效于GB9282-88的规定进行测定。 1.主题内容与适用范围: 本标准适用于标明有此指标的本公司生产的产品 2.原理: 以目测比较样品与色标的色泽,用Hazen(铂—钴)色泽单位表示结果。 3.定义: Hazen色泽单位:每升溶液含铂(以氯铂型)1ml和氯化钴六水合物2mg时的色泽。 4.仪器及药品 4.1 1000ml容量瓶 4.2 25ml或50ml纳氏比色管(比色管进可能为瓶底,具底至少100mm 处有刻线标记,特别是各管的玻璃颜色和刻度线标记的高度要匹配)4.3 100ml容量瓶 4.4氯铂酸钾(K2PtCl)试剂级 4.5氯化钴六水合物(CoCL2、6H2O)试剂级 4.6盐酸密度约1.19g/ml,约38%(m/m)溶液,或约12N溶液。 5.色度标准液的制备 5.1 500号色度标准液的制备: 准确称取1.245g氯铂酸钾(K2PtCl6)和1.000g氯化钴(CoCL2、6H2O),
溶于200ml6mol/L 盐酸和适量水中,稀释至1000ml 摇匀,所得溶液即为500号色度标准液。 5.2其他号数色度标准液的制备 取不同量的500号色度标准液,用0.1mol/L 盐酸稀释至100ml 。所取500号标准液的体积可按下式计算: V=N×100500 式中:V —所取500号标准液的体积,ml ; N —欲制备的色度标准液的号数。 6.测定方法 6.1将预测的溶液(或液体样品)注入比色管中至刻度,以日光或日光灯强照射为白色背景下,注意避开侧面照射,从管顶向管底沿轴线放像观看,用目测法与同体积色度标准液予以比较。 6.2测量低色泽(低于50Hazen 单位)时,刻线标记的高度一定要比测量深色时的大,并且通过色泽较深的液体看时,标准Hazen 比较溶液间的区别足以清晰可见。 7.结果的表示N×100500 7.1以最接样品色汉的标准Hazen 比较Hzen 色泽单位数表示样品的色泽。 7.2如果样品的色泽与任何标准Hazen 比较溶液(棕—黄)均不相符,应尽可能以估计并记录观察到色泽。 同外观的测量。
AQUEOUS SOLUBILITY OF INORGANIC COMPOUNDS AT VARIOUS TEMPERATURES The solubility of over 300 common inorganic compounds in water is tabulated here as a function of temperature. Solubility is defined as the concentration of the compound in a solution that is in equilibrium with a solid phase at the specified temperature. In this table the solid phase is generally the most stable crystalline phase at the temperature in question. An asterisk * on solubility values in adjacent columns indicates that the solid phase changes between those two temperatures (usually from one hydrated phase to another or from a hydrate to the anhydrous solid). In such cases the slope of the solubility vs. temperature curve may show a dis-continuity. All solubility values are expressed as mass percent of solute, 100?w2, where w2 = m2/(m1 + m2) and m2 is the mass of solute and m1 the mass of water. This quan-tity is related to other common measures of solubility as follows: Molarity: c2 = 1000 ρw2/M2 Molality: m2 = 1000w2/M2(1-w2) Mole fraction: x2 = (w2/M2)/{(w2/M2) + (1-w2)/M1} Mass of solute per 100 g of H2O: r2 = 100w2/(1-w2) Here M2 is the molar mass of the solute and M1 = 18.015 g/mol is the molar mass of water. ρ is the density of the solution in g cm-3. The data in the table have been derived from the references in-dicated; in many cases the data have been refitted or interpolated in order to present solubility at rounded values of temperature. Where available, values were taken from the IUPAC Solubility Data Series (Reference 1) or the related papers in the Journal of Physical and Chemical Reference Data (References 2 to 5), which present carefully evaluated data. The solubility of sparingly soluble compounds that do not ap-pear in this table may be calculated from the data in the table “Solubility Product Constants”. Solubility of inorganic gases may be found in the table “Solubility of Selected Gases in Water”. Compounds are listed alphabetically by chemical formula in the most commonly used form (e.g., NaCl, NH4NO3, etc.). References 1. Solubility Data Series, International Union of Pure and Applied Chemistry. Volumes 1 to 53 were published by Pergamon Press, Oxford, from 1979 to 1994; subsequent volumes were published by Oxford University Press, Oxford. The number following the colon is the volume number in the series. 2. Clever, H. L., and Johnston, F. J., J. Phys. Chem. Ref. Data, 9, 751, 1980. 3. Marcus, Y., J. Phys. Chem. Ref. Data, 9, 1307, 1980. 4. Clever, H. L., Johnson, S. A., and Derrick, M. E., J. Phys. Chem. Ref. Data, 14, 631, 1985. 5. Clever, H. L., Johnson, S. A., and Derrick, M. E., J. Phys. Chem. Ref. Data, 21, 941, 1992. 6. S?hnel, O., and Novotny, P., Densities of Aqueous Solutions of Inorganic Substances, Elsevier, Amsterdam, 1985. 7. Krumgalz, B.S., Mineral Solubility in Water at Various Temperatures, Israel Oceanographic and Limnological Research Ltd., Haifa, 1994. 8. Potter, R. W., and Clynne, M. A., J. Research U.S. Geological Survey, 6, 701, 1978; Clynne, M. A., and Potter, R. W., J. Chem. Eng. Data, 24, 338, 1979. 9. Marshal, W. L., and Slusher, R., J. Phys. Chem., 70, 4015, 1966; Knacke, O., and Gans, W., Zeit. Phys. Chem., NF, 104, 41, 1977. 10. Stephen, H., and Stephen, T., Solubilities of Inorganic and Organic Compounds, Vol. 1, Macmillan, New York, 1963. Compound0°C10°C20°C25°C30°C40°C50°C60°C70°C80°C90°C100°C Ref. AgBrO30.193 1.327 AgClO20.170.310.470.550.640.82 1.02 1.22 1.44 1.66 1.88 2.117 AgClO3157 AgClO481.683.084.284.885.386.386.987.587.988.388.688.86 AgNO20.1550.4137 AgNO355.962.367.870.172.376.179.281.783.885.486.787.86 Ag2SO40.560.670.780.830.880.97 1.05 1.13 1.20 1.26 1.32 1.397 AlCl330.8430.9131.0331.1031.1831.3731.6031.8732.1732.5132.9033.327 Al(ClO4)354.964.47 AlF30.250.340.440.500.560.680.810.96 1.11 1.28 1.45 1.647 Al(NO3)337.038.239.940.842.044.547.350.453.8*61.5*6 Al2(SO4)327.527.828.229.230.732.634.937.640.744.27 As2O3 1.19 1.48 1.80 2.01 2.27 2.86 3.43 4.11 4.89 5.77 6.727.7110 BaBr247.648.549.550.050.451.452.553.554.555.556.657.66 Ba(BrO3)20.2850.4420.6560.7880.935 1.30 1.74 2.27 2.90 3.61 4.40 5.251:14 Ba(C2H3O2)237.044.27 BaCl223.3024.8826.3327.0327.7029.0030.2731.5332.8134.1435.5437.058 Ba(ClO2)230.531.344.77 Ba(ClO3)216.9021.2323.6627.5029.4333.1636.6940.0543.0445.9048.7051.171:14 Ba(ClO4)267.3070.9674.3075.7577.0579.2380.9282.2183.1683.8884.4384.907 BaF20.1580.1617 BaI262.564.767.368.869.169.570.170.771.372.072.773.46 8-112
表中的符号意义如下。 ——吸收系数,指在气体分压等于101.325 kPa时,被一体积水所吸收的该气体体积(已折合成标准状况); l——是指气体在总压力(气体及水气)等于101.325 kPa时溶解于1体积水中的该气体体积;q——是指气体在总压力(气体及水气)等于101.325 kPa时溶解于100 g水中的气体质量(单位:g)。 气体在水中的溶解度 The Aquatic Solubilities of Gases 气体 (Gas) H 2 He Ar Kr Xe Rn O 2 N 2 Cl
Br 2 (蒸气) 空气 NH 3 H 2S HCl CO CO 2溶解度符 号 (Solubility symbol)温度(Temperature)/℃010203040506080100×102 q×1042.171.981.821.721.661.631.621.601.60 1.921.741.601.471.391.291.180.79 0.970.9910.9941.0031.0211.07 -1.751.741.721.701.69
- - - 5.284.133.372.882.51 0.1110.0810.0630.0510.043 0.2420.1740.1230.0980.082 0.5100.3260.2220.1620.126- - 0.036 - 0.085-----0 ------0000 ---×102 q×104 ×102 ×102 q×1032.091.84
4.893.803.102.612.312.091.951.761.70 6.955.374.343.593.082.662.271.38 2.942.311.891.621.391.211.050.660 4.613.152.301.801.441.231.020.683 1.460.9970.7290.5720.4590.3930.3290.223 60.535.121.313.8 42.924.814.99.5 2.9182.2841.8681.564- - -- - -- - ---- 2.351.861.551.341.181.091.020.9580.947×102 q×103 l q q l×102
水溶液中乙二醇的测定——容量法 1.主要内容与适用范围 本方法规定了水溶液中MEG的测定方法。 本方法适用于水溶液中MEG的测定,测定下限:0.01%(kg/kg)。 2.方法概要 HOCH2CH2OH + HIO4(过量) → HIO3 + 2HCHO + H2O HIO4 + 2KI + H2O → HIO3 + I2 +2KOH Na3AsO3(过量) + I2 +H2O → Na3AsO4 + 2HI 3.材料与试剂 3.1 碳酸氢钠粉末(NaHCO3) 3.2 亚砷酸钠溶液 C(1/3 Na3AsO3)=0.1mol/L 称取15克As2O3和15克NaOH溶于160mL水中,加入0.1%的甲基橙指示剂1~2滴,用1:1的HCL中和至微红色,再加入15克NaHCO3加水稀释至3立升水中。 3.3 高碘酸溶液C(HIO4)=0.2mol/L 称取HIO4·2H2O 23克溶于1立升水中。 3.410%碘化钾溶液(KI) 称取50克KI溶于500mL水中。 3.51%淀粉指示剂 称取可溶性淀粉5克溶于500mL水中,再加10克硼酸(H3BO3),煮沸,冷却后使用。 3.6I2的标准溶液 C(1/2I2)=0.1mol/L 4.操作步骤 4.1在500mL碘量瓶中加入约30mL蒸馏水和NaHCO3粉末一匙 4.2用移液管加入适量的样品
样品的加入量:MEG在60毫克以下 MEG含量%(kg/kg)取样体积(mL) 5~10 0.5 2~5 1.0 1~2 2.0 0.5~1 5.0 0.1~0.5 10 0.05~0.1 20 0.05以下50 4.3加入0.2mol/L的HI04溶液20mL,放置10分钟,不断摇动之。 4.4加入0.1mol/L Na3AsO3溶液50mL和10%KI溶液3毫升,再加入0.5%淀粉指 示剂1~2毫升。 4.5 0.1mol/L I2标准溶液滴定至淡蓝色为止。 4.6 同时做一空白试验。 5.结果与表示 水中MEG的含量由下式计算: MEG%(kg/kg) = (Vs — Vb)× N × f ×62/2000 × 100% V样 式中: Vs——滴定样品所消耗0.1mol/L I2的毫升数 Vb——滴定空白溶液所消耗0.1mol/L I2的毫升数 N——I2标准溶液的浓度 V样——样品体积(mL) 6. 精密度 重复性:在同一实验室由同一操作员,用同一试验方法与仪器,对同一试样相继做两次重复试验,所得结果的差值不大于其算术平均值的10%。 7.报告
乙二醇含量的测定 乙二醇含量的测定可以分为工业用乙二醇含量的测定和样品中乙二醇含量的测定。前者是对市售化学品乙二醇质量的分析判定,后者是对各种含有乙二醇样品中乙二醇含量的分析判定。通过查阅文献资料,将常规的测定方法总结如下。 工业用乙二醇的含量测定 ◆国标法 可用作抗冻剂的工业乙二醇,其含量的测定,可以按照国标GB/T4649-2008《工业用乙二醇》中所描述的方法测定。主要是通过测定乙二醇中杂质的含量来计算乙二醇的质量分数,杂质包括水分、二乙二醇、灰分等,具体测定方法在国标中有描述。此法较为精确,可准确判断乙二醇的品质优劣。但测试项目较多,较为复杂。 GB/T4649-2008《工业用乙二醇》中规定的乙二醇含量测定方法 样品中乙二醇含量的测定 ◆气相色谱法 采用极性毛细管柱进行分离,装备有FID检测器的GC可以测定乙二醇的含量。国内外有一些文献报道,但基本是对于微量乙二醇含量的测定,最低限可以达到ppm级甚至更低。用GC测定乙二醇原液的纯度,仅搜索到一篇描述较为简单模糊的应用方案,可以进行相关实验后判定其适用性。 ◆比色法 可通过品红亚硫酸法或变色酸法比色测定乙二醇浓度,原理是乙二醇经过碘酸氧化成甲醛,再用品红亚硫酸或变色酸测定生成的甲醛。此法对
仪器设备要求较低,方法也较为简单,适合于测定乙二醇浓度不大于10mg/L。如果要用于工业乙二醇的浓度测定,需要对样品进行中至少100倍以上的稀释,此过程易产生误差。 ◆乙二醇浓度计 乙二醇浓度计,又称防冻液乙二醇浓度计,乙二醇浓度测试仪,乙二醇浓度测试仪,乙二醇浓度检测仪,乙二醇浓度测量仪,是为测量乙二醇等水溶液的乙二醇浓度的比例而设计的精密的光学仪器。乙二醇浓度计是根据乙二醇浓度与折射率、冰点的对应关系而设计的光学仪器,该产品不仅可以测量乙二醇的浓度,同时也可以测量乙二醇冰点。在测量时,只要滴几滴乙二醇在折光仪棱镜上,然后向着光观察,就可以快速读出乙二醇的浓度,不用电池和任何电源。测量浓度范围因产品而异。国产仪器价格在250~450元,进口仪器价格在2500元左右。
?100毫升水能溶解多少克食盐》一课两上课例、初次教学设计:
100毫升水能溶解多少克食盐? 外思考:100毫升水能溶解多少克白糖(或味精)?家里试一试活
、教学设施: 《100毫升水能溶解多少食盐》是研究常温下食盐在水中的溶解度。在第4课学生已 经发现食盐在水里的溶解不是无限的,那么,一定量的水到底能溶解多少克食盐呢?在这一课中学生将通过自主探究活动,获得“溶解度”“饱和溶液”的前概念。 三、教学反思: 《100毫升水能溶解多少克食盐》本课的设计意图是让学生通过实验获得“在一定的温度下,一定量的水只能溶解一定量的食盐“的认识,并在教师的引导下经历一个较为完整的自主探究活动过程。本节课我安排了二个活动,首先是不断的将盐溶解到水中,让学生产生似乎不断的搅拌就可不断的将盐溶入水中的假象。新理念提倡“用教材教”,我在尊重教材的基础上,重新整合了教材内容,这样的处理体现了活动的系列性原则,更利于学生获得主动探究、全面发展。 其次,我在学生产生矛盾的基础上,让他们自己开始设计实验,指导学生把提出的问题转化为可操作和进行研究的问题,并指导他们围绕研究的问题做好相应的研究准备工作,我让全体学生参与,充分讨论在实验中可能出现的问题,使每个学生都能参与探究,都有所收获。通过讨论和辩论,使学生明了在实验中应该注意的问题一一水的体积和每份盐的重量。不过,教材也还是有些提示的:图中盛放着四堆标有2克的食盐,提示学 生可以按每次投入2克的量进行溶解实验。当然也可以每次加入一小匙食盐进行实验,等溶解完了第一匙再加入第二匙;溶解完了第二匙再加入第三匙,,直到加入的食盐不能 再溶解,然后统计或算出一共溶解了多少匙(或多少克)食盐。还让学生动脑想了其他地方法,例如:先称一称一袋盐的重量,然后慢慢放盐,直到水不再溶解盐了,再称一下盐的重量,第一次食盐的重量减去第二此的重量,就是100毫升水溶解的盐的重量。总之让 学生还想出了其他的方法。这些研究方法,要求是不一样的。“ 100毫升水能溶解几克盐” 比“ 100毫升水能溶解几匙盐”的研究要求更高,而且准备工作也更复杂。学生由于对称量工具的用法并不是十分的熟悉,在课堂中浪费了很多时间,这是最后实验没有完成的根本原因,因此,基本称量工具的使用,我们在教学中还要加强。再次,学生实验,实验中反映了很多的问题是课前没有想到
三元水盐系溶解度测定(参考) 一、实验目的 水盐系是自然界(海水、盐湖)和无机化工生产中(肥料、碱、盐)常见的反应体系。在无机盐生产中常常要将可溶性盐或原料溶解在水溶液中,或者需要将某种盐从水溶液种结晶出来。在发生溶解、结晶、混合、蒸发、冷却、分离等水盐体系的相变化过程时,首先需要了解盐类的溶解度关系。将水盐体系平衡状态下的溶解度实验数据标绘在坐标纸上而得到的图即为相图。它不仅能给出盐类的溶解或结晶顺序、名称和组成,还能进行物料量的计算,并能对工艺过程及其操作条件乃至反应器的设计提供基本要求。无机化工生产中最常用的是三元水盐体系,因此设置本实验,提出如下要求: (1)学习三元水盐体系液固相平衡数据的测定方法。 (2)自行设计实验方案,绘制出NaCl-NH4Cl-H2O三元体系等温相图,学会相图的绘制与应用; (3)复习液固相平衡知识,训练恒温、取样、称量、分析等基本操作技术。 二、实验原理与方法 根据NaCl、NH4Cl在水中溶解度的不同,配制不同重量组成的一系列样品溶液,在恒温下搅拌一定时间后,对各饱和溶液进行分析,用所得数据在坐标纸上绘出一系列点。同时,测定与饱和溶液相平衡的固相组成,以所得数据在图上绘出的点与相应的饱和溶液点相连即得相应的直线。连接各饱和溶液即为该温度下的NaCl、NH4Cl溶解度曲线。 三元水盐体系溶解度与相图实验测定有湿固相法、合成复合体法和物理化学分析法,本实验采用湿固相法。 湿固相法以连线规则为基础,当液固相达平衡后,分别取出饱和溶液和含饱和溶液的湿固相加以分析,所得的点可连成几条不同的直线,它们的交点就是这些饱和溶液所平衡的固相点。如果交点正好落在代表一种盐的顶点,则为该盐的无水盐点;如果交点刚好落在两直线角边上,则固相点为水合物;如果交点落在直角三角形的斜边上,则固相为无水复盐;交点落在三角形内任一点,固相均为水合复盐。另外,如果有两条或两条以上的相邻连线都从液相的同一点出发,则这液相点为两盐的共饱和点。如图2-1所示,在平面图上,用等边三角形来表示各组分的浓度。三个顶点分别代表纯组分A,B,C.每条边代表两组分所组成的二元体系。三角形内的任意点,可称为系统点,代表三组分体系。D,E,:B,C 在水中某一温度下的溶解度。 DF:B在含有C的水溶液中的溶解度曲线。若向B的饱和溶液中加入组分C,则B的溶解度沿DF变化。 EF:C在含有B的水溶液中的溶解度曲线。 F:共饱和点。溶液中B,C同时达到了饱和。 DFEA:不饱和溶液,单液相区。