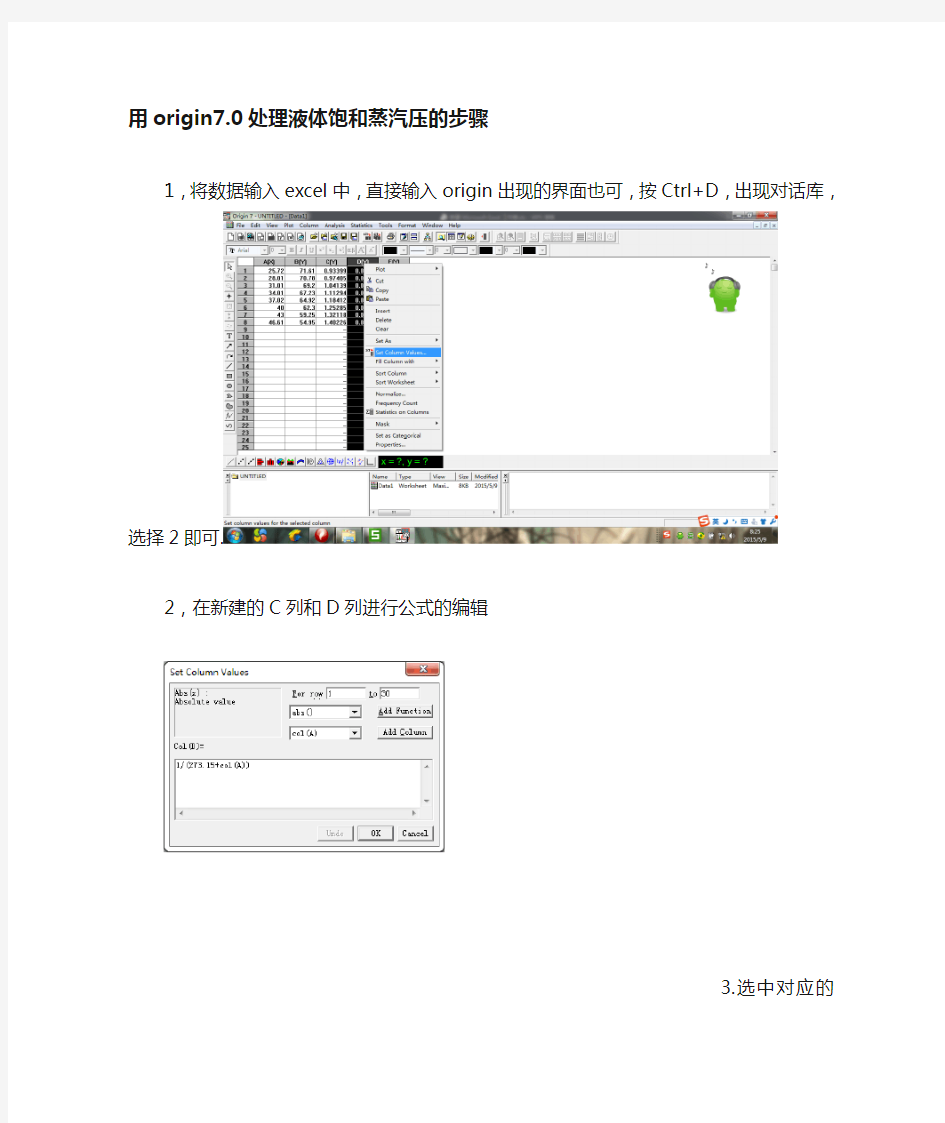

用origin7.0处理液体饱和蒸汽压的步骤
1,将数据输入excel中,直接输入origin出现的界面也可,按Ctrl+D,出现对话库,选择2即
可.
2,在新建的C列和D列进行公式的编辑
3.选中对应的列,在工具栏中选择线性拟合
4.导出图和拟合数据
面的右下角,注意每一次拟合都有其对应的字段。
压力(MPa) 温度(℃) 0.001 6.9491 0.002 12.9751 0.002 17.5403 0.003 21.1012 0.003 24.1142 0.004 26.6707 0.004 28.9533 0.005 31.0533 0.005 32.8793 0.006 34.6141 0.006 36.1663 0.007 37.6271 0.007 38.9967 0.008 40.2749 0.008 41.5075 0.009 42.6488 0.009 43.7901 0.010 44.8173 0.010 45.7988 0.011 47.6934 0.012 49.4281 0.013 51.0488 0.014 52.5553 0.015 53.9705 0.016 55.3401 压力(MPa) 温度(℃) 0.017 56.5955 0.018 57.8053 0.019 58.9694 0.020 60.0650 0.021 61.1378 0.022 62.1422 0.023 63.1237 0.024 64.0596 0.025 64.9726 0.026 65.8628 0.027 66.7074 0.028 67.5291 0.029 68.3280 0.030 69.1041 0.032 70.6106 0.034 72.0144 0.036 73.3611 0.038 74.6508 0.040 75.8720 0.045 78.7366 0.050 81.3388 0.055 83.7355 0.060 85.9496 0.065 88.0154 0.070 89.9556 压力(MPa) 温度(℃) 0.075 91.7816 0.080 93.5107 0.085 95.1485 0.090 96.7121 0.095 98.2014 0.100 99.6340 0.110 102.3160 0.120 104.8100 0.130 107.1380 0.140 109.3180 0.150 111.3780 0.160 113.3260 0.170 115.1780 0.180 116.9410 0.190 118.6250 0.200 120.2400 0.210 121.7890 0.220 123.2810 0.230 124.7170 0.240 126.1030 0.250 127.4440 0.260 128.7400 0.270 129.9980 0.280 131.2180 0.290 132.4030 压力(MPa) 温度(℃) 0.300 133.5560 0.310 134.6770 0.320 135.7700 0.330 136.8360 0.340 137.8760 0.350 138.8910 0.360 139.8850 0.370 140.8550 0.380 141.8030 0.390 142.7320 0.400 143.6420 0.410 144.5350 0.420 145.4110 0.430 146.2690 0.440 147.1120 0.450 147.9330 0.460 148.7510 0.470 149.5500 0.480 150.3360 0.490 151.1080 0.500 151.8670 0.520 153.3500 0.540 154.7880 0.560 156.1850 0.580 157.5430 压力(MPa) 温度(℃) 0.600 158.8630 0.620 160.1480 0.640 161.4020 0.660 162.6250 0.680 163.8170 0.700 164.9830 0.720 166.1230 0.740 167.2370 0.760 168.3280 0.780 169.3970 0.800 170.4440 0.820 171.4710 0.840 172.4770 0.860 173.4660 0.880 174.4360 0.900 175.3890 0.920 176.3250 0.940 177.2450 0.960 178.1500 0.980 179.0400 1.000 179.9160 1.050 18 2.0480 1.100 184.1000 1.150 186.0810 1.200 187.9950 压力(MPa) 温度(℃) 1.250 189.8480 1.300 191.6440 1.350 193.3860 1.400 195.0780 1.450 196.7250 1.500 198.3270 1.550 199.8870 1.600 201.4100 1.650 20 2.8950 1.700 204.3460 1.750 205.7640 1.800 207.1510 1.850 208.5080 1.900 209.8380 1.950 211.1400 2.000 212.4170 2.050 21 3.6690 2.100 214.8980 2.150 216.1040 2.200 217.2890 2.250 218.4520 2.300 219.5960 2.350 220.7220 2.400 221.8290 2.450 222.9180 1 / 2
水的饱和蒸汽压与温度对应表 一、水的饱和蒸汽压与温度的关系 蒸汽压是一定外界条件下,液体中的液态分子会蒸发为气态分子,同时气态分子也会撞击液面回归液态。这是单组分系统发生的两相变化,一定时间后,即可达到平衡。平衡时,气态分子含量达到最大值,这些气态分子对液体产生的压强称为蒸气压。 水的表面就有水蒸气压,当水的蒸气压达到水面上的气体总压的时候,水就沸腾。我们通常看到水烧开,就是在100摄氏度时水的蒸气压等于一个大气压。蒸气压随温度变化而变化,温度越高,蒸气压越大,当然还和液体种类有关。 一定的温度下,与同种物质的液态(或固态)处于平衡状态的蒸气所产生的压强叫饱和蒸气压,它随温度升高而增加。如:放在杯子里的水,会因不断蒸发变得愈来愈少。如果把纯水放在一个密闭的容器里,并抽走上方的空气。当水不断蒸发时,水面上方气相的压力,即水的蒸气所具有的压力就不断增加。但是,当温度一定时,气相压力最终将稳定在一个固定的数值上,这时的气相压力称为水在该温度下的饱和蒸气压力。当气相压力的数值达到饱和蒸气压力的数值时,液相的水分子仍然不断地气化,气相的水分子也不断地冷凝成液体,只是由于水的气化速度等于水蒸气的冷凝速
度,液体量才没有减少,气体量也没有增加,液体和气体达到平衡状态。所以,液态纯物质蒸气所具有的压力为其饱和蒸气压力时,气液两相即达到了相平衡。饱和蒸气压是物质的一个重要性质,它的大小取决于物质的本性和温度。饱和蒸气压越大,表示该物质越容易挥发。 二、水的饱和蒸汽压与温度对应表 水的饱和蒸汽压与温度对应表
三、水的饱和蒸汽压与温度的换算公式 当10℃≤T≤168℃时,采用安托尼方程计算:lgP=7.07406-(1657.46/(T+227.02)) 式中:P——水在T温度时的饱和蒸汽压,kPa; T——水的温度,℃ 四、水的饱和蒸汽压曲线
饱和蒸气压 编辑[bǎo hézhēng qìyā] 在密闭条件中,在一定温度下,与固体或液体处于相平衡的蒸气所具有的压力称为饱和蒸气 压。同一物质在不同温度下有不同的蒸气压,并随着温度的升高而增大。不同液体饱和蒸气 压不同,溶剂的饱和蒸气压大于溶液的饱和蒸气压;对于同一物质,固态的饱和蒸气压小于 液态的饱和蒸气压。 目录 1定义 2计算公式 3附录 ?计算参数 ?水在不同温度下的饱和蒸气压 1定义编辑 饱和蒸气压(saturated vapor pressure) 例如,在30℃时,水的饱和蒸气压为4132.982Pa,乙醇为10532.438Pa。而在100℃时,水的 饱和蒸气压增大到101324.72Pa,乙醇为222647.74Pa。饱和蒸气压是液体的一项重要物理性 质,液体的沸点、液体混合物的相对挥发度等都与之有关。 2计算公式编辑 (1)Clausius-Claperon方程:d lnp/d(1/T)=-H(v)/(R*Z(v)) 式中p为蒸气压;H(v)为蒸发潜热;Z(v)为饱和蒸汽压缩因子与饱和液体压缩因子之差。 该方程是一个十分重要的方程,大部分蒸汽压方程是从此式积分得出的。 (2)Clapeyron 方程: 若上式中H(v)/(R*Z(v))为与温度无关的常数,积分式,并令积分常数为A,则得Clapeyron方 程:ln p=A-B/T 式中B=H(v)/(R*Z(v))。 (3)Antoine方程:lg p=A-B/(T+C) 式中,A,B,C为Antoine常数,可查数据表。Antoine方程是对Clausius-Clapeyron方程最 简单的改进,在1.333~199.98kPa范围内误差小。 3附录编辑 计算参数 在表1中给出了采用Antoine公式计算不同物质在不同温度下蒸气压的常数A、B、C。其公 式如下 lgP=A-B/(t+C)(1) 式中:P—物质的蒸气压,毫米汞柱; t—温度,℃ 公式(1)适用于大多数化合物;而对于另外一些只需常数B与C值的物质,则可采用(2) 公式进行计算 lgP=-52.23B/T+C (2) 式中:P—物质的蒸气压,毫米汞柱; 表1 不同物质的蒸气压 名称分子式范围(℃) A B C 1,1,2-三氯乙烷C2H3Cl3 \ 6.85189 1262.570 205.170 1,1,2一三氯乙烯C2HCl3 \ 7.02808 1315.040 230.000 1,2一丁二烯C4H6 -60~+80 7.16190 1121.000 251.000
实验1-3 纯液体饱和蒸气压的测定 【目的要求】 1. 掌握静态法测定液体饱和蒸气压的原理及操作方法。学会由图解法求平均摩尔气化热和正常沸点。 2. 理解纯液体的饱和蒸气压与温度的关系、克劳修斯-克拉贝龙(Clausius -Clapeyron)方程式的意义。 3. 了解真空泵、恒温槽及气压计的使用及注意事项。 【实验原理】 在通常温度下(距离临界温度较远时),纯液体与其蒸气达平衡时的蒸气压称为该温度下液体的饱和蒸气压,简称为蒸气压。蒸发一摩尔液体所吸收的热量称为该温度下液体的摩尔气化热。 液体的蒸气压随温度而变化,温度升高时,蒸气压增大;温度降低时,蒸气压降低,这主要与分子的动能有关。当蒸气压等于外界压力时,液体便沸腾,此时的温度称为沸点,外压不同时,液体沸点将相应改变,当外压为101.325kPa 时,液体的沸点称为该液体的正常沸点。 液体的饱和蒸气压与温度的关系用克劳修斯-克拉贝龙方程式表示: 2m vap d ln d RT H T p ?= (1) 式中,R 为摩尔气体常数;T 为热力学温度;Δvap H m 为在温度T 时纯液体的摩尔气化热。 假定Δvap H m 与温度无关,或因温度范围较小,Δvap H m 可以近似作为常数,积分(1)式得: ln p =C T R H +??-1m vap (2) 其中C 为积分常数。由此式可以看出,以ln p 对1/T 作图,应为一直线,直线的斜率为 R H m vap ?-,由斜率可求算液体的Δvap H m 。 测定液体饱和蒸气压的方法很多。本实验采用静态法,是指在某一温度下,直接测量饱和蒸气压,此法一般适用于蒸气压比较大的液体。实验所用仪器是纯液体饱和蒸气压测定装置,如图2-1所示。 平衡管由A 球和U 型管B 、C 组成。平衡管上接一冷凝管5,以橡皮管与压力计相连。A 内装待测液体,当A 球的液面上纯粹是待测液体的蒸气,而B 管与C 管的液面处于同一水平时,则表示B 管液面上的(即A 球液面上的蒸气压)与加在C 管液面上的外压相等。此时,体系气液两相平衡的温度称为液体在此外压下的沸点。用当时的大气压减去压力计两水银面的高度差,即为该温度下液体的饱和蒸气压。 用静态法测量不同温度下纯液体饱和蒸气压的实验方法,有升温法和降温法二种。 【仪器试剂】 纯液体饱和蒸气压测定装置1套; 放大镜(×5)1只; 直尺1把;真空泵及附件等。。 蒸馏水;无水乙醇 【实验步骤】 升温法测定不同温度下纯液体的饱和蒸气压
物理化学实验--纯液体饱和蒸汽压的测定 化学化工学院 07应化1W 宋强
Ⅰ目的要求 一.明确纯液体饱和蒸气压的定义和气液两相平衡的概念,深入了解纯液体饱和蒸气压和温度的关系——克劳修斯—克拉贝龙方程式 二.用等压记测定不同温度下环已烷(或正已烷)的饱和蒸气压。初步掌握真空实验技术 三.学会用图解法求被测液体在实验温度范围内的平均摩尔气化热与正常沸点Ⅱ基本原理 在一定温度下,与纯液体处于平衡态时的蒸气压力,称为该温度下的饱和蒸气压。这里的平衡状态是指动态平衡。在某一温度下,被测液体处于密闭真空容器中,液体分子中表面逃逸成蒸气,同时蒸气分子因碰撞而凝结成液相,当两者的速率相等时,就达到了动态平衡,此时气相中的蒸气密度不再改变,因而具有一定的饱和蒸气压。 纯液体的蒸气压是随温度变化而变化的,它们之间的关系可用克劳修斯—克拉贝龙方(Clausius—Clapeyron)方程来表示: dLnp*/dT=△v H m/RT2 (3—1) 式中p*为纯液体温度T时的饱和蒸气压;T为热力学温度;△v H m为液体摩尔气化热;R为气体常数。如果温度变化的范围不大,△v H m视为常数,可当作平均摩尔气化热。将(3—1)式积分得: Lnp*=-△v H m/RT + c (3—2) 式中c为积分常数,此数与压力p*有关。 由(3—2)式可知,在一定温度范围内,测定不同温度下的饱和蒸气压,以Lnp*对1/T作图,可得一条直线。由该直线的斜率可求得实验范围内液体的平均摩尔
气化热。当外压为101.325Kpa时,液体的蒸气压与外压相等时的温度称为该液体的正常沸点。从图中也可求得其正常沸点。 测定饱和蒸气压常用的方法有动态法、静态法、和饱和气流法等。本实验采用静态法,既被测物质放在一个密闭的体系中,在不同温度下直接测量其饱和蒸气压,在不同外压下测量相应的沸点。此法适用于蒸气压比较大的液体。 Ⅲ仪器试剂 蒸气压测定装置1套真空泵1台 数字式气压计1台电加热器1只 温度计2支数字式真空及计1台 磁力搅拌器1台异丙醇(分析纯,沸点82.5℃) 一、仪器装置如图所示: 所有借口必须严密封闭。平衡管由三根相连通的玻璃管a,b和c组成,a管中存储被测液体,b和c中也有液体在底部相连。当a、c管的上部纯粹是待测液体的蒸气,b与c管中的液面在同一水平时,则表示在c管液面上的蒸气压与加在b 管液面上的外压相等,此时液体的温度即体系的气液平衡温度,亦即沸点。 平衡管中的液体可用下法装入:先将平衡管取下洗净,烘干,然后烤烘(可用煤气灯)a管,赶走管内空气,速将液体自b管的管口灌入,冷却a管,液体即被吸入。反复二,三次,使液体灌至a管高度的三分之二为宜,然后接在装置上。
3 温度密度压力 100 0.6 1.103 101 0.611 1.05 102 0.639 1.088 103 0.66 1.127 104 0.682 1.167 105 0.705 1.208 106 0.728 1.25 107 0.752 1.294 108 0.776 1.339 109 0.801 1.385 110 0.827 1.433 111 0.853 1.482 112 0.88 1.532 113 0.908 1.583 114 0.936 1.636 115 0.965 1.691 116 0.995 1.747 117 1.025 1.804 118 1.057 1.863 119 1.089 1.923 120 1.122 1.985 121 1.155 2.049 122 1.19 2.115
123
1.225 2.182 124 1.261 2.25 125 1.298 2.321 126 1.336 2.393 127 1.375 2.468 128 1.415 2.544 129 1.455 2.622 130 1.497 2.701 131 1.539 2.783 132 1.583 2.867 133 1.627 2.953 134 1.672 3.041 135 1.719 3.131 136 1.766 3.223 137 1.815 3.317 138 1.864 3.414 139 1.915 3.513 140 1.967 3.614 141 2.019 3.717 142 2.073 3.823 143 2.129 3.931 144 2.185 4.042 145 2.242 4.155 146 2.301 4.271 147 2.361 4.398 148 2.422 4.51 149 2.484 4.634 150 2.548 4.76 151 2.613 4.889 152 2.679 5.021 153 2.747 5.155 154 2.816 5.292 155 2.886 5.433 156 2.958 5.577 157 3.032 5.732 158 3.106 5.872 159 3.182 6.025 160 3.26 6.181 161 3.339 6.339 162 3.42 6.502 163 3.502 6.667 164 3.586 6.836 165 3.671 7.008 166 3.758 7.183
水蒸气是一种离液态较近的气体,在空气处理中应用广泛,易获得污染小。以实践经验总结出的数据图表作为计算依据 饱和水蒸气压力温度密度表 温度 (t) 压力 (P) 密度(ρ)温度 (t) 压力 (P) 密度(ρ) ℃ MPa kg/m3 ℃ MPa kg/m3 100 0.1013 0.5977 128 0.2543 1.415 101 0.1050 0.6180 129 0.2621 1.455 102 0.1088 0.6388 130 0.2701 1.497 103 0.1127 0.6601 131 0.2783 1.539 104 0.1167 0.6821 132 0.2867 1.583 105 0.1208 0.7046 133 0.2953 1.627 106 0.1250 0.7277 134 0.3041 1.672 107 0.1294 0.7515 135 0.3130 1.719 108 0.1339 0.7758 136 0.3222 1.766 109 0.1385 0.8008 137 0.3317 1.815 110 0.1433 0.8265 138 0.3414 1.864
111 0.1481 0.8528 139 0.3513 1.915 112 0.1532 0.8798 140 0.3614 1.967 113 0.1583 0.9075 141 0.3718 2.019 114 0.1636 0.9359 142 0.3823 2.073 115 0.1691 0.9650 143 0.3931 2.129 116 0.1746 0.9948 144 0.4042 2.185 117 0.1804 1.025 145 0.4155 2.242 118 0.1863 1.057 146 0.4271 2.301 119 0.1923 1.089 147 0.4389 2.361 120 0.1985 1.122 148 0.4510 2.422 121 0.2049 1.155 149 0.4633 2.484 122 0.2114 1.190 150 0.4760 2.548 123 0.2182 1.225 151 0.4888 2.613 124 0.2250 1.261 152 0.5021 2.679 125 0.2321 1.298 153 0.5155 2.747
饱和蒸汽压
饱和蒸气压 编辑 [bǎo hézhēng qìyā] 饱和蒸汽压即饱和蒸气压。 在密闭条件中,在一定温度下,与固体或液体处于相平衡的蒸气所具有的压力称为饱和蒸气压。同一物质在不同温度下有不同的蒸气压,并随着温度的升高而增大。不同液体饱和蒸气压不同,溶剂的饱和蒸气压大于溶液的饱和蒸气压;对于同一物质,固态的饱和蒸气压小于液态的饱和蒸气压。 蒸汽压指的是在液体(或者固体)的表面存在着该物质的蒸汽,这些蒸汽对液体表面产生的压强就是该液体的蒸汽压。比如,水的表面就有水蒸汽压,当水的蒸汽压达到水面上的气体总压的时候,水就沸腾。我们通常看到水烧开,就是在100摄氏度时水的蒸汽压等于一个大气压。蒸汽压随温度变化而变化,温度越高,蒸汽压越大,当然还和液体种类有关。一定的温度下,与同种物质的液态(或固态)处于平衡状态的蒸汽所产生的压强叫饱和蒸汽压,它随温度升高而增加。如:放在杯子里的水,会因不断蒸发变得愈来愈少。如果把纯水放在一个密闭的容器里,并抽走上方的空气。当水不断蒸发时,水面上方汽相的压力,即水的蒸汽所具有的压力就不断增加。但是,当温度一定时,汽相压力最终将稳定在一个固定的数值上,这时的汽相压力称为水在该温度下的饱和蒸汽压力。当汽相压力的数值达到饱和蒸汽压力的数值时,液相的水分子仍然不断地气化,汽相的水分子也不断地冷凝成液体,只是由于水的气化速度等于水蒸汽的冷凝速度,液体量才没有减少,气体量也没有增加,液体和气体达到平衡状态。所以,液态纯物质蒸汽所具有的压力为其饱和蒸汽压力时,汽液两相即达到了相平衡。饱和蒸汽压是物质的一个重要性质,它的大小取决于物质的本性和温度。饱和蒸汽压越大,表示该物质越容易挥发。 1定义编辑 饱和蒸气压(saturated vapor pressure) 例如,在30℃时,水的饱和蒸气压为4132.982Pa,乙醇为10532.438Pa。而在100℃时,水的饱和蒸气压增大到101324.72Pa,乙醇为222647.74Pa。饱和蒸气压是液体的一项重要物理性质,液体的沸点、液体混合物的相对挥发度等都与之有关。 2计算公式编辑 (1)Clausius-Claperon方程:d lnp/d(1/T)=-H(v)/(R*Z(v)) 式中p为蒸气压;H(v)为蒸发潜热;Z(v)为饱和蒸汽压缩因子与饱和液体压缩因子之差。 该方程是一个十分重要的方程,大部分蒸汽压方程是从此式积分得出的。 (2)Clapeyron 方程: 若上式中H(v)/(R*Z(v))为与温度无关的常数,积分式,并令积分常数为A,则得Clapeyron方程:ln p=A-B/T 式中B=H(v)/(R*Z(v))。 (3)Antoine方程:lg p=A-B/(T+C) 式中,A,B,C为Antoine常数,可查数据表。Antoine方程是对Clausius-Clapeyron方程最简单的改进,在1.333~199.98kPa范围内误差小。 3附录编辑 计算参数 在表1中给出了采用Antoine公式计算不同物质在不同温度下蒸气压的常数A、B、C。其公式如下 lgP=A-B/(t+C)(1) 式中:P—物质的蒸气压,毫米汞柱; t—温度,℃ 公式(1)适用于大多数化合物;而对于另外一些只需常数B与C值的物质,则可采用(2)公式进行计算 lgP=-52.23B/T+C (2)
饱和蒸汽压力与温度对照表 压力KPa 温度℃压力KPa 温度℃压力MPa 温度℃压力MPa 温度℃9.8 101.76 470.7 156.76 3.43 243.03 7.65 292.73 19.6 104.24 490.3 158.07 3.53 244.62 7.75 293.60 29.4 106.56 509.9 159.35 3.63 246.17 7.85 294.47 39.2 108.73 529.6 160.60 3.72 247.68 7.94 295.32 49 110.78 549.2 161.82 3.82 249.17 8.04 296.17 58.8 112.72 568.8 163.01 3.92 250.63 8.14 297.01 68.6 114.57 588.4 164.17 4.02 252.07 8.24 297.85 78.4 116.32 608 165.30 4.12 253.48 8.34 298.67 88.2 118.00 627.6 166.41 4.21 254.86 8.43 299.49 98 119.61 647.2 167.50 4.31 256.22 8.53 300.30 107.8 121.15 666.9 168.56 4.41 257.56 8.63 301.11 117.6 122.64 686.5 169.60 4.51 258.87 8.73 301.90 127.4 124.07 706.1 170.62 4.61 260.16 8.73 302.69 137.2 125.45 725.7 171.63 4.7 261.44 8.92 303.48 147.1 126.78 745.3 172.61 4.8 262.69 9.02 304.26 156.9 128.08 764.9 173.58 4.9 263.92 9.12 305.03 166.7 129.33 784.5 174.53 5.0 265.14 9.22 305.79 176.5 130.54 882.6 179.03 5.09 266.34 9.32 306.55 186.3 131.72 980.7 183.20 5.19 267.52 9.41 307.30 196.1 132.87 1.079MPa 187.08 5.29 268.68 9.51 308.05 205.9 133.99 1.177 190.71 5.39 269.83 9.61 308.79 215.7 135.08 1.27 194.13 5.49 270.96 9.71 309.52 225.6 136.14 1.37 197.36 5.59 272.08 9.81 310.25 235.4 137.17 1.47 200.43 5.69 273.19 10 310.98 245.2 138.18 1.57 203.35 5.79 274.27 10.2 312.41
饱和蒸气压(s a t u r a t e d v a p o r p r e s s u r e) 在密闭条件中,在一定温度下,与液体或固体处于相平衡的蒸气所具有的压力称为饱和蒸气压。同一物质在不同温度下有不同的蒸气压,并随着温度的升高而增大。不同液体饱和蒸汽压不同,溶剂的饱和蒸汽压大于溶液的饱和蒸汽压;对于同一物质,固态的饱和蒸汽压小于液态的饱和蒸汽压。例如,在30℃时,水的饱和蒸气压为4132.982Pa,乙醇为10532.438Pa。而在100℃时,水的饱和蒸气压增大到101324.72Pa,乙醇为222647.74Pa。饱和蒸气压是液体的一项重要物理性质,如液体的沸点、液体混合物的相对挥发度等都与之有关。 饱和蒸气压曲线 水在不同温度下的饱和蒸气压 SaturatedWaterVaporPressuresatDifferentTemperatures
编辑本段饱和蒸汽压公式 (1)Clausius-Claperon方程:dlnp/d(1/T)=-H(v)/(R*Z(v)) 式中p为蒸汽压;H(v)为蒸发潜热;Z(v)为饱和蒸汽压缩因子与饱和液体压缩因子之差。 该方程是一个十分重要的方程,大部分蒸汽压方程是从此式积分得出的。 (2)Clapeyron方程: 若上式中H(v)/(R*Z(v))为与温度无关的常数,积分式,并令积分常数为A,则得Clapeyron 方程:lnp=A-B/T 式中B=H(v)/(R*Z(v))。 (3)Antoine方程:lnp=A-B/(T+C)
式中,A,B,C为Antoine常数,可查数据表。Antoine方程是对Clausius-Clapeyron方程最简单的改进,在1.333~199.98kPa范围内误差小。 编辑本段附录 在表1中给出了采用Antoine公式计算不同物质在不同温度下蒸气压的常数A、B、C。其公式如下 lgP=A-B/(t+C)(1) 式中:P—物质的蒸气压,毫米汞柱; t—温度,℃ 公式(1)适用于大多数化合物;而对于另外一些只需常数B与C值的物质,则可采用(2)公式进行计算 lgP=-52.23B/T+C(2) 式中:P—物质的蒸气压,毫米汞柱; 表1不同物质的蒸气压 名称分子式范围(℃)ABC 银Ag1650~1950公式(2)2508.76 氯化银AgCl1255~1442公式(2)185.58.179 三氯化铝AlCl370~190公式(2)11516.24 氧化铝Al2O31840~2200公式(2)54014.22 砷As440~815公式(2)13310.800 砷As800~860公式(2)47.16.692 三氧化二砷As2O3100~310公式(2)111.3512.127 三氧化二砷As2O3315~490公式(2)52.126.513 氩Ar-207.62~-189.19公式(2)7.81457.5741 金Au2315~2500公式(2)3859.853 三氯化硼BCl3……6.18811756.89214.0 钡Ba930~1130公式(2)35015.765 铋Bi1210~1420公式(2)2008.876 溴Br2……6.83298113.0228.0 碳C3880~4430公式(2)5409.596 二氧化碳CO2……9.641771284.07268.432 二硫化碳CS2-10~+1606.851451122.50236.46 一氧化碳CO-210~-1606.24020230.274260.0 四氯化碳CCl4……6.933901242.43230.0 钙Ca500~700公式(2)1959.697 钙960~1100公式(2)37016.240 镉Cd150~320.9公式(2)1098.564 镉500~840公式(2)99.97.897 氯Cl2……6.86773821.107240 二氧化氯ClO2-59~+11公式(2)27.267.893 钴Co2374公式(2)3097.571 铯Cs200~230公式(2)73.46.949 铜Cu2100~2310公式(2)46812.344 氯化亚铜Cu2Cl2878~1369公式(2)80.705.454 铁Fe2220~2450公式(2)3097.482
水的饱和蒸汽压与温度对应表 蒸气压蒸气压指的是在液体(或者固体)的表面存在着该物质的蒸气,这些蒸气对液体表面产生的压强就是该液体的蒸气压。比如,水的表面就有水蒸气压,当水的蒸气压达到水面上的气体总压的时候,水就沸腾。我们通常看到水烧开,就是在100摄氏度时水的蒸气压等于一个大气压。蒸气压随温度变化而变化,温度越高,蒸气压越大,当然还和液体种类有关。一定的温度下,与同种物质的液态(或固态)处于平衡状态的蒸气所产生的压强叫饱和蒸气压,它随温度升高而增加。如:放在杯子里的水,会因不断蒸发变得愈来愈少。如果把纯水放在一个密闭的容器里,并抽走上方的空气。当水不断蒸发时,水面上方气相的压力,即水的蒸气所具有的压力就不断增加。但是,当温度一定时,气相压力最终将稳定在一个固定的数值上,这时的气相压力称为水在该温度下的饱和蒸气压力。当气相压力的数值达到饱和蒸气压力的数值时,液相的水分子仍然不断地气化,气相的水分子也不断地冷凝成液体,只是由于水的气化速度等于水蒸气的冷凝速度,液体量才没有减少,气体量也没有增加,液体和气体达到平衡状态。所以,液态纯物质蒸气所具有的压力为其饱和蒸气压力时,气液两相即达到了相平衡。饱和蒸气压是物质的一个重要性质,它的大小取决于物质的本性和温度。饱和蒸气压越大,表示该物质越容易挥
发。 当气液或气固两相平衡时,气相中A物质的气压,就为液相或固相中A物质的饱和蒸气压,简称蒸气压。下面为影响因素: 1.对于放在真空容器中的液体,由于蒸发,液体分子不断进入气相,使气相压力变大,当两相平衡时气相压强就为该液体饱和蒸汽压,其也等于液相的外压;温度升高,液体分子能量更高,更易脱离液体的束缚进入气相,使饱和蒸气压变大。 2.但是一般液体都暴露在空气中,液相外压=蒸气压力+空气压力=101.325KPa),并假设空气不溶于这种液体,一般情况由于外压的增加,蒸气压变大(不过影响比较小) 3.一般讨论的蒸气压都为大量液体的蒸气压,但是当液体变为很小的液滴是,且液滴尺寸越小,由于表面张力而产生附加压力越大,而使蒸气压变高(这也是形成过热液体,过饱和溶液等亚稳态体系的原因)。所以蒸气压与温度,压力,物质特性,在表面化学中液面的曲率也有影响. 不同物质的蒸气压不同,下面总结给出水在不同温度下的饱和蒸气压:
饱和水蒸气压表
二、Wexler的饱和水汽压表 温度℃.0 .1 .2 .3 .4 .5 .6 .7 .8 .9 变化率Pa Pa Pa Pa Pa Pa Pa Pa Pa Pa Pa/度 0 611.213 615.667 610.158 624.662 629.203 633.774 638.373 643.003 647.662 652.350 44.400 1 567.069 661.819 666.598 671.408 676.249 681.121 686.024 690.958 695.923 700.920 47.340 2 705.949 911.010 716.10 3 721.228 726.386 731.576 736.799 742.055 747.34 4 752.667 50.448 3 758.023 763.412 768.836 774.29 4 779.786 785.312 790.873 796.469 802.100 807.766 53.729 4 813.467 819.204 824.977 830.786 836.631 842.512 848.429 854.384 860.37 5 866.403 57.192 5 872.469 878.572 884.713 890.892 897.109 903.364 909.658 915.991 922.362 928.773 60.845 6 935.223 941.712 948.241 954.810 961.419 968.069 974.759 981.490 988.262 995.075 64.969 7 1001.93 1008.83 1005.76 1022.74 1029.77 1036.069 974.759 981.490 988.262 1065.52 68.75 8 1072.80 1080.13 1087.50 1094.91 1102.37 1109.87 1117.42 1125.01 1132.65 1140.33 73.03 9 1148.06 1155.84 1163.66 1171.53 1179.45 1187.41 1195.42 1203.48 1211.58 1219.74 77.53 10 1227.94 1236.19 1244.49 1252.84 1261.24 1269.68 1278.18 1286.73 1295.33 1303.97 82.26 11 1312.67 1321.42 1330.22 1339.08 1347.98 1356.94 1365.95 1375.01 1384.12 1393.29 87.24
饱和蒸气压(saturated vapor pressure) 在密闭条件中,在一定温度下,与液体或固体处于相平衡的蒸气所具有的压力称为饱和蒸气压。同一物质在不同温度下有不同的蒸气压,并随着温度的升高而增大。不同液体饱和蒸汽压不同,溶剂的饱和蒸汽压大于溶液的饱和蒸汽压;对于同一物质,固态的饱和蒸汽压小于液态的饱和蒸汽压。例如,在30℃时,水的饱和蒸气压为,乙醇为。而在100℃时,水的饱和蒸气压增大到,乙醇为。饱和蒸气压是液体的一项重要物理性质,如液体的沸点、液体混合物的相对挥发度等都与之有关。 饱和蒸气压曲线 水在不同温度下的饱和蒸气压 Saturated Water Vapor Pressures at Different Temperatures
编辑本段饱和蒸汽压公式 (1)Clausius-Claperon方程:d lnp/d(1/T)=-H(v)/(R*Z(v)) 式中p为蒸汽压;H(v)为蒸发潜热;Z(v)为饱和蒸汽压缩因子与饱和液体压缩因子之差。 该方程是一个十分重要的方程,大部分蒸汽压方程是从此式积分得出的。 (2)Clapeyron 方程: 若上式中H(v)/(R*Z(v))为与温度无关的常数,积分式,并令积分常数为A,则得Clapeyron 方程:ln p=A-B/T 式中B=H(v)/(R*Z(v))。 (3)Antoine方程:ln p=A-B/(T+C) 式中,A,B,C为Antoine常数,可查数据表。Antoine方程是对Clausius-Clapeyron方
程最简单的改进,在~范围内误差小。 编辑本段附录 在表1中给出了采用Antoine公式计算不同物质在不同温度下蒸气压的常数A、B、C。其公式如下 lgP=A-B/(t+C)(1) 式中:P—物质的蒸气压,毫米汞柱; t—温度,℃ 公式(1)适用于大多数化合物;而对于另外一些只需常数B与C值的物质,则可采用(2)公式进行计算 lgP=T+C (2) 式中:P—物质的蒸气压,毫米汞柱; 表1 不同物质的蒸气压 名称分子式范围(℃) A B C 银Ag 1650~1950 公式(2)250 氯化银AgCl 1255~1442 公式(2) 三氯化铝AlCl3 70~190 公式(2)115 氧化铝Al2O3 1840~2200 公式(2)540 砷As 440~815 公式(2)133 砷As 800~860 公式(2) 三氧化二砷As2O3 100~310 公式(2) 三氧化二砷As2O3 315~490 公式(2) 氩Ar ~ 公式(2) 金Au 2315~2500 公式(2)385 三氯化硼BCl3 …… 钡Ba 930~1130 公式(2)350 铋Bi 1210~1420 公式(2)200 溴Br2 …… 碳 C 3880~4430 公式(2)540 二氧化碳CO2 …… 二硫化碳CS2 -10~+160 一氧化碳CO -210~-160 四氯化碳CCl4 …… 钙Ca 500~700 公式(2)195 钙960~1100 公式(2)370 镉Cd 150~ 公式(2)109 镉500~840 公式(2) 氯Cl2 (240) 二氧化氯ClO2 -59~+11 公式(2) 钴Co 2374 公式(2)309 铯Cs 200~230 公式(2) 铜Cu 2100~2310 公式(2)468 氯化亚铜Cu2Cl2 878~1369 公式(2) 铁Fe 2220~2450 公式(2)309 氯化亚铁FeCl2 700~930 公式(2)
纯液体饱和蒸气压 姓名:黄琳学号:20105051240 班级:2010级化学(2)班指导老师:杨术民 一﹑实验目的 1.明确纯液体饱和蒸汽压和蒸汽压的概念及其与温度的关系,加深对劳修斯-克拉贝龙(Clausius-Clapeyron)方程式的理解。 2.用数字式真空计测定不同温度下异丙醇的饱和蒸气压。出不掌握低真空实验技术; 3.学会用绘图解法求被测液体在实验温度范围内的平均摩尔汽化热与正常沸点。 二﹑实验原理 在通常温度下(距离临界温度较远时),纯液体与其蒸气达平衡时的蒸气压称为该温度下液体的饱和蒸气压,简称为蒸气压。蒸发一摩尔液体所吸收的热量称为该温度下液体的摩尔气化热。 液体的蒸气压随温度而变化,温度升高时,蒸气压增大;温度降低时,蒸气压降低,这主要与分子的动能有关。当蒸气压等于外界压力时,液体便沸腾,此时的温度称为沸点,外压不同时,液体沸点将相应改变,当外压为p?(101.325kPa)时,液体的沸点称为该液体的正常沸点。 液体的饱和蒸气压与温度的关系用克劳修斯-克拉贝龙方程式表示: (1) [1] 式中,R为摩尔气体常数;T为热力学温度;Δvap H m为在温度T时纯液体的摩尔气化热。 假定Δ vap H m 与温度无关,或因温度范围较小,Δ vap H m 可以近似作为常数,积 分上式,得: (2) 其中C为积分常数。由此式可以看出,以ln p对作图,应为一直线,直 线的斜率为,由斜率可求算液体的Δ vap H m 。
测定液体饱和蒸气压的方法很多。本实验采用静态法,是指在某一温度下,直接测量饱和蒸气压,此法一般适用于蒸气压比较大的液体。实验所用仪器是纯液体饱和蒸气压测定装置,如图Ⅲ-3-1所示。 平衡管由A球和U型管B、C组成。平衡管上接一冷凝管5,以橡皮管与压力计相连。A内装待测液体,当A球的液面上纯粹是待测液体的蒸气,而B管与C管的液面处于同一水平时,则表示B管液面上的(即A球液面上的蒸气压)与加在C管液面上的外压相等。此时,体系气液两相平衡的温度称为液体在此外压下的沸点。用当时的大气压减去压力计两水银面的高度差,即为该温度下液体的饱 和蒸气压。 纯液体饱和蒸气压测定装置图 1.恒温水浴; 2.温度计; 3.搅拌; 4.平衡管; 5.冷凝管; 6.水银压力计; 7.缓冲 瓶;8.进气活塞;9.三通活塞;10.安全瓶。 三﹑实验仪器及试剂 蒸汽压测定装置:1套真空泵:1台数字式气压计:1台电加热器:1只温度计:两只数字式真空计:1台磁力搅拌器:1台异丙醇(分析纯)四﹑实验步骤 1.装置仪器 将待测液体装入平衡管中,A球约2/3体积,B和C球各1/2体积,然后按图装妥各部分。(这部分已由老师装置完毕) 2.系统气密性检查
纯液体饱和蒸汽压的测 量实验报告 Document number:PBGCG-0857-BTDO-0089-PTT1998
一、目的要求 1. 明确纯液体饱和蒸气压的定义和汽液两相平衡的概念,深入了解纯液体饱和蒸气压与温度的关系公式——克劳修斯-克拉贝龙方程式。 2. 用数字式真空计测量不同温度下环己烷的饱和蒸气压。初步掌握真空实验技术。 3. 学会用图解法求被测液体在实验温度范围内的平均摩尔气化热与正常沸点。 二、实验原理 通常温度下(距离临界温度较远时),纯液体与其蒸气达平衡时的蒸气压称为该温度下液体的饱和蒸气压,简称为蒸气压。蒸发1mol 液体所吸收的热量称为该温度下液体的摩尔气化热。 液体的蒸气压随温度而变化,温度升高时,蒸气压增大;温度降低时,蒸气压降低,这主要与分子的动能有关。当蒸气压等于外界压力时,液体便沸腾,此时的温度称为沸点,外压不同时,液体沸点将相应改变,当外压为1atm ()时,液体的沸点称为该液体的正常沸点。 液体的饱和蒸气压与温度的关系用克劳修斯-克拉贝龙方程式表示为: 2 m vap d ln d RT H T p ?= 式中,R 为摩尔气体常数;T 为热力学温度;m H vap ?为在温度T 时纯液体的摩尔气化热。 假定m H vap ?与温度无关,或因温度范围较小,m H vap ?可以近
似作为常数,积分上式,得: C T R H p +??- =1 ln m vap 其中C 为积分常数。由此式可以看出,以ln p 对1/T 作图,应为一直线,直线的斜率为vap m H R ?- ,由斜率可求算液体的vap m H ?。 三、仪器、试剂 蒸气压测定装置 1套 循环式真空泵 1台 精密数字压力计 1台 数字控温仪 1只 无水乙醇(分析纯) 四、实验步骤 1.读取室内大气压 2.安装仪器:将待测液体(本实验是无水乙醇)装入平衡管,之后将平衡管安装固定。 3.抽真空、系统检漏 4排气体:先设定温度为20℃,之后将进气阀打开,调压阀关闭,稳定后,关闭进气阀,置零,打开冷却水,同时打开真空泵和调压阀(此时调压阀较大)。抽气减压至压力计显示压差为-80kpa 左右时,将调压阀调小。待抽气减压至压力计显示压差为-97kpa 左右,保持煮沸3-5min ,关闭真空泵。 4.测定不同温度下纯液体的饱和蒸气压:当温度保持20o c 不变时,调节进 气阀使液面趋于等高。当液面等高时,关闭进气阀,记录压力表值。之后重新设置温度,重复操作。 5.测量温度 分别测定在26℃,31℃,36℃,41℃,46℃,51℃,56℃,61℃,66℃,71℃,76℃时的饱和蒸汽压。 6.实验结束,整理仪器 五、文献值 无水乙醇在标准压力下的沸点为℃,标准摩尔气化热为 KJ/mol 。 六、数据记录与数据处理 温度/K 压强/KPa P*/KPa 1/T lnP* 299 304 309