
海水腐蚀情况
海水腐蚀的原因
浸入海水中的金属,表面会出现稳定的电极电势。由于金属有晶界存在,物
理性质不均一;实际的金属材料总含有些杂质,化学性质也不均一;加上海水中溶解氧的浓度和海水的温度等,可能分布不均匀,因此金属表面上各部位的电势不同,形成了局部的腐蚀电池或微电池。其中电势较高的部位为阴极,较低的为阳极。
电势较高的金属,例如铁,腐蚀时阳极进行铁的氧化;电势较低的金属,例如镁,被海水腐蚀时,镁作为阳极而被溶解,阴极处释放出氢。当电势不同的两种金属在海水中接触时,也形成腐蚀电池,发生接触腐蚀。例如锌和铁在海水中接触时,因锌的电势较低,腐蚀加快;铁的电势较高,腐蚀变慢,甚至停止。海洋环境对腐蚀的影响
盐度海水含盐量较高,水中的含盐量直接影响水的电导率和含氧量,随着
水中含盐量的增加,水的电导率增加但含氧量却降低。海水中的盐度并不和NaCI 的行为相一致,这是因为其中所含的钙离子和镁离子,能够在金属表面析出碳酸钙和氢氧化镁的沉淀,对金属有一定的保护作用。河口区海水的盐度低,钙和镁的含量较小,金属的腐蚀性增加。海水中的氯离子能破坏金属表面的氧化膜,并
能与金属离子形成络合物,后者在水解时产生氢离子,使海水的酸度增大,使金属的局部腐蚀加强。
电导率海水中不仅含盐量高,而且其中的盐类几乎全部处于电离状态,这使得海水成为一种导电性良好的电解质。这就决定了海水腐蚀过程中,不仅微观电池腐蚀的活性大,同时宏观电池的活性也大。研究表明:随着电导率的增大,微观电池腐蚀和宏观电池腐蚀都将加速。
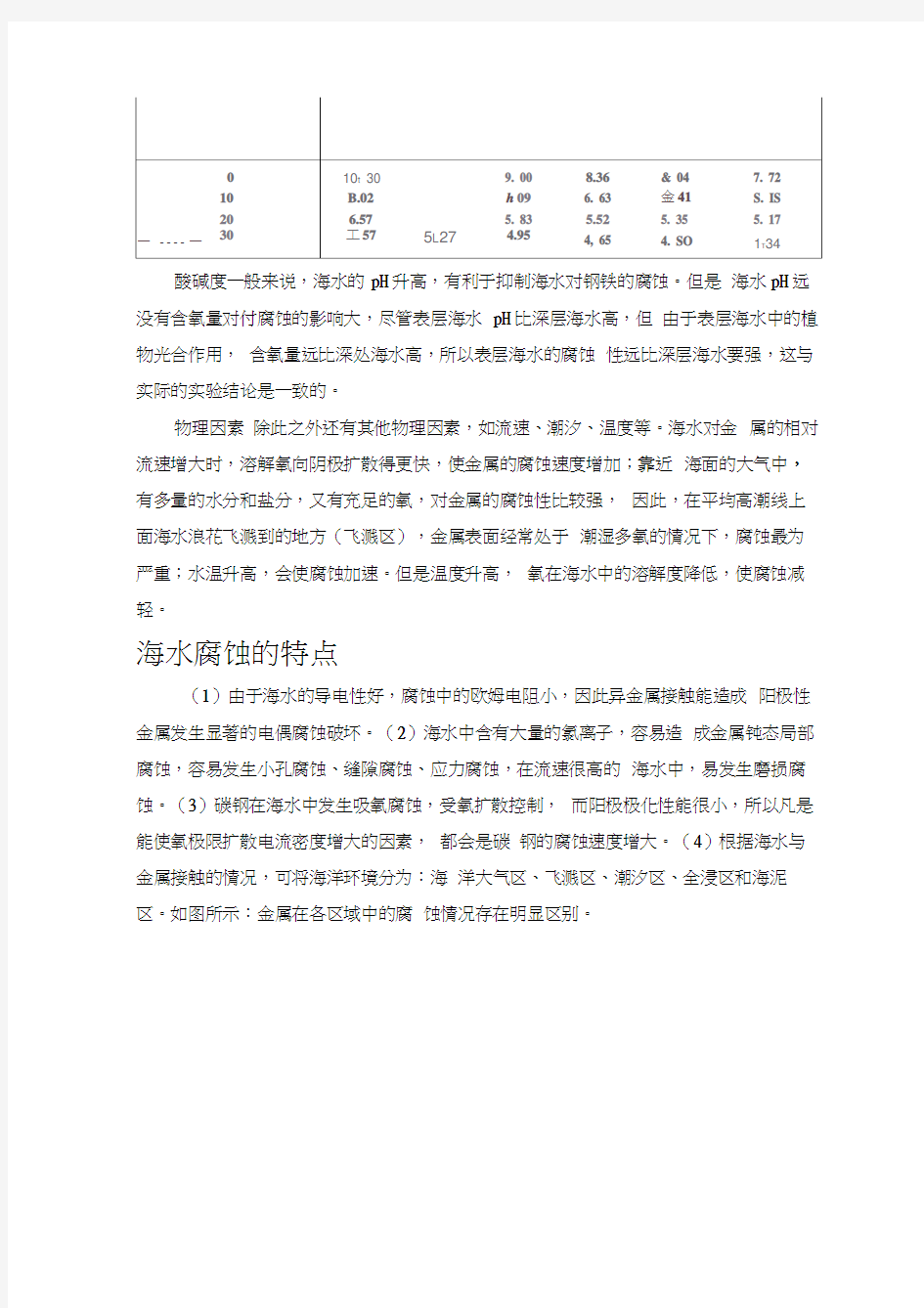
溶解氧海水溶解氧的含量越多,金属在海水中的电极电位越高,金属的腐蚀速度越快。但对于铝和不锈钢一类金属,当其被氧化时,表面形成一薄层氧化膜,保护金属不再被腐蚀,即保持了钝态。此外,在没有溶解氧的海水中,铜和铁几乎不受腐蚀。(常压下氧在海水中的溶解度如下)
(表一)
酸碱度一般来说,海水的pH升高,有利于抑制海水对钢铁的腐蚀。但是海水pH远没有含氧量对付腐蚀的影响大,尽管表层海水pH比深层海水高,但由于表层海水中的植物光合作用,含氧量远比深处海水高,所以表层海水的腐蚀性远比深层海水要强,这与实际的实验结论是一致的。
物理因素除此之外还有其他物理因素,如流速、潮汐、温度等。海水对金属的相对流速增大时,溶解氧向阴极扩散得更快,使金属的腐蚀速度增加;靠近海面的大气中,有多量的水分和盐分,又有充足的氧,对金属的腐蚀性比较强,因此,在平均高潮线上面海水浪花飞溅到的地方(飞溅区),金属表面经常处于潮湿多氧的情况下,腐蚀最为严重;水温升高,会使腐蚀加速。但是温度升高,氧在海水中的溶解度降低,使腐蚀减轻。
海水腐蚀的特点
(1)由于海水的导电性好,腐蚀中的欧姆电阻小,因此异金属接触能造成阳极性金属发生显著的电偶腐蚀破坏。(2)海水中含有大量的氯离子,容易造成金属钝态局部腐蚀,容易发生小孔腐蚀、缝隙腐蚀、应力腐蚀,在流速很高的海水中,易发生磨损腐蚀。(3)碳钢在海水中发生吸氧腐蚀,受氧扩散控制,而阳极极化性能很小,所以凡是能使氧极限扩散电流密度增大的因素,都会是碳钢的腐蚀速度增大。(4)根据海水与金属接触的情况,可将海洋环境分为:海洋大气区、飞溅区、潮汐区、全浸区和海泥区。如图所示:金属在各区域中的腐蚀情况存在明显区别。
图一
耐海水腐蚀材料的研究现状
碳钢及低合金钢的海水腐蚀性能
由于海生物的附着和锈层的稳定,碳钢及低合金钢在海水中耐蚀性能的差异 主要表现在局部腐蚀上(点蚀),由于点蚀的不可预测性、自催化性、隐蔽性和发 生的几率极高,在所有腐蚀失效中最具有破坏性,点蚀深度是评价钢铁材料的主 要依据。
近期,研究者用现场海水暴露制备试样对碳钢的微生物腐蚀做了详细的研 究,研究发现:在海水中碳钢的腐蚀速度经历下降 -上升的变化趋势,其趋势与 3.5%的NaCI 溶液保持一致;微生物因素,主要是内锈层中的硫酸盐还原菌,改 变了碳钢的海水腐蚀机制,从而加速碳钢的腐蚀;碳钢在海水中的腐蚀机制可分 为氧扩散控制、过渡和硫酸盐还原菌活性控制 3个阶段。
在海水和3.5%NaCI 溶液中的Rt 随时间变化 Q235在海水和3.5%NaCI 溶液中的icorr 随
时间的变化
60(1 ?
i
-P- 3 5% XaCl
-
%』一…
0 ■
i. - - - ■ 1 ■ a j. | ■ j
1
::
◎ I* ■**
\
300
Q
ik
2W 100
f/d
魏型橋蚀宰
不锈钢的海水腐蚀性能
不锈钢在海水中的局部腐蚀主要取决于钢的化学成分和热处理状态,不锈钢是易钝金属,其腐蚀规律与碳钢和低合金钢不同,海水中大量的Cr-对依靠钝化防腐蚀的合金破坏极大,一般是全浸区最重(Cl-离子最多),潮差区次之,飞溅区最轻。不同海域的环境因素及海生物附着对不锈钢的腐蚀敏感性产生重要影响。
不锈钢在海水中的耐蚀性通常高Cr钢优于低Cr钢,Ni—Cr钢优于C钢,随Ni、Cr含量的提高耐蚀性增加,降低含C量可提高不锈钢耐蚀性,不锈钢中加人Mo能提高钝化膜对Cl-的抵抗力。
现阶段对于高强耐海水腐蚀不锈钢的研究着眼于研制出一种既具有高的强韧性,又有优良的耐海水腐蚀性能和良好的可焊性的新型不锈钢。双真空熔炼保证钢中低的C、N、O等杂质元素含量,使钢体韧化;铁素体不锈钢通常所适用的热处理是退火(从高温处急冷),适当的热处理工艺与双真空熔炼配合可以避免脆断情况的发生。
为了解决双真空熔炼中相脆性、导热率等焊接工艺难题,研究者采用TIG低热输入焊接方法来防止过热,降低相析出倾向和元素烧损;采用与母材成分相同的焊接材料以有利于保证焊缝金属的化学成分和组织与母材的相近;对焊板进行预先固溶退火处理,消除原始组织中的脆性相和不均匀性。使接头具有合格的力学性能,并兼具和母材相当的耐海水腐蚀性能。
熔炼方法对钢纯洁度的影响
治炼方法c
1 d [O]夹杂栩H级}|(;“1仆561 - K9)
A B[) TiN
中频感应十 1 0 1.巧IJ)0
2()0219120II. 5电洒卓熔0(k 50()
直空感应
0. 5£ 5 1 00
2105424—
050()
00. 500 20072120. 5
0000
双真空钢的锻造加热工艺
镍基耐海水腐蚀材料的研究概况
纯镍在海水中的性能是可变的,在快速流动的海水中,镍能在全浸的条件下保持钝态,其腐蚀速度小于0.127mm/a。在静止海水中,镍表面被污损生物(藤壶或贝类)所覆盖,在这些沉积物下以及在缝隙处会丧失其钝态。因此,镍在海水中尤其是在低速流动的海水中并不具有良好的抗蚀性,这就需要添加各种抗点蚀、缝隙腐蚀的合金元素以提高镍的抗蚀性能
镍在不锈钢中的主要作用在于它改变了钢的晶体结构。普通碳钢的晶体结构
称为铁氧体,呈体心立方(BCC)结构,加入镍,促使晶体结构从体心立方(BCC)结构转变为面心立方。在不锈钢中增加镍的一个主要原因就是形成奥氏体晶体结构,从而改善诸如可塑性、可焊接性和韧性等不锈钢的属性,所以镍被称为奥氏体形成元素。
但是,镍对铜、铬、铝等元素有较高的固溶度,因而能够组成成分范围广泛的合金,所以,镍在海洋领域的主要用途是作为一种合金组分,各种镍基合金的耐腐蚀性能见下表:
锰基耐海水腐蚀材料的研究概况
细镍粉有致癌和过敏作用,这就促使粉末冶金工作者寻找价廉而又能达到同 样效果的其它合金元素。锰作为钢中重要的合金元素,其强化作用在许多合金元 素之上,且锰的矿藏丰富、价格低廉、容易获取,是最便宜的合金元素之一。 BENESOVSKY 和KIEFFER 于1950年阐述了关于Fe-Mn 系粉末冶金材料的基础知 识,此后陆续有一些关于Fe-Mn 系合金的报道,并于20世纪70年代逐渐增多。
抗裂性和韧性是评定海洋结构用焊接材料优劣的主要性能指标。
【7】
锰是金
属材料中重要合金元素之一。它在钢中通常以固溶体及化合态形式存在。 锰是良 好的脱氧剂和脱硫剂,能降低由于钢中硫所引起的热脆性, 从而改善钢的热加工
【8】
性能,提高钢的可锻性。增加锰的含量,可提高钢的强度和硬度; 可以改善
焊缝抗裂性能。下图是不同Mn 、Si 含量下焊缝金相组织特点:
铜基耐海水腐蚀材料的研究概况
研究表明:含Cu 低合金钢不仅比碳钢表现出良好的耐全面腐蚀的能力,而 且表现出优异的耐点蚀性能。实验钢的化学成分(质量分数 /%)如下图所示:
Steel C Si Mn
P
S
Cu
Al Fe A 0. 051 0. 36 0.85
0. 035 0/022 0. 54 0. 012
Bal B
0* 052 Fract 1.27 0, 037 0,017 CL 56 0. 001 Bal
C 0. 071 0. 32 1.28 0. 033 0. 024 ——
0. 021 Bal
D
0. 059
Trace
1.25 0. 030 0.021
——
CL 005 Bal
■亠 m ~I 0、?- — --------------- ■* --
Mn ! Si 1,33 0.56
分丨晶腔面寸晶界自由
I
晶界牲点
号 心屮铁索体畅
1 ,07 o.gi^'i l.ii ______ :
0 f] 1 p
1, i_i.—[
0.75 I _ __
______ I I
0.88
■6 7
G
一6
一 3 S
1
一
釣莹殆程
银緡
囲冲一冲備呻中
■ ~……摆头岡状铁炒独輕雲柠+应氏禄40
细小铁案休
运馥氏组飙
霞嘛氣9?10二瘵酥密貝匚■讦状議素落车不则
数氏數旅+粒號城氏体
! -■ -大纂钎趺雜*体+「少主醫
毀览氏体士光楚殊逼协一 针状魏氏绘奴+珠光体
& ;4.5?G.3 12.1^13.4 、5.3 2.8
25.5 啊状铁素体 二一铲
毀
掘齿狀題氏纽织
組硅据,硅猛魏
中过低中一低高一
通过一系列表征,研究者对A钢与C钢的内锈层做了详细的研究,研究发现: 尽管含Cu低合金钢和碳钢的宏观阴极区的锈层主要组成相同,但其内锈层明显比碳钢致密。从宏观阴极区的合金元素组成和分布看,Cu的含量相对较多,在
条带中分布也较均匀,没有发现明显的富集。结合SEM和XRD分析结果可知,含Cu 低合金钢内锈层中的针状物质主要为a FeOOH,且Cu可成为氧化物结晶的核心,从而促进a FeOOH的形成。由于a FeOOH在锈层中是一种相对稳定的相,它有利于致密锈层的形成,因此,Cu的添加可提高锈层对宏观阴极区基体的保护能力。
A钢(a)和C钢(b)蚀坑内锈层的SEM形貌
两种钢内锈层的X射线衍射谱阳极电流密度随阴极电位变化曲线
另外,在相同的外部阴极极化电位下含Cu低合金钢的阳极电流密度明显小于碳钢。由于该阳极电流是蚀坑外部宏观阴极区电位和蚀坑内电位的电偶作用产生的,因此,模拟闭塞腐蚀电池实验的结果也表明Cu可提高蚀坑内的电位。由此可认为,Cu的添加可有效提高钢的耐点蚀性能。
编号:SY-AQ-09483 ( 安全管理) 单位:_____________________ 审批:_____________________ 日期:_____________________ WORD文档/ A4打印/ 可编辑 金属管道腐蚀防护基础知识 Basic knowledge of metal pipeline corrosion protection
金属管道腐蚀防护基础知识 导语:进行安全管理的目的是预防、消灭事故,防止或消除事故伤害,保护劳动者的安全与健康。在安全管理的四项主要内容中,虽然都是为了达到安全管理的目的,但是对生产因素状态的控制,与安全管理目的关系更直接,显得更为突出。 1.什么叫金属腐蚀? 金属腐蚀是金属与周围介质发生化学、电化学或物理作用成为金属化合物而受破坏的一种现象。 2.金属管道常见的腐蚀按其作用原理可分为哪几种? 金属管道常见的腐蚀按其作用原理可分为化学腐蚀和电化学腐蚀两种。 3.常用的防腐措施有哪几种? 常用的防腐措施有涂层、衬里、电法保护和缓蚀剂。 4.什么叫化学腐蚀? 化学腐蚀是指金属表面与非电解质直接发生纯化学作用而引起的破坏。化学腐蚀又可分为气体腐蚀和在非电解质溶液中的腐蚀。 5.什么叫电化学腐蚀? 电化学腐蚀是指金属与电解质因发生电化学反应而产生破坏的
现象。 6.缝隙腐蚀是如何产生的? 许多金属构件是由螺钉、铆、焊等方式连接的,在这些连接件或焊接接头缺陷处可能出现狭窄的缝隙,其缝宽(一般在 0.025~0.1mm)足以使电解质溶液进入,使缝内金属与缝外金属构成短路原电池,并且在缝内发生强烈的腐蚀,这种局部腐蚀称为缝隙腐蚀。 7.什么是点腐蚀? 点腐蚀是指腐蚀集中于金属表面的局部区域范围内,并深入到金属内部的孔状腐蚀形态。 8.点蚀和坑蚀各有什么特征? 点蚀:坑孔直径小于深度;坑蚀:坑孔直径大于深度。 9.什么是应力腐蚀,应力腐蚀按腐蚀机理可分为几种? 由残余或外加拉应力导致的应变和腐蚀联合作用所产生的材料破坏过程称为应力腐蚀。应力腐蚀按腐蚀机理可分为:(1)阳极溶解(2)氢致开裂。
华北水利水电大学North China University of Water Resources and Electric Power 题目材料腐蚀与防护论文 学院环境与市政工程学院 专业 姓名 学号 指导教师 完成时间2016年10月20日 华北水利水电大学
前言 工程材料的腐蚀给国民经济和社会生活造成的严重危害已越来越为人们所认识重视。金属腐蚀的年损失远远超过水灾、火灾、风灾和地震灾害(平均值)损失的总和,在这里还不包括由于腐蚀导致的停工、减产和爆炸等造成的间接损失。金属在水溶液中的腐蚀是一种电化学反应。在金属表面形成一个阳极和阴极区隔离的腐蚀电池,金属在溶液中失去电子,变成带正电的离子,这是一个氧化过程即阳极过程。随着腐蚀过程的进行,在多数情况下,阴极或阳极过程会因溶液离子受到腐蚀产物的阻挡,导致扩散被阻而腐蚀速度变慢,这个现象称为极化,金属的腐蚀随极化而减缓。影响金属腐蚀的因素有内部因素、外部因素及设备结构因素。控制腐蚀的根本办法自然应是控制电化学作用,即如何消除腐蚀电池。即使不能完全消除,也要设法使腐蚀电流密度降至最低程度。常用的腐蚀防护方法有涂料、缓蚀剂和电化学保护 关键词:金属腐蚀电化学腐蚀化学腐蚀 Abstract:The serious damage to the national economy and the social life caused by the corrosion of engineering materials has been more and more recognized by people. The loss of metal corrosion is far more than the flood, fire, typhoon and earthquake disaster (average) the total loss, here does not include indirect losses due to corrosion caused by production downtime, and explosion caused by. Corrosion of metals in aqueous solutions is an electrochemical reaction. The formation of a corrosion cell isolation of anode and cathode area on the metal surface, the metal loses electrons in solution, a positively charged ion, this is a process that the anodic process of oxidation. With the development of the corrosion process, in most cases, cathode or anode process will be blocked by ionic corrosion products, leading to the proliferation resistance and corrosion speed is slow, this phenomenon is called polarization, the corrosion of metal decreases with increasing polarization. Factors affecting metal corrosion include internal factors Keyword :Metal corrosion Electrochemical corrosion
管道的腐蚀与防护方法集团企业公司编码:(LL3698-KKI1269-TM2483-LUI12689-ITT289-
管道的腐蚀与防护方法一、碱线腐蚀与防护 1.概况 大庆石化总厂炼油厂输转车间81单元碱管道用于向生产装置提供浓度30%~40%的碱液,管道材质为碳钢,连接采用焊接方式,工作压力为0.6~0.7Mpa,工作方式为间歇式。冬季操作时需用0.3Mpa压力的蒸气伴热,由于碱液温度高,造成管道焊口开裂,碱液经常泄漏,生产很被动。同时泄漏出的碱液腐蚀其它管道,每年维修费用很大,这种现象94年前一直没有得到解决。 2.腐蚀原因分析 普通碳钢在碱液中会形成一层以Fe3O4或Fe2O3为主要成分的表面膜,同时由于晶界上有碳化物和氮化物析出,使晶界上的表面膜不稳定,易溶解。在外应力的作用下产生了晶界裂纹,使新暴露出来的铁产生FeO2-的选择性溶解,形成应力腐蚀。 碳钢在NaOH溶液浓度5%以上的全部浓度范围都可能产生碱脆,而以30%左右的浓度最危险,发生碱脆的最低温度为50℃,在沸点附近的高温区最易发生。见图一。
管道使用过程中,夏季或管道不加热时,浓度在30~40%的碱液不发生碱脆;而在冬季,管道加热时,温度超过50℃,碱浓度仍为30~40%时则发生碱脆,因为实际碱管道在加热的情况下往往都高于50℃。 另外,碱性溶液只有在非常富集的情况下,才会通过如下反应溶解铁: 3Fe+7NaOH→Na3FeO3·2Na2FeO2+7H Na3FeO3·2Na2·2Na2FeO2+4H2O→7NaOH+Fe3O4+H 7H+H→4H2 3Fe+4H2O→Fe3O4+4H2 该管道每10日左右送一次碱,容易在焊口处沉积碱液。管道一般为单面焊,内壁常有未焊透处,存有间隙。随时间延长,碱液浓缩,造成碱液在焊口处富集,使焊口处首先腐蚀,而且使焊道不存在金属钝化膜,常露出新鲜的金属表面。根据电化学腐蚀原理,该处的金属表面常处于阳极处,处于腐蚀状态。 原管道的接头为焊接,焊口附近的金相组织比基体的金相组织晶粒大,加之焊接组织不均匀性及焊接后存在较多的缺陷,这样焊道与基体金属的表面机械性能及化学成分存在较大的差异。 该管道在50℃以上的情况下使用和停用交替进行时,由于碱液的富集及较高温度的双重作用,很快发生应力腐蚀开裂,使管道泄漏在冬季频繁发生。 3.材料选择依据
姓名:贾永乐学号:201224190602 班级:机械6班 检索主题:材料的腐蚀与防护 数据库:中国知识资源总库——中国期刊全文数据库 检索方法:用高级检索,主题词:腐蚀与防护关键词:材料相与检索结果:1456篇,其中关于航空材料的13篇;金属材料的腐蚀的183篇;材料的防护的522篇,其余为腐蚀与防护相关 的其它技术和方法。 文献综述 1材料腐蚀与防护的发展史: 所有的材料都有一定的使用寿命,在使用过程中将遭受断裂、磨损、腐蚀等损坏。其中,腐蚀失效的危害最为严重,它所造成的经济损失超过了各种自然灾害所造成的损失总和,造成许多灾难性的事故,造成了资源浪费和环境污染。因此,研究与解决材料的腐蚀问题,与防止环境污染、保护人民健康息息相关。在现代工程结构中,特别足在高温、高压、多相流作用下,以及在磨损、断裂等的协同作用下,腐蚀损坏格外严重。据统计,材料腐蚀带来的经济损失约占国民生产总值的1.8%~4.2%。而常用金属材料最容易遭受腐蚀,因此金属腐蚀的研究受到广泛的重视【1】。我们只有在搞清楚材料腐蚀的原因的基础上,才能研制适宜的耐腐蚀材料、涂层及采取合理的保护措施,以达到防止或控制腐蚀的目的。从而减少经济损失和事故,保护环境保障人类健康。 每年由于腐蚀引起的材料失效给人类社会带来了巨大的损失。航
空材料的腐蚀损失尤为巨大。我国针对航空产品的腐蚀与防护的研究和应用起始于上世纪五十年代,经过几十年的曲折发展,取得了很大进步。目前在航空产品的常温腐蚀与防护上,已经进入了向国际接轨的发展阶段。航空材料由于服役环境复杂多变, 不同构成材料相互配合影响, 导致航空材料在飞行器的留空阶段、停放阶段遭受多种不同种类的腐蚀, 增加了飞行器的运营成本, 对飞行器的功能完整性和使用安全性造成严重的危害。英美空军每架飞机每年因腐蚀造成的直接修理费用为11 000~ 55 000美元之间【2】。1985年8月12日,日本一架B747客机因应力腐蚀断裂而坠毁,死亡500余人。因此航空材料的腐蚀防护技术研究对航空业的发展具有举足轻重的作用。 1978.10国家科委主任方毅在全国聘任27位科学家组建了我国《腐蚀科学》学科组,笔者作为学科组成员,第三专业组(大气腐蚀专业组)副组长,承担了航空航天部分的调查任务。1980.1—1982.6广泛函调一百多个工厂,并深入26个厂、所、部队,机场进行了实地考查,发现了大量的腐蚀问题,笔者1985年在我国首次出版了《航空产品腐蚀故障事例集》,汇集了数据比较周全,二十世纪六、七十年代的46个腐蚀故障【3】。 1990年前,铁道车辆车体结构通常采用普碳钢制造,加之使用涂料档次低,对表面处理和涂装工艺不够重视,车辆锈蚀严重,修理时车体钢板的更换率相当高,有些客车甚至仅使用1个厂修期就报废。1985年,耐大气腐蚀钢(即Corten钢,又称耐候钢)开始用于车辆,到1990年,已在全部新造车辆上采用。由于这类钢材含有(0.2%~0.4%
第一章前言 1.1 国内外海洋平台事故 近30年来,海洋腐蚀向人类敲响的警钟。1980年3月,在北海艾克菲斯油田上作业的“亚历山大·基定德”号钻井平台,在8级大风掀起的高6∽8m的海浪的反复冲击下,5根巨大的桩腿中的D号桩腿因6根主撑管先后断裂而发生剪切断裂,万余吨重的平台在25min 内倾倒,使123人遇难,造成近海石油钻探史上罕见的灾难。挪威事故调查委员会检查报告表明,D号桩腿上的D-6主撑管首先断裂。该主撑管曾经开过一个直径325mm的孔,并焊上一个法兰,准备安装平台定位声纳装置,实际上后来并未安装,开裂就是从这个法兰角的6mm焊缝处开始的,裂纹在海浪与荷载的反复作用下不断扩展,最后导致平台沉没。 2010年9月7日23时,山东东营胜利油田位于渤海的作业3号修井作业平台受玛瑙台风影响(风力最大时阵风9级,浪高近4米)平台发生倾斜发生倾斜45度事故。平台上4人落水,32人被困平台。目前已有34人获救。平台设计通常都考虑台风的影响,况且又是在中国的内海-渤海,我觉得平台倒塌与海洋腐蚀应有一定的关联。 1.2 腐蚀工程 腐蚀工程包括腐蚀原理和防护技术两部分。 腐蚀原理是从热力学和动力学方面解释和论述腐蚀的原因、过程和控制。 防护技术泛指防止或延缓腐蚀损害所采用的有效措施。大体上有以下几种: ①选择材料,根据使用环境合理选用各类金属材料或非金属材料; ②电化学保护技术,主要是阴极保护技术、阳极保护技术与排流技术;③表面处理技术,如磷化、氧化、钝化及表面转化膜; ④涂层、镀层技术,主要有涂料、油脂、镀层、衬里与包覆层等; ⑤调节环境,即改善环境介质条件,如封闭式循环体系中使用缓蚀剂、调节pH值,以及脱气、除氧和脱盐等; ⑥正确设计与施工,从工程与产品设计时就应考虑腐蚀问题,如正确选材与配合,合理设计表面与几何形状,严格施工工艺,采取保护措施,特别是防止接触腐蚀、应力腐蚀、缝隙腐蚀及焊接腐蚀等。 由此可见,腐蚀工程涉及的专业知识领域很广,主要有冶金、材料、机械、表面处理、化学、
海水腐蚀情况 海水腐蚀的原因 浸入海水中的金属,表面会出现稳定的电极电势。由于金属有晶界存在,物理性质不均一;实际的金属材料总含有些杂质,化学性质也不均一;加上海水中溶解氧的浓度和海水的温度等,可能分布不均匀,因此金属表面上各部位的电势不同,形成了局部的腐蚀电池或微电池。其中电势较高的部位为阴极,较低的为阳极。 电势较高的金属,例如铁,腐蚀时阳极进行铁的氧化;电势较低的金属,例如镁,被海水腐蚀时,镁作为阳极而被溶解,阴极处释放出氢。当电势不同的两种金属在海水中接触时,也形成腐蚀电池,发生接触腐蚀。例如锌和铁在海水中接触时,因锌的电势较低,腐蚀加快;铁的电势较高,腐蚀变慢,甚至停止。 海洋环境对腐蚀的影响 盐度海水含盐量较高,水中的含盐量直接影响水的电导率和含氧量,随着水中含盐量的增加,水的电导率增加但含氧量却降低。海水中的盐度并不和NaCl 的行为相一致,这是因为其中所含的钙离子和镁离子,能够在金属表面析出碳酸钙和氢氧化镁的沉淀,对金属有一定的保护作用。河口区海水的盐度低,钙和镁的含量较小,金属的腐蚀性增加。海水中的氯离子能破坏金属表面的氧化膜,并能与金属离子形成络合物,后者在水解时产生氢离子,使海水的酸度增大,使金属的局部腐蚀加强。 电导率海水中不仅含盐量高,而且其中的盐类几乎全部处于电离状态,这使得海水成为一种导电性良好的电解质。这就决定了海水腐蚀过程中,不仅微观电池腐蚀的活性大,同时宏观电池的活性也大。研究表明:随着电导率的增大,微观电池腐蚀和宏观电池腐蚀都将加速。 溶解氧海水溶解氧的含量越多,金属在海水中的电极电位越高,金属的腐蚀速度越快。但对于铝和不锈钢一类金属,当其被氧化时,表面形成一薄层氧化膜,保护金属不再被腐蚀,即保持了钝态。此外,在没有溶解氧的海水中,铜和铁几乎不受腐蚀。(常压下氧在海水中的溶解度如下) (表一)
海水海洋大气腐蚀特点 及防腐 COmPany number : [0089WT-8898YT-W8CCB-BUl^^^?8]
海水、海洋大气中的金属腐蚀 1、海水水质的主要特点 含盐量高,盐度一般在3□g∕L左右;腐蚀性大;海水中动、植物多;海水中各种离子组成比例比较稳。PH变化小,海水表层PH在~范围内,而在深层PH则为左右。 2、海水腐蚀的特点 海水腐蚀为电化学腐蚀;海水腐蚀的阳极极化阻滞对大多数金属(铁、钢、铸铁、锌等)都很小,因而腐蚀速度相当大;海水氯离子含量很高,CI-破坏钝化膜,因此大多数金属在海水中不能建立钝态,在海水中山于钝化的局部破坏,很容易发生空隙和缝隙腐蚀等局部腐蚀。不锈钢在海水中也遭到严重腐蚀;多数金属阴极过程为氧去极化作用,少数负电性很强金属(Mg)及合金腐蚀时发生阴极氢去极化作用;海水电导率很大,海水腐蚀电阻性阻滞很小,所以海水腐蚀中不仅腐蚀微电池的活性大,腐蚀宏电池的活性也很大。 海水的电阻率很小,因此异种金属接触能造成的显着的电偶腐蚀。其作用强烈,作用范围大。 3、海水腐蚀的影响因素 盐类及浓度 盐度是指IOO克海水中溶解的固体盐类物质的总克数。一般在相通的海洋中总盐度和各种盐的相对比例并无明显改变,在公海的表层海水中,其盐度范围为%~%,这对—般金属的腐蚀无明显的差异。但海水的盐度波动却直接影响到海水的比电导率,比电导率又是影响金属腐蚀速度的一个重要因素,同时因海水中含有大量的氯离子,破坏金属的钝化,所以很多金属在海水中遭到严重腐蚀。 盐类以CI-为主,一方面:盐浓度的増加使得海水导电性増加,使海水腐蚀性很强;另一方面:盐浓度增大使溶解氧浓度下降,超过一定值时金属腐蚀速度下降。 PH值
金属管道腐蚀防护基础知识 1.什么叫金属腐蚀? 金属腐蚀是金属与周围介质发生化学、电化学或物理作用成为金属化合物而受破坏的一种现象。 2.金属管道常见的腐蚀按其作用原理可分为哪几种? 金属管道常见的腐蚀按其作用原理可分为化学腐蚀和电化学腐蚀两种。 3.常用的防腐措施有哪几种? 常用的防腐措施有涂层、衬里、电法保护和缓蚀剂。 4.什么叫化学腐蚀? 化学腐蚀是指金属表面与非电解质直接发生纯化学作用而引起的破坏。 化学腐蚀又可分为气体腐蚀和在非电解质溶液中的腐蚀。 5.什么叫电化学腐蚀? 电化学腐蚀是指金属与电解质因发生电化学反应而产生破坏的现象。 6.缝隙腐蚀是如何产生的? 许多金属构件是由螺钉、铆、焊等方式连接的,在这些连接件或焊接接头缺陷处可能出现狭窄的缝隙,其缝宽(一般在0.025~0.1mm)足以 使电解质溶液进入,使缝内金属与缝外金属构成短路原电池,并且在缝内发生强烈的腐蚀,这种局部腐蚀称为缝隙腐蚀。 7.什么是点腐蚀? 点腐蚀是指腐蚀集中于金属表面的局部区域范围内,并深入到金属内部的孔状腐蚀形态。 8.点蚀和坑蚀各有什么特征? 点蚀:坑孔直径小于深度;坑蚀:坑孔直径大于深度。 9.什么是应力腐蚀,应力腐蚀按腐蚀机理可分为几种? 由残余或外加拉应力导致的应变和腐蚀联合作用所产生的材料破坏过
程称为应力腐蚀。应力腐蚀按腐蚀机理可分为:(1)阳极溶解(2)氢致开裂。 10.腐蚀疲劳的定义? 金属在腐蚀的环境中与交变应力的协同作用下引起材料的破坏,称为腐蚀疲劳。 11.氧浓差腐蚀是如何产生的? 地下管道最常见的腐蚀现象是氧浓差电池。由于在管道的不同部位氧的浓度不同,在贫氧的部位管道的自然电位(非平衡电位)低,是腐蚀原电池的阳极,其阳极溶解速度明显大于其余表面的阳极溶解速度,故遭受腐蚀。管道通过不同性质土壤交接处时,粘土段贫氧,易发生腐蚀,特别是在两种土壤的交接处或埋地管道靠近出土端的部位腐蚀最严重。对储油罐来讲,氧浓差主要表现在罐底板与砂基接触不良,还有罐周和罐中心部位的透气性差别,中心部位氧浓度低,成为阳极被腐蚀。 12.什么是细菌腐蚀?它是如何产生的? 细菌腐蚀是当金属在含有硫酸盐的土壤中腐蚀时,阴极反应的氢将硫酸盐还原为硫化物,硫酸盐还原菌利用反应的能量进行繁殖从而加速金属腐蚀的现象。 在某些缺氧的土壤中含有硫酸盐时,硫酸盐还原细菌就会繁殖起来,它们在代谢过程中需要氢或某些还原物质将硫酸盐还原为硫化物利用反应的能量而繁殖。 SO42-+8H→S2-+4H2O 由于硫酸盐及其它H+的存在,金属在土壤中腐蚀过程的阴极反应有原子态氢产生。在土壤中它附在金属表面上,不能连续地成为气泡逸出,就会发生阴极极化,使腐蚀过程明显减慢。但硫酸还有菌的存在,恰好给原子氢找到了出路,把SO42-还原成S2-,再与Fe2+化合生成黑色的FeS沉积物。当土壤pH值在5~9,温度在25~30℃时,最有利于细菌的繁殖。 13.电偶腐蚀是怎样产生的? 当两种具有不同电极电位的金属或合金互相接触,并处于电解质溶液之中时,电极电位较负的金属不断腐蚀,而电极电位较正的金属却得到了保护,这种腐蚀称为电偶腐蚀。
《腐蚀与防护》课程教学大纲 一、课程性质 本课程是应用化学的专业选修课,有助于学生拓展知识面,更好的开展科研、生产专业学习。通过介绍工业生产过程中产生的各种腐蚀过程及其原理,各种防腐蚀技术,腐蚀试验方法等,使学生熟悉企业不同生产过程中所产生的各种腐蚀,充分了解如何对其进行有效的防护。 二、教学目的 本课程是化学工程专业一门应用性较强的专业课程。主要目的是使学生了解材料发生各种腐蚀的基本规律及作用机理,掌握材料腐蚀的评价方法。控制原理及防腐技术,并能够结合材料的成分与结构特征,分析耐腐蚀材料的设计及其热处理原理。 三、教材教参 教参 1. 王增品,姜安玺,腐蚀与防护工程高等教育出版社,1991 2. 美国腐蚀工程师协会编,腐蚀与防护技术基础,冶金工业出版社,1987 3. 化学工业部化工机械研究院主编,腐蚀与防护手册,化学工业出版社,1991 4. 尤里克,腐蚀与腐蚀控制,石油工业出版社,1996 5. 张远声,腐蚀破坏事故,100例,化学工业出版社,2001 6. 王保成,材料腐蚀与防护(21世纪全国高等院校材料类创新型应用人才培养规划教材),北京大学出版社,2012 四、教学方式 本课程以课堂讲授为主、自学和讨论为辅的方式组织教学,适当使用多媒体课件进行教学,增大课堂容量,在有限的学时内取得最佳的教学效果。 五.教学内容及时数 根据化学本科专业人才培养方案,本课程共1.5学分,总的教学时数为27学时,具体如下: 第一章腐蚀与防护概论(2学时) 基本内容:腐蚀的定义、分类,影响腐蚀的因素及腐蚀的普遍性与严重性。腐蚀防护的意义,腐蚀与防护工作概况,防腐蚀方法。防腐蚀设备的使用与保养;防腐蚀工作中劳动保
Advances in Energy and Power Engineering 电力与能源进展, 2014, 2, 64-69 Published Online October 2014 in Hans. https://www.doczj.com/doc/1816655850.html,/journal/aepe https://www.doczj.com/doc/1816655850.html,/10.12677/aepe.2014.25009 Corrosion and Protection of Seawater Cooling System of Power Units Qiang Fu1, Yang Yang2, Ziyue Cao2, Rui Wang2, Zhao Li2, Xuejun Xie2* 1Guangdong Power Grid Electric Power Science & Research Institute, Guangzhou 2School of Power and Mechanical Engineering, Wuhan University, Wuhan Email: 446979438@https://www.doczj.com/doc/1816655850.html,, *xiexuejun@https://www.doczj.com/doc/1816655850.html, Received: Aug. 29th, 2014; revised: Sep. 24th, 2014; accepted: Sep. 28th, 2014 Copyright ? 2014 by authors and Hans Publishers Inc. This work is licensed under the Creative Commons Attribution International License (CC BY). https://www.doczj.com/doc/1816655850.html,/licenses/by/4.0/ Abstract Composition and main material of seawater cooling systems of power units are stated briefly. Some corrosion and protection examples of seawater cooling systems are summarized. In order to protect totally seawater cooling system, the right material should be chosen, and surface treat-ment such as coating or lining and cathodic protection should be done well. In order to protect seawater cycling cooling system, beyond that, protection of the seawater cycling cooling tower and biocide treatment of the seawater cycling cooling system should be done well, too. In addition, rubber ball cleaning should be done well; the seawater cycling cooling system, especially the inner surface of condenser tubes should be kept clean. Keywords Seawater Cooling, Corrosion, Protection 发电机组海水冷却系统的腐蚀与防护 付强1,杨洋2,曹子月2,王瑞2,李钊2,谢学军2* 1广东电网公司电力科学研究院,广州 2武汉大学动力与机械学院,武汉 Email: 446979438@https://www.doczj.com/doc/1816655850.html,, *xiexuejun@https://www.doczj.com/doc/1816655850.html, *通讯作者。
管道的腐蚀与防护方法(新版) Safety management is an important part of enterprise production management. The object is the state management and control of all people, objects and environments in production. ( 安全管理 ) 单位:______________________ 姓名:______________________ 日期:______________________ 编号:AQ-SN-0382
管道的腐蚀与防护方法(新版) 一、碱线腐蚀与防护 1.概况 大庆石化总厂炼油厂输转车间81单元碱管道用于向生产装置提供浓度30%~40%的碱液,管道材质为碳钢,连接采用焊接方式,工作压力为0.6~0.7Mpa,工作方式为间歇式。冬季操作时需用0.3Mpa 压力的蒸气伴热,由于碱液温度高,造成管道焊口开裂,碱液经常泄漏,生产很被动。同时泄漏出的碱液腐蚀其它管道,每年维修费用很大,这种现象94年前一直没有得到解决。 2.腐蚀原因分析 普通碳钢在碱液中会形成一层以Fe3 O4
或Fe2 O3 为主要成分的表面膜,同时由于晶界上有碳化物和氮化物析出,使晶界上的表面膜不稳定,易溶解。在外应力的作用下产生了晶界裂纹,使新暴露出来的铁产生FeO2 - 的选择性溶解,形成应力腐蚀。 碳钢在NaOH溶液浓度5%以上的全部浓度范围都可能产生碱脆,而以30%左右的浓度最危险,发生碱脆的最低温度为50℃,在沸点附近的高温区最易发生。见图一。 管道使用过程中,夏季或管道不加热时,浓度在30~40%的碱液不发生碱脆;而在冬季,管道加热时,温度超过50℃,碱浓度仍为30~40%时则发生碱脆,因为实际碱管道在加热的情况下往往都高于50℃。 另外,碱性溶液只有在非常富集的情况下,才会通过如下反应溶解铁:
耐海水腐蚀不锈钢国内发展现状 摘要 1.前沿 占地球表面积约71%的海洋中蕴藏着丰富的资源,开发海洋、利用海洋,让海洋成为我们巨大财富的源泉,这已成为人们多年来努力的方向之一。我国幅员辽阔,大陆海岸线长达1.8万公里,开发沿海经济对我国国民经济具有重大战略意义。随着人类对海洋需求的日益增长,对海洋工程技术的研究越来越重视,近年来海洋运输、海洋军事、海底资源探测与开发等各项技术得以迅速发展。鉴于陆地资源日益枯竭,海洋将成为矿产、能源和食品资源的主要供应基地。为此,海洋开发被列为21世纪的重点目标[1, 2],而耐海水腐蚀材料的开发和应用研究又是海洋开发的基础和前提。海水中含有大约3.5%的含盐量,因此海水具有腐蚀性。此外,海洋中的某些生物污染也加速了海水的腐蚀。 在海洋资源的开发和利用过程中,钢材扮演着不可或缺的角色,如潮流发电、海水发电、海水温差发电设备及海滨大型跨海桥梁,与海洋开发相关的海底容器,用于资源开发的各种大型海洋构件以及造船用钢等领域中均离不开钢[3]。由于海洋的特定环境,对海洋工程材料有很多特殊要求,最主要的是耐海水腐蚀问题,因为许多水下设备往往由于腐蚀而报废,其次是深海下密封壳体结构的强度问题,这对于长期进行水下作业的设备尤为重要。 目前国内外常用的耐海水腐蚀不锈钢大致分为四种类型。第一种
是为奥氏体型不锈钢,有较好的耐腐蚀性,但屈服强度均不大于300MPa;第二种为铁素体型不锈钢,但屈服强度均低于300Mpa;第三种为双相不锈钢,屈服强度可达到700MPa左右;第四种是为沉硬化型不锈钢,有较高的强度,但耐蚀性能达不到要求。从提高强度确保耐蚀性的思路出发,调整钢中合金元素,特别是时效强化元素的含量,以期获得强度较高的耐海水腐蚀的新型不锈钢。[1] 现今海洋工程及造船工业中大量使用的钢结构材料大多是碳钢和低合金钢。对于碳钢和低合金钢来说,其在海洋环境中的腐蚀类型主要有不均匀全面腐蚀以及点蚀,而其腐蚀形貌可分为斑状、麻点状、蜂窝状、坑状、溃疡状腐蚀等[9]。 所谓不均匀全面腐蚀,就是碳钢和低合金钢在海洋环境中不能建立钝态,腐蚀是在整个金属暴露的表面上发生和发展。根据相关研究记载,其在海水中的腐蚀过程可分为3个阶段,分别是: 1) 表面的大气氧化膜局部破坏而产生锈点; 2) 出现锈点聚集区和不腐蚀区; 3) 钢表面被锈层全面覆盖并继续受到腐蚀。 对碳钢来说,第1阶段约为lh,第2阶段约为1天时间,大约经过20-30 天时间表面可被锈层全面覆盖。而由于冶炼过程所造成的组织结构和表面状态的不同,以及海生物污损、微观合金元素富集等原因都可能引起钢表面的腐蚀速率不均匀,从而在碳钢腐蚀的表面出现浅斑、点状坑或是溃疡状腐蚀坑等各异腐蚀形貌。 而所谓点蚀,就是由于钢表面的腐蚀速率不均匀,腐蚀后的表面
管道的腐蚀与防护方法 一、碱线腐蚀与防护 1.概况 大庆石化总厂炼油厂输转车间81单元碱管道用于向生产装置提供浓度30%~40%的碱液,管道材质为碳钢,连接采用焊接方式,工作压力为0.6~0.7Mpa,工作方式为间歇式。冬季操作时需用0.3Mpa压力的蒸气伴热,由于碱液温度高,造成管道焊口开裂,碱液经常泄漏,生产很被动。同时泄漏出的碱液腐蚀其它管道,每年维修费用很大,这种现象94年前一直没有得到解决。2.腐蚀原因分析 普通碳钢在碱液中会形成一层以 Fe 3O 4 或Fe 2 O 3 为主要成分的表面膜,同 时由于晶界上有碳化物和氮化物析出,使晶界上的表面膜不稳定,易溶解。在外应力的作用下产生了晶界裂纹,使新暴露出来的铁产生FeO 2 -的选择性溶解,形成应力腐蚀。 碳钢在NaOH溶液浓度5%以上的全部浓度范围都可能产生碱脆,而以30%左右的浓度最危险,发生碱脆的最低温度为50℃,在沸点附近的高温区最易发生。见图一。 管道使用过程中,夏季或管道不加热时,浓度在30~40%的碱液不发生碱脆;而在冬季,管道加热时,温度超过50℃,碱浓度仍为30~40%时则发生碱脆,因为实际碱管道在加热的情况下往往都高于50℃。 另外,碱性溶液只有在非常富集的情况下,才会通过如下反应溶解铁: 3Fe+7NaOH→Na 3FeO 3 ·2Na 2 FeO 2 +7H
Na 3FeO 3 ·2Na 2 ·2Na 2 FeO 2 +4H 2 O→7NaOH+Fe 3 O 4 +H 7H+H→4H 2 3Fe+4H 2O→Fe 3 O 4 +4H 2 该管道每10日左右送一次碱,容易在焊口处沉积碱液。管道一般为单面焊,内壁常有未焊透处,存有间隙。随时间延长,碱液浓缩,造成碱液在焊口处富集,使焊口处首先腐蚀,而且使焊道不存在金属钝化膜,常露出新鲜的金属表面。根据电化学腐蚀原理,该处的金属表面常处于阳极处,处于腐蚀状态。 原管道的接头为焊接,焊口附近的金相组织比基体的金相组织晶粒大,加之焊接组织不均匀性及焊接后存在较多的缺陷,这样焊道与基体金属的表面机械性能及化学成分存在较大的差异。 该管道在50℃以上的情况下使用和停用交替进行时,由于碱液的富集及较高温度的双重作用,很快发生应力腐蚀开裂,使管道泄漏在冬季频繁发生。 3.材料选择依据 通过对几种防腐方法比较,认为“天津大学国家教委形状记忆材料工程研究中心”提供的“Fe基形状记忆合金管接头”效果最佳。因为形状记忆合金的效应是指材料经变形后(通常在Ms 温度以下或Ms附近),当加热到超过一定温度时能恢复原来的形状。这种具有形状记忆效应的材料称为记忆材料。 利用铁基形状记忆合金连接管道的原理如图2所示。在室温下,使管接头扩孔形变,形变后管接头内径大于被连接管子的外径,因此可使被连接管较容易插入到管接头中间,然后加热管接头到一定温度(Af以上),管接头欲恢复其原来小口径形状收缩而抱紧管子。达到连接管子的目的。 采用铁基形状记忆合金管接头连接管道,可以避免管道连接因焊接而引起的金相组织变化和管道焊口的应力腐蚀开裂。
《材料腐蚀与防护》思考题 第一章绪论 何谓腐蚀?为何提出几种不同的腐蚀定义? 表示均匀腐蚀速度的方法有哪些?它们之间有何联系? 镁在海水中的腐蚀速度为 1.45g/m2.d, 问每年腐蚀多厚?若铅以这个速度腐蚀,其 深(mm/a)多大? 已知铁在介质中的腐蚀电流密度为0.1mA/cm2,求其腐蚀速度 失和 深。问铁在此介质中是否耐蚀? 第二章电化学腐蚀热力学 如何根据热力学数据判断金属腐蚀的倾向?如何使用电极电势判断金属腐蚀的倾向? 何谓电势-pH图?举例说明它在腐蚀研究中的用途及其局限性。 何谓腐蚀电池?有哪些类型?举例说明可能引起的腐蚀种类。 金属化学腐蚀与电化学腐蚀的基本区别是什么? a)计算Zn在0.3mol/LZnSO4溶液中的电解电势(相对于SHE)。 b) 将你的答案换成相对于SCE的电势值。 当银浸在pH=9的充空气的KCN溶液中,CN-的活度为1.0和Ag(CN)2-的活度为0.001时,银是否会发生析氢腐蚀? Zn浸在CuCl2溶液中将发生什么反应?当Zn2+/Cu2+的活度比是多少时此反应将停止? 第三章电化学腐蚀反应动力学 从腐蚀电池出发,分析影响电化学腐蚀速度的主要因素。 在活化极化控制下决定腐蚀速度的主要因素是什么? 浓差极化控制下决定腐蚀速度的主要因素是什么? 混合电位理论的基本假说是什么?它在哪方面补充、取代或发展了经典微电池腐蚀理论? 何谓腐蚀极化图?举例说明其应用。 试用腐蚀极化图说明电化学腐蚀的几种控制因素以及控制程度的计算方法。 何谓腐蚀电势?试用混合电位理论说明氧化剂对腐蚀电位和腐蚀速度的影响。 铁电极在pH=4.0的电解液中以0.001A/cm2的电流密度阴极化到电势-0.916V(相对1mol/L 甘汞电极)时的氢过电势是多少? Cu2+离子从0.2mol/LCuSO4溶液中沉积到Cu电极上的电势为-0.180V(相对1mol/L甘汞电极),计算该电极的极化值。该电极发生的是阴极极化还是阳极极化? 碳钢在pH=2的除去空气的溶液中,腐蚀电势为-0.64V(相对饱和Cu-CuSO4电极)。对于同样的钢的氢过电势(单位为V)遵循下列关系:(=0.7+0.1lg ,式中 单位为A/cm2。假定所有的钢表面近似的作为阴极,计算腐蚀速度(以mm/a为单位)。 第四章析氢腐蚀与吸氧腐蚀 在稀酸中工业锌为什么比纯锌腐蚀速度快?酸中若含有Pb2+离子为什么会降低锌的腐蚀速度? 说明影响析氢腐蚀的主要因素及防止方法,并解释其理由。 影响吸氧腐蚀的主要因素是什么?为什么? 假定所有的Zn表面起阴极作用,Tafel斜率为±0.10V,Zn和H2在Zn上的交换电流密度分别为0.1和10-4A/m2,求Zn在1mol/L盐酸中的腐蚀电势和腐蚀速度(以mm/a为单位)。 计算纯铜与含质量分数为30%锌的铜合金在非含氧酸中的腐蚀速度比。 第五章金属的钝化
耐海水腐蚀电缆,本橡套电缆线采用防水外护套制成。JHS防水电缆/JHSB防水扁电缆线为水下潜水泵用防水线,本橡套电缆线采用防水外护套制成。JHS型防水橡套电缆供交流电压500V及以下的潜水电机上传输电能用。JHS/JHSB潜水机电缆,JHS/JHSB防水电缆价格型号规格标准生产厂家在长期浸水及较大的水压下,具有良好的电气绝缘性能 来源:阿仪网https://www.doczj.com/doc/1816655850.html,/supply/offerdetail/1336607.html 耐海水腐蚀电缆,本橡套电缆线采用防水外护套制成。JHS防水电缆/JHSB防水扁电缆线为水下潜水泵用防水线,本橡套电缆线采用防水外护套制成。JHS型防水橡套电缆供交流电压500V及以下的潜水电机上传输电能用。JHS/JHSB潜水机电缆,JHS/JHSB防水电缆价格型号规格标准生产厂家在长期浸水及较大的水压下,具有良好的电气绝缘性能JHS/JHSB潜水机电缆,JHS/JHSB防水电缆价格型号规格标准生产厂家弯曲性能良好,JHS/JHSB潜水机电缆,深水电缆水下电缆高密度防水电缆橡胶电缆 来源:阿仪网https://www.doczj.com/doc/1816655850.html,/supply/offerdetail/1336607.html 本发明公开了一种耐海水腐蚀电缆,由导体(1)、包复导体并与导体同心的绝缘层(2)、填充材料(3)、玻璃纤维包带(4)和氯丁橡胶护套(5)组成,导体采用5类软结构导体,绝缘层材料为乙丙橡胶,氯丁橡胶护套的含胶量为45%~55%,氯丁橡胶护套的厚度比常规船用电缆护套厚度加厚45%~55%,乙丙橡胶绝缘层厚度比常规船用电缆绝缘层厚度加厚45%~55%,由于氯丁橡胶护套含胶量提高,氯丁橡胶护套和绝缘层厚度加厚,增强了电缆抵抗海水腐性能,提高了电缆抗拉强度,改善了电缆的弯曲性能。 橡胶接头主要利用橡胶的独特性能,如高弹性、高气密性,耐介质性及耐辐射性,采用高强度,冷热稳定性强的聚酯帘布斜交与之复合侯,经高压,高温模压交联而成,内部致密度高,能承受较高压力,弹性变形效果优异,产品结构设计端面弧高,曲线长,具有较大的多项位移功能,特别使用于地质条件复杂,沉降幅度大和管道运行中冷热变化频繁易造成管道损伤的场所,利用橡胶的弹性滑动位移和变形机械力的传热散逸功能有效的消除泵,阀及管道自身的位移物理破坏。因橡胶属不良传导材料,所以它又是一种良好的降低振动和噪声传递的理想环保产品,该产品设计内壁光滑,经实际测试,对介质的流速,流量无任何影响,并且永不生锈,基本可以免除有效运行期内的维修 作为新型防海电缆具有良好的防水、耐磨、耐腐蚀、高弹性耐弯曲、抗撕裂、耐老化等性能。可根据客户要求定制各种规格各种长度。 线缆结构: 导体:采用多股细绞和精绞成束细一级无氧镀锡铜丝作导体 绝缘:优质防海水混合料颜色:彩色线芯或编码线芯 护套:优质防海水混合料颜色:黑色 温度范围:℃ -40℃~+80℃
绪论 1,腐蚀分类:化学腐蚀、电化学腐蚀 2,电化学腐蚀的特点:(1)介质为离子导电的电解质(2)金属/电解质界面反应过程是因为电荷转移而引起的电化学反应(3)界面上的电化学过程可以分为两个相互独立的氧化和还原过程(4)电化学腐蚀过程伴随电子的流动 3,金属/电解质界面上伴随电荷转移发生的化学反应称为电极反应第一章 1,电化学腐蚀——依靠腐蚀原电池的作用而进行的腐蚀过程叫做电化学腐蚀。 2,电位—pH图(p9) (1)m线:4H+ + 4e + O2 =2H2O n线:2H+ + 2e=H2 n线之下有H2析出,是H2稳定区;高于m线则有O2析出,是O2稳定区 (2)D到D’的发生过程 ①Fe位于D点处生成铁锈的腐蚀过程 在该区域内Fe(OH)2和H2O是稳定的,因此在PH=9.6∽12.5的范围内能形成Fe(OH)2钝化膜。腐蚀体系中的电极反应为 阳极反应:Fe——Fe2++2e 2H2O=2H++2OH- 次生反应:Fe2++2OH-——Fe(OH)2 阴极反应:2H++1/2O2+2e——H2O 总反应:Fe+1/2O2+ H2O——Fe(OH)2
②当体系的电位升高至D点以上,在图的右上方D’时,随着电位上升,氧的平衡分压增加,Fe(OH)2将进一步氧化成Fe(OH)3 阳极反应:2Fe(OH)2+2H2O——2 Fe(OH)3+2H++2e 阴极反应:1/2O2+ H2O+2e——2OH- 总反应:2Fe(OH)2+1/2O2+ H2O——2 Fe(OH)3 ③欲使图1-6中的B点位置移出腐蚀区,可采用的控制腐蚀措施:a:降低电极电位至非腐蚀区,即通常采用的阴极保护法;b:把Fe 的电位升高至钝化区,即采用阳极保护,或在溶液中注入缓蚀剂,使金属表面形成钝化膜;c:调整溶液PH值,在PH=9.6∽12.5的范围内能形成Fe(OH)2 或Fe(OH)3钝化膜 3,腐蚀原电池分类:微电池、宏电池 地下管道最常见的腐蚀现象——氧浓差电池 4,腐蚀原电池作用过程:①阳极过程:金属溶解,以离子形式转入溶液,并把当量电子留在金属上;②电子转移:在电路中电子由阳极流至阴极;③阴极过程:由阳极流过来的电子被溶液中能吸收电子的氧化剂D所接受,其本身被还原 5,腐蚀原电池形成条件:①有电解质溶液与金属相接触;②金属的不同部位或两种金属间存在电极电位差;③两极之间相互连通 6,腐蚀速度v-是指单位时间内单位面积上损失的质量。g/(m2h) v-=W/St=3600IA/(SFn) S——阳极的金属表面积 凡是能降低腐蚀电流I的因素,都能减缓腐蚀 7,极化——腐蚀原电池在电路接通以后,电流流过电极时电位偏离
《材料腐蚀与防护》习题与思考题 第一章绪论 1.何谓腐蚀?为何提出几种不同的腐蚀定义? 2.表示均匀腐蚀速度的方法有哪些?它们之间有何联系? 3.镁在海水中的腐蚀速度为 1.45g/m2.d, 问每年腐蚀多厚?若铅以这个速度腐蚀,其?深(mm/a)多大? 4.已知铁在介质中的腐蚀电流密度为0.1mA/cm2,求其腐蚀速度?失和?深。问铁在此介质中是否耐蚀? 第二章电化学腐蚀热力学 1.如何根据热力学数据判断金属腐蚀的倾向?如何使用电极电势判断金属腐蚀的倾向?2.何谓电势-pH图?举例说明它在腐蚀研究中的用途及其局限性。 3.何谓腐蚀电池?有哪些类型?举例说明可能引起的腐蚀种类。 4.金属化学腐蚀与电化学腐蚀的基本区别是什么? 5.a)计算Zn在0.3mol/LZnSO4溶液中的电解电势(相对于SHE)。 b) 将你的答案换成相对于SCE的电势值。 6.当银浸在pH=9的充空气的KCN溶液中,CN-的活度为1.0和Ag(CN)2-的活度为0.001时,银是否会发生析氢腐蚀? 7.Zn浸在CuCl2溶液中将发生什么反应?当Zn2+/Cu2+的活度比是多少时此反应将停止? 第三章电化学腐蚀反应动力学 1.从腐蚀电池出发,分析影响电化学腐蚀速度的主要因素。 2.在活化极化控制下决定腐蚀速度的主要因素是什么? 3.浓差极化控制下决定腐蚀速度的主要因素是什么? 4.混合电位理论的基本假说是什么?它在哪方面补充、取代或发展了经典微电池腐蚀理论? 5.何谓腐蚀极化图?举例说明其应用。 6.试用腐蚀极化图说明电化学腐蚀的几种控制因素以及控制程度的计算方法。 7.何谓腐蚀电势?试用混合电位理论说明氧化剂对腐蚀电位和腐蚀速度的影响。 8.铁电极在pH=4.0的电解液中以0.001A/cm2的电流密度阴极化到电势-0.916V(相对1mol/L甘汞电极)时的氢过电势是多少? 9.Cu2+离子从0.2mol/LCuSO4溶液中沉积到Cu电极上的电势为-0.180V(相对1mol/L甘汞电极),计算该电极的极化值。该电极发生的是阴极极化还是阳极极化? 10.碳钢在pH=2的除去空气的溶液中,腐蚀电势为-0.64V(相对饱和Cu-CuSO4电极)。 对于同样的钢的氢过电势(单位为V)遵循下列关系:Γ=0.7+0.1lgι,式中ι单位为A/cm2。 假定所有的钢表面近似的作为阴极,计算腐蚀速度(以mm/a为单位)。 第四章析氢腐蚀与吸氧腐蚀 1.在稀酸中工业锌为什么比纯锌腐蚀速度快?酸中若含有Pb2+离子为什么会降低锌的腐蚀速度? 2.说明影响析氢腐蚀的主要因素及防止方法,并解释其理由。