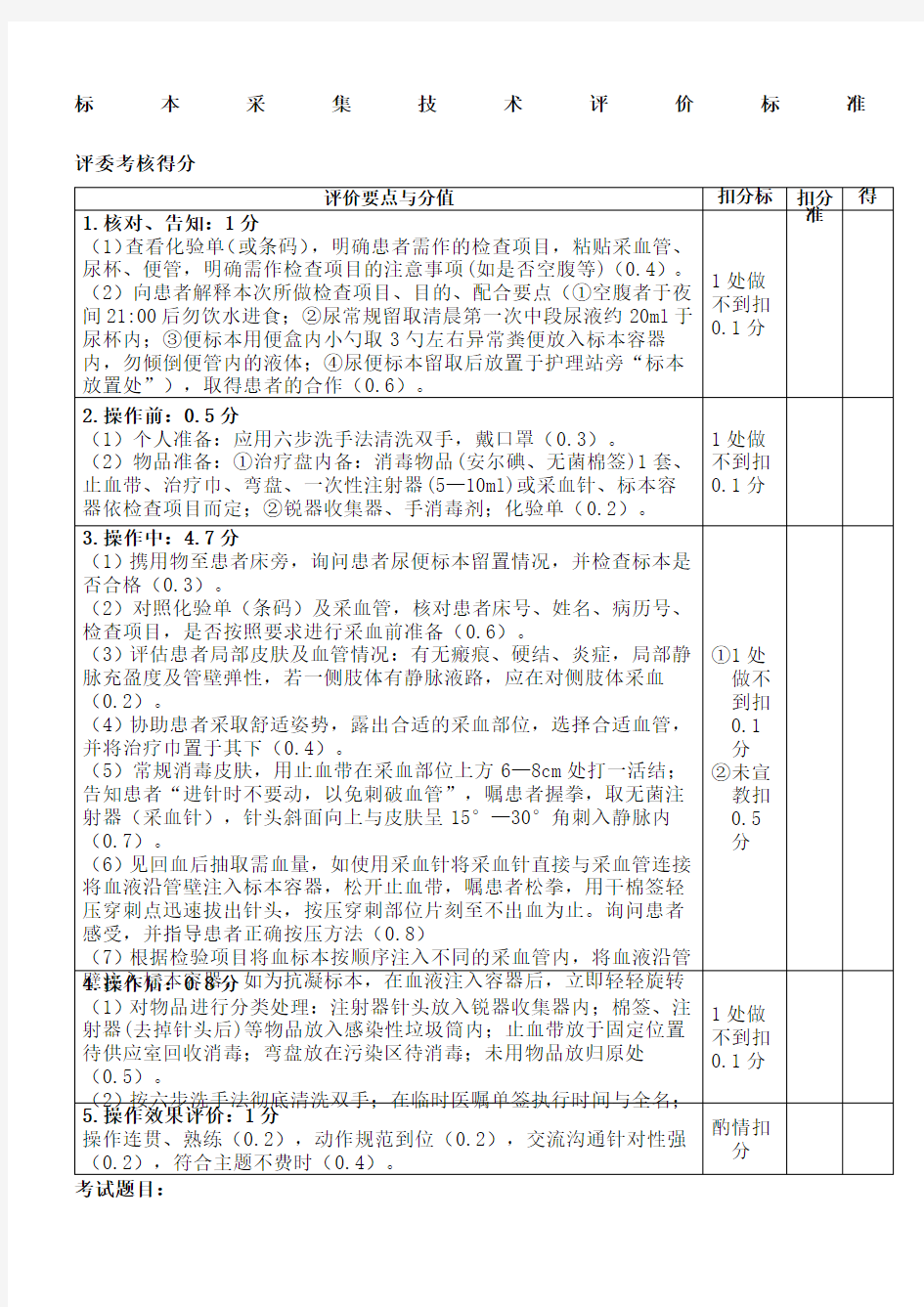

标本采集技术评价标准评委考核得分
1、1床,朱一丹,女,62岁,职业:退休教师,住院号:0732891,诊断:冠心病不稳定心绞痛为当日新入院患者,化验项目:血尿便常规、生化全项。
2、13床,温建国,男,47岁,职业:处级公务员,住院号:0739818,诊断:高血脂,化验项目:血尿便常规、肝功能,血脂。
3、20床,陈阳,男,23岁,职业:大学生,住院号:0638291,诊断:发热原因待查,化验项目:血尿便常规、血常规,血培养。
4、36床,王一荣,男,50岁,职业:司机,住院号:0715697,诊断:房颤(口服华法林,为抗凝药物),化验项目:血尿便常规、凝血常规。
5、45床,高瑞欢,女,80岁,职业:家庭主妇,住院号:0569132,诊断:慢性支气管炎急性发作,化验项目:血尿便常规、痰培养。
6、患者,李妮,65岁,住院号:0665650,诊断为:冠心病,慢性支气管炎。新入院
患者,需留标本:尿便痰,生化全项。
微生物标本采集解读 微生物标本采集时机 ( ) A. 尽早采集:使用抗生素前 B. 抗生素停止用药1-2天后 C. 抗生素下次用药前 D. 抗生素血药浓度较低时采集。 微生物标本运送时机: A.要关注温度和时间。 B. 通常应在留取标本后2小时内送达检验科 C. 对一些温度敏感的细菌(脑膜炎奈瑟军、淋病奈瑟菌、流感嗜血杆菌等)应保温立即送检。 D.不必过于强调晨痰晨尿,更重要的是确保用药前采集和2小时内送检。 微生物标本保存() A.如在2小时内不能送检,应将标本4度保存且不超过24小时(血培养室温保存) B.深部标本如需厌氧菌培养时,应床边接种或置于厌氧菌专用培养基运送。 C.检体来自无菌区域者:宜放室温或温箱保存;并加入营养的培养基中; D.检体来自有菌区域者:宜放冰箱保存;不可加入营养的培养基中; 血培养的规范采集的采血指征是什么 A.怀疑患者有血流感染 B.不明原因的发烧(>38℃)或体温过低(<36℃) C.白细胞增多(>10,000/ul),粒细胞减少(<1,000ul) D.休克,寒颤,僵直 E.严重的局部感染(脑膜炎,心内膜炎,肺炎,肾盂肾炎,腹部术后感染,…) F.心率异常加快,低血压或高血压,呼吸频率加快。 血流感染时血培养采血时机 A.尽可能在寒战或开始发热时采血 B.在接受抗生素治疗前 C.抗生素停止用药1-2天后 D.采血如已经应用抗菌药物进行治疗,应在下一次用药之前采血培养。 E.坚决不能从静脉滴注侧取血;应该采几套血液标本?
A.每位患者每次采血最少2套,3套更好 B.儿童类似于成人,应在24小时内采2-3次血培养 C.初发患者,绝不能只采1套标本 D.越多越好 血培养标本须间隔多久采集? A.急性败血症或骨髓炎、脑膜炎、肺炎等需同时或短时间内采集2套血培养,因为体内巨噬细胞吞噬系统会在15~30min内清除掉进入人体内的细菌。 B.可疑急性感染性心内膜炎患者要立即取血作血培养,1-2h内完成3套血培养的采集,采集后立即进行抗菌药的经验治疗。如果24小时内报告阴性,则继续采集2套血培养。 C.不明原因发热,可疑的亚急性心内膜炎或菌血症、真菌血症患者每间隔30分钟至1h采集1套,连续采集3套标本。如果24小时内报告阴性,则继续采集2套血培养。 微生物标本如何留取痰液(ABD) A.咳痰:咳痰前,患者用无菌生理盐水漱口。用力咳出深部痰,勿将唾液和鼻后分泌物当作痰咳出。 B.诱导痰:患者咳痰困难,可先清洁口腔黏膜、舌头和牙龈,再用无菌水或生理盐水漱口后,用超声雾化器,患者吸入20-30ml3%的NaCl,用无菌容器收集送检。 C.痰标本留少于1ml,2h内送检,4℃保存≤24h。 D.痰标本至少留1ml,2h内送检,4℃保存≤24h。 下列哪项是合格的痰标本,可以做痰培养:() 细胞数/低倍视野 分类白细胞扁平上皮细胞__________________________________________ 5 >25 <10 4 >2 5 10~25 3 >25 >25 2 10~25 >25 1 <10 >25 有下列哪一种症状指征,可进行尿液培养()
微生物常见标本的采集规范 一、血液、骨髓、胸腹水标本的采集 1、最好用药前采集,在发热高峰前1h内或发热高峰时采血最为理想。 2、采血量在5-10ml为宜,成人必须左右手各一套瓶(需氧+厌氧)、并标明左右手,儿童左右手各一瓶需氧。 3、轻轻颠倒混匀以防凝固,立即送检(2小时之内),禁止4℃冷藏保存。 4、骨髓和胸腹水标本或其他穿刺液标本,抽取后将5-10ml直接打入一套血培养瓶内(需氧+厌氧),并注明标本种类。 二、尿液标本的采集 1、清洁中段尿的采集: 通常以晨起第一次尿液、未服用抗生素前送检以提高阳性率。留取标本后尽快送检,不得超过1小时。 女性患者应用清水和肥皂或清洁剂清洗外阴,男性应清洗龟头。排出前段尿后,打开无菌尿杯或无菌管留取中段尿。 2、插管尿的采集: 直接插管或称临时插管尿标本采集: 用夹子钳夹插管约30 分钟,以获取足够尿液。乙醇消毒插管的取样端口或导尿管的适当部位后,应用注射器抽吸留取尿标本,将获取的尿标本转至带盖的无菌管中。尿路插管不做培养,拒收! 3、以下是不适于尿培养的尿标本: 1)自留置导尿管内获取的尿液标本可能有定值菌的污染。
2)集导尿袋内获取的尿液标本,可能有定值菌及环境微生物的污染。3)导管尖因为不可避免地受到尿道菌群的影响而不适合作为尿培养标本。 三、粪标本的采集: 1、直肠拭子法:先将肛门周围洗净,用无菌拭子蘸生理盐水,放入 直肠旋动取出放入拭子转运管送检。 2、自然排便法:清洁便盘内排便,挑取脓血或粘液部分,放入无菌 粪杯送检。 四、下呼吸道标本的采集(痰、肺泡灌洗液) 1、咳痰:患者清晨清水漱口3次后,深咳自下呼吸道痰液,量≥1ml, 避免不合格的口水痰。 2、诱导性痰:清洁口腔后用水漱口,用喷雾器吸入约25ml 3%-10%生理盐水诱导痰。 3、气管抽吸痰:病区医生采样。 4、支气管肺泡灌洗液:(做支气管镜检查)采集量10ml。 五、上呼吸道标本的采集 1、鼻:用无菌拭子生理盐水湿润后,插入鼻孔2cm,用力旋转 2、鼻咽:用无菌湿润拭子经鼻腔插入鼻咽后部(约2.5cm),旋转拭子5圈或停留10秒吸收分泌物。 3、咽部;采集前清水反复漱口,将舌向外拉,将棉拭子通过舌根到咽后壁或腭垂的后侧,涂抹数次,但拭子要避免接触口腔和舌粘膜。 4、常温2小时内送检
检验标本采集规范 一、常规标本采集规范 (一)静脉血标本采集规范 1.真空采血标本对应真空管 真空管项目备注 血培养瓶血培养 儿童1-2ml 成人8-10ml 枸橼酸抗凝管(1:9抗凝)(蓝帽) 凝血全项 (PT、APTT、FIB、TT、D-D、FDP、 AT3) 标本采集2ml (不能多不能少) 枸橼酸抗凝管 (1:4)抗凝(黑色)血沉 至刻度线 (不能多不能少) 促凝剂管(黄帽)生化全项、肝功能、肾功能、血糖、血 脂、心肌酶、电解质、RF、ASO、血 清铁、血清同型半胱氨酸、淀粉酶 标本采集量4-5ml 促凝剂管 (黄帽) 肌钙蛋白I、人绒毛膜促性腺激素标本采集量4-5ml 无添加剂管 (红帽) 乙肝三系、病毒四项标本采集量4-5ml 无添加剂管甲状腺激素五项,雌激素五项,甲胎蛋标本采集量4-5ml
(红帽)白、癌胚抗原、CA125、CA19-9、CA15-3 总前列腺特异性抗原 无添加剂管 (红帽) 结核抗体、肺炎支原体标本采集量4-5ml 无添加剂管 (红帽) PCR 标本采集量4-5ml EDTA-2K 抗凝管(红帽)血常规、血型、CRP 标本采集量2ml 可以使用同一管 血 网织红细胞计数 外周血涂片 糖化血红蛋白标本采集量2ml 交叉配血标本采集量2ml 2.理想的采集血标本的时间是早晨7∶00~8∶00。 3.采血部位和数量成人首选肘部血管:正中静脉、贵要静脉、头静脉等,婴幼儿可采用大隐静脉、颈外静脉、股静脉等。 4.采血顺序 为血培养管→凝血项目管(蓝帽)→血沉管(黑帽)→促凝剂管(黄帽)→无添加剂管(红帽)→EDTA管(紫帽) 5.在实际工作中,如患者静脉条件较差,有可能采血不足,血培养优先考虑需氧瓶,其他管应首先考虑凝血(蓝帽)和血沉(黑帽)检测管,因为这2种标本对血量要求最严格,且二者抗凝剂均为枸橼酸钠。 6.检验申请条码贴在采血管上时,请注意不要将采血管完全包裹,应留出空白,以便观察液面高和血液状态,若未打印条码,请将采血管上的
临床检验标本采集、运输、保存操作规程 目录 第一章、体液标本的采集、运输、保存操作规程 一、尿液标本采集、运输、保存 二、阴道分泌物标本采集、运输 三、精液标本采集、运输、保存 四、粪便采集、运输、保存 第二章、血液一般检验的标本采集、运输、保存操作规程 一、未梢血标本采集 二、静脉血采集、运输、保存 第三章、生化检验标本采集、运输、保存操作规程 前言 在临床工作中,检验标本的分析结果是临床医生诊断疾病、制订治疗方案的重要依据,而标本采集及送检工作的合格与否直接影响检验结果的真实性,进而影响疾病的诊治工作。为了进一步提高检验结果的准确性和可靠性,除了要求检验科提高检验质量水平外,还要求临床医护人员正确采集标本。为确保标本的正确采集、运输和保存,检验科特编写了临床检验标本采集、运输、保存操作规程,要求医护人员严格按操作规程采集、运输和保存标本。 第一章体液标本的采集、运输、保存操作规程 一、尿液标本采集、运输、保存 (一)检查项目 1.尿液干化学测定:尿液比重、pH 值、尿胆原、胆红素、潜血、酮体、蛋白质、白细胞、亚硝酸盐、葡萄糖、抗坏血酸。 2.尿液有形成份检测:包括红细胞及白细胞形态等。
3.其它:尿HCG、尿液红细胞显微镜形态分析。 (二)标本采集 【容器及采样量】 门诊病人由检验科提供专用塑料尿杯,采样量20-30ml。住院病人使用清洁容器取尿,再将尿液倒入专用的试管内,量约5-10ml。24小时尿液收集于清洁容器中,如小的带盖的塑料桶。 【标本种类及适用人群或项目】 (1)晨尿 即清晨起床后的第一次尿标本,为较浓缩和酸化的标本,血细胞、上皮细胞及管型等有形成分相对集中且保存得较好。门诊患者可采集清晨第二次尿标本。适用:住院病人、可疑或已知泌尿系统疾病的动态观察及早期妊娠试验等。 (2)随机尿(随意一次尿) 即留取任何时间的尿液。本法留取方便,但易受饮食、运动、用药等影响,可使低浓度或病理临界浓度的物质和有形成分漏检,也可能出现饮食性糖尿或药物如维生素C等的干扰。适用:门诊和急诊病人。 (3)其他 包括留取中段尿(女病人易受阴道分泌物污染,应采集中段尿)、导尿、耻骨上膀胱穿刺尿等。 【注意事项】 (1)避免阴道分泌物、月经血、粪便等污染,女性病人应采集中段尿,尽量避免经期做尿常规检查; (2)避免干扰化学物质(如表面活性剂、消毒剂)混入; (3)住院病人送检的标本要标上病人姓名,门诊病人的标本和检验申请单放在指定的标本收集盘上。
微生物标本采集、送检及处理原则 一、标本采集的一般原则: 1、病程早期、急性期或症状典型时,使用抗生素前。 2、无菌采集应无污染,严格进行无菌操作。 3、根据目的菌的特性用不同的方法采集适量标本,采集量不应过少。 4、注意在不同病程采集不同部位标本。 5、采集标本时要防止传播和自身感染。 二、标本的处理: 1、标本保存在4℃环境中,在2h之内送检。脑脊液则要在25 ℃保存,用于细菌培养的标本保存时间不应超过24h。对环境敏感的细菌应保温并立即送检。 2、标本中可能含有致病菌,必须注意安全防护。切勿污染环境。对于烈性传染病标本运送时更要由专人运送,严格按规定包装。 3、厌氧性标本应放在专门的运送瓶或试管内运送,有时可直接用抽取标本的注射器运送。 Ⅰ血液及骨髓标本: 血液标本的细菌培养是诊断菌血症或败血症的基本方法。如从患者血液中检出细菌,一般应视为病原菌。 常见的病原菌主要有金黄色或表皮葡萄球菌、链球菌(A、B群、肺炎链球菌等)、肠球菌、产单核细胞李斯特菌、脑膜炎奈瑟菌、伤
寒及副伤寒沙门菌和厌氧菌等。 1、采血时间及次数 2、抽血部位及抽血量 3、报告方式:培养5d无菌生长者报告“培养5d无菌生长”。 查见细菌报告菌名和药敏结果。 4、菌血症、败血症的诊断标准:1)两次培养均出现同一种细菌(可排除污染); 2)发病星期后血中抗体滴度上升。 Ⅱ脑脊液标本: 脑脊液的细菌学检查对于细菌性脑膜炎的诊断有重要价值。正常人的脑脊液是无菌的,检出细菌提示有细菌性(急性化脓性、结核性等)脑膜炎。 常见的病原菌主要有脑膜炎奈瑟菌、流感嗜血杆菌、链球菌(A、B群和肺炎链球菌)、葡萄球菌、产单核细胞李斯特菌、结核分枝杆菌等。 1、涂片检查: (1) 一般细菌涂片检查:例如:革兰阴性、凹面相对的球菌,可能是脑膜炎奈瑟菌;链状排列的革兰阳性球菌;长丝状等多形态性的革兰阴性杆菌,可能是流感嗜血杆菌。 (2)结核分枝杆菌涂片检查 (3)新生隐球菌涂片检查
临床检验标本采集规范 一血常规检验标本 1用EDTA-2K(EDTA-K2.2H2O)1.5~2.2mg/ml抗凝(EDTA抗凝管、紫色帽)采血。 2注意事项: A 按抗凝管刻度准确采血至2ml。 B 采血后立即上下颠倒混匀5~10次,不可用强力震荡,以免造成溶血。 C 采血后尽快送检(为保证结果准确,必须在2h内完成检测)。 二红细胞沉降率(血沉、ESR)检验标本 1静脉采集枸橼酸钠(109mmol/L,即32.06g/L)抗凝血(枸橼酸钠抗凝管、黑色帽)。2注意事项: A 单独采1管血,按抗凝管刻度准确采血至2ml(抗凝剂:全血=0.4:1.6)。 B 采血后立即上下颠倒混匀5~10次,不可用强力震荡。 C 采血后尽快送检(为保证结果准确,必须在2h内完成检测)。 三凝血检测(PT、APTT、Fbg、TT、D2-聚体)标本 1静脉采集枸橼酸钠(109mmol/L,即32.06g/L;抗凝剂:全血=0.2:1.8)抗凝血(枸橼酸钠抗凝管、蓝色帽)。 注意事项: A 单独采1管血,按抗凝管刻度准确采血至2ml。 B 采血后立即上下颠倒混匀5~10次,不可有凝块。 C 采血后尽快送检(为保证结果准确,必须在2h内完成检测)。 D 空腹采血(餐后脂血会影响检验结果)。 四血型与交叉配合标本 1用EDTA-2K(EDTA-K2.2H2O)1.5~2.2mg/ml抗凝(EDTA抗凝管、蓝色帽)采血。 2注意事项: A 按抗凝管刻度采血至2~3ml。最好单独采血,便于标本保存。 B 采血后立即上下颠倒混匀5~10次,不可用强力震荡,以免造成溶血。
五血流变检查标本 1 用肝素钠抗凝管(肝素钠、绿色帽) 2 注意事项: A 按抗凝管刻度采血至4~5ml。 B 采血后立即上下颠倒混匀5~10次,不可用强力震荡,以免造成溶血。 六尿液常规检查标本 1住院病人尽量留取晨尿(安静状态下留取清晨第一次尿)。 2门急诊病人可留取随机尿,但结果受多种因素影响。 3尿液采集于洁净尿杯中,不可使用其它未经洗涤的器皿如药瓶、试剂瓶等。 标本留取后尽快送检(为保证结果准确,必须在2h内完成检测)。 七尿液特殊检查标本 1尿液成分定量检查应根据检查目的选择并在检验科领取防腐剂。 A 尿爱迪氏计数或3h计数:甲醛(40%),5ml/L尿液;3h和12h尿沉渣计数的留尿时间 分别为(5:30-8:30)和(20:00-次日8:00)。 B 尿蛋白或尿糖定量:甲苯,5~20ml/L尿液。 C 尿17-羟、17-酮、肾上腺素、儿茶酚胺和尿钙等:浓盐酸,10ml/L尿液。 2尿稀释浓缩试验:试验日正常进餐,上午8点排尿弃去,没隔2h留尿一次,至晚上8点共六次标本;晚8点至次晨8点为夜尿,收集于一个容器中,分别标记时间后送检。 八粪便常规检查标本 1一般应为新鲜的自然排出的粪便3~5g,必要时可肛试子取出,但需注明。 2样品置于洁净容器中,最好用带盖塑料盒。 3粪便应选取含脓、血、粘液等异常成分进行检查。 4做隐血试验时,应嘱病人检查前3天禁食肉类、含动物血的食物。 九浆膜腔积液检查标本 1标本一般由临床医师无菌穿刺采取。
咽拭子标本采集技术操作及评分标准 操作目的: 取患者咽部及扁桃体分泌物做细菌培养。 评估要点: 1、了解患者病情、口腔黏膜和咽部感染情况。 2、向患者解释目的,取得配合。 操作准备: 护士准备:着装整洁规范,仪表端庄大方。2分 操作用物:治疗盘、PDA、无菌咽拭子培养管、化验单、压舌板、一次性手套、温开水、纱布、手电筒、弯盘。3分 操作准备: (1)核对医嘱及标本容器上的条码信息。2分 (2)核对床号、姓名、住院号(呼唤患者、核对床头卡及腕带),评估患者。4分 (3)洗手,戴口罩。2分 (4)备齐用物携至患者床旁,再次核对,使用PDA扫描患者手腕带及试管上的条码信息,确认一致。2分 (5)协助患者取合适体位,用清水漱口。2分 (6)戴手套,核对标本标签,让患者张口发“啊”音,必要时使用压舌板。2分 (7)取出培养管中的拭子轻柔、快速的擦拭两腭弓、咽及扁桃体的分泌物,避免咽拭子触及其他部位。6分 (8)迅速把咽拭子插入无菌试管内塞紧。3分
(9)再次核对,将条形码标签贴于痰液收集器上,注明留取时间。3分(10)用纱布擦浄患者口唇,脱手套,整理床单位,协助患者取舒适体位,询问患者需要。2分 (11)处理用物。2分 (12)洗手,取口罩。2分 (13)医嘱签字,并在电脑上确认采样时间。2分 (14)按要求将标本送检。2分 (15)记录。2分 (16)操作时间:完成时间限6分钟以内。2分 综合评价: A 5分; B 4分; C 3分; D 2分; E 1分; F 0分 指导要点: 告知患者检查目的、采集方法、采集时间。 注意事项: (1)操作过程中,应注意瓶口消毒,保持容器无菌。 (2)最好在使用抗菌药物治疗前采集标本。 (3)避免在进食后2h内留取咽拭子标本,以防呕吐,棉签不要触及其他部位以免影响检验结果。 评分标准: (1)按操作程序各项实际分值评分。 (2)原则性操作程序颠倒一处扣2分。 (3)关心、体贴病人不够,态度不亲切扣2分。
临床检验标本采集规范及注意事项 一、检验标本采集原则(书108页) 二、检验标本的种类: 1、血液检验标本:全血、血浆、骨髓等 2、体液检验标本:尿液、粪便、脑脊液、胸水、腹水、精液、前列腺液、阴道分泌物、胃液、十二指肠引流液、胆汁、痰液、羊水、泪液等。 3、其它特珠标本:如细胞穿剌、皮屑、指甲、毛发等的成分分析。 三、检验结果的影响因素 (一)主要影响因素: 患者的状态;.患者的饮食;药物的影响。 1.不可变的生物因素:如年龄、性别等; 2.可变的生物因素:情绪、运动、生理节律变化; 3.采取标本时:体位:立位、卧位 4.止血带的使用等。 5.年龄与性别:部分检验结果与年龄和性别而有所不同: 红细胞总数:男:(4.0-5.7)*1012/L 女:(3.7-5.1)*1012/L 新生儿:(5.2-6.4)*1012/L 婴儿:(4.0-4.3)*1012/L 儿童:(4.0-4.5)*1012/L 血清碱性磷酸酶: 儿童:<500U/L 成人:40-150U/L 6.情绪 原则上患者应在平静、休息状态下采集标本,特别是血液标本。患者对采集标本时的恐惧、紧张,有时造成标本采集的失败。有研究指出,患者处于激动、兴奋、恐惧状态时,可使血红蛋白、白细胞增高。 7.运动 血清丙氨酸氨基转移酶(谷-丙转氨酶、GPT)、血清天门冬氨酸氨基转移酶(谷-草转氨酶GOT)、乳酶脱氢酶(LDH)、肌酸激酶(CK)等一时升高;还可引起血中钾、钠、
钙、白蛋白、血糖等成分的变化。 8.劳累或受冷、热空气刺激,往往可见白细胞的增高。 9.昼夜生理变化 分析物峰值时间谷值时间范围(日均值的%) 钾14-1623-14-6 铁14-182-450-70 磷酸盐2-48-1230-40 血红蛋白6-1822-248-15 促甲状腺素20-27-135-15 甲状腺素8-1223-310-20 生长素21-231-21300-400 泌乳素5-710-1280-100 醛固酮2-412-1460-80 10.体位 从立位到卧位时 Hgb下降4%;Hct下降6%;K下降1%;Ca下降4%;ALT下降7%;AST下降9%;ALP下降9%;IgG下降7%;IgA下降7%;IgM下降5%;TG下降6%;T4下降11%。 11.饮食 一顿标准餐后,可使血中甘油三酯增高50%、血糖增高15%。进食高碳水化合物食物,可引起血糖增高;进食高蛋白或高核酸食物,可引起血中尿素氮及尿酸的增高;进食高脂肪食物,可引起血脂的大幅度增高。餐后采集的血液标本,其血清常出现乳糜状,影响到许多检验测定的正确性。 12.饮料及吸烟 咖啡:可使AMY、AST、ALT、ALP、TSH、Glu等升高。 酒:可使Glu降低,使TG、G-GT、HDL-Ch升高。 尼古丁:可使儿茶酚胺、胃泌素、皮质醇、生长激素、碳氧血红蛋白、血球压积、癌胚抗原升高;使免疫球蛋白降低。 13.药物的影响 引起WBC\RBC下降,ALT升高,凝血功能改变 四、采集标本要选择最佳时间 临床检验血液标本原则上晨起空腹时采集,其结果准确可靠,因它避免了摄入成分和生
临床检验标本的采集规范
第一部分各类检验标本容器类型及要求
第二部分患者准备 2.1 病人在采血前24h 内应避免运动和饮酒,避免情绪激动,注意合理饮食除了急诊或其它特殊原因外,一般主张正常饮食3 天后采血,应避免暴饮暴食及刻意控制饮食。静脉血 标本采集最好在起床后1h 内进行。应在空腹10~14 小时后第二天清晨采血。餐后或延长空腹时间(饥饿)均可引起血液化学成分的改变。门诊病人提倡静坐15 分钟后再采血。另外饮食的量及质对检验结果也有影响,如高蛋白饮食可使血清尿素氮、血氨、尿酸升高;高脂肪饮食引起乳糜微粒血症,导致血清脂血(混浊);饮水过多或过少可使血清稀释或浓缩;含咖啡因的饮料可使儿茶酚胺释放等。 2.2 采血时间:有些血液成份日间生理变化较大,因此应相对固定采血时间,一般以清晨空腹抽血为宜〈急症项目除外〉。 2.3 患者体位:体位影响血液循环,由于血液和组织间液因体位不同而平衡改变,则细胞成分和大分子物质的改变较为明显,例如由卧位改为站位,血浆ALB、TP、酶、Ca、胆红素、Tch 及TG 等浓度增高;Hb、HCT、RBC 等亦可增加。由于体位的因素,在确立参考值时,应考虑门诊和住院病人可能存在的结果差异,故采集标本时要注意保持正确的体位和保持体位的相对一致性。
2.4 药物影响:很多药物进入人体后可使某些化验项目的结果增高或降低,如咖啡因可使血糖和胆固醇增高;冠心平可使 甘油三酯和乳酸脱氢酶降低;维生素C 可使乳酸脱氢酶降低;口服避孕药可使转氨酶升高等。故病人在化验前应尽可能停服对检验有干扰的药物。 2.5 输液的影响:不能在静脉输液同侧臂或输液三通处进行采 血。输液时应在输液的另一侧手臂取血。 2.6 生活方式的影响:烟、酒、咖啡及高脂、高糖饮食,可使血液中某些成份高于正常,需与一般病理情况相区别,取血前几日应注意避免。 2.7 生理差别的影响:不同年龄组的个体及妇女的妊娠期、月经期,血液成份有一定的生理差异,应注意与病理情况区别。 第三部分标本采集及注意事项 1. 静脉血液采集 1.1 采血注意事项:严格按照无菌技术操作,无论医生、护士、检验人员除穿戴工作服外,还应戴帽子、口罩和一次性医用乳胶手套,同时严格做好采血者手和患者采血部位的消毒,防止患者采血部位感染。保证一人一针一管一带,杜绝交叉感染。真空采血过程如有血液外溢和污染,立即用0.2%消毒灵或其它消毒液进行消毒处理。对所有的采血材料严格执行使用前再次检查,保证安全。采血人员对所采集的标本做好
临床微生物学标本采取和处理的规范化要求 正确的采取、处理与运送用于细菌培养的标本是临床细菌检验成功的关键。标本采取与处理的规范化是准确、及时地向临床提供重要的临床感染信息的基础;而标本采取与处理不当将严重影响检验结果,给临床以误导,延误对患者的正确治疗。为此,我们提出初步的参考意见,并希望在实践中不断完善。 一、血液细菌培养标本的采集和处理 临床上疑为败血症、脓毒血症或其他血液感染的患者,需做血液细菌培养以明确病原。 1.采集方法:静脉采血,以无菌操作方法抽取血液后,直接注入血培养瓶中,轻轻颠倒混匀,以防血液凝固。如果同时作需氧和厌氧培养,应先将标本接种到厌氧瓶中,再注入需氧瓶,严格防止将空气注入厌氧瓶中。 2.采血时间以及血培养份数:在患者发热期间越早越好,最好在抗菌治疗前,用药前24小时内采集2~3次血液标本,可使细菌检出率高达99%。对间歇性寒战或发热的患者,应在寒战或体温高峰到来之前0.5~1小时采血,亦可在寒战或发热后1小时采集血液标本。特殊感染患者采血培养时应遵循以下原则: (1)可疑急性发热性菌血症、败血症患者:应在使用抗菌药物之前,在24小时内从不同部位采集2~3份血液标本培养。 (2)可疑细菌性心内膜炎患者、感染性心内膜炎患者:在1~2小时内采集3份血标本培养,如果24小时后阴性,再采集两份血标本培养。 (3)不明原因发热患者:先采集2~3份血标本,抽血间隔60 min,24~36小时后体温升高之前,再采集2份血标本进行培养。因为1次血培养不足以说明问题,可能会遗漏阳性结果。
(4)可疑菌血症但血培养持续阴性时;应改变血培养方法,以获得罕见或苛养的微生物。 (5)在急性发热性疾病如脑膜炎、细菌性肺炎,需马上做抗菌治疗;或急性骨髓炎、化脓性关节炎等要紧急手术的患者,应立即从两臂分别取2份标本。 3.采血部位:采血部位通常为肘静脉。疑为亚急性心内膜炎的患者,以肘动脉或股动脉采血为宜。疑为细菌性骨髓炎或伤寒患者,在病灶或髂前(后)上棘处严格消毒后抽取骨髓。多次采血应在不同部位的血管穿刺以排除皮肤菌丛污染的可能。要避免从血管插管内取血,因插管常被污染,其培养结果不能反映真实情况。在不同部位取血,2次分离出同样菌种才是确定病原菌的有力证据。采血时要求严格无菌操作,防止皮肤正常菌群污染。 4.采血量:采血量与血培养的检出率相关,所以采血量一定要足够。成人一般为8~10ml/瓶,新生儿与婴幼儿为1~5 ml/瓶,骨髓采血量为1~2ml/瓶。 5.标本运送与保存:含血样的培养瓶应立即送往实验室;不能及时送检的标本,应将其放在室温,切忌冰箱存放,因为某些苛养菌可在低温环境中死亡,而使培养阳性率下降。 二、下呼吸道分泌物(痰培养)的标本采取和处理 下呼吸道分泌物(痰)的细菌学检查对病原学诊断起着重要作用,但痰标本的质量往往难以保证,造成病原学诊断和实际引起感染的病原菌脱节,直接影响抗菌药物的应用、甚至耐药菌的出现或流行。痰标本的细菌学检验地带网检查应注意如下几个问题。 1.标本的采集:痰液标本最好在应用抗菌药物之前采集,以深咳晨痰最好,主 要有自然咳痰法、支气管镜采集法、胃内采痰法、小儿采痰法和气管穿刺法等。
微生物标本采集及保存要求 一、总则:用于培养的标本在收集时应注意严格无菌操作和及时送检,检测后标本应妥善保存。 二、临床标本的采集 (一)下呼吸道分泌物(痰液) 令患者早上起床后用清水濑口,不要刷牙,立即从下部呼吸道咳出第一口痰,吐在无菌塑料痰盒中,及时送检。 (二)、尿液(中段尿) 护理人员协助采取中段尿约3ml入无菌试管中,及时送检。 (三)、粪便:取有粘液、脓血部分的粪便置玻璃大便专用管中,如为稀水便,可直接收集于玻璃管中,及时送检。 (四)、眼、耳、鼻、喉拭子:将棉拭子沾取少许无菌生理盐水(如沾取的太多,可在无菌生理盐水瓶壁上挤去多余的水份),然后采取可疑部位的分泌物,倒悬于无菌试管内,及时送检。 (五)、脓液:用沾有生理盐水的棉拭子沾取脓液,要尽量多取一些,然后将棉拭置于无菌试管中,及时送检。 (六)、: 1、凡怀疑菌血症和败血病的患者,采血培养时,应尽量在未使用抗菌素前采血,如已使用抗菌素,应尽量选择抗菌素在体内浓度最低时采血,应在病人第二次使用抗菌素之前采集血培养标本。当然在病人发热或寒颤时采集也可。 2、成人每次采血5—10ml,小儿采血2—3ml; 3、严格消毒病人采血部位和血培养瓶口,抽一定量血液后,无菌注入血培养瓶内,轻轻摇匀, 4、从抽血到接种入瓶,动作要快,防止血液凝固,同时要及时送检。 (七)、穿刺液:胸腹水、心包液、关节腔液、鞘膜积液: 严格无菌抽取后,注入含肝素抗凝的无菌试管中,轻轻颠倒试管10余次,使肝素与穿刺液混匀达到抗凝的目的,或直接无菌注入血培养瓶内及时送检。 (八)、胆汁:由专科医生以无菌方法取引流液10ml注入无菌试管。 (九)、脑脊液:以无菌方法取脑脊液3-5ml,置无菌试管内,常温保存送检,如只做培养可直接无菌注入血培养瓶内,及时送检。 (十)、生殖器官标本:阴道、子宫颈及前列腺等分泌物应由医师采集,收集于无菌试管内送检。如疑为淋病奈瑟菌感染,做培养检查时,采集的标本应床旁接种并及时放入孵箱培养。(十一)、烧伤标本:以无菌棉拭子直接采取多个部位创面的脓汁分泌物放入无菌试管中. (十二)、支原体(解脲、人型)培养+药敏的标本采集 1、支原体对干、热抵抗力差,标本采集后应尽快接种支原体运送培养基送检。 2、男性:用细的无菌棉拭子沾取无菌盐水少许深入尿道口内2.5-3cm。 三、临床标本的保存 细菌室标本原则上要求及时送检、及时处理,不得保存。
精品文档 动脉血标本采集操作程序和评分标准
一、含肝素液的采血注射器准备 1、稀释肝素液的配置方法及浓度: 现用现配。用 1ml 注射器吸取肝素原液 0.2ml 加入 100ml0.9NS 溶液中摇匀。浓度为: 12.5-125U 肝素 /ml 。 2、用 5ml 注射器吸 2ml 稀释肝素液市容注射器内壁,使稀释液充分与注射器内壁接触,然后排尽注射器内空气和稀释肝素液,放于无菌盘内备用。 二、影响血气分析检测结果的因素及对策。 1、患者情绪。患者呼吸急促或瞬间屏气均会影响检测结果。应避免因消极的语句引起患者呼吸和心率的变化,耐心细致地解释工作可缓解患者的紧张情绪,提高穿刺成功率。在采血时应尽量减少患者痛苦,使之处在情绪稳定状态下进行,如果不是卧床患者还应在采样前让患者卧床休息 3-5min 。 2、温度。不同温度将会影响血气标本的监测结果。因此在采集标本时应测量体温并注明。 3、吸氧浓度。在采集标本时应根据病人当时的用氧情况计算氧浓度并注明。计算公式为:吸入氧浓度(% = 21 +吸入氧流量(L/min)x 4。允许情况下应尽量做到: 1 )停止吸氧 30min 后再采集标本。 2)改变吸氧浓度时,要经过15 min 再采血。 3)机械通气病人采血前 30 min 呼吸机设置保持不变,保证患者处于相对稳定的呼吸状态。 4、药物。部分药物会影响标本的检测结果。 1 )含脂肪乳剂。尽量在输注乳剂前取血,或输完 12h 后采血。 2)碱性药物、大剂量青霉素钠盐、氨苄青霉素输入后短期内引起酸碱平衡变化。采血应在用药前 30 min 进行。 3)使用呼吸兴奋剂,应在用药后30 min 再采血。 三、采集动脉血气分析标本的注意事项。 1 、采血注射器内壁与稀释肝素液充分接触,防止标本凝固。 2、注射器内不得留有空气,血标本抽出后应立即将针头插入橡皮塞内使之与空气隔绝。 3、血液是活的组织,即使抽在注射器内,它也继续消耗氧,产生二氧化碳,血气标本宜立 即送检。一般从采集标本到完成测定,期间不超过30min。若无法及时送检,最好将血 标本立即置于冰箱保存,温度为0-4 C,但不可直接放置于冰中。冰箱保存不应超过 1h。 4、有动脉穿刺管者可从该管内抽取血标本。方法为先抽出相当于动脉置管容积的 3-6 倍血液(约 6ml ),再采 集标本。 1、穿刺过程必须严格无菌操作。一次穿刺失败,切勿在同一区域反复穿刺,以免形成血 肿。 2、尽量不用负压抽取血液,防止空气进入影响检验结果。 3、穿刺点按压 5min 以上。凝血功能障碍者按压时间延长至10min。 精品文档
检验标本采集、运送规章制度 一、检验科制定标本采集规范,包括对患者的准备要求、标本采集的方式与途径、标本处理、运送、保存环境等内容,要对相关医务人员进行教育与培训,使员工能知晓和遵循,避免由于标本采集环节因素而影响分析前的质量控制。遵循,避免由于标本采集环节因素而影响分析前的质量控制。 二、标本采集前做好事前向患者告知,正确识别患者无误,按照正确的标本采集途径、规范的操作方法、采集合格的标本。 三、采集到的标本应有唯一性的识别标志,条形码识别系统。 四、标本应在规定的时限内及时送达检测,避免因采集不当、暂存环境与时间的延缓,而影响标本检测结果的真实性,不得将明知是可能是“失真的”检验标本送检。 五、建立标本验收、登记、处理的工作程序,对不符合标本采集规范的标本应及时通报送检医师或其它相关人员明确处理意见,不得上机检测,更不得将明知是“失真的”检验结果签发报送临床,危及救治质量与病人安全。 六、为确保生物安全性与严防医院感染,应当使用密闭容器收集标本,开放型容器收集标本应当使用加盖的标本运送箱,加盖封闭放置标本及运送,符合生物安全性要求。应当根据不同的检查项目将标本分开
放置于标本箱内,避免混淆,血、尿标本分开放置,盛放标本工具应当加盖密闭,检查申请单不得与标本容器卷裹混放。 七、具有高危传染性标本、传染病医院的标本以及急诊抢救病人的标本,在采集后应由专人用专门盛具及时送检。 八、标本运送人员在拿取标本时必须佩带防护手套,接触标本后,按要求彻底清洗双手,防止污染。 九、各类标本在采集、暂存与运送过程中发生标本洒漏、标本容器破损等紧急意外事件,有紧急处理的程序与措施。
《微生物标本采集与运送规范》培训试卷 科室姓名职业得分 一、单选题50分(每题5分) 1. 微生物实验室误差最大的影响因素为: ( ) A. 实验前误差 B. 实验误差 C 验后误差 D. 随机误差 2. 血培养必须在( )内送检 A. 30min B. 1h C. 2h D. 4h 3 血培养的阳性检出率与( )成正比例的关系 A. 温度和时间 B. 采血量和采血时间 C. 采血量和采血套数 D. 采集方法和采血量 4. 某患者采血培养1套,培养结果为“表皮葡萄球菌”,判断这是污染菌还是致病菌,需要( ) A. 增加消毒次数 B. 增加采血量 C. 增加采血套数 D. 延长培养时间 5. 血培养瓶接种前和接种后,放置的最佳温度为( ) A. 0℃ B. 4℃ C. 室温(15~25℃) D. 35℃ 6. 下呼吸道感染患者最佳的送检标本为( ) A. 痰液 B. 支气管肺泡灌洗液(BALF) C. 咽拭子 D.唾液(口水) 7. 下呼吸道感染患者,除了做痰培养以外,还应该做( ) A. 血培养 B. 咽拭子 C. 厌氧菌 D. 分泌物 8. 下列申请单中标本采集部位不确定,检验目的不明确,属于不合格申请单的是( ) A. 中段尿培养 B. 痰培养 C. 分泌物培养 D. 脑脊液培养 9. 中段尿标本最常见的影响因素是( ) A. 容易受污染 B. 喝水过量 C.喝水过少 D. 无影响 10. 下列尿液标本中适合做厌氧菌培养是( ) A. 清洁中段尿 B. 留置尿管导尿 C. 耻骨上膀胱穿刺 D. 24h尿 二、多选题25分(每题5分) 1. 下列标本类型中, ( )属于有价值的标本,有重要的临床意义,鼓励送检 A. 血液 B. 骨髓 C. 胸腹水 D.脑脊液 E. 关节液 2 常用的拭子标本不适合作为送检标本的原因有( ) A. 使用方便 B. 标本量太少 C. 容易干燥 D. 不易接种到培养基中 E. 木(竹)签中含有抑菌物质 3. 下列关于痰液标本采集和运送的做法正确的有( ) A. 采样前应刷牙(不用牙膏)或用冷开水漱口,以避免口腔正常菌群污染 B. 采取晨痰第一口痰最佳,咳痰时应咳取深部痰液 C. 做结核分支杆菌检查时,痰液量应增加 D. 肺部感染患者中有25%~50%可能会有菌血症,因此应同时做血培养 4. 下列关于血培养标本采集和运送的做法正确的有( ) A. 在使用抗菌药物治疗前采集 B. 如患者已经使用抗菌药物的,应在下次使用抗菌药物之前采集 C. 应在患者寒战开始时,或发热初起时采集 D. 血培养标本应按“套”采集,采集套数为2~3套,不能采集单一瓶数 E. 必须严格执行无菌操作,避免污染,采集后应快送检,如未能及时送检,应放置4℃冰箱保存 5.下列痰培养标本属于不合格标本,应予拒收的有( ) A. 24h内重复采集的痰样本 B. 唾液(口水) C. 咽拭子 D.. 痰液做厌氧菌培养 三、简答题25分 简述微生物样本采样基本原则
临床微生物标本采集与送检规范(试行)临床微生物标本采集与送检是目前临床实验室诊断质量保证中 较为薄弱的环节,严重影响临床微生物学实验室对感染样本中致病 菌的分离培养的阳性率和医院感染病原体监控,也影响临床诊断, 合理选用抗菌药物,降低耐药菌的产生和提高感染的治愈率,而且 对预测或及时发现医院感染的暴发流行、杜绝感染蔓延、研究医院 感染的发病机制和环节、制定有效的医院感染控制措施等,均具有 十分重要的意义。严格实施正确的微生物标本送检和检验方法,是 做好医院感染病原体监测的关键。鉴此,希望临床各科能按照本操 作规范采样送检。 一、医院感染标本的采集和运送基本原则 1.发现医院感染应及时采集微生物标本作病原学检查,我院总的医院微生物标本送检率应不低于40%。 2.尽量在抗菌药物使用前采集标本。 3.标本采集时应严格执行无菌操作,减少或避免机体正常菌群及其他杂菌污染。 4.标本采集后立即送至实验室,床旁接种可提高病原菌检出率。5.以棉拭子采集的标本如咽拭子、肛拭子或伤口拭子,应立即送检。 6.盛标本容器须经灭菌处理,但不得使用消毒剂。 7.送检标本应注明来源和检验目的,使实验室能正确选用相应的培养基和适宜的培养环境,必要时应注明选用何种抗菌药物。
二、常见医院感染标本送检方法 1.血液与骨髓 ①通常采血部位为肘静脉。疑似细菌性心内膜炎时,以肘动脉或股动脉采血为宜。切忌在静脉点滴抗菌药物的静脉处采取血标本。 ②采血部位的局部皮肤应严格消毒。将采集的血液注入血培养基前,应更换针头或过火消毒针头。血培养瓶应在避光室温中保存,不必 置冰箱保存。 ③每次采血量成人5~10ml,婴幼儿l~5ml,培养基与血液之比以lO:1为宜,以稀释血液中的抗菌药物、抗体等杀菌物质。 ④怀疑菌血症应尽早采血,体温上升阶段采血可提高阳性率,但要防止因等待而延误时机。对已用抗菌药物而又不能停药者,可在下 次用药前采血。 ⑤每例病人至少采血两次,间隔0.5~lh,以利于提高阳性率和 区分感染菌与皮肤污染菌。 ⑥对疑为细菌性骨髓炎或伤寒病人,在病灶部位或髂前(后)上棘处严格消毒后抽取骨髓lml作增菌培养。 2.尿液 ①中段尿:女性采样前应先用肥皂水或0.1%高锰酸钾溶液冲洗 外阴部及尿道口;男性须翻转包皮冲洗,用O.1%新洁尔灭消毒尿 道口.灭菌纱布擦干后收集标本。 ②导尿管导尿采样可减少污染。对留置导尿者,可用碘酒消毒尿道口处的导尿管壁,用空针细针头斜穿管壁抽吸尿液。或消毒后解开
静脉血标本采集法评分标准 科室姓名得分年月日
考核者:年月日 静脉采血操作流程 一、操作前准备 1.着装整洁,修剪指甲,洗手,戴口罩。 2.物品准备: ⑴选择适当的标本容器,检查容器是否完好,采血管软塞是否严密,并在容器外贴上标签,注明科室、床号、姓名、性别、检验目的及采集日期。 ⑵治疗车上层:治疗盘、棉签,一次性采血针2个,真空采血管(标本容器的选择根据检验项目选择诸如试管、密封瓶,按需要备一次性注射器或头皮针、酒精灯、火柴。)、皮肤消毒剂、手消毒液、止血带,小枕(垫巾),弯盘、化验单、笔等。
⑶治疗车下层:锐器盒、医疗垃圾桶、生活垃圾桶。 3.核对医嘱、化验单。 4.评估患者:病情、意识及配合程度,需空腹取血者了解是否空腹。评估穿刺部位皮肤、血管状况和肢体活动度。心理方面:合作程度及有无恐惧,焦虑等。解释采血标本的目的、要求和意义。 二、步骤 1.携用物至床旁,先进行床号、姓名身份识别,再持化验单进行详细核对(依据患者、化验单、床头卡、标本容器):床号、姓名、性别、年龄、住院号、检验项目、标本容器,向患者解释,取得合作。 2.选择血管,常用肘窝静脉、肘正中静脉、前臂内侧静脉,小儿可采用颈外静脉、大隐静脉。 3.在穿刺部位肢体下放小枕垫巾、止血带,常规消毒穿刺部位皮肤。 4.消毒穿刺部位皮肤。在静脉上方5-6cm处系止血带,嘱患者握拳(请患者不要进行松紧拳头的动作),再次常规消毒穿刺部位皮肤。 5.再次确认床号、姓名、性别、检验项目等。 6.采血 注射器采血: ⑴穿刺、抽血:持一次性注射器或头皮针,按静脉注射法行静脉穿刺,见回血后抽取所需血量。 ⑵抽血毕,松止血带,嘱患者松拳,迅速拔出针头,按压局部1-2分钟(凝血功能障碍者按压时间延长至10分钟)。 ⑶将血液注入标本容器。(同时抽取不同种类的血标本,应先将血液注入血培养瓶,次注入抗凝管,最后注入干燥试管。) ①血培养标本:先除去密封瓶铝盖中心部分,常规消毒瓶塞,更换针头后将血液注入瓶内,轻轻摇匀。如患者已使用抗生素,在化验单上注明。一般血培养取血5ml,对亚急性细菌性心内膜炎患者,采血10-15ml。 ②全血标本:取下针头,将血液沿管壁缓慢注入盛有抗凝剂的试管内,防气泡注入,轻轻摇匀。
病原微生物检验标本采集、运送操作规程 1、目的:正确的标本采集,运送,保存和处理对于微生物检验工作质量至关重要,为了准确检出病原菌,避免漏检与误诊,临床医护人员和实验室工作人员应掌握微生物标本的选择,采集,运送,保存及处理的一般原则。 2、标本采集的一般原则 2.1早期采集 采集时间最好在病程早期,急性期,且必须在使用抗菌药物之前采集,确保病原菌的检出。 2.2无菌操作采集标本时应尽量减少或避免感染部位附近或皮肤黏膜正常菌群的污染,使病原菌与正常菌群混淆,造成临床误诊。采集的标本应存放在无菌容器内,容器不能使用消毒剂处理,标本中也不能添加防腐剂,以免降低病原菌的检出。 2.3适量的标本标本量过少可能导致假阴性结果。 2.4适当的采集方法 对于厌氧菌,需氧菌或兼性厌氧菌的采集方法是不同的,用于厌氧菌培养的标本应尽量用注射器采集抽取物,室温保存,不能冷藏和冷冻。 2.5盛放标本的容器采集标本应存放在无菌,防漏,应带有螺旋盖的容器内。 3、标本的运送 3.1标本采集后立即送检,若有延迟也应在2 小时内送到实验室,否则会影响病原菌的检出,一般性的细菌培养标本若需延迟送检时,应置于4 度冰箱保存,且不能超过24 小时。 3.2.临床标本最佳运送时间取决于标本的量,少量液体(小于1ml)或组织(小 于1cm3)应在15~30 分钟内送到实验室,较多量的标本置于运送培养基中可放
12~24小时,厌氧培养标本原则上是床边接种,如延迟送检,需保存在厌氧运送培养基中,室温保存,不得超过24 小时。 4、不同标本的采集,运送 4.1血液标本采集,运送 4.1.1血培养指针征当患者出现:发热(大于38 度)或低温(小于36 度),寒战,白细胞增多,皮肤黏膜出血,休克,多器官衰竭,血压降低,c 反应蛋白升高及呼吸加快,血液病患者出现粒细胞减少,血小板减少等,具备上述一种或几种体征时,临床怀疑菌血症应采集血液标本进行血培养,对入院危重感染患者应在未使用抗菌药物治疗前,及时做血培养。 4.1.2对怀疑菌血症、真菌血症的患者,在考虑使用抗菌药物之前,应立即采集血培养标本。必须同时或间隔短时间内采集2套以上血培养标本。成年患者:推荐同时采集2-3套(不同部位)血培养标本(即双瓶双臂同时采集血培养标本),采血量每瓶不少于5ml;婴幼儿患者:推荐同时采集2次(不同部位)血培养标本, 采血量每瓶不少于2ml。(少于病人总血容量的1%).在采取血培养后的2—5 天内,无需重复采取血培养。两个例外:细菌性心内膜炎和金黄色葡萄球菌菌血症。 4.1.3血标本采集的量是影响检出率的最重要的因素。检出率与采血量成比例增长,每增加1ml 的血液,病原菌的检出率就会相应增加。儿童患者血液中病原菌浓度较高,血培养量无需等同于成人。采用一对(需氧瓶+厌氧瓶)组合,比采用二个需氧瓶的组合可检出更多的葡萄球菌、肠杆菌科细菌和厌氧菌。采血量不能满足推荐的量时,应首先满足需氧瓶的需要。推荐从外周静脉采集血液标本,不推荐静脉留置导管,因其常伴有高污染率。如果必须从留置导管内采血,也应同时从外周静脉采集另外一个血培养标本以帮助阳性结果的判读。 4.1.4血标本采集的注意事项 在采血之前,血培养瓶的橡皮塞需使用75%酒精消毒并干燥。然后再进行穿刺部 位的皮肤消毒。严格按照“酒精、含碘消毒剂、酒精”的消毒步骤操作,并等待足够的消毒时