实验4.5 二组分溶液沸点-组成图的绘制 一、目的要求 1.掌握阿贝折光仪及超级恒温槽的使用方法 2.掌握沸点-组成图的绘制方法 3.掌握用折光率确定二元液体组成的方法 二、实验原理 二组分完全互溶液体系统蒸馏曲线可分为三类: (1)系统中两组分对拉乌尔定律的偏差都不大,在T-x图上溶液的沸点总是介于A、B两纯液体的沸点之间,(如图) (2)两组分对拉乌尔定律都产生较大的负偏差,在p-x图上出现最小值时,在T-x图上将出现最高点,(如图) (3)两组分对拉乌尔定律都产生较大的正偏差,在p-x图上出现最大值时,在T-x图上将出现最低点,(如图) 最高点和最低点分别称为最高恒沸点和最低恒沸点,对应的组成称为恒沸组成,其相应的混合物称为恒沸混合物。
系统中两组分对拉乌尔定律的偏差都不大两组分对拉乌尔定律都产生较大的负偏差 两组分对拉乌尔定律都产生较大的正偏差
本实验是在某恒定压力下则定乙醇—正己烷二组分系统的沸点与组成平衡数据,并绘制该液体混合物的蒸馏曲线,其类型是系统中两组分对拉乌尔定律的偏差都较大的类型。 三、仪器试剂 超级恒温槽、阿贝折光仪、蒸馏瓶、恒流源、精密数字温度计、量筒、移液管、滴管、 环己烷、无水乙醇、丙酮、重蒸馏水、80%、60%、40%、20%环己烷—-乙醇标准混合液; 各种组成的环己烷—乙醇混合液。 四、实验步骤 1.测定沸点与组成的关系:使用折光率仪测量上述混合溶液相应的折光率。以折射率对浓度作图,即可绘制工作曲线。 2. 一定组成环己烷——乙醇混合液沸点及气液两相折射率的测定。按图装好装置后,加入药品,环己烷/乙醇: 26.21ml/0.45ml、25.44ml/1.23ml、23.41ml/3.25ml、 19.46ml/7.21ml、17.15ml/9.52、11.61ml/15.85ml、 6.4ml/20.23ml、1.41ml/25.26ml,加热回流。 3.待温度读数稳定后,将蒸馏瓶稍稍倾斜,使小槽中的冷凝回流蒸气瓶,发福倾倒三次,待小槽收集满后,记下沸点温度,
液氨-33、35℃特殊溶解性:能溶解碱金属与碱土金属剧毒性、腐蚀性 液态二氧化硫-10、08 溶解胺、醚、醇苯酚、有机酸、芳香烃、溴、二硫化碳,多数饱与烃不溶剧毒 甲胺-6、3 就是多数有机物与无机物的优良溶剂,液态甲胺与水、醚、苯、丙酮、低级醇混溶,其盐酸盐易溶于水,不溶于醇、醚、酮、氯仿、乙酸乙酯中等毒性,易燃 二甲胺7、4 就是有机物与无机物的优良溶剂,溶于水、低级醇、醚、低极性溶剂强烈刺激性 石油醚不溶于水,与丙酮、乙醚、乙酸乙酯、苯、氯仿及甲醇以上高级醇混溶与低级烷相似 乙醚34、6 微溶于水,易溶与盐酸、与醇、醚、石油醚、苯、氯仿等多数有机溶剂混溶麻醉性 戊烷36、1 与乙醇、乙醚等多数有机溶剂混溶低毒性 二氯甲烷39、75 与醇、醚、氯仿、苯、二硫化碳等有机溶剂混溶低毒,麻醉性强 二硫化碳46、23 微溶与水,与多种有机溶剂混溶麻醉性,强刺激性 溶剂石油脑与乙醇、丙酮、戊醇混溶较其她石油系溶剂大 丙酮56、12 与水、醇、醚、烃混溶低毒,类乙醇,但较大 1,1-二氯乙烷57、28 与醇、醚等大多数有机溶剂混溶低毒、局部刺激性 氯仿61、15 与乙醇、乙醚、石油醚、卤代烃、四氯化碳、二硫化碳等混溶中等毒性,强麻醉性 甲醇64、5 与水、乙醚、醇、酯、卤代烃、苯、酮混溶中等毒性,麻醉性, 四氢呋喃66 优良溶剂,与水混溶,很好的溶解乙醇、乙醚、脂肪烃、芳香烃、氯化烃吸入微毒,经口低毒 己烷68、7 甲醇部分溶解,比乙醇高的醇、醚丙酮、氯仿混溶低毒。麻醉性,刺激性 三氟代乙酸71、78 与水,乙醇,乙醚,丙酮,苯,四氯化碳,己烷混溶,溶解多种脂肪族,芳香族化合物 1,1,1-三氯乙烷74、0 与丙酮、、甲醇、乙醚、苯、四氯化碳等有机溶剂混溶低毒类溶剂 四氯化碳76、75 与醇、醚、石油醚、石油脑、冰醋酸、二硫化碳、氯代烃混溶氯代甲烷中,毒性最强 乙酸乙酯77、112 与醇、醚、氯仿、丙酮、苯等大多数有机溶剂溶解,能溶解某些金属盐低毒,麻醉性 乙醇78、3 与水、乙醚、氯仿、酯、烃类衍生物等有机溶剂混溶微毒类,麻醉性 丁酮79、64 与丙酮相似,与醇、醚、苯等大多数有机溶剂混溶低毒,毒性强于丙酮 苯80、10 难溶于水,与甘油、乙二醇、乙醇、氯仿、乙醚、、四氯化碳、二硫化碳、丙酮、甲苯、二甲苯、冰醋酸、脂肪烃等大多有机物混溶强烈毒性 环己烷80、72 与乙醇、高级醇、醚、丙酮、烃、氯代烃、高级脂肪酸、胺类混溶低毒,中枢抑制作用
各种水的区别 纯净水是通过采用电渗吸、反渗透等,多项技术对水进行深层处理加工后,彻底消除细菌微生物病毒和矿物质的饮用水。对人身体健康极为有利,它容易吸收、没有污染、促进新陈代谢、还可以减轻肝和肾的负担。 什么是矿泉水? 矿泉水来自地下深层并含有大量的矿物质。但矿化水不益过量饮用,以防胆结石。另外目前有些厂商也在制造一些人造矿泉水,即纯净水内添加矿物质,其口感与天然矿泉水有所不同。 矿泉水是泉水或地下水的一种含有各种矿物质元素,只有将有害成份除去后才能饮用。而纯净水中不含任何杂质和有害元素,对人体有益。所以矿泉水与纯净水有很大的区别。 矿泉水是天然的,矿物质水是后天添加的,纯净水是经过净化已经什么都没有了的水。 1,自来水 对于自来水,人们第一印象是既干净清洁又卫生方便,打开水龙头就可以接到干净的水。可是实际是不一样的,现在的自来水并没有想象的那么干净,在不知不觉中它也受到了污染.自来水中的致变物质,一部分是从水源中带来的,还有一部分是由水厂加氯消毒后产生的.另外自来水还有一个污染的途径,就是用来输送自来水的水管,一路从水厂到你家,也会产生污染物。你喝的自来水因为病菌超标,所以不能直饮;烧开了的水中还有致癌物,又是死水。这一杯水,你准备喝多久? 2,井水 现在的井水是最恶劣的饮用水了。井水污染包括:生活污水和其它耗氧废物,传染病菌和病毒;植物营养剂——氮和磷;有机化学合成剂——杀虫剂、除锈剂和合成洗涤剂;来自工业、矿业和农业操作的其它矿物质和化学物质;来自土地侵蚀的沉淀物;热污染等。
大量饮用纯净水,会带走人体内有用的微量元素,从而降低人体免疫力,易引发疾病。由于人体的体液微碱性的,而纯净水呈弱碱性,如果长期饮用弱酸性的水,体内环境将遭到破坏。此外,长期饮用纯净水还会增加钙的流失。若长期饮用胸闷、恶心、体力衰退,性情急躁,罹患心血管疾病等。纯净水水质偏酸性,不宜长期饮用。 4,蒸馏水 医学专家已经发出忠告:蒸馏水属医疗用水,不宜长期饮用。蒸馏水是利用整流设备使水蒸气凝成水,冷却称为蒸馏水,除去水中的金属离子,但也除去了人体所需要的微量元素,蒸馏水虽为纯净无菌水,却是没有生命的“死水”,是不利于身体细胞正常新陈代谢的。 5,矿泉水 国家标准对天然矿泉水规定是:从地下深处自然涌出的或经过人工揭露的、未受污染的地下矿水;含有一定量的矿物盐,微量元素或二氧化碳气体;真正的矿泉水区别于其它饮用水的特点是:地表水经历千百年的渗透、过滤、地下深部循环才形成的,通过天然净化而不含有致癌化合物、农药、重金属、细菌、病毒、寄生虫等对人体有害的成分。水中含有多种人体必需的微量元素,微量元素在人体重量中虽然很少。但是,商场上真正的矿泉水多数受到质疑,桶装或者瓶装矿泉水成为静态水、大分子团水,还有污染之忧。 6,富氧水 富氧水是指在纯净水里,人为的加入更多的氧气,这种水中的氧分子到体内,会破坏细胞的正常分裂,加速衰老。富氧水属于医疗用水,是针对特殊人群的,不能作为正常人群的饮用水。央视专家表示氧气只能被肺吸收,不能够被胃吸收,富氧水可能只是概念炒作,消费者“不要被太多概念忽悠。”目前市面上类似新水种最常见的是富氧水、离子水、纳米水、冰凌水等,消费者应该理性选购。
学号:21 成绩: 基础物理化学实验报告 实验名称:二组分溶液沸点—组成图 的绘制 应用化学二班级3 组号 实验人姓名:xx 同组人姓名:xx 指导老师:周崇松 实验日期:2013.9 湘南学院化学与生命科学系
一.实验目的 1.测定常压下环己烷-乙醇二元系统的气液平衡数据,绘制沸点-组成相图。 2.掌握双组分沸点的测定方法,通过实验进一步理解分馏原理。 3.掌握阿贝折射仪的使用方法。 二.实验原理 在一定的外压下,纯液体的沸点是恒定的,但对于完全互溶双液系,沸点 不仅与外压有关,而且还与其组成有关,并且在沸点时,平衡的气-液两相组成往往不同。根据相律:F=C-P+2,一个气液共存的二组分体系,其自由度为2,只需再任意确定一个变量,其自由度就减为1,整个体系的存在状态就可以用二维图来描述。本实验中采用在一定压力下,作出体系的温度T 和组分x 的关系图,即T-x 图。 完全互溶体系的T-x 图可分为三类:①液体与Raoult 定律的偏差不大,在T-x 图上,溶液的沸点介于两种纯液体的沸点之间(图1.a ),如苯-甲苯系统;②由于两组分的相互作用,溶液与Raoult 定律有较大的负偏差,在T-x 图上存在最高沸点(图1.c ),如卤化氢-水系统;③ 溶液与Raoult 定律有较大的正偏差,在T-x 图上存在最低沸点(图1.b ),如乙醇-水系统。②和③类溶液,在最高或最低沸点时的气-液两相组成相同,这些点称为恒沸点,此浓度的溶液称为恒沸点混合物,相应的温度称为恒沸温度,相应的组成称为恒沸组成。 本实验所要测绘的环己烷-乙醇体系即属于第二类溶液。对于一个组成恒定的封闭系统,当系统达到气液平衡温度时,气液两相的组成和温度恒定不变,以此便能得到该温度下的平衡气-液两相组成的一对坐标。依次改变系统的组成就能得到一系列的平衡气-液两相组成坐标点,用光滑曲线连接即成相图。 实验所用的沸点仪结构如图2,冷凝管底部的小球用以收集冷凝下来的 气相样品。电热丝直接浸入溶液中加热可避免暴沸现象,温度计外的小玻璃罩有利于降低周围环境可能造成的温度计读数波动。平衡时气-液两相组成的分析用的是折射率法,因为溶液的折射率与其组成有关。若在一定温度下,测得一系列已知浓度溶液的折射率,作出该温度下溶液的折射率-组成工作曲线,就可通过测量同温度下的未知浓度溶液的折射率得到此溶液的浓度。因折射率是温度的函数,测定时必须严格控制阿贝折光仪的测量温度。 t/℃ t/℃ t/℃ A A A B B B x B (a) x B (b) 气 气 气 液 液 液 x B (c)
AZEOTROPIC DATA FOR BINARY MIXTURES Liquid mixtures having an extremum (maximum or minimum) vapor pressure at constant temperature, as a function of composition, are called azeotropic mixtures, or simply azeotropes. Mixtures that do not show a maximum or minimum are called zeotropic. Azeotropes in which the pressure is a maximum are often called positive azeotropes, while pressure-minimum azeotropes are called negative azeotropes. The coordinates of an azeotropic point are the azeotropic temperature t az, pressure P az , and liquid-phase composition, usually expressed as mole fractions. At the azeotropic point, the vapor-phase composition is the same as the liquid-phase composition. This table gives azeotropic data for a number of binary mixtures at normal atmospheric pressure (P az =101.3 kPa). Component 1 of each mixture is given in bold face. The temperature t az and mole fraction x1 of component 1 are listed for each choice of component 2. The components are arranged in a modified Hill order, with substances that do not contain carbon preceding those that do contain carbon. REFERENCES 1.Lide, D.R., and Kehiaian, H.V., CRC Handbook of Thermophysical and Thermochemical Data, CRC Press, Boca Raton, FL, 1994. 2.Horsley, L.H., Azeotropic Data, III, American Chemical Society, Washington, D.C., 197 3. Molecular formula Name t az/°C x1 Water H2O CHCl3Trichloromethane56.10.160 CH2O2Formic acid107.20.427 CH3NO2Nitromethane83.60.511 CS2Carbon disulfide42.60.109 C2H3N Acetonitrile76.50.307 C2H5NO2Nitroethane87.20.624 C2H6O Ethanol78.20.096 C4H8O2Ethyl acetate70.40.312 C4H10O1-Butanol92.70.753 C4H10O2-Butanol870.601 C5H5N Pyridine93.60.755 C5H11N Piperidine92.80.718 C5H12Pentane34.60.054 C6H5Cl Chlorobenzene90.20.712 C6H6Benzene69.30.295 C6H6O Phenol99.50.981 C6H10Cyclohexene70.80.308 C6H12Cyclohexane69.50.300 C6H14Hexane61.60.221 C7H8Toluene84.10.444 C7H16Heptane79.20.452 C8H101,3-Dimethylbenzene920.767 C8H10Ethylbenzene920.744 C8H18Octane89.60.673 C8H18O Dibutyl ether92.90.781 C9H20Nonane94.80.970 C12H27N Tributylamine99.70.976 Tetrachloromethane CCl4 CH2O2Formic acid66.70.569 CH3NO2Nitromethane71.30.660 CH4O Methanol55.70.445 C2H3N Acetonitrile65.10.566 C2H6O Ethanol65.00.615 C3H6O Acetone56.10.047 C3H8O1-Propanol73.40.820 C4H10O1-Butanol76.60.951 Formic acid CH2O2 CS2Carbon disulfide42.60.253 Nitromethane CH3NO2 CS2Carbon disulfide41.20.845 Methanol CH4O C3H6O Acetone55.50.198 ? 2000 CRC Press LLC
C7二元体系沸点-组成图测绘 ——实验日期:2014年4月日姓名:马玉仁学号:1120122488 班级:10011202 一、实验目的 (一)在大气压下,测定环己烷-乙醇体系气、液平衡相图(沸点-组成图)。(二)掌握阿贝折光仪的测量原理和使用方法。 二、原理及实验公式 一个完全互溶的二元体系,两个纯液体组分,在所有组成范围内完全互溶。在定压下,完全互溶的二元体系的沸点—组成图可分为三类,如图C7.1所示。 a.溶液的沸点介于两纯组分沸点之间,如苯一甲苯体系; b.溶液有最低恒沸点,如环己烷-乙醇体系; c.溶液有最高恒沸点,如丙酮—氯仿体系。 b、c两类溶液在最高或最低恒沸点时气、液两相组成相同,加热蒸发只能使气相总量增加,气、液相组成及溶液沸点保持不变,此温度称恒沸点,相应组成称恒沸组成。 图C7.1 二元体系T-x图 下面以a为例,简单说明绘制沸点-组成图的原理。加热总组成为x1的溶液,体系的温度上升,达液相线上1点时溶液开始沸腾,组成为x2的气相开始生成,但气相量很少(趋于0),x1、x2二点代表达到平衡时液、气两相组成。继续加热,气相量逐渐增多,沸点继续上升,气、液二相组成分别在气相线和液相线上变化,当达某温度(如2点),并维持温度不变时,则x3、x4为该温度下液、气两相组成,气相、液相的量之比按杠杆规则确定。从相律f = c - p +2可知,当外压恒定时,在气、液两相共存区域自由度等于1,当温度一定时,则气、液两相的组成也就确定,总组成一定,由杠杆规则可知两相的量之比也已确定。因此,在一定的实验装置中,全回流的加热溶液,在总组成、总量不变时,当气相的量与液相的量之比也不变时(达气-液平衡),则体系的温度也就恒定。分别取出气、液两相的样品,分析其组成,得到该温度下,气、液两相平衡时各相的组成。改变溶
常见的共沸物 共沸物组分的沸点(度) 组成(w/w) 共沸点(度) 水--乙醇 100--78、5 5--95 78、15 水--正丙醇--97、2 28、8--71、2 87、7 水--异丙醇--82、4 12、1--87、9 80、4 水--正丁醇--117、7 37、5--62、5 92、2 水--异丁醇--108、4 30、2--69、8 89、9 水--叔丁醇--82、5 11、8--88、2 79、9 水--异戊醇--131、0 49、6--50、4 95、1 水--正戊醇--138、3 44、7--55、3 95、4 水--氯乙醇--129、0 59、0--41、0 97、8 水--乙醚--35 1、0--99、0 34 水--乙腈--81、5 14、2--85、8 76 水--丙烯腈--78、0 13、0--87 70、0 水--甲酸--101 26--74 107 水--丙酸--141、4 82、2--17、8 99、1 水--乙酸乙酯--78 9、0--91 70 水--二氧六环--101、3 18--82 87、8 水--氯仿--61、2 2、5--97、5 56、1 水--四氯化碳--77、0 4、0--96 66、0 水--二氯乙烷--83、7 19、5--80、5 72、0 水--苯--80、4 8、8--91、2 69、2 水--甲苯--110、5 20--80 85、0 水--二甲苯--137-140、5 37、5--62、5 92、0 水--吡啶--115、5 42--58 94、0 水--二硫化碳--46 2、0--98、0 44 甲醇--二氯甲烷 64、7--41 7、3--92、7 37、8 甲醇--氯仿--56、2 12--88 55、5 甲醇--四氯化碳--77、0 21--79 55、7 甲醇--丙酮--56、2 12--88 55、5 甲醇--苯--80、6 39、1--60、9 57、6 甲醇/甲酸甲酯/环己烷 17、8/48、6/33、6 50、8 乙醇--乙酸乙酯 78、3--78、0 30--70 72、0 乙醇--苯--80、6 32--68 68、2 乙醇--氯仿--61、2 7--93 59、4 乙醇--四氯化碳--77、0 16--84 65、1 乙醇/苯/水78、3/80、6/100 19/74/7 64、9 乙酸乙酯--四氯化碳78、0--77、0 43--57 75、0 乙酸乙酯--环己烷 46--54 71、6
实验名称:二元液系相图 学院:XXXXXXXXXX 班级:XXXXXXXXX 姓名(学号):XXX(XXXXXXXX) 指导教师:XXX 实验时间:XXXXXXXXXXXXXX
二元液系相图 一、实验目的 1.测定环己烷-乙醇系统的沸点组成图(T-X图)。 2.掌握阿贝(Abbe)折光仪的使用方法。 二、实验原理 两种液态物质以任何比例混合都形成均相溶液的系统称这完全 互中溶双液系。在恒定压力下溶液沸点与平衡的气液相组成的关系,可用沸点-组成图(t-x图)表示。 完全互溶双液系的沸点-组成图可分为两三种: 一种为最简单的情况,溶液沸点介于两个纯组分沸点之间,如图6-1所示。纵坐标表示温度,横坐标表示组分B的摩尔分数(x B,y B)。下面一条曲线表示气液平衡时温度(即溶液沸点)与液想组成的关系,称液相线(T-x线)。上面的线表示平衡温度与气相组成的关系,称气相线(T-y线)。若总组成为Z B的系统在压力p及温度t时达到气液两相平衡,其液相组成为x B气相组成为y B(见图6-1)。 另两种类型为具有恒沸点的完全互溶双液系统气液平衡相图,如图6-2所示。其中(a)为具有低恒沸点相图,(b)为具有高恒沸点相图。这两类相图中气相线与液相线在某处相切。相切点对应的温度称为恒沸温度,对应组成的混合物称恒沸混合物。恒沸混合物在恒沸点达气液平衡,平衡的气、液组成相同。同一双液系在不同压力下,恒沸点及恒沸混合物是不同的。
本实验绘制环己烷-乙醇二元液系的T-X图。其方法为将不同组成的溶液于蒸馏仪中进行蒸馏,沸腾平衡后记下温度,依次吸取少量的蒸馏液和蒸出液。分别用阿贝折光计测定其折射率,然后由环己烷-乙醇的折射率-组成标准曲线或其数据表确定相应组成,从而绘制环己烷-乙醇二元液系相图。 三、仪器和试剂 沸点测定仪;取样管;阿贝折光仪。 环己烷(分析纯);无水乙醇(分析纯);环己烷摩尔分数分别为0.2、0.4、0.6、0.8的乙醇溶液。 四、实验步骤 1.纯液体折光率的测定 分别测定乙醇和环己烷的折光率。 2.标准曲线的绘制 测定环己烷摩尔分数分别为0.2、0.4、0.6、0.8的乙醇溶液的折光率,绘制标准曲线。 3.测定沸点-组成数据 1)安装沸点测定仪。 2)溶液配制。 粗略配制环己烷质量百分数分别为0.05、0.1、0.2、0.45、0.55、0.6、0.7、0.8、0.9等组成的环己烷-乙醇溶液约50ml。
二元体系沸点-组成图测绘 1 实验目的及要求 1)在大气压下,测定环己烷-乙醇体系气、液平衡相图(沸点-组成图)。 2)掌握阿贝折光仪的测量原理和使用方法。 2 原理 一个完全互溶的二元体系,两个纯液体组分,在所有组成范围内完全互溶。在定压下,完全互溶的二元体系的沸点—组成图可分为三类,如图C7.1所示。 a.溶液的沸点介于两纯组分沸点之间,如苯一甲苯体系; b.溶液有最低恒沸点,如环己烷-乙醇体系; c.溶液有最高恒沸点,如丙酮—氯仿体系。 b、c两类溶液在最高或最低恒沸点时气、液两相组成相同,加热蒸发只能使气相总量增加,气、液 图C7.1 二元体系T-x图 下面以a为例,简单说明绘制沸点-组成图的原理。加热总组成为x1的溶液,体系的温度上升,达液相线上1点时溶液开始沸腾,组成为x2的气相开始生成,但气相量很少(趋于0),x1、x2二点代表达到平衡时液、气两相组成。继续加热,气相量逐渐增多,沸点继续上升,气、液二相组成分别在气相线和液相线上变化,当达某温度(如2点),并维持温度不变时,则x3、x4为该温度下液、气两相组成,气相、液相的量之比按杠杆规则确定。从相律f = c - p +2可知,当外压恒定时,在气、液两相共存区域自由度等于1,当温度一定时,则气、液两相的组成也就确定,总组成一定,由杠杆规则可知两相的量之比也已确定。因此,在一定的实验装置中,全回流的加热溶液,在总组成、总量不变时,当气相的量与液相的量之比也不变时(达气-液平衡),则体系的温度也就恒定。分别取出气、液两相的样品,分析其组成,得到该温度下,气、液两相平衡时各相的组成。改变溶液总组成,得到另一温度下,气、液两相平衡时各相的组成。测得溶液若干总组成下的气液平衡温度及气、液相组成,分别将气相点用线连接即为气相线,将液相点用线连接即为液相线,得到沸点-组成图。 气相、液相的成份分析采用折光率法:先绘出折光率~组成(n~x)的等温线,方法是在定温下测定已知各种组成(x)的折光率(n),绘出n~x等温线。对于未知组成的样品,取出各相样品后,迅速测出该温度下的折光率(n),便可以从n~x线查出其相应组成。 3 仪器与试剂 恒温槽 恒沸点仪 折光仪 镜头纸 加热电源 电热丝 导线(带夹子) 橡皮塞 温度计(0.1,50~100℃)放大镜 量筒(30ml)洗耳球 吸管 环己烷(A.R.)无水乙醇(A.R.)
实验四环己烷-乙醇双液系相图 一.实验目的 1.绘制在p下环已烷-乙醇双液系的气----液平衡图,了解相图和相率的基本概念。 2.掌握测定双组分液系的沸点的方法,找出恒沸点混合物的组成和最低恒沸点。 3.掌握用折光率确定二元液体组成的方法。 4.掌握阿贝折射仪的测量原理及使用方法。 二.实验原理 液体的沸点是指液体的饱和蒸汽压和外压相等时的温度。在一定外压下,纯液体的沸点有确定的值。但对于完全互溶的双液系,沸点不仅与外压有关,而且还与双液系的组成有关。 常温下,两种液态物质以任意比例相互溶解所组成的体系称为完全互溶双液系。在恒定压力下,表示溶液沸点与组成关系的相图称为沸点—组成图,即为T-x相图。完全互溶双液系的T-x图可分为三类: (1)理想双液系,溶液沸点介于两纯物质沸点之间如图(a); (2)各组分对拉乌尔定律发生正偏差,溶液具有最低恒沸点(图中最低点)如图(b); (3)各组分对拉乌尔定律发生负偏差,溶液具有最高恒沸点(图中最高点)如图(c);
绘制双液系的T-x图时,需要同时测定气液平衡时溶液的沸点及气相组成、液相组成数据。例如图(a)中,与沸点t 1 对应的气相组成 是气相线上g 1点对应的,液相组成是液相线上lgBx 1 点对应的。实验测 定整个浓度范围内不同组成溶液的气液相平衡组成和沸点后,即可绘出T-x图。 本实验采用回流冷凝的方法绘制环己烷-乙醇体系的T-x图。其方法是用Abbe折射仪测定不同组分的体系在沸点时气液两相的折光率。在折光率-组成图(标准曲线)找出未知浓度溶液的折光率,就可从曲线上查出相对应的组成 三.仪器试剂 沸点仪1套;超级恒温水浴1台;阿贝折光仪1台;移液管2支;滴管2支 环己烷(A.R.);无水乙醇(A.R.) 沸点仪
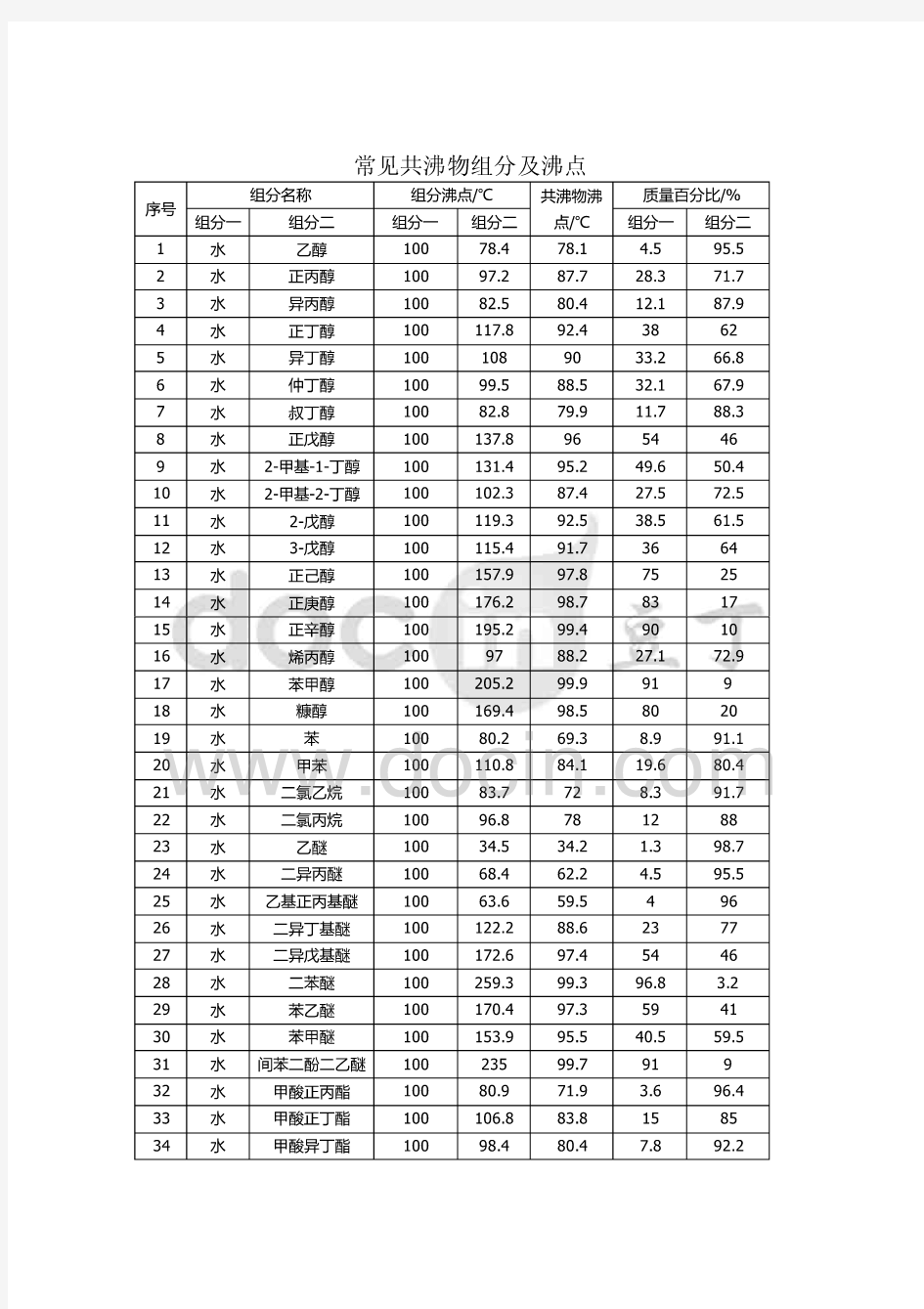
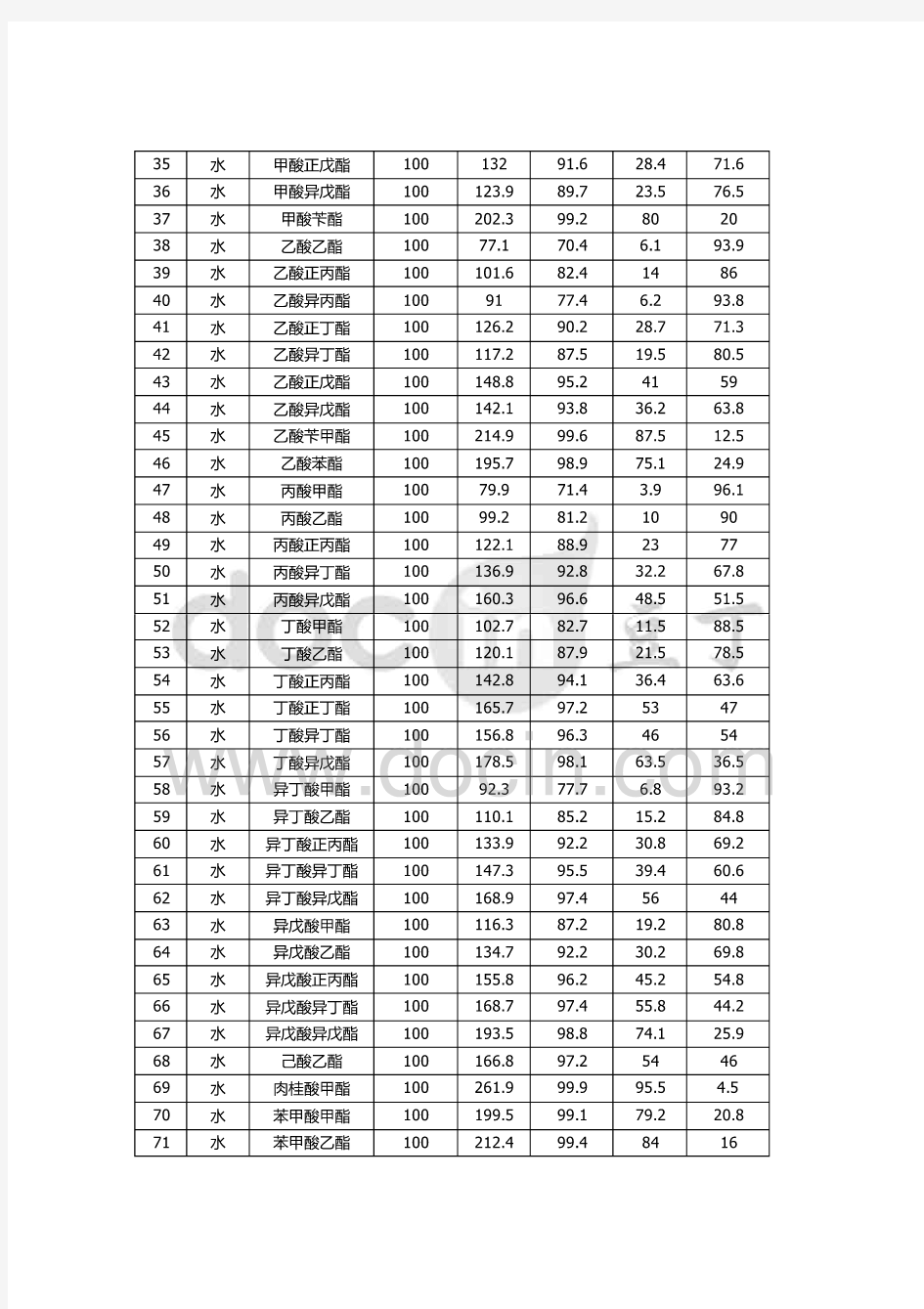
常见的共沸物
又称恒沸物,是指两组分或多组分的液体混合物,在恒定压力下沸腾时,其组分与沸点均保持不变。这实际是表明,此时沸腾产生的蒸汽与液体本身有着完全相
同的组成。共沸物是不可能通过常规的蒸馏或分馏手段加以分离的。并非所有的二元液体混合物都可形成恒沸物,一些例子列在了下面。这类混合物的温度-组分相图有着显著的特征,即,其气相线(气液混合物和气态的交界)与液相线(液态和气液混合物的交界)有着共同的最高点或最低点。如此点为最高点,则称为正恒沸物;如此点为最低点,则称为负恒沸物。大多数恒沸物都是负恒沸物,即有最低沸点。 非均相共沸精馏分离叔丁醇和水的方法 专利号:20XX10016030 本发明公开了一种非均相共沸精馏分离叔丁醇和水方法。采用包括精馏塔的精馏装置,非均相共沸精馏分离叔丁醇和水,其过程,常压下将叔丁醇与水的恒沸物或混合物,按恒沸物或混合物与共沸剂环已烷的质量比为0.3~1.5,加入精馏塔的塔釜中,在塔釜为60-80℃进行全回流,全回流结束后,采出分相器中富集的水,当塔顶在64~83℃,塔釜在70~87℃,以回流比为1~5,采出三元共沸物收集在分相器中,分相器上层的环己烷和叔丁醇有机相采出备用。再以回流比1-4,在塔顶62-82℃下由塔顶采出环己烷-水及少量环己烷-叔丁醇的混合物后,在塔釜82-88℃,塔顶82-83℃下从塔顶得到纯度为98.2wt%的叔丁醇产品。本发明的优点是,共沸剂的用量少,叔丁醇的一次收率高。 乙醇沸点78.3乙醇与水二元共沸沸点78.1二元共沸组成:水4.4%,乙醇95.5%要想精馏得到无水乙醇需加人苯,三元共沸。 ?【PDF下载】化学滴定分析用标准溶液的制备(国标)15种常用有机溶剂的纯化?
常见的共沸混合物的组成及共沸点 共沸物,又称恒沸物,是指两组分或多组分的液体混合物,在恒定压力下沸腾时,其组分与沸点均保持不变。这实际是表明,此时沸腾产生的蒸汽与液体本身有着完全相同的组成。共沸物是不可能通过常规的蒸馏或分馏手段加以分离的。并非所有的二元液体混合物都可形成共沸物,科学堂在下列表格列出了一些常用的共沸物组成及其共沸点。这类混合物的温度-组分相图有着显著的特征,即,其气相线(气液混合物和气态的交界)与液相线(液态和气液混合物的交界)有着共同的最高点或最低点。如此点为最高点,则称为正共沸物;如此点为最低点,则称为负共沸物。大多数共沸物都是负共沸物,即有最低沸点。值得注意的是:任一共沸物都是针对某一特定外压而言。对于不同压力,其共沸组分和沸点都将有所不同;实践证明,沸点相差大于30K的两个组分很难形成共(恒)沸物(如水与丙酮就不会形成共沸物)。 (a)与水形成的二元共沸物(水沸点100℃) 溶剂沸点/℃共沸点/℃含水量/%溶剂沸点/℃共沸点/℃含水量/%氯仿61.256.1 2.5甲苯110.585.020 四氯化碳77.066.0 4.0正丙醇97.287.728.8苯80.469.28.8异丁醇108.489.988.2丙稀腈78.070.013.0二甲苯137-40.592.037.5二氯乙烷83.772.019.5正丁醇117.792.237.5乙睛82.076.016.0吡啶115.594.042乙醇78.378.1 4.4异戊醇131.095.149.6乙酸乙酯77.170.48.0正戊醇138.395.444.7异丙醇82.480.412.1氯乙醇129.097.859.0乙醚3534 1.0二硫化碳4644 2.0甲酸10110726 (b)常见有机溶剂间的共沸混合物 共沸混合物组分的沸点/℃共沸物的组成(质量)/%共沸物的沸点/℃乙醇-乙酸乙酯78.3,78.030:7072.0乙醇-苯78.3,80.632:6868.2 乙醇-氯仿78.3,61.27:9359.4乙醇-四氯化碳78.3,77.016:8464.9乙酸乙酯-四氯化碳78.0,77.043:5775.0甲醇-四氯化碳64.7,77.021:7955.7甲醇-苯64.7,80.439:6148.3 氯仿-丙酮61.2,56.480:2064.7 甲苯-乙酸101.5,118.572:28105.4 乙醇-苯-水78.3,80.6,10019:74:764.9
二组分溶液沸点一组成图的绘制 一内容提要 本实验采用回流冷凝法测定不同浓度的环己烷-乙醇溶液的沸点和气液两相的平衡浓度,绘制沸点—组成图,并从图上确定体系的最低恒沸物及其相应的组成。 二目的要求 1.掌握沸点一组成图的绘制方法。 2.掌握阿贝折光仪及超级恒温槽的使用方法。 三实验关键 1.在测定工作曲线步骤中,配制液体时要求使用移液管准确移液,从而保证绘制工作曲线的准确性。每种浓度样品其沸腾状态应尽量一致,即以气泡“连续”、“均匀”冒出为好,不要过于激烈也不要过于缓慢。 2.由于液体的折射率受温度影响很大,折射仪采和用温槽恒温,恒温水在回路中要保持循环畅通。用阿贝折光仪测液体折射率时,用滴管滴数滴液体于棱镜上,待整个镜面浸润后再进行观察。 3.蒸馏瓶中电热丝一定要被溶液浸没后方能通电加热,否则电热丝易烧断或燃烧着火。四预备知识 1.杠杆原则.当组成以物质的量分数(x)表示时,两相的物质的量反比于系统点的两个相点线段的长度。 2.在恒定压力下,实验测定一系列不同组成液体的沸腾温度及平衡时气液两相的组成,即可绘出该压力下的温度-组成图。最大正偏差系统的温度-组成图上出现最低点,在此点气相线和液相线相切,由于对应于此点组成的液相在指定压力下沸腾时产生气相与液相组成相同,故沸腾时温度恒定,且这一温度又是液态混合物的最低温度,故称之为最低恒沸点,与此类似,最大负偏差系统的温度—组成图上出现最高点,即为最高恒沸点。恒沸混合的组成取决于压力,压力一定,恒沸混合物的组成一定;压力改变,恒沸混合物的组成改变,甚至恒沸点可以消失,这证明恒沸混合物不是一种化合物。 五实验原理 在恒压下完全互溶的二组分溶液体系的沸点一组成图可分三类: 1.理想的二组分溶液,其沸点介于两组分沸点之间,如苯-甲醇体系。 2.对拉乌尔定律发生负偏差的溶液,其溶液有最高恒沸点,如丙酮—氯仿、硝酸—水体系。 3.对拉乌尔定律发生正偏差的溶液,其溶液有最低恒沸点,如苯—乙醇、乙醇—水体系。 了解二组分溶液的沸点—组成图,对两组分的分离——精馏有指导意义。 本实验采用回流冷凝法测定不同浓度的环已烷——乙醇溶液的沸点和气、液两相的组成,从而绘制T-x图。 它们表明了沸点和气、液两相组成的关系,当体系总组成x的溶液开始沸腾时,气相组成为y,继续蒸馏,则气相量增加,液相量相应减少(体系总量不变),溶液温度上升,由于回流的作用,控制了两相的量为一定,其沸点也为一定,此时气相组成为y′,与其平衡的液相组成为x′,系统的平衡沸点为t 沸,此时气液两相的量服从杠杆原理。 压力一定时,对两相共存区进行相律分析:组分K=2,相数 =2,所以自由度F=K+1-=2+1-2=1,就是说,若系统温度一定,气、液两相成分就已确定,当总量一定时由杠杆原理可知,两相的量也一定:反过来,在一定实验装置中,利用回流的方法,控制气液两相的相对量一定,使系统的温度一定,则气、液组成一定。 用精密温度计可以测出平衡温度(即沸点),取出该温度下的气液两相样品,用折射率测定可以求出其组成。因为折射率与组成有一一对应的函数关系。这可以通过测定一系列已知组成的样品的折射率,绘出工作曲线即折射率-组成图表示出来。这样,只要测定出未知样品的折射率就可以从图上找到未知样品的组成。 折射率是用阿贝折光仪测得,仪器的原理、构造及使用方法见附录“阿贝折光仪”。 本实验的工作就是测出溶液的沸点和气液相的折射率。
二组分系统气液平衡相图的绘制 一实验目的 1.确定不同组成的环己烷——乙醇溶液的沸点及气、液两相的平衡浓度,由此绘制其沸点组成图。 2.掌握阿贝折射仪的原理及使用方法。 二实验原理 本实验用回流冷凝法测定不同浓度的环己烷——乙醇溶液的沸点和气、液两相的组成,从而绘制T----x图。 下图为环己烷——乙醇的沸点组成图的大致形状,ADC和BEC为气相线,AD′C和BE′C 为液相线。体系总组成为x的溶液开始沸腾时,气象组成为y ,继续蒸馏,气相量增加,液相量减少(总量不变),溶液温度上升,回流作用,控制了两相的量一定,沸点一定。此时,气相组成为y′,与其平衡的液相组成为x′,体系的平衡沸点为t沸,此时气液两相服从杠杆原理。 当压力一定时,对两相共存区进行相律分析:独立组分K=2,相数P=2,则自由度f=K-P+1=2-2+1=1 即有,体系温度一定,则气液两相成分确定。总量一定时,亮相的量也一定。在一实验装置中,控制气液两相的相对量一定,使体系温度一定, 则气液组成一定。 用精密温度计可以测出平衡温度,取出气液两相样品 测定其折射率可以求出其组成。折射率和组成有一一对应 关系,可以通过测定仪系列已知组成的样品折射率,绘出 工作曲线。测出样品就可以从工作曲线上找到未知样品的 组成。 三仪器与药品 仪器:阿贝折射仪、超级恒温槽、蒸馏瓶、调压 变压器、1/10℃刻度温度计、25ml移液管一支、5ml、 10ml移液管各两支、锥形瓶四个、滴管若干支 药品:环己烷、乙醇、丙酮 四实验步骤 1.工作曲线的测定 把超级恒温槽调至25℃,连接好恒温槽与阿贝折 射仪,使恒温水流经折射仪。 准确配制下列溶液,测定纯环己烷,乙醇和下列 溶液的折射率,并测定溶液温度。 环己烷 1 2 3 4ml 乙醇 4 3 2 1ml 2.测定环己烷的沸点 按图装好仪器,调压变压器调至最小,将25ml苯加入蒸馏瓶,打开冷凝水,接通电源,
液氨 -33.35℃特殊溶解性:能溶解碱金属和碱土金属剧毒性、腐蚀性 液态二氧化硫溶解胺、醚、醇苯酚、有机酸、芳香烃、溴、二硫化碳,多数饱和烃不溶剧毒 甲胺是多数有机物和无机物的优良溶剂,液态甲胺与水、醚、苯、丙酮、低级醇混溶,其盐酸盐易溶于水,不溶于醇、醚、酮、氯仿、乙酸乙酯中等毒性,易燃 二甲胺是有机物和无机物的优良溶剂,溶于水、低级醇、醚、低极性溶剂强烈刺激性 石油醚不溶于水,与丙酮、乙醚、乙酸乙酯、苯、氯仿及甲醇以上高级醇混溶与低级烷相似 乙醚微溶于水,易溶与盐酸.与醇、醚、石油醚、苯、氯仿等多数有机溶剂混溶麻醉性 戊烷与乙醇、乙醚等多数有机溶剂混溶低毒性 二氯甲烷与醇、醚、氯仿、苯、二硫化碳等有机溶剂混溶低毒,麻醉性强 二硫化碳微溶与水,与多种有机溶剂混溶麻醉性,强刺激性 溶剂石油脑与乙醇、丙酮、戊醇混溶较其他石油系溶剂大 丙酮与水、醇、醚、烃混溶低毒,类乙醇,但较大 1,1-二氯乙烷与醇、醚等大多数有机溶剂混溶低毒、局部刺激性 氯仿与乙醇、乙醚、石油醚、卤代烃、四氯化碳、二硫化碳等混溶中等毒性,强麻醉性 甲醇与水、乙醚、醇、酯、卤代烃、苯、酮混溶中等毒性,麻醉性, 四氢呋喃 66 优良溶剂,与水混溶,很好的溶解乙醇、乙醚、脂肪烃、芳香烃、氯化烃吸入微毒,经口低毒 己烷甲醇部分溶解,比乙醇高的醇、醚丙酮、氯仿混溶低毒。麻醉性,刺激性 三氟代乙酸与水,乙醇,乙醚,丙酮,苯,四氯化碳,己烷混溶,溶解多种脂肪族,芳香族化合物 1,1,1-三氯乙烷与丙酮、、甲醇、乙醚、苯、四氯化碳等有机溶剂混溶低毒类溶剂 四氯化碳与醇、醚、石油醚、石油脑、冰醋酸、二硫化碳、氯代烃混溶氯代甲烷中,毒性最强 乙酸乙酯与醇、醚、氯仿、丙酮、苯等大多数有机溶剂溶解,能溶解某些金属盐低毒,麻醉性 乙醇与水、乙醚、氯仿、酯、烃类衍生物等有机溶剂混溶微毒类,麻醉性 丁酮与丙酮相似,与醇、醚、苯等大多数有机溶剂混溶低毒,毒性强于丙酮苯难溶于水,与甘油、乙二醇、乙醇、氯仿、乙醚、、四氯化碳、二硫化碳、丙酮、甲苯、二甲苯、冰醋酸、脂肪烃等大多有机物混溶强烈毒性 环己烷与乙醇、高级醇、醚、丙酮、烃、氯代烃、高级脂肪酸、胺类混溶低毒,中枢抑制作用 乙睛与水、甲醇、乙酸甲酯、乙酸乙酯、丙酮、醚、氯仿、四氯化碳、氯乙烯及各种不饱和烃混溶,但是不与饱和烃混溶中等毒性,大量吸入蒸气,引起急性中毒
实验报告纸 x乙醇0 0.1 0.2 0.3 0.4 0.5 折射率n 1.4232 1.4147 1.4085 1.402 1.3952 1.3882 x乙醇0.5 0.6 0.7 0.8 0.9 1 折射率n 1.3882 1.3850 1.3791 1.3700 1.3624 1.3585 表4-1 实验数据记录表 室温:23.8℃气压:汞柱759.4mm=103278.4Pa 在20ml乙醇中加入环己烷 气相液相沸点(℃) 折射率n x乙醇折射率n x乙醇T沸点ΔT T正常 0.5 1.3606 0.9558 1.3600 0.9640 76.89 -0.1482 76.74 1 1.3750 0.7308 1.3619 0.9358 74.89 -0.1444 74.75 2 1.3860 0.5574 1.3660 0.8779 71.16 -0.1372 71.02 3 1.3927 0.4538 1.3711 0.7919 68.05 -0.1312 67.92 4 1.3940 0.4347 1.3770 0.6964 66.29 -0.1278 66.16 5 1.3940 0.4317 1.3830 0.6009 65.33 -0.1259 65.20 注:乙醇的沸点77.83℃ 表4-2 实验数据记录表 室温:23.8℃气压:汞柱759.4mm=103278.4Pa 在20ml环己烷中加入乙醇 气相液相沸点(℃) 折射率n x乙醇折射率n x乙醇T沸点ΔT T正常 0.5 1.4092 0.1956 1.4209 0.0125 71.61 -0.1380 71.47 1 1.4038 0.2801 1.4174 0.0673 65.83 -0.1269 65.70 2 1.4020 0.308 3 1.4099 0.1847 64.67 -0.1246 64.55 3 1.4011 0.322 4 1.4036 0.2833 64.59 -0.124 5 64.47 4 1.3996 0.3459 1.3956 0.408 5 64.65 -0.124 6 64.53 5 1.3982 0.3678 1.3888 0.5149 64.88 -0.1251 64.75 注:环己烷的沸点80.25℃ΔT=T沸(101325-P)/(101325*10);T正常=T沸+ΔT
液氨-33.35℃特殊溶解性:能溶解碱金属和碱土金属剧毒性、腐蚀性 液态二氧化硫-10.08 溶解胺、醚、醇苯酚、有机酸、芳香烃、溴、二硫化碳,多数饱和烃不溶剧毒 甲胺-6.3 是多数有机物和无机物的优良溶剂,液态甲胺与水、醚、苯、丙酮、低级醇混溶,其盐酸盐易溶于水,不溶于醇、醚、酮、氯仿、乙酸乙酯中等毒性,易燃 二甲胺7.4 是有机物和无机物的优良溶剂,溶于水、低级醇、醚、低极性溶剂强烈刺激性石油醚不溶于水,与丙酮、乙醚、乙酸乙酯、苯、氯仿及甲醇以上高级醇混溶与低级烷相似 乙醚34.6 微溶于水,易溶与盐酸.与醇、醚、石油醚、苯、氯仿等多数有机溶剂混溶麻醉性戊烷36.1 与乙醇、乙醚等多数有机溶剂混溶低毒性 二氯甲烷39.75 与醇、醚、氯仿、苯、二硫化碳等有机溶剂混溶低毒,麻醉性强 二硫化碳46.23 微溶与水,与多种有机溶剂混溶麻醉性,强刺激性 溶剂石油脑与乙醇、丙酮、戊醇混溶较其他石油系溶剂大 丙酮56.12 与水、醇、醚、烃混溶低毒,类乙醇,但较大 1,1-二氯乙烷57.28 与醇、醚等大多数有机溶剂混溶低毒、局部刺激性 氯仿61.15 与乙醇、乙醚、石油醚、卤代烃、四氯化碳、二硫化碳等混溶中等毒性,强麻醉性 甲醇64.5 与水、乙醚、醇、酯、卤代烃、苯、酮混溶中等毒性,麻醉性, 四氢呋喃66 优良溶剂,与水混溶,很好的溶解乙醇、乙醚、脂肪烃、芳香烃、氯化烃吸入微毒,经口低毒 己烷68.7 甲醇部分溶解,比乙醇高的醇、醚丙酮、氯仿混溶低毒。麻醉性,刺激性 三氟代乙酸71.78 与水,乙醇,乙醚,丙酮,苯,四氯化碳,己烷混溶,溶解多种脂肪族,芳香族化合物 1,1,1-三氯乙烷74.0 与丙酮、、甲醇、乙醚、苯、四氯化碳等有机溶剂混溶低毒类溶剂四氯化碳76.75 与醇、醚、石油醚、石油脑、冰醋酸、二硫化碳、氯代烃混溶氯代甲烷中,毒性最强 乙酸乙酯77.112 与醇、醚、氯仿、丙酮、苯等大多数有机溶剂溶解,能溶解某些金属盐低毒,麻醉性 乙醇78.3 与水、乙醚、氯仿、酯、烃类衍生物等有机溶剂混溶微毒类,麻醉性 丁酮79.64 与丙酮相似,与醇、醚、苯等大多数有机溶剂混溶低毒,毒性强于丙酮 苯80.10 难溶于水,与甘油、乙二醇、乙醇、氯仿、乙醚、、四氯化碳、二硫化碳、丙酮、甲苯、二甲苯、冰醋酸、脂肪烃等大多有机物混溶强烈毒性 环己烷80.72 与乙醇、高级醇、醚、丙酮、烃、氯代烃、高级脂肪酸、胺类混溶低毒,中枢抑制作用 乙睛81.60 与水、甲醇、乙酸甲酯、乙酸乙酯、丙酮、醚、氯仿、四氯化碳、氯乙烯及各种不饱和烃混溶,但是不与饱和烃混溶中等毒性,大量吸入蒸气,引起急性中毒 异丙醇82.40 与乙醇、乙醚、氯仿、水混溶微毒,类似乙醇 1,2-二氯乙烷83.48 与乙醇、乙醚、氯仿、四氯化碳等多种有机溶剂混溶高毒性、致癌乙二醇二甲醚85.2 溶于水,与醇、醚、酮、酯、烃、氯代烃等多种有机溶剂混溶。能溶解各种树脂,还是二氧化硫、氯代甲烷、乙烯等气体的优良溶剂吸入和经口低毒 三氯乙烯87.19 不溶于水,与乙醇.乙醚、丙酮、苯、乙酸乙酯、脂肪族氯代烃、汽油混溶有机有毒品 三乙胺89.6 水:18.7以下混溶,以上微溶。易溶于氯仿、丙酮,溶于乙醇、乙醚易爆,皮肤黏膜刺激性强