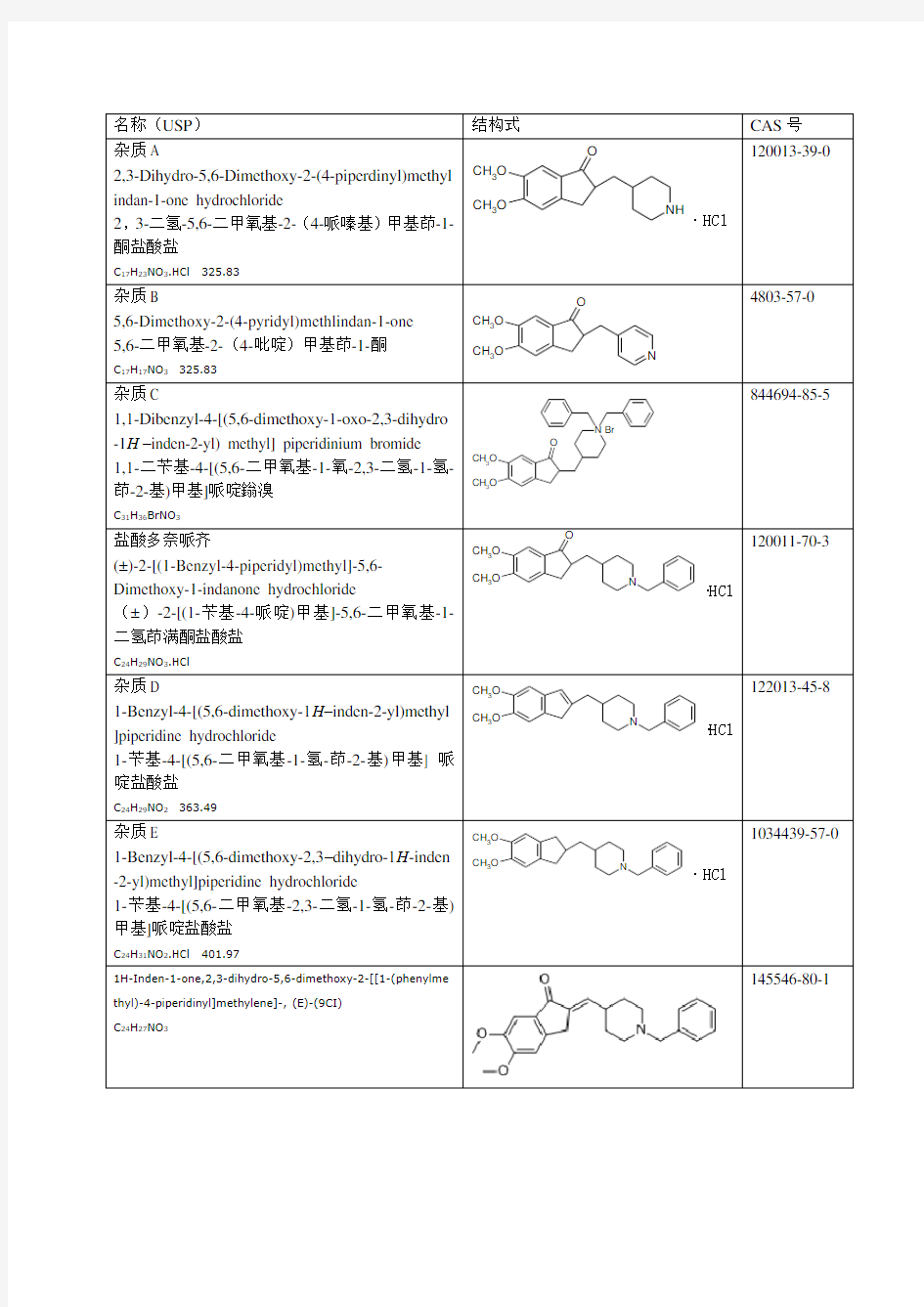
名称(USP)结构式CAS号
杂质A
2,3-Dihydro-5,6-Dimethoxy-2-(4-piperdinyl)methyl indan-1-one hydrochloride
2,3-二氢-5,6-二甲氧基-2-(4-哌嗪基)甲基茚-1-酮盐酸盐
C17H23NO3.HCl 325.83
O
CH
3
O
CH
3
O NH
·HCl
120013-39-0
杂质B
5,6-Dimethoxy-2-(4-pyridyl)methlindan-1-one 5,6-二甲氧基-2-(4-吡啶)甲基茚-1-酮
C17H17NO3325.83
O
CH
3
O
CH
3
O N
4803-57-0
杂质C
1,1-Dibenzyl-4-[(5,6-dimethoxy-1-oxo-2,3-dihydro -1H–inden-2-yl) methyl] piperidinium bromide
1,1-二苄基-4-[(5,6-二甲氧基-1-氧-2,3-二氢-1-氢-茚-2-基)甲基]哌啶鎓溴
C31H36BrNO3CH
3
O
CH
3
O
O
N Br
844694-85-5
盐酸多奈哌齐
(±)-2-[(1-Benzyl-4-piperidyl)methyl]-5,6- Dimethoxy-1-indanone hydrochloride
(±)-2-[(1-苄基-4-哌啶)甲基]-5,6-二甲氧基-1-二氢茚满酮盐酸盐
C24H29NO3.HCl
O
CH
3
O
CH
3
O N
·HCl
120011-70-3
杂质D
1-Benzyl-4-[(5,6-dimethoxy-1H–inden-2-yl)methyl ]piperidine hydrochloride
1-苄基-4-[(5,6-二甲氧基-1-氢-茚-2-基)甲基] 哌啶盐酸盐
C24H29NO2363.49CH
3
O
CH
3
O N
·HCl
122013-45-8
杂质E
1-Benzyl-4-[(5,6-dimethoxy-2,3–dihydro-1H-inden -2-yl)methyl]piperidine hydrochloride
1-苄基-4-[(5,6-二甲氧基-2,3-二氢-1-氢-茚-2-基)甲基]哌啶盐酸盐
C24H31NO2.HCl 401.97CH
3
O
CH
3
O N
·HCl
1034439-57-0
1H-Inden-1-one,2,3-dihydro-5,6-dimethoxy-2-[[1-(phenylme
thyl)-4-piperidinyl]methylene]-, (E)-(9CI)
C24H27NO3
145546-80-1
安理申薄膜衣片Aricept 制造商卫材英国Boots公司 性状多奈哌齐的化学名称为(±)-2,3-双羟基-5,6-双甲氧基-2-{[1-(苯甲基)-4-呱啶基]甲基}-1H-茚-1-酮盐酸盐。分子式为C24H29NO3Cl。分子量为415.96。本药的无活性成分有单水乳糖、玉米淀粉、微晶纤维素、羟丙基纤维素和硬酯酸镁。 药理作用药效学盐酸多奈哌齐为特异的可逆性乙酰胆碱酯酶抑制剂,此酶主要存在于脑部。盐酸多奈哌齐在活体外实验对乙酰胆碱酯酶的抑制作用比对丁酰胆碱酯酶的抑制作用强1252倍,后者主要存在于中枢神经系统以外。临床试验中,阿尔茨海默型痴呆病人一日一次口服本药5 mg或10 mg ,服药后稳态时乙酰胆碱酶活性测定(红细胞膜)分别被抑制63.6%和77.3%。盐酸多奈哌齐抑制红细胞乙酰胆碱酯酶活性(AChE)的作用与其ADAS-cog 量表的变化有关,这个量表是一个检查认知功能某些方面的敏感量表。尚没有对盐酸多奈哌齐改变疾病的原发神经病理过程的潜力进行过研究。临床前安全资料:广泛的动物试验表明,该药除了有胆碱能神经兴奋的药理作用以外,其它作用很少。在细菌Ames回复突变实验或小鼠体外淋巴瘤正向突变实验中,未发现盐酸多奈哌齐有致畸作用。体外实验中观察到药物有某些致畸作用,但仅在对细胞有明显毒性的浓度,及在临床试验病人稳态浓度3000倍以上的浓度时才有此作用。在小鼠体内微核模型中,盐酸多奈哌齐无致畸作用。在对大鼠和家兔的长期致癌研究中,没有证据表明有致癌的可能。盐酸多奈哌齐对大鼠生殖功能无影响,在大鼠和家兔中无致畸性,但当给妊娠大鼠50倍人用剂量时,对死胎和仔鼠的早期存活有轻微影响。 药代动力学药动学吸收:口服本药后3-4小时达血浆峰浓度,血浆浓度和药时曲线下面积与剂量成正比。消除半衰期约70小时,所以,多次每日单剂量给药将缓慢达到稳态。治疗开始后3周内达稳态,稳态后,血浆盐酸多奈哌齐浓度和相应的药效学活性在一日中变化很小。饮食对盐酸多奈哌齐的吸收无影响。分布:约95%的盐酸多奈哌齐与人血浆蛋白结合。有活性的代谢产物6-O-desmethyl donepezil的血浆蛋白结合情况尚不清楚。盐酸多奈哌齐在不同组织中的分布尚未明确研究。但是,在健康成年男性志愿者做的放射性质量平衡研究中,给予单剂14C-标记的盐酸多奈哌齐240小时后,仍有28%的标记物未被回收,表明盐酸多奈哌齐和(或)其代谢物在体内存在10天以上。代谢/排泄:盐酸多奈哌齐以原型由尿排泄,或由细胞色素P450系统代谢为多种代谢产物,其中某些尚未确定。服用单剂14C-标记的盐酸多奈哌齐5 mg后,血浆放射性(以服用剂量的百分比表示),主要为盐酸多奈哌齐原型(30%),6-O-desmethyl donepezil(11%,唯一具有盐酸多奈哌齐相似活性的代谢物),denepezil-cis-N-oxide(9%),5-O-desmethyl donepezil(7%)和5-O-desmethyl donepezi的葡萄糖醛酸结合物(3%)。约见57%的总放射物从尿中回收(有17%是没有转化的多奈哌齐),14.5%从粪便中回收,提示生物转化和尿排泄为消除的主要途径。尚无证据表明盐酸多奈哌齐和(或)其代谢产物有肝肠循环。血浆中多奈哌齐浓度以半衰期70小时下降。性别、种族和吸烟史对血浆盐酸多奈哌齐浓度的影响在临床上无显著差异。多奈哌齐的药代动力学还没有在健康的老年人或阿尔茨海默病病人中进行过正式的研究,但是,病人的平均血浆浓度与年轻的健康志愿者的数值相近。 适应症轻度或中度阿尔茨海默型痴呆症状的治疗。
盐酸多奈哌齐在老年痴呆治疗中的应用 摘要:目的:在老年痴呆治疗中应用盐酸多奈哌齐,并分析其应用价值。方法:选取2016年1月-2018年1月,到我院进行治疗的96例老年痴呆患者,将患者 分为两组。对照组48例,采取常规药物对症治疗;观察组48例,在常规治疗基 础上,使用盐酸多奈哌齐治疗。结果:治疗后,观察组患者的ADL评分、MMSE 评分均明显优于对照组(P<0.05);观察组治疗总有效率为93.75%,对照组为77.08%,差异明显(P<0.05)。结论:在老年痴呆治疗中应用盐酸多奈哌齐,能 够提升治疗效果,改善患者精神状态,提高患者日常生活能力,具有较高的临床 应用价值。 关键词:盐酸多奈哌齐;老年痴呆;治疗效果 老年痴呆是一种常见的中枢神经系统退行性病变,大量研究证实,该病主要与大脑皮质、海马等枢神经系统功能退化有关。患者发病后,主要表现为记忆功能、认知功能、语言功能 障碍,严重降低患者的生活自理能力。随着老龄人口数量的增加,老年痴呆的发病率也明显 上升,已经成为威胁老年人身体健康的常见疾病。据相关调查显示[1],老年痴呆患者的平均 生存期为5.9年。盐酸多奈哌齐是一种新型碱酯酶抑制剂,对乙酰胆碱酯酶具有较强的亲和力。本文将在老年痴呆治疗中应用盐酸多奈哌齐,并分析其应用价值,现报道如下。 1.资料与方法 1.1一般资料 选取2016年1月-2018年1月,到我院进行治疗的96例老年痴呆患者,所有患者均已 经过明确诊断,自愿参与本次研究。排除标准:(1)合并严重肝肾疾病、恶性肿瘤患者;(2)本次研究使用药物过敏患者;(3)存在自身免疫系统疾病患者;(4)存在其他精神 疾病患者等。采取随机综合序贯法,将患者分为两组。观察组48例,男性31例,女性17 例,年龄60~88岁,平均年龄(72.36±4.95)岁,病程3~12年,平均病程(7.17±2.08)年。 对照组48例,男性30例,女性18例,年龄61~87岁,平均年龄(71.73±4.86)岁,病程 2~11年,平均病程(7.24±2.12)年。两组患者上述基础资料具有可比性(P>0.05)。 1.2方法 所有患者均采取常规药物对症治疗,根据患者情况,使用降压药物、降脂药物、钙拮抗剂、抗血小板药等。观察组患者在常规治疗基础上,使用盐酸多奈哌齐(天津力生制药股份 有限公司,国药准字H20040745)治疗,5mg/次,1次/d,睡前口服给药,持续治疗1个月。治疗过程中,应停止使用血管扩张药以及脑功能改善药。根据患者的病情变化,可调整给药 剂量,单日最大剂量不超过10mg。 1.3评价标准 使用ADL量表、MMSE量表评价两组患者治疗前后的日常生活能力、精神状态[2],其中,ADL总分100分,分为生活基本自理(60~100分)、中度残疾(41~60分)、重度残疾 (21~40分)、完全残疾(≤20分)几个等级。MMSE总分30分,包括时间及地点定向力、 注意力、计算力、即刻记忆等共7个方面,分数越高,表明患者老年痴呆症状越轻。根据MMSE变化情况,评价患者的治疗效果,显效:MMSE评分改善≥20%;有效:MMSE评分改 善12%~20%;无效:MMSE评分改善<12%;前两者合计为总有效率。 1.4统计学方法 采取SPSS21.0进行数据处理,计数资料以(%)表示,计量资料以(x±s)表示,行X2 或t检验;P<0.05表示差异,有统计学意义。 2.结果 2.1ADL评分及MMSE评分对比 治疗前,两组患者的ADL评分、MMSE评分无明显差异(P>0.05);治疗后,观察组患 者的上述评分均明显优于对照组(P<0.05);见表1。 表1两组患者治疗前后ADL评分及MMSE评分对比(n=48,x±s)
<711> DISSOLUTION 溶出度 (USP39-NF34 Page 540) General chapter Dissolution <711> is being harmonized with the corresponding texts of the European Pharmacopoeia and/or the Japanese Pharmacopoeia. These pharmacopeias have undertaken to not make any unilateral change to this harmonized chapter. 通则<711>溶出度与欧盟药典和日本药典中的相应部分相统一。这三部药典承诺不做单方面的修改。 Portions of the present general chapter text that are national USP text, and therefore not part of the harmonized text, are marked with symbols to specify this fact. 本章中的部分文字为本国USP内容,并没有与其他药典统一。此部分以()标注。 This test is provided to determine compliance with the dissolution requirements where stated in the individual monograph for dosage forms administered orally. In this general chapter, a dosage unit is defined as 1 tablet or 1 capsule or the amount specified. Of the types of apparatus designs described herein, use the one specified in the individual monograph. Where the label states that an article is enteric coated and a dissolution or disintegration test does not specifically state that it is to be applied to delayed-release articles and is included in the individual monograph, the procedure and interpretation given for Delayed-Release Dosage Forms are applied, unless otherwise specified in the individual monograph. 本测试用于检测药品口服制剂的溶出度是否符合各论中的规定。本章中,除另有规定外,单位制剂定义为1片或1粒胶囊。对于本章中所述多种仪器,使用各论中规定的种类。除各论中另有规定外,如果检品是肠溶衣片且各论中的溶出度或崩解时限检查项下没有特别指出适用迟释剂的,使用本章中适用于迟释剂的流程和解释。 FOR DOSAGE FORMS CONTAINING OR COATED WITH GELATIN涂有或包含明胶的剂型 If the dosage form containing gelatin does not meet the criteria in the appropriate Acceptance Table (see Interpretation, Immediate-Release Dosage Forms, Extended-Release Dosage Forms, or Delayed-Release Dosage Forms) because of evidence of the presence of cross-linking, the dissolution procedure should be repeated with the addition of enzymes to the medium, as described below, and the dissolution results should be evaluated starting at the first stage of the appropriate Acceptance Table. It is not necessary to continue testing through the last stage (up to 24 units) when criteria are not met during the first stage testing, and evidence of cross-linking is observed. 如果剂型中含有明胶,其不符合验收表中的标准(见判断,速释制剂,延释制剂,缓释制剂),因为存在明胶交联结合作用,它的溶解过程与外加的媒介酶是重复的,见下面的描述,并且溶解结果可以通过适当的验收表的开始的第一阶段标准进行评估。如果溶出结果不满足第一阶段的测试标准,那么就没有必要继续测试到最后阶段,并且也证明了明胶交联结合作用的存在。
盐酸多奈哌齐多晶型及制备方法 盐酸多奈哌齐Ⅰ晶型 制备方法: 1、将一克盐酸多奈哌齐溶于5毫升甲醇加。加入10毫升二异丙醚,在冰水浴中搅拌该混 合物,过滤所析出的结晶,在大气压下干燥,得到0.9克该化合物。 2、在加热下,将一克盐酸多奈哌齐溶于5毫升甲醇。冷却至室温后,加入10毫升二异丙 醚。继续在室温下家搅拌30分钟,然后过滤所析出的结晶,在大气压下干燥,得到0.9克该化合物。 3、再加热下,将一克盐酸多奈哌齐溶于5毫升甲醇。开始冷却溶液后,在15℃内温下开始 析出结晶。10分钟后,加入10毫升二异丙醚。继续在室温下搅拌1小时,然后过滤所析出的结晶,在大气压下干燥,得到0.9克该化合物。 4、在加热下,将5克盐酸多奈哌齐溶于25毫升甲醇,然后将该混合物在冰水浴中冷却。 过滤所析出的结晶,在大气压下干燥,得到4.6克该化合物。 5、将0.3克多奈哌齐溶于1.5毫升甲醇,在大气压下干燥,得到0.2克该化合物。 6、在加热下,将0.3克多奈哌齐溶于3毫升乙醇,然后加入3毫升二异丙醚和0.79毫升10% 的盐酸在甲醇中的混合物。过滤所析出的结晶,在大气压在干燥,得到0.2克该化合物。 7、在加热下,将10克多奈哌齐溶于100毫升乙醇。在搅拌下,向其中加入浓盐酸(3.1克) 与乙醇(28毫升)的混合物,然后加入150毫升二异丙醚。结晶析出后10秒钟过滤,在大气压下干燥,得到9.36克该化合物,收率85.4%,含水量为5.17%,熔点为225-226℃(分解)。 8、在加热下,将10克盐酸多奈哌齐溶于50毫升甲醇。在冰水浴中一边搅拌,一边加入600 毫升二乙醚。继续在相同条件在搅拌1小时,然后过滤结晶,在大气压下干燥,得到10.0克该化合物。 9、在加热下,盐酸多奈哌齐(20.26g,48.71mmol)溶于甲醇(100ml)和水(2.0ml)。降 温至15℃,在原溶液中加入悬浮于TBME(200ml)的Ⅰ晶种(0.51g,1.23mmol)。在10-15℃下搅拌该悬浮液15min,过滤得湿固体和母液(filtration)。湿固体用TBME洗涤得到新的湿固体和新的母液(Washing Ⅰ)。洗涤再重复4次(Washing2-5)。收集每一种湿固体的样品,在室温在保持21小时,40℃下真空干燥。得到结果
盐酸多奈哌齐治疗老年痴呆疗效观察 目的探讨盐酸多奈哌齐治疗老年痴呆的临床疗效。方法案例分析法。对本院近年来收治的60例老年痴呆患者按照老年性痴呆、血管性痴呆和混合痴呆进行分组,老年性痴呆组患者18例,血管性痴呆组患者22例,混合痴呆组患者20例。三组患者均在常规治疗基础上给予盐酸多奈哌齐治疗,1次/d、5mg/次,1个疗程为8w时间。分别在治疗前、治疗后对患者日常生活活动能力以及简易智能精神状态进行评价测量,对结果进行统计分析。结果治疗后患者简易智能精神状态:老年性痴呆患者组显著提升(P<0.05);血管性痴呆患者组无显著变化(P>0.05);混合痴呆组患者显著提升(P<0.05)。治疗后患者日常生活能力变化:老年性痴呆患者组下降(P<0.05);血管性痴呆及混合痴呆患者组无显著变化(P>0.05)。结论盐酸多奈哌齐对老年性痴呆患者及部分混合痴呆患者记忆认知能力具有一定改善效果,临床疗效较好,但对血管性痴呆患者无显著疗效,在治疗中应加以明确。 标签:盐酸多奈哌齐;老年痴呆;研究分析;临床研究 老年痴呆是一种起病较为隐秘的进行性发展精神疾病。此病症在临床中又称作是阿尔茨海默病。临床主要表现为失语、记忆障碍、失用、视空间技能损伤、人格行为改变及执行功能障碍。老年痴呆疾病病因目前尚不明确。在临床治疗中,65岁以前发病称之为老性痴呆,而在65岁以后发病则称之为是老年性痴呆。为了进一步探讨盐酸多奈哌齐治疗老年痴呆的临床疗效,现对本院2012年9月~2013年12月收治的60例老年痴呆患者临床资料进行回顾性分析,且总结如下。 1 资料与方法 1.1 一般资料选取本院2012年1月~2014年1月收治的60例老年痴呆患者临床资料(男44例,女16例)。患者年龄67~92岁,平均81岁。所有60例患者均经过一般体检、病史分析、精神询问等,且进行脑CT检查、脑电图等进行检查,确诊为老年痴呆。全部患者均排除老年性抑郁症、良性老年遗忘以及急性脑外伤导致的痴呆。 1.2 方法按照老年性痴呆、血管性痴呆和混合痴呆进行分组,老年性痴呆组患者18例,血管性痴呆组患者22例,混合痴呆组患者20例。三组患者均在常规治疗基础上给予盐酸多奈哌齐治疗,1次/d、5mg/次,1个疗程为8w时间。 1.3 疗效评价分别在治疗前、治疗后对患者日常生活活动能力以及简易智能精神状态进行评价测量,对结果进行统计分析。 1.4 统计学方法采用SPSS13.0软件对数据结果进行统计分析,以P<0.05为差异具有统计学意义。 2 结果
美国药典(USP)规定的色谱柱编号 L1和L8是美国药典(USP)规定的色谱柱编号,其实就是ODS柱和NH2柱。下面是USP规定的编号所对应的色谱柱类型。 L1:十八烷基键合多孔硅胶或无机氧化物微粒固定相,简称ODS柱 L2:30~50m m表面多孔薄壳型键合十八烷基固定相,简称C18柱 L3:多孔硅胶微粒,即一般的硅胶柱 L4:30~50m m表面多孔薄壳型硅胶柱 L5:30~50m m表面多孔薄壳型氧化铝柱 L6:30~50m m实心微球表面包覆磺化碳氟聚合物,强阳离子交换柱 L7:全多孔硅胶微粒键合C8官能团固定相,简称C8柱 L8:全多孔硅胶微粒键合非交联NH2固定相,简称NH2柱 L9:强酸性阳离子交换基团键合全多孔不规则形硅胶固定相,即SCX柱 L10:多孔硅胶微球键合氰基固定相(CN),简称CN柱 L11:键合苯基多孔硅胶微球固定相,简称苯基柱 L12:无孔微球键合季胺功能团的强阴离子交换柱 L13:三乙基硅烷化学键合全多孔硅胶微球固定相(C1),简称C1柱 L14:10m m硅胶化学键合强碱性季铵盐阴离子交换固定相,简称SAX柱 L15:已基硅烷化学键合全多孔硅胶微球固定相,简称C6柱 L16:二甲基硅烷化学键合全多孔硅胶微粒固定相 C2柱 L17:氢型磺化交联苯乙烯-二乙烯基苯共聚物,强阳离子交换柱 L18:3~10m m全多孔硅胶化学键合胺基(NH2)和氰基(CN)柱 L19:钙型磺化交联苯乙烯-二乙烯基苯共聚物,强阳离子交换柱 L20:二羟基丙烷基化学键合多孔硅胶微球固定相(Diol),简称二醇基柱 L21:刚性苯乙烯-二乙烯基苯共聚物微球填料柱
盐酸多奈哌齐片 【药品名称】 通用名称:盐酸多奈哌齐片 英文名称:Donepezil Hydrochloride 【成份】 盐酸多奈哌齐。化学名称:(±)2,3-二氢-5,6-二甲氧基-2-{[(1-苯甲基)-4-哌啶基]甲基}-1H-茚-1-酮盐酸盐。 【适应症】 用于轻度或中度阿尔茨海默型痴呆症状的治疗。 【用法用量】 口服。初始用量每次5mg(1片),每日一次,睡前服用;并至少将初始剂量维持1个月以上,才可根据治疗效果增加剂量至每次10mg(2片),仍每日一次。最大推荐剂量为每日10mg。大于每日10mg的剂量未进行过临床研究。停止治疗后,盐酸多奈哌齐的疗效逐渐减退,中止治疗无反跳现象。对于肾功能不全及轻至中度肝功能不全者,盐酸多奈哌齐的消除不受影响,因此这些病人可使用相似剂量方案。或遵医嘱。 【不良反应】 常见不良反应包括:恶心、腹泻、失眠、呕吐、肌肉痉挛、乏力、倦怠与食欲减退,症状通常轻微且短暂,不必调整剂量,连续服药症状可缓解。较少见的不良反应包括头痛、头晕、精神紊乱(幻觉、易激惹、攻击行为),体重减轻,视力减退,胸痛,关节痛,抑郁,多梦,嗜睡,新的神经症状,皮疹,胃痛,胃肠功能紊乱,尿频或无规律。报道有极少的不良反应为昏厥、心动过缓或心律不齐,窦房传导阻滞、房室传导阻滞,心脏杂音,癫痫或黑便。【禁忌】
对盐酸多奈哌齐、哌啶衍生物或制剂中辅料有过敏反应者禁用。 【注意事项】 应当由一个在阿尔茨海默型痴呆的诊断和治疗方面有经验的医师开始并监督盐酸多奈哌齐的治疗。通过公认的标准(如DSMIV,ICD10)来诊断,只有当患者有可靠的照料者并且能够经常监控病人服用药物时才能开始多奈哌齐的治疗。治疗可以一直持续,只要对病人治疗的益处一直存在。因此,多奈哌齐的临床疗效应当定期被重新评估。当治疗的益处不再存在时,应当考虑终止治疗。每个病人对于多奈哌齐的反应是不能被预估的。对于那些严重的阿尔茨海默型痴呆病人,其他类型的痴呆或其他类型的记忆损伤(例如:与年龄相关的认知功能减退)病人应用盐酸多奈哌齐的效果还未全面观察。麻醉:盐酸多奈哌齐为胆碱酯酶抑制剂,麻醉时可能会增强琥珀酰胆碱型药物的肌肉松弛作用。心血管系统:胆碱酯酶抑制剂因其药理作用可对心率产生迷走样作用(如心动过缓),患有&ldquo;病窦综合征&rdquo;或其他室上性心脏传导疾病病人需尤其注意。曾有昏厥和癫痫发生的报道。需特别注意观察那些可能患有心脏传导阻滞或窦性停搏的病人。消化系统:对于患溃疡病危险性增大的病人,例如有溃疡病史或合用非甾体抗炎药物的(NSAIDS)病人应监测其症状。但在盐酸多奈哌齐的临床试验中,与安慰剂比,消化性溃疡或胃肠道出血的发病率未见增加。泌尿生殖系统:拟胆碱药物可引起膀胱排出受阻,但在盐酸多奈哌齐临床试验中未见此作用。神经系统:拟胆碱作用可能造成癫痫大发作。但癫痫也可能是阿尔茨海默病的表现之一。拟胆碱药有可能加重或诱发锥体外系症状。呼吸系统:因其拟胆碱作用,有哮喘史或阻塞性肺疾病史的病人应慎用。服用盐酸多奈哌齐时应避免合用其它乙酰胆碱酯酶抑制剂、胆碱能系统的激动剂或拮抗剂。目前几乎没有报道过服用盐酸多奈哌齐后出现包括肝炎的肝功能异常,但如果出现有肝功能异常,应考虑停药。如果用药的患者出现幻觉、易激惹和攻击行为等精神紊乱症状,应采取减量或停止治疗。对驾驶及操作机器能力的影响:阿尔茨海默型痴呆可能会影响驾驶
名称(USP)结构式CAS号 杂质A 2,3-Dihydro-5,6-Dimethoxy-2-(4-piperdinyl)methyl indan-1-one hydrochloride 2,3-二氢-5,6-二甲氧基-2-(4-哌嗪基)甲基茚-1-酮盐酸盐 C17H23NO3.HCl 325.83 O CH 3 O CH 3 O NH ·HCl 120013-39-0 杂质B 5,6-Dimethoxy-2-(4-pyridyl)methlindan-1-one 5,6-二甲氧基-2-(4-吡啶)甲基茚-1-酮 C17H17NO3325.83 O CH 3 O CH 3 O N 4803-57-0 杂质C 1,1-Dibenzyl-4-[(5,6-dimethoxy-1-oxo-2,3-dihydro -1H–inden-2-yl) methyl] piperidinium bromide 1,1-二苄基-4-[(5,6-二甲氧基-1-氧-2,3-二氢-1-氢-茚-2-基)甲基]哌啶鎓溴 C31H36BrNO3CH 3 O CH 3 O O N Br 844694-85-5 盐酸多奈哌齐 (±)-2-[(1-Benzyl-4-piperidyl)methyl]-5,6- Dimethoxy-1-indanone hydrochloride (±)-2-[(1-苄基-4-哌啶)甲基]-5,6-二甲氧基-1-二氢茚满酮盐酸盐 C24H29NO3.HCl O CH 3 O CH 3 O N ·HCl 120011-70-3 杂质D 1-Benzyl-4-[(5,6-dimethoxy-1H–inden-2-yl)methyl ]piperidine hydrochloride 1-苄基-4-[(5,6-二甲氧基-1-氢-茚-2-基)甲基] 哌啶盐酸盐 C24H29NO2363.49CH 3 O CH 3 O N ·HCl 122013-45-8 杂质E 1-Benzyl-4-[(5,6-dimethoxy-2,3–dihydro-1H-inden -2-yl)methyl]piperidine hydrochloride 1-苄基-4-[(5,6-二甲氧基-2,3-二氢-1-氢-茚-2-基)甲基]哌啶盐酸盐 C24H31NO2.HCl 401.97CH 3 O CH 3 O N ·HCl 1034439-57-0 1H-Inden-1-one,2,3-dihydro-5,6-dimethoxy-2-[[1-(phenylme thyl)-4-piperidinyl]methylene]-, (E)-(9CI) C24H27NO3 145546-80-1
盐酸多奈哌齐治疗老年痴呆的临床疗效分析 【摘要】目的:分析并且探讨在临床上选择盐酸多奈哌齐医治痴呆老年患者的效果。方法:在我院2012年9月至2015年7月期间诊治的痴呆老年患者中抽取70例实行研究,将他们 随机分成研究组及对照组,每组35例。对照组选择一般的措施实行医治,研究组在对照组 的基础上采用盐酸多奈哌齐医治。比较并观察两组医治的效果。结果:研究组的临床医治效 果明显好于对照组,差异存在统计学意义(p<0.05)。结论:对老年痴呆症患者给予盐酸多 奈哌齐治疗具有良好的临床效果,值得推广及应用。 【关键词】老年痴呆;盐酸多奈哌齐;临床疗效 本文对我院2012年9月至2015年7月间收治的70例痴呆老年患者实行分析及研究,并对 其中的35例患者选取了盐酸多奈哌齐的医治方式,效果良好,下述为此次研究的成果。 1.1普通资料 把70例患者分成研究组及对照组,每组人数35。研究组中,男性17例,女性18例,年龄57~75岁,平均(66.8±2.3)岁,病程4个月~5年,平均(2.8±1.2)年;对照组中,男性16例,女性19例,年龄58~77岁,平均(3.2±1.7)岁,病程2个月~5年,平均(2.5±1.1)年。将两组的普通资料实行对比后发现在统计学上无意义(p>0.05),存在可比性。 1.2医治措施 对照组选择一般医治的措施,包含了对血压和血糖实行控制,以及实行抗血小板的聚集医治。在医治的过程当中需要对患者生命各项的体征实行密切的观察,一旦有异常发生则需要立刻 停止药物的应用。研究组在这个基础之上选择盐酸多奈哌齐(生产厂家:西安海欣制药有限 公司;国药准字:H20030106)实行医治,睡前口服5mg,需要连续服用21天。 1.3 判定疗效的标准 MMSE医治前与医治后分支的改变率当做此次效果的判定准则。在20%以上或者等于为显效;在12%至19%为有效;在12%以下为无效。 1.4 统计学的处理 选择SPSSl8.O的统计学软件实行处理。检测的结果选择均数±标准差( ±s)来表示,组间 对比实行x2的分析,数据的差异在统计学上存在意义(p<0.05)。 2 研究的结果 2.1 对比两组MMSE的评分 两组通过医治以后都有不同水平的改善。而MMSE对患者医治前、医治后的3个月及随访的1年这3个时间阶段实行评定发现,医治前及医治后3个月患者MMSE的评分相对比,在统 计学方面上的差异不存在意义(p>0.05);但随访一年后两组间的在统计学方面上的差异存 在意义(p<0.05)。详情见表1: 2.3 对比两组发生的不良反应 研究组中有3例(8.57%)患者有不良反应出现,失眠、恶心及头晕各1例,通过对症医治 以后症状都得到了缓解。对照组中有7例(8.57%)不良反应出现,恶心及皮疹各2例,全 身乏力、失眠及头晕各1例,通过对症医治以后症状都得到了缓解。按照随访的资料表明, 两组血常规、尿常规、血生化及心电图的检查都没有显著的异常情况出现。
美国药典USP31-NF26无菌检查法《71》.doc 71 STERILITY TESTS 无菌检查法 此通则的各部分已经与欧洲药典和/或日本药典的对应部分做了协调。不一致的部分用符号()来标明。 下面这些步骤适用于测定是否某个用于无菌用途的药品是否符合其具体的各论中关于无菌 检查的要求。只要其性质许可,这些药品将使用供试产品无菌检查法项下的膜过滤法来检测。如果膜过滤技术是不适合的,则使用在供试产品无菌检查法项下的培养基直接接种法。除了具有标记为无菌通道的设备之外,所有的设备均须使用培养基直接接种法进行检测。在结果的观测与理解项下包含了复验的规定。 由于无菌检查法是一个非常精确的程序,在此过程中程序的无菌状态必须得到确保以实现对结果的正确理解,因此人员经过适当的培训并取得资质是非常重要的。无菌检查在无菌条件下进行。为了实现这样的条件,试验环境必须调整到适合进行无菌检查的方式。为避免污染而采取的特定预防措施应不会对任何试图在检查中发现的微生物产生影响。通过在工作区域作适当取样并进行适当控制,来定期监测进行此试验的工作条件。 这些药典规定程序自身的设计不能确保一批产品无菌或已经灭菌。这主要是通过灭菌工艺或者无菌操作程序的验证来完成。 当通过适当的药典方法获得了某物品中微生物污染的证据,这样获得的结果是该物品未能达到无菌检验要求的结论性证据,即便使用替代程序得到了不同的结果也无法否定此结果。如要获得关于无菌检验的其他信息,见药品的灭菌和无菌保证<1211> 按照下面描述的方法配制实验用培养基;或者使用脱水培养基,只要根据其制造商或者分销商说明进行恢复之后,其能够符合好氧菌、厌氧菌、霉菌生长促进试验的要求即可。使用经过验证的工艺对培养基进行灭菌操作。 下面的培养基已经被证实适合进行无菌检查。巯基醋酸盐液体培养基主要用于厌氧菌的培养。但其也用于检测好氧菌。大豆酪蛋白消化物培养基适合于培养霉菌和好氧菌。 Fluid Thioglycollate Medium 巯基醋酸盐液体培养基
《671》包装容器——性能检测 本章规定了用来包装的塑料容器及其组件功能性质上的标准(药品、生物制剂、营养补充剂和医疗器械),定义了保存、包装、存储和标签方面的凡例与要求。本文提供的试验用于确定塑料容器的透湿性和透光率。盛装胶囊和片剂的多单元容器章节适用于多单元容器。盛装胶囊和片剂的单位剂量容器章节适用于单位剂量容器。盛装胶囊和片剂的多单元容器(没有密封) 的章节适用于没有密封的聚乙烯和聚丙烯容器。盛装液体的多元和单元容器的章节适用于多元的和单元的容器。 一个容器想要提供避光保护或作为一个符合耐光要求的容器,由具有耐光的特殊性质的材料组成,包括任何涂层应用。一个无色透明或半透明的容器通过一个不透明的外壳包装变成耐光的(见凡例和要求 ),可免于对光的透射要求。在多单元容器和封盖与水泡的单位剂量容器由衬垫密封情况下,此处使用的术语“容器”指的是整个系统的组成。 盛装胶囊和片剂的多元容器 干燥剂——放置一些颗粒4—8目的无水氯化钙在一个浅的容器里,仔细剔除细粉,然后置于110°干燥,并放在干燥器中冷却。 试验过程——挑选12个类型和尺寸一致的容器,用不起毛的毛巾清洁密闭表面,并打开和关闭每个容器30次。坚决每次应用容器密闭一致。通过扭矩关闭螺旋盖容器,使气密性在附表规定的范围内。10个指定的测试容器添加干燥剂,如果容器容积大于等于20mL,每个填充13mm以内封闭;如果容器的容积小于20毫升,每个填充容器容量的三分之二。如果容器内部的深度超过63mm,惰性填料或垫片可以放置在底部来最小化容器和干燥剂的总重量;干燥剂层在这样一个容器中深度不低于5cm。添加干燥剂之后,立即按附表中规定的扭矩封闭螺旋帽容器。剩余的2个指定为对照容器,每个添加足够数量的玻璃珠,重量约等于每个测试容器的重量,并用附表中规定的扭矩封闭螺旋帽容器。记录各个容器的重量,如果容器的容积小于20毫升,精确到0.1毫克;如果容器容积为20毫升或以上但小于200毫升,精确到毫克;如果容器容积为200毫升及以上,精确到厘克(10毫克);在相对湿度75±3%和温度23±2°的环境下存储。[注意——浓度为35g/100mL的氯化钠溶液放在干燥器底部的渗透系统来维持指定湿度。其他的方法可以用来维护这些条件。] 336±1小时(14天)后,用同样的办法记录每个容器的重
盐酸多奈哌齐治疗阿尔茨海默病临床疗效评价 发表时间:2015-09-09T17:18:32.710Z 来源:《世界复合医学》2015年第7期供稿作者:熊杰[导读] 贵州省第二人民医院贵州贵阳治疗后患者临床疗效无明显改变、意识模糊、生活不能自理表示未改善。总改善率等于显著改善率加改善率。 熊杰贵州省第二人民医院贵州贵阳 550004 【摘要】目的探讨研究盐酸多奈哌齐治疗阿尔茨海默病的临床疗效。方法选取2013 年1 月至2015 年1 月本院收治的阿尔茨海默病患者80 例为研究对象,随机分成对照组与实验组两组。对照组患者40 例,给予茴拉西坦分散片进行治疗;实验组患者40 例,给予盐酸多奈哌齐与茴拉西坦分散片共同进行治疗,并观察两组患者的临床疗效。结果实验组患者总改善率为95.00%,对照组患者的总改善率为 77.50%,实验组患者的总改善率明显高于对照组患者,实验组患者相对于对照组患者临床疗效更显著,P<0.05,差异具有统计学意义。结论盐酸多奈哌齐治疗阿尔茨海默病有显著临床疗效,该方案值得应用并推广。 【关键词】盐酸多奈哌齐;阿尔茨海默病;临床疗效【中图分类号】R852.35【文献标识码】A【文章编号】1276-7808(2015)-07-167-01 阿尔茨海默病是一种神经系统退行性疾病【1】,具有起病隐匿的特点。大多数发病患者为老年人,它的主要临床表现为:意识障碍、说话困难、行动能力差、痴呆等【2】。该病受多种因素的影响,如家族遗传、社会环境、心理因素等。本文主要对盐酸多奈哌齐治疗阿尔茨海默病的临床疗效展开研究分析,具体研究报告如下。 1.资料和方法1.1 一般资料选取2013 年1 月至2015 年1 月我院收治的阿尔茨海默症患者80例为本次研究对象,并将这80 例阿尔茨海默病患者随机分成对照组与实验组两组。对照患者40 例,实验组患者40 例。 对照组患者为40 例,男性患者为20 例,女性患者为20 例;年龄为60 至80 岁,平均年龄为(65.34±4.15)岁;病程为2 至5 年,平均病程为(3.12±1.37)年;实验组患者为40 例,男性患者为19 例,女性患者为21 例;年龄为63 至81 岁,平均年龄为(67.21±3.98)岁;病程为3 至4 年,平均病程为(2.38±1.41)年;统计分析对照组和实验组阿尔茨海默病患者的性别比例、平均年龄、病程以及临床表现均无明显差异,差异无统计学意义,P>0.05,可进行对比研究。 1.2 治疗方法对照组阿尔茨海默病患者治疗方法如下:给予对照组患者口服两百毫克的茴拉西坦分散片,一天服用三次,以一个月为一个疗程,总共服用两个疗程。 实验组阿尔茨海默病患者治疗方法如下:给予实验组患者盐酸多奈哌齐片五毫克,一天服用一次即可;同时给予患者茴拉西坦分散片两百毫克,一天服用三次,以一个月为一个疗程,总共服用两个疗程。 1.3 观察指标观察两组患者治疗后的临床疗效,用简易精神状态检查量表(MMSE)以及日常生活能力评定量表(ADL)作为评价指标,并将该指标分为显著改善、改善、未改善这三个指标。治疗后患者临床症状消失、意识清醒、生活能够自理表示显著改善;治疗后患者临床症有所缓解、意识存在一定障碍、生活能够自理表示改善;治疗后患者临床疗效无明显改变、意识模糊、生活不能自理表示未改善。总改善率等于显著改善率加改善率。 1.3.2 观察两组患者治疗后1.4 统计学方法对实验组与对照组患者治疗后的总改善率与未改善率等,进行统计学分析,研究结束后,使用SPSS18.0 进行数据处理,使用率(%)表示计数资料,用卡方检验进行对比分析,P<0.05,差异有统计学意义,若P>0.05,差异无统计学意义。 2 结果研究结果显示,对照组患者总改善率为77.50%;实验组患者总改善率为95.00%。实验组患者的总改善率明显高于对照组的总改善率,实验组患者的临床疗效更显著,差异有统计学意义(P<0.05),详情如表1 所示。 表1 两组阿尔茨海默病患者的临床疗效比较分析表[例(%)] 注:实验组与对照组比较,P<0.05。 3.讨论阿尔茨海默病又称为老年痴呆,目前属于一种异质性疾病【3】。多见于老年人,女性患者对于男性,该病可根据认知能力水平分为三个时期:第一时期为轻度痴呆期,表现为记忆力下降,对近期发生的事情很容易遗忘,不能进行复杂的运算,很难对事情做出正确的判断,视空间能力下降;第二时期为中度痴呆期,表现为记忆力急剧下降,对近远期发生的事情都想不起来,很简单的运算也不会,简单的生活都不能自理;第三时期为重度痴呆期,患者生活完全不能自理,大小便失禁。 盐酸多奈哌齐是一种乙酰胆碱酯酶抑制剂【4】,能有效抑制乙酰胆碱酯酶对乙酰胆碱递质的水解作用,增加胆碱能神经元的传导活性,从而改善阿尔茨海默症患者记忆力减退的症状。本文选择了80 例患者,并分成了两组,研究盐酸多奈哌齐对阿尔茨海默病的治疗效果。 本研究结果表明,对照组患者显著改善为10(25.00%),改善为21(52.50%),总改善率为77.50%;实验组患者显著改善为15(37.50%),改善为23(57.50%),总改善率为95.00%。实验组阿尔茨海默病患者的总改善率明显高于对照组的总改善率,差异有统计学意义(P<0.05),实验组患者的临床疗效明显高于对照组的临床疗效,该方案安全可靠,值得应用并推广。 参考文献:[1]胡洪涛,张振馨,姚景莉等.盐酸美金刚治疗阿尔茨海默病多中心随机对照临床试验[J].中华内科杂志,2006,45(4):277-280.[2]张楠,程焱,杜红坚等.盐酸美金刚治疗阿尔茨海默病的临床研究[J].中国神经精神疾病杂志,2008,34(1):6-9.[3]范廷俊.盐酸多奈哌齐治疗阿尔茨海默病的疗效观察[J].山东医药,2008,48(7):94-95.[4]杨静,杨传英,宋超等.盐酸多奈哌齐与石杉碱甲治疗阿尔茨海默病的疗效[J].中国老年学杂志,2012,32(21):4631-4633.
USP35-NF-30结构整理 vivi2010-10-02 USP总目录: 1 New Official Text修订文件 加快修订过程包括勘误表,临时修订声明(IRAS),修订公告。勘误表,临时修订声明,修订公告在USP网站上New Official Text部分刊出,勘误表,临时修订公告也会在PF上刊出2front matter前言 药典与处方集增补删减情况,审核人员,辅料收录情况 3凡例
药典, 1标题和修订 2 药典地位和法律认可 3标准复合性 4专论和通则 5 专论组成 6 检验规范和检验方法 7 测试结果 8 术语和定义 9 处方和配药 10 包装存储与标签 4通则 4.1章节列表 4.2一般检查和含量测定(章节编号小于1000)
检查和含量分析的一般要求 检查和含量分析的仪器, 微生物检查,生物检查和含量测定, 化学检查和含量测定, 物理检查和测定 4.3一般信息(章节号大于1000) 5食物补充剂通则 6试剂(试剂,指示剂,溶液等) 7参考表 性状描述和溶解性查询表(按字母顺序) 8食品补充剂各论(字母顺序) 9NF各论(辅料标准) 10 USP各论 11术语 附件:通则的章节中文目录(使用起来比较方便,直接找对应章节号即可)一、通用试验和检定 (1)试验和检定的总要求 1 注射剂 11 参比标准物 (2)试验和检定的装置 16 自动分析方法 21 测温仪 31 容量装置,如容量瓶、移液管、滴定管,各种规格的误差限度
41 砝码和天平 (3)微生物学试验 51 抗菌效力试验 55 生物指示剂:耐受性能试验 61 微生物限度试验 61 非灭菌制品的微生物检查:计数试验 62 非灭菌制品的特定菌检查,如大肠杆菌、金葡菌、沙门氏菌等 71 无菌试验 (4)生物学试验和检定 81 抗生素微生物检定 85 细菌内毒素试验 87 体外生物反应性试验:检查合成橡胶、塑料、高聚物对哺乳类细胞培养的影响 88 体内生物反应性试验:检查上述物质对小鼠、兔iv、ip或肌内植入的影响 91 泛酸钙检定 111 生物检定法的设计和分析 115 右泛醇检定 121 胰岛素检定 141 蛋白质——生物适应试验,用缺蛋白饲料大鼠,观察水解蛋白注射液和氨基酸混合物的作用 151 热原检查法 161 输血、输液器及类似医疗装置的内毒素、热原、无菌检查 171 维生素B12 活性检定 (5)化学试验和检定 A 鉴别试验 181 有机含氮碱的鉴别 191 一般鉴别试验 193 四环素类鉴别 197 分光光度法鉴别试验 201 薄层色谱鉴别试验 B 限量试验
á233? ELEMENTAL IMPURITIES—PROCEDURES INTRODUCTION This chapter describes two analytical procedures (Procedures 1 and 2) for the evaluation of the levels of the elemental impuri-ties. The chapter also describes criteria for acceptable alternative procedures. By means of validation studies, analysts will confirm that the analytical procedures described herein are suitable for use on specified material. Use of Alternative Procedures The chapter also describes criteria for acceptable alternative procedures. Alternative procedures that meet the validation re-quirements herein may be used in accordance with General Notices and Requirements 6.30, Alternative and Harmonized Meth-ods and Procedures . Information on the Requirements for Alternate Procedure Validation is provided later in this chapter.Speciation The determination of the oxidation state, organic complex, or combination is termed speciation . Analytical procedures for spe-ciation are not included in this chapter, but examples may be found elsewhere in USP–NF and in the literature. PROCEDURES ? C OMPENDIAL P ROCEDURES 1 AND 2 System standardization and suitability evaluation using applicable reference materials should be performed on the day of analysis. Procedure and detection technique:Procedure 1 can be used for elemental impurities generally amenable to detection by inductively coupled plasma–atomic (optical) emission spectroscopy (ICP–AES or ICP–OES). Procedure 2 can be used for ele-mental impurities generally amenable to detection by ICP–MS. Before initial use, the analyst should verify that the proce- dure is appropriate for the instrument and sample used (procedural verification) by meeting the alternative procedure vali-dation requirements below. Sample preparation:Forms of sample preparation include Neat , Direct aqueous solution , Direct organic solution , and Indi- rect solution . The selection of the appropriate sample preparation depends on the material under test and is the responsibil-ity of the analyst. When a sample preparation is not indicated in the monograph, an analyst may use any of the following appropriately validated preparation procedures. In cases where spiking of a material under test is necessary to provide an acceptable signal intensity, the blank should be spiked with the same Target elements , and where possible, using the same spiking solution. Standard solutions may contain multiple Target elements . [N OTE —All liquid samples should be weighed.]Neat:Used for liquids or alternative procedures that allow the examination of unsolvated samples. Direct aqueous solution:Used when the sample is soluble in an aqueous solvent. Direct organic solution:Used where the sample is soluble in an organic solvent. Indirect solution:Used when a material is not directly soluble in aqueous or organic solvents. Total metal extraction is the preferred sample preparation approach to obtain an Indirect solution . Digest the sample using the Closed vessel diges-tion procedure provided below or one similar to it. The sample preparation scheme should yield sufficient sample to allow quantification of each element at the limit specified in the corresponding monograph or chapter. Closed vessel digestion:This sample preparation procedure is designed for samples that must be digested in a Concen-trated acid using a closed vessel digestion apparatus. Closed vessel digestion minimizes the loss of volatile impurities. The choice of a Concentrated acid depends on the sample matrix. The use of any of the Concentrated acids may be appropri-ate, but each introduces inherent safety risks. Therefore, appropriate safety precautions should be used at all times. [N OTE —Weights and volumes provided may be adjusted to meet the requirements of the digestion apparatus used.] An example procedure that has been shown to have broad applicability is the following. Dehydrate and predigest 0.5 g of primary sample in 5 mL of freshly prepared Concentrated acid . Allow to sit loosely covered for 30 min in a fume hood.Add an additional 10 mL of Concentrated acid , and digest, using a closed vessel technique, until digestion or extraction is complete. Repeat, if necessary, by adding an additional 5 mL of Concentrated acid . [N OTE —Where closed vessel digestion is necessary, follow the manufacturer’s recommended procedures to ensure safe use.] Alternatively, leachate extraction may be appropriate with justification following scientifically validated metal disposition studies, which may include animal studies, speciation, or other means of studying disposition of the specific metal in the drug product. Reagents:All reagents used for the preparation of sample and standard solutions should be free of elemental impurities,in accordance with Plasma Spectrochemistry á730?. ? P ROCEDURE 1: ICP–OES Standardization solution 1: 1.5J of the Target element(s) in a Matched matrix Standardization solution 2:0.5J of the Target element(s) in a Matched matrix Sample stock solution:Proceed as directed in Sample preparation above. Allow the sample to cool, if necessary. For mer-cury determination, add an appropriate stabilizer. Sample solution:Dilute the Sample stock solution with an appropriate solvent to obtain a final concentration of the Target elements at NMT 1.5J . Blank: Matched matrix 298 á233? Elemental Impurities—Procedures / Chemical Tests USP 40