
?W?hler’s Synthesis of Urea:
?Synthesis –Construct complex organic chemicals from simpler, more readily available ones (Chapter 8).
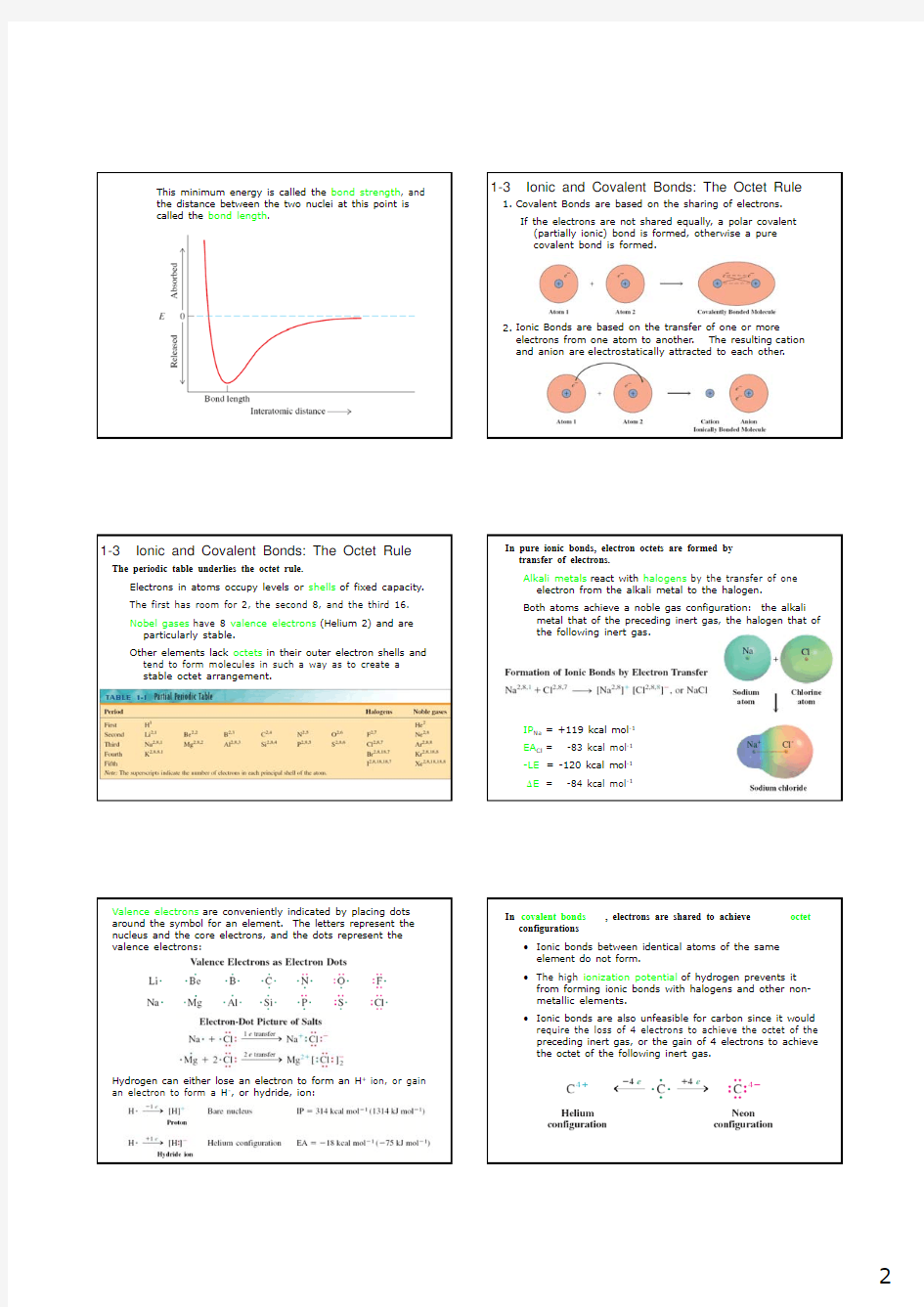
covalent bond is formed.
Ionic Bonds are based on the transfer of one or more
electrons from one atom to another. The resulting cation
and anion are electrostatically attracted to each other.
metal that of the preceding inert gas, the halogen that of
valence electrons:
Hydrogen can either lose an electron to form an H
an electron to form a H-, or hydride, ion:
configuration.
?In certain cases, one atoms supplies both of the electrons
in the bond:
?Often 4 electron (double) and 6 electron (triple) bonds are
formed:
?As a rule of thumb, electronegativity differences less
than 0.3 represent pure covalent bonds, from 0.3 to 2.0
polar covalent bonds, and greater than 2.0 ionic bonds.
?The separation of opposite charges in polar covalent
molecules results in the formation of dipoles:
Correct Lewis Structure Incorrect Lewis Structures
satisfy the octet rule:
?(# bonding electrons surrounding the atom)
In molecules such as nitric acid, charges occur on
individual atoms, even though the molecule itself is
neutral.
The 2 negative charges are delocalized over all three
Structures with a maximum of octets are most
Charges should be preferentially located on atoms with
electronegativity. If this conflicts with rule
1, then rule 1 takes precedence.
more important resonance contributors than those with
1 takes precedence over guideline 2:
If there are two or more charge separated resonance
structures which comply with the octet rule, the most
producing either constructive or destructive interference:
called s orbitals. The lowest energy s orbital is the 1s orbital.contains a spherical nodal surface.
Of slightly higher energy than the 2s orbital are 3 degenerate 2p orbitals. These orbitals are shaped like a figure 8 and point along the 3 Cartesian axes.
Aufbau principle assigns electrons to
Lower energy orbitals are filled before those with higher
No orbital may be occupied by more than two electrons. ( Exclusion Principle). If two electrons occupy a single orbital,
configuration.
The process of filling up the energy level diagram one electron at a time is called the Aufbau process.
The d orbitals on atoms of row 3 and higher are involved in the formation of expanded octets(10 and 12 electrons about
orbital places most of the electron probability to the left and right of
with the observed bond angle in the BeH2molecule.
Hybridization does not change the number of orbitals on
the atom. In this case two atomic orbitals are replaced by
two new hybrid orbitals. The two un-hybridized p orbitals
are still available to hold electrons.
approximately 109.5 approximately 120
The molecule, BH3is isoelectric with the methyl cation, CH3+.
Both involve sp2hybridization about the central atom.
contain lone pairs of electrons.
The bond angles in ammonia are 107.3o and that in water is
104.5o, both close to 109.5o. The slightly smaller bond
angles in ammonia and water are due to the slightly larger
volume requirements for lone pair electrons, which forces the
connectivity of atoms are called constitutional or structural
molecular structures.
高等有机化学习题 第一章 化学键 一、用共振轮说明下列问题 1) 联本中的C 1-C 2键长为什么比乙烷中的键长短?联苯的硝化反应为什么主要发生在2-位 和4-位? 联苯的共振结构式可表是如下: (1) 由共振结构式可以看出C 1-C 2键有双键结构的贡献,故比乙烷的C 1-C 2键短。 (2) 由共振结构式可以看出邻对位负电荷相对集中,故有利于发生硝化反应。 2) 方酸为什么是强酸?(强于硫酸) 方酸的共振结构式可表是如下:对吗? 由方酸的共振结构式可以看出方酸的电子离域效果更好。 二、试推测6,6-二苯基富烯的亲电取代发生于哪个环,哪个位置?亲核取代发生于哪个环, 哪个位置? 6,6-二苯基富烯的共振式如下: 由6,6-二苯基富烯的共振式可以看出,亲电取代发生在五元环的2位上,而亲核取代 发生在苯环的2位上。 三、计算烯丙基正离子和环丙烯正离子π分子轨道的总能量,并比较两者的稳定性。 烯丙基正离子有两个电子在成键轨道上其总能量为 E 烯丙基正离子=2E 1=2(α+1.414β)=2α+2.828β 11' O HO O O O OH O O O OH O O O HO O O O S O O HO O S O O OH O S O O O S O O OH
环丙烯正离子有两个电子在成键轨道上其总能量为 E 环丙烯正离子=2E 1=2(α+2β)=2α+2β 能量差值为 E 烯丙基正离子- E 环丙烯正离子=(2α+2.828β)- (2α+2β)=0.828β 因此,环丙烯正离子比烯丙基正离子稳定。 四、用HMO 法分别说明烯丙基负离子和环丙烯负离子的电子排布和成键情况,并比较两者 稳定性。 五、简要说明 1)吡咯和吡啶分子的极性方向相反,为什么? 吡咯分子中氮原子给出一对为共用电子参与了共轭分子的大π键,也就是电子从氮原子流向五员环,而吡啶分子中氮原子只拿出一个电子参与共轭,并且氮原子的电负性大于碳原子使电子流向氮原子的方向。因此,两个分子的极性正好相反。 2)富烯分子为什么具有极性?其极性方向与环庚富烯的相反,为什么? 富烯分子中环外双键的流向五员环形成稳定的6π体系的去向,从而环外双键中的末端碳原子带有部分正电荷,五员环接受电子后变成负电荷的中心,因此分子具有极性。 N N H 能级 烯丙基负离子 环丙基负离子 α+1.414β α+2β E=2(α+1.414β)+2α-2(α+2β)-2(α-β) = 2α+2.828β+2α-2α-4β-2α+2β =1.172β
第十一章卡宾
11.1 卡宾的定义 C:表示,卡宾(carbene),又称碳烯,一般以R 2 指碳原子上只有两个价键连有基团,还剩两个未成键电子的高活性中间体。卡宾的寿命远低于1秒,只能在低温下(77K以下)捕集,在晶格中加以分离和观察。它的存在已被大量实验所证明。 卡宾的两个未成键电子既能自旋方向相反,处于单线态,也可自旋方向平行,处于三线态。取哪种状 C:的两种态应视取代基和制备方法而异。下式为H 2 状态: 单线态和三线态卡宾
11.2 卡宾的轨道 1CH2H f=110.856KCAL/MOL3CH2H f=80.809KCAL/MOL 11.3 卡宾的立体结构 烷基卡宾 三线态卡宾的结构,最简单是用中心碳原子sp杂化来描述。两个sp杂化轨道和两个氢原子成键,两个没有杂化的p轨道,每一个容纳一个电子。这是形成两个σ键和最大程度降低所有六个电子的电子与电子之间相互排拒的最有效的形式。
三线态卡宾的分子构型是线性的。由于每一个p轨道只容纳了一个电子,因而可以把三线态卡宾看作是一个双游离基。事实上,它们在许多方面的表现也确是如此。 单线态卡宾最简单是用中心碳原子sp2杂化来描述。在这三个sp2杂化轨道中,有两个和氢原子成键,第三个容纳孤电子对。没有杂化的p轨道保持是空的。这是对三个电子对的最大程度减少电子与电子之间排拒作用的最有效的形式。 单线态的几何构型是弯的,由于孤电子对对C-H 键的排拒作用,键角小于120°。单线态卡宾同时显示了碳负离子的独电子对和碳正离子的空p轨道。
实际上,这样考虑的单线态和三线态的结构是过于简单化的。最近的计算和测定的结果:单线态卡宾的键角约为103°,三线态键角约为136°。单线态和三线态之间的能量差别也曾经见诸报导,三线态比单线态稳定,能量差约为8~9千卡/摩尔。 芳基卡宾 电子自旋共振谱表明芳基卡宾的基态是三线态。反应物光解首先形成单线态卡宾,然后自旋反转,形成三线态卡宾。三线态的esr信号的寿命比较长,在77K长达几小时。 芳基卡宾的esr谱表明芳基卡宾有一个未成对电子和芳香π体系共轭,一个未成对电子和它垂直。
第一章习题 1.用共振式说明苯甲醚分子中甲氧基的邻/对位效应。 2.比较下列各组化合物的酸性大小并予以解释。 (1)HOCH2CH2COOH 和CH3CH(OH)COOH (2)乙酸、丙二酸、乙二酸和甲酸 (3)COOH NO 2 和 COOH HO (4) H 2C CH 2H 3C CH 3HC CH 、和 3.比较碱性。 H 2N (1) CH 3CH 2NH 2 和 (2)NH 2HO NH 2 O 2N 和(3) N H N 和 比较C-Br 键断裂的难易次序 和CH 3CH 2CHCH 2CH 3CH 3OCHCH 2CH 3CH 3CH 2CHCF 2CF 3在极性条件下,、4. 5.下列共振式哪一个贡献大,为什么? C C C C O A B 6.在亲核加成反应中ArCH 2COR 和ArCOR 哪一个活性高,为什么? 7.解释酸性大小。 COOH < COOH (1) COOH COOH (2) OH > 8.为什么ArCOR 被HI 断裂时,得到的产物是RI 和ArOH ,而不是ROH 和ArI 。 9.下列反应中几乎不会生成PhCH 2CBr(CH 3)2,为什么? PhCH 2CH(CH 3)2 + Br 2 PhCHBrCH(CH 3)2 + HBr hv 10.比较拗CH 3COCH 2COCH 3和CH 3COCH 2COOC 2H 5的酸性,并简要说明原因。 11.为什么胺的碱性大于酰胺? 12.羧酸及其衍生物的亲核取代反应活性为什么是RCOCl>(RCO)2O>RC OOR’~ RCOOH>RCONH 2。 13.为什么顺丁烯二酸的p K a1比反丁烯二酸小,p K a2却正相反?
高等有机化学复习资料 第二章:电子效应、空间效应 2.1电子效应(I效应)(+ - 交替)(键的极性或极化。) 2.11诱导效应(逐级递减传递) —N+(CH3)3>—NO2> —CN > —F > —Cl > —Br > —I > —OH > —OCH3> —C6H5> —CH=CH2 > — H > —CH3 > — CH2CH3 > —C(CH3)3(吸电子能力大小) 中间体稳定性:连的烷基越多的碳正离子和碳自由基的稳定性越大,而碳负离子的稳定性正相反羧酸酸性:带吸电基时将增加羧酸的酸性,带供电基时减小其酸性。 注:+N(CH3)3具有强烈的-I效应,很强的间位定位基,亲电取代比苯难于进行。 反应速率:羰基的亲核加成反应,羰基碳原子的电子云密度越低,就越容易和亲核试剂发生加成反应Cl3C—CHO > Cl2CHCHO > ClCH2CHO > CH3CHO 2.12共轭效应(电子的离域)共轭键传递而不会明显削弱 π-π共轭> p-π共轭>σ- π超共轭>σ-p 超共轭 Y为吸电子基团时-吸电子共轭效应 (-C), X为供电子基团时-供电子共轭效应 (+C). 2.13空间效应 构象(位阻大时:a > e 键处于e键稳定) SN2反应,空间位阻愈大,反应速率慢。 CH3X>1°RX>2°RX>3°RX SN1反应:3°RX >2°RX >1°RX > CH3X 消除反应:3o>2 o>1 oRX(E1或E2) 总结:重点 酸性:吸电子,酸性增强;供电子酸性减弱 苯环上: 吸电子共轭效应--邻>对>间给电子共轭效应--邻>间>对 邻位(诱导、共轭、场、氢键效应、空间效应均要考虑。) 对位(诱导很小、共轭为主。) 间位(诱导为主、共轭很小。) 空间位阻>电子效应 第三章:反应机理 苯炔历程,或消除-加成反应(P221) 烯烃加溴历程:反式加成
第一章 有机化学反应概论 反应物转变为产物的具体途径叫反应历程或反应机理,研究和确定一个新的有机反应历程时一般经过如下步骤:首先,要提出一个与已有的实验结果及理论相符合的可能的反应历程;然后通过实验来验证所提出的历程。如果新的实验结果与提出的历程相符合,即可对最初提出的历程加以肯定;如果新的实验结果与假设的历程不相符合,则需重新提出历程;如果部分符合,则需要罪提出的历程进行修正。 1.1 有机化学反应的分类 1.1.1按反应历程分类 按化学键断裂和形成方式可将有机化学反应分为三类: 一、离子反应(异裂历程) 共价键发生异裂形成了正负离子,有离子参与的反应叫离子反应。 R 3C R 3C ++Br -慢 异裂 R 3C + 2 R 3C OH 2 -H +R 3C OH + 这是 S N 1反应 二、自由基反应(均裂反应) 共价键发生均裂形成两个自由基,如烯的反马氏加成即过氧化反应。 均裂2RO 快 ROH + 慢 2CH CH BrCH 23 +HBr + Br BrCH 23 BrCH 2CH 2CH 3 三 分子反应(协同反应,周环反应) 共价键的断裂与形成是同时(协同) 进行的,反应一步完成反应叫协同反应。如S N 2,E2,Diels-Alder 均叫协同反应。 如果经过一个环状过渡态,一步形成产物,过程无任何中间体的反应叫周环反应。 S N 2,E2,Diels-Alder 均叫协同反应。但只有 Diel-Alder 反应叫周环反应。 环转过渡态
周环反应的特点:1一般不受溶剂极性、酸性、催化剂、自由基引发剂或抑制剂的影响,而受加热或光照的影响,而且光照和加热的结果相反。2具有高度的立体专一性。 3周环反应通过环状过渡态而实现的协同反应。 周环反应分类:电环化、环加成和σ-迁移。 1.1.2按反应物与产物之间的关系分类 不饱和度计算:UN=n 4+1+1/2(n 3-n 1) 一、取代反应 反应产物的不饱和度不发生变化,根据进攻试剂的类型分为亲核取代,亲电取代和自由基取代。 RCH 2Br +OH - RCH 2 OH +Br -亲核取代 +NO 2+ NO 2 + H + 亲电取代 RCH(CH 3)2++HCl Cl 2 RCCl(CH 3)2自由基取代 二、加成反应 反应物不饱和度减少,分为亲核加成,亲电加成和自由基加成。 亲核加成 R - C H CN O - H + R C H CN HO 亲电加成RCH 2 +H + R CH CH 3 Cl -R CH CH 3 Cl 自由基加成 RCH CH 2 + Br. R CH 2Br 三、消除反应 反应物不饱和度减小,分为离子消去及协同消去或α-消除,β—消除 RCHCH 2X H OH - RCH=CH 2+HX 离子消去和β—消除 (CH 3)3COK CCl 2+(CH 3)3COH +KCl +CHCl 3 α-消除 四、重排反应 碳骨架发生变化,分子的不饱和度不变,有离子重排、自由基重排和协同重排
当前位置:第一章电子效应和空间效应 1、下列羰基化合物分别与亚硫酸氢钠溶液加成,哪一个反应速度快?哪一个最慢?为什么? (1)CH3COCH2CH3(2)HCHO(3)CH3CH2CHO HCHO反应速度最快,CH3COCH2CH3反应速度最慢。羰基化合物的亲核加成反应,其速度主要由空间效应决定。同时,与羰基相连的取代基的性质也将影响其加成速度。烷基是供电子基,将减少碳原子上的正电荷,不利于亲核加成反应。甲醛中与羰基相连的是两个氢原子,空间位阻最小,因此加成反应速度最快。丁酮中供电的甲基和乙基与羰基相连,空间位阻大,因此加成反应速度最慢。 2、比较下列各组化合物的酸性强弱,并予以解释。 (1)HOCH2CH2COOH和CH3CH(OH)COOH (2)对硝基苯甲酸和对羟基苯甲酸 (3)a.ClCH2COOH b.CH3COOH c.FCH2COOH d.CH2ClCH2COOH e.CH3CHClCOOH (4)CH3COCH2COCH3和CH3COCH2CO2C2H5 (1)-羟基丙酸的酸性比-羟基丙酸的强;羟基有-I效应,-I效应常随距离的增长而作用迅速减弱。 (2)对羟基苯甲酸的酸性比对硝基苯甲酸弱;NO2是强吸电子基,其诱导效应和共轭效应方向一致,OH有-I和+C效应,一般取代基诱导效应和共轭效应方向不一致时,往往以共轭效应为主,OH基总的来看是供电基。 (3)c>a>e>d>b。 (4)后者酸性较弱。 3、试解释亲核加成反应中,ArCH2COR的反应活性为何比ArCOR高。 Ar直接与>C=O相连时,羰基和芳环共轭使羰基碳的正电荷离域分散,使羰基碳正电性减少,活性降低。在ArCH2COR中,Ar与羰基无共轭效应,只有吸电子诱导作用,增加羰基碳正电性。故加速亲核反应进行。 当前位置:第二章立体化学 1、具有n个C=C双键的化合物,总共应存在多少个Z-E异构体,并举例说明。 有2n个Z-E异构体,举例略。 2、下列化合物是相同的、对映异构,还是非对映异构?
亲核取代反应 预计下列各对反应中哪一个比较快解释之。 (1) CF 3 C CH 33 OSC 6F 5 O Ⅰ Ⅱ 和 H 3C C CH 33 OSC 6F 5 O 在100%乙醇中溶剂解反应。 (2) H 2C=CHCH 2CH 2OTs (Ⅰ)或H 3CCH=CHCH 2OTs (Ⅱ)在98%的甲酸中溶剂解反应 (3) O OP h CH CH Br CH C O OPh 和 在醋酸中的溶剂解反应。 试对下列反应提出合理的反应机理。 (1) OCH 3 H 3 Cl Cl- (2) OH N OCCH 3 H + ,△(CH 3CO )2O O 旋光性反应物 外消旋化产物
用碱性氧化铝处理2—溴代—ρ—羟基乙苯生成一种白色固体:40~43℃,IR :1640cm -1 ;UV :282nm (水中),261nm (醚中);NMR 在和(TMS 内标)处有两个等幅单峰,元素分析(%):C,;H,%,对产物提出合理的机构,并提出此产物生成的机理。 具有结构式A 的物质在弱碱水溶液中反应,得产物B 。 S N + 2C C 6H 5 O CH 3 Br-NaHCO 3/H 2O S N C 6H 5OH C O CH 3 A B 这是一个分步骤完成的反应。其第一步为HO - 对A 的进攻 (1) 试给出一个由A 生成B 的可信的反应机理; (2) 核磁共振(NMR )的实验证实,B 中的N —(C=O)键的转动速度比A 中的N —CH2键的 转动速度低的很多。其可能原因是什么 写出下列反应的机理 (1) C H 3C H 3CH 3 CH 2OH P h 3P ,CCl 4 CH 2Cl CH 3 C H 3CH 3 (2) C 6H 5CH 2SCH 2CHCH 2SCH 2C 6H 5 C 6H 5CH 2SCH 2CSCH 2C 6H 5 SOCl 2 OH H CH 2Cl (3) (E tO)3P +CH 3I 回流 P OE t tO CH 3 O
《高等有机化学》教学大纲 课程名称:高等有机化学 学时/学分:54/4 先修课程:无机化学、有机化学 适用专业:化学 开课教研室:有机化学 一、课程的性质和任务 1.课程性质:本课程是化学专业师范方向本科生的专业选修课程。 2.课程任务:本课程基本任务是在学习四大基础化学的基础上,对《有机化学》课程的进一步深化,为有关后继课程《精细化学品化学》和《有机合成化学》的学习以及毕业论文打下良好的理论基础。通过本门课程的学习,要求学生掌握有机反应历程的分类和测试方法。熟悉各类基本有机反应的历程、立体化学关系、影响因素和在有机合成上的应用。理解一些基本的有机反应理论,并能够用所学的知识解决一些有机化学问题和指导专业有机实验。 二、课程教学基本要求 本课程的教学环节包括课堂讲授,学生自学,习题讨论课,习题,答疑,质疑,期中测验和期末考试。通过上述基本教学步骤,要求同学们能用现代化学的理论知识,认识有机化学中化学键的本质,深刻认识有机化学分子结构与物理、化学性质的内在联系和变化规律。掌握高等有机化学的基本原理、动态学原理及其有机化学的五大反应原理。掌握研究反应机理和设计合成方法。从微观电子结构层次上认识有机化学动态反应过程。通过有机化合物的结构可推测其物理性质和化学反应性质。学会并领悟分析问题、解决问题的方法和技能,为继续学习相关课程奠定理论基础,为从事相应专业的工作提供必要的理论知识。本课程课堂讲授(包括自学、讨论)54学时,以便于每学期根据实际情况调整教学,考试方式为闭卷考试,总评成绩:平时成绩占40%,期末考试占60%。 三、课程教学内容
第一章化学键. (一)主要内容 1.偶极矩、氢键、氢键在有机化学中的应用 2.共振论与分子轨道,共振论在有机化学中的应用,分子轨道理论简介 (二)基本要求 掌握偶极矩、氢键、氢键在有机化学中的应用。共振论与分子轨道,共振论在有机化学中的应用,分子轨道理论简介。解决难点:共振论与分子轨道,共振论在有机化学中的应用,分子轨道理论简介。 第二章有机化学中的电子效应和空间效应 (一)主要内容 1.诱导效应、共轭效应与超共轭效应、场效应、烷基的电子效应 2.有机化合物的空间效应、空间效应对反应活性的影响、空间效应对酸碱性的影响 3.利用堵位基团的空间效应进行选择性反应 (二)基本要求 掌握诱导效应、共轭效应与超共轭效应、场效应、烷基的电子效应、有机化合物的空间效应、空间效应对反应活性的影响、空间效应对酸碱性的影响。解决难点:空间效应对酸碱性的影响。 第三章反应机理及研究方法 (一)主要内容 1.有机反应的类型如:取代反应、加成反应、消除反应、重排反应、氧化还原反应、协同反应 2.研究反应机理的方法 (二)基本要求 掌握研究反应机理的方法。解决难点:研究反应机理的方法。 第四章氧化与还原反应 (一)主要内容 1.催化氧化、催化脱氢、二甲基亚砜氧化 2.氨氧化、过氧化物氧化、锰化合物氧化、四氧化锇氧化、铬酸及其衍生物氧化、
高等有机化学Advanced Organic Chemistry 阳年发2008年9月一、自我介绍 姓名:阳年发 Tel. 139******** 二、对同学们的要求 ?1、端正学习态度,认真扎实地学?2、有事请假 ?3、对老师有什么要求可以提出来。 Chapter 1. Introduction ?1、About Contents of Advanced Organic Chemistry ?2、The Relation between Advanced Organic Chemistry and Organic Syntheses ?3、The method of Studying Advanced Organic Chemistry 1、About Contents of Advanced Organic Chemistry 高等有机化学 内容:研究有机化合物的结构、性质、反应, 以及结构和性质的关系。 目的:指导探索反应条件、指导有机合成。 亦称物理有机化学,有人称理论有机化学。 2、The Relation between Advanced Organic Chemistry and Organic Syntheses ?高等有机侧重点:有机理论 ?有机合成侧重点:合成方法和合成路线?前者指导后者,后者证实前者,应用于实际。 ?有机合成非常重要,几乎全院的研究生都要接触他,为了化学院研究的需要我们还会开出后续课程《有机合成》。?书签1?有机合成不能光靠讲课来学好,要做大量的实验。写一个反应很容易,实施起来就不容易。特别是实验手段很重要。 ?高等有机学不好,有机合成就无法学。因为有机合成是建立在掌握大量的有机反应类型的基础上的,而高等有机就主要讲有机反应的性质和结构的关系,从而讨论大量的反应类型。 返回
第十二章苯炔
12.1 苯炔的定义 苯炔(benzyne) 又称脱氢苯。为比苯分子少两个氢的化合物。 苯炔及其衍生物是从某些芳香族亲核取代反应研究中发现的。1953年美国的J. D.罗伯茨用氨基钾处理1-位碳上用14C标记的氯苯,得到1-位和2-位碳上含有等量14C的两种苯胺。 这一反应的第一步发生卤化氢的消除反应产生苯炔,然后苯炔再与氨发生加成反应,得到1-和2-位碳上都有14C标记的苯胺。
这一中间体的证实可以解释许多芳香亲核反应在过去难以解释的现象。 苯炔的一个C≡C连结在苯环中,C≡C 两端的键被迫弯曲,不能保持线型构型,环张力很高。苯炔极不稳定,至今尚无法在一般条件下将苯炔分离出来,不过有人在8K的低温下于氩模床中获得稳定的苯炔。苯炔亦能与碘代二羰基镍形成稳定的二聚π络台物。
实验研究也发现其他的芳炔,如萘炔(1,2)、吡啶炔等等。 N 12.2 苯炔的结构 关于苯炔的结构,可以设想有两种情况。首先,如下图所示,分子具有一个三键;两个碳原子有sp杂化轨道。 结构式1
这里,sp2杂化轨道和sp杂化轨道之间得到重叠则必须有很大的扭曲;因此,苯炔是非常活泼的。 在另外一种结构里,除了脱掉两个相邻的氢原子以外,苯环基本上没有被扰乱。在相邻的sp2杂化轨道之间必然有些重叠,这样形成一个很弱的键,这种情况和观察到的活泼性是一致的。 结构式2 至于苯炔的结构到底属于这两种情况的哪一种,倾向性的意见属于后者,红外光谱也表明苯炔应具备结构式2所示的结构。 理论计算几何构型H =140.4036KCal/mol f
理论计算HOMO轨道 12.3 苯炔的生成 在许多反应里,苯炔是作为中间体存在的。但是在所有的例子里,反应都是从邻位脱掉了一个电负性的基团和一个电正性的基团。