
1.名词解释:
生物化学——简称生命的化学;是从分子水平上阐明生命有机体化学本质的一门学科。
酶——由生物活细胞产生,具有高度专一性和极高催化效率的生物催化剂。
酶原——在细胞内最初合成或分泌时并没有催化活性,必须经过适当物质的作用才具有催化活性的酶的前体。
同工酶——是指催化相同的化学反应,但酶蛋白的分子结构、理化性质和免疫学性质不同的一组酶。
酶原的激活——使无活性的酶原转变成有活性的酶的过程。
维生素——维持细胞正常功能所必需,但需要量很少,动物体内不能合成,必须由食物供给的一类有机化合物。
酶活性部位——酶分子中能直接与底物相结合并催化底物转化为产物的部位。
活化能——从反应物(初态)转化成中间产物(过渡态)所需要的能量。
必需基团——直接参与对底物分子结合和催化的基团以的3及参与维持酶分子构象的基团。
诱导契合学说——
酶活力——酶催化底物化学反应的能力
2.酶催化作用的特征(P2)
答:1.酶具有很高的催化效率 2.酶具有高度的专一性 3.反应条件温和 4.体内的酶活性是受调控 5.酶易变性失活
3.单纯酶和结合酶
单纯酶:只含有蛋白质成分,如:脲酶、溶菌酶、淀粉酶、脂肪酶、核糖核酸酶等。
结合酶:除蛋白质组分外,还有非蛋白质的小分子物质,只有两者同时存在才有催化功能。
4.维生素与辅酶(P3)
名称辅酶形式主要作用缺乏病
B1 TPP 丙酮酸脱氢酶的辅酶脚气病
B2 FMN、FAD 脱氢酶的辅酶,递氢口角炎等
B3 CoA 酰基转移酶的辅酶
B5 NAD+、NADP 脱氢酶的辅酶,递氢、递电子作用癞皮病
B6 磷酸吡哆醛氨基转移的载体
B7 生物素羧化酶的辅酶
B9 FH4 一碳基团的载体巨红细胞贫血
B12 变位酶的辅酶,甲基的载体恶性贫血
5.酶催化机理(P4)
答:过渡态和活化能:酶能降低化学反应所需的活化能
中间产物学说
诱导契合学说
6.酶活力及其单位
(一)酶活力(酶活性): 酶催化底物化学反应的能力。
(二)酶活单位:在最适的条件下,每分钟催化减少1μmol/L底物或生成1μmol/L产物所需的酶量为一个国际单位(IU)。
7.酶促反应动力学(P5)
答:1)底物浓度[S]对酶反应速度的影响2)酶浓度对酶反应速度的影响3)溶液pH对酶反应速度的影响4)温度对酶反应速度的影响5)激活剂对酶反应速度的影响
6)抑制剂对酶反应速度的影响:
不可逆性抑制作用:专一性不可逆抑制(有机磷农药中毒) 非专一性不可逆抑制
可逆性抑制作用:竟争性抑制(磺胺类药物对酶的竟争性抑制) 非竟争性抑制作用
8.酶的命名与分类(P8)
1)氧化还原酶乳2)转移酶类谷3)水解酶类4)裂合酶类5)异构酶类6)合成酶类7)核酸酶1.糖的生理功能(10)
1)构成组织细胞的成分2)动物体内的重要能源物质3)动物体内的重要功能物质
2.糖的来源与去路(11)
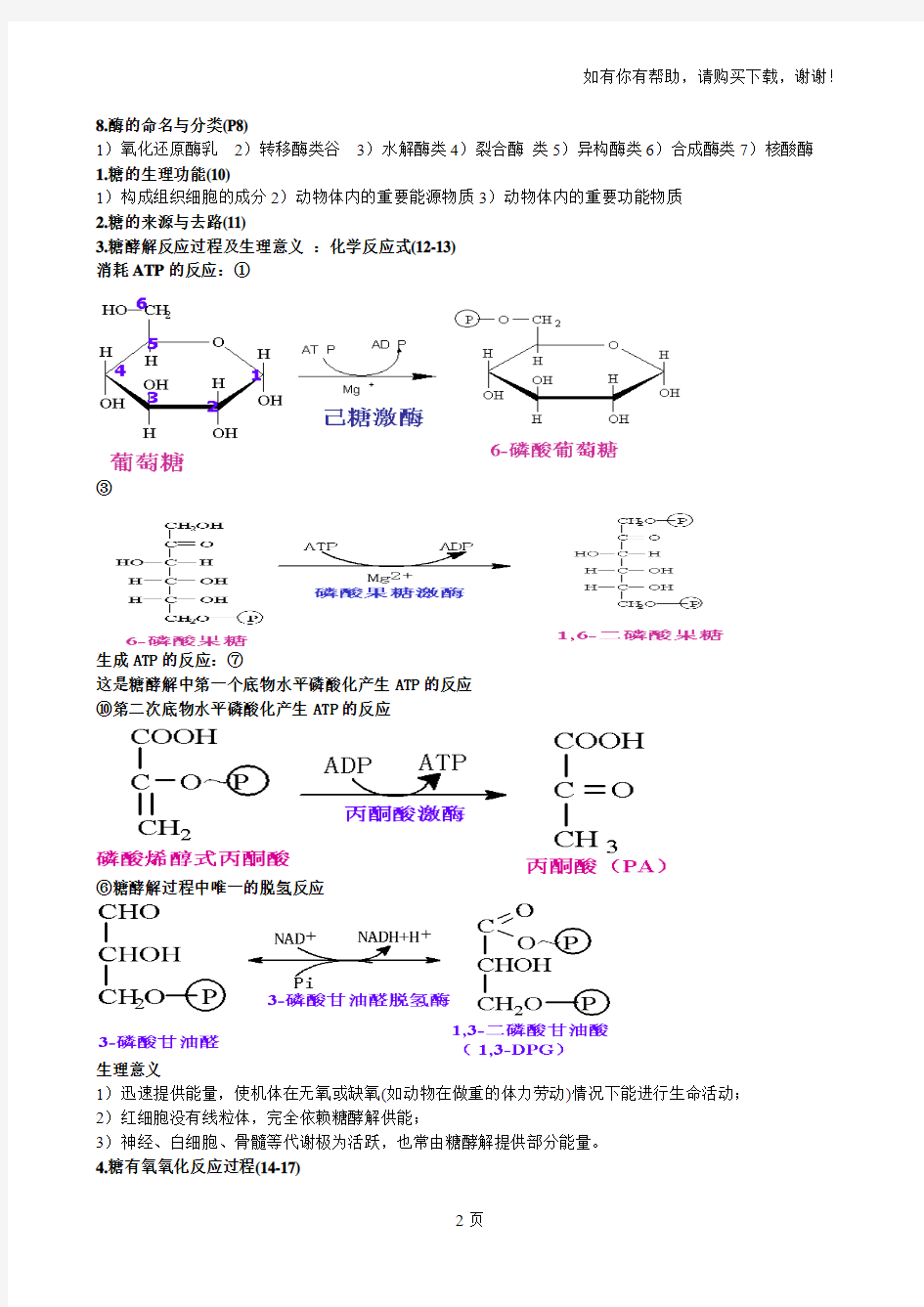
3.糖酵解反应过程及生理意义:化学反应式(12-13)
消耗ATP的反应:①
③
生成ATP的反应:⑦
这是糖酵解中第一个底物水平磷酸化产生ATP的反应
⑩第二次底物水平磷酸化产生ATP的反应
⑥糖酵解过程中唯一的脱氢反应
生理意义
1)迅速提供能量,使机体在无氧或缺氧(如动物在做重的体力劳动)情况下能进行生命活动;
2)红细胞没有线粒体,完全依赖糖酵解供能;
3)神经、白细胞、骨髓等代谢极为活跃,也常由糖酵解提供部分能量。
4.糖有氧氧化反应过程(14-17)
(一)糖酵解途径:葡萄糖丙酮酸
(二)丙酮酸乙酰CoA
(三)三羧酸循环
5. TCA循环特点及其生理意义(18,19)
柠檬酸循环的特点
1)柠檬酸循环的反应位于线粒体间质中
2)在有O2条件下运转,是生成A TP的主要途径
3)循环一周产生2分子CO2
4)在每次循环中消耗2分子H2O
5)TCA循环中并没有分子氧的直接参与,但该循环必须在有氧条件下才能进行
限速酶:柠檬酸合成酶、异柠檬酸脱氢酶、α-KG脱氢酶复合体;受ATP,NADH浓度的影响.
柠檬酸循环的意义
1)是葡萄糖生成ATP的主要途径,也是糖、脂肪、蛋白质分解的最终代谢通路;
2)是三大物质(糖类、脂类、蛋白质)代谢联系的枢纽;
3)可为其他合成代谢提供小分子前体。
6.三羧酸循环反应的全过程
7.磷酸戊糖途径的特点及生理意义(21):蚕豆病机理
1)特点
6-磷酸葡萄糖是直接脱氢和脱羧即可彻底分解;
氢受体为NADP+;
重要产物是NADPH和磷酸戊糖.
2)生理意义
生成的5-磷酸核糖供核苷酸的生物合成;
生成的还原型辅酶Ⅱ(NADPH)可供还原性的生物合成如脂肪酸、类固醇等;同时可保护生物膜被氧化剂的破坏。
与糖酵解、有氧氧化相联系: 3-磷酸甘油醛是三条途径的交汇点。
8. 葡萄糖完全氧化产生的ATP
9.磷酸戊糖途径的特点及生理意义
1)特点
6-磷酸葡萄糖是直接脱氢和脱羧即可彻底分解;
氢受体为NADP+;
重要产物是NADPH和磷酸戊糖
2)生理意义
生成的5-磷酸核糖供核苷酸的生物合成;
生成的还原型辅酶Ⅱ(NADPH)可供还原性的生物合成如脂肪酸、类固醇等;同时可保护生物膜被氧化剂的破坏。
与糖酵解、有氧氧化相联系: 3-磷酸甘油醛是三条途径的交汇点。
10.糖异生的意义
1)维持血糖浓度恒定:空腹,饥饿;反刍动物2)补充肝糖原3)调节酸碱平衡(乳酸异生为糖,防止乳酸堆积造成酸中毒.)
11.名词解释
血糖——血液中所含的葡萄糖
糖酵解——在无氧的情况下,葡萄糖生成乳酸并产生ATP的过程
底物水平磷酸化——底物在脱氢或脱水的过程中引起原子发生重排而生成高能磷酸键,把生成的高能磷酸
动物生物化学试题 (A) 2006.1 一、解释名词(20分,每小题4分) 1. 氧化磷酸化 2. 限制性核酸内切酶 3. Km 4. 核糖体 5. 联合脱氨基作用 二、识别符号(每小题1分,共5分) 1.SAM 2.Tyr 3.cDNA 4.PRPP 5.VLDL 三、填空题(15分) 1. 蛋白质分子的高级结构指的是(1分), 稳定其结构的主要作用力有(2分)。 2. 原核生物的操纵子是由 (1分)基因, (1分)基因及其下游的若干个功能上相关的(1分)基因所构成。 3. NADH呼吸链的组成与排列顺序为 (3分)。 4. 酮体是脂肪酸在肝脏中产生的不完全分解产物,包括(1分),
(1分)和(1分),在肝外组织中利用。 5. 脂肪酸的氧化分解首先要(1分)转变成脂酰辅酶A,从胞浆转入线粒体需要一个名为(1分)的小分子协助;而乙酰辅 酶A须经过 (1分)途径从线粒体转入胞浆合成脂肪酸。 四、写出下列酶所催化的反应,包括所需辅因子,并指出它所在的代谢途径 (10分) 1. 氨甲酰磷酸合成酶I 2. 谷丙转氨酶 五、问答题(50分) 1. 什么是蛋白质的变构作用(4分),请举例说明(4分)。(8分) 2. 以磺胺药物的抗菌作用为例(4分),说明酶的竞争抑制原理(4分)。(8分) 3. 一摩尔的乙酰辅酶A经过三羧酸循环完全氧化分解可以生成多少ATP?(3分)请说明理由(5分)。(8分) 4.比较在原核生物DNA复制过程中DNA聚合酶III和聚合酶I作用的异同。(8分) 5.真核基因有什么特点,简述真核生物mRNA转录后的加工方式。(8分) 6.简述由肾上腺素经PKA途径调控糖原分解代谢的级联放大机制。(10分)
第一章 1.酶工程:是生物工程的重要组成部分,是随着酶学研究迅速发展,特别是酶的推广应用,使酶学和工程学相互渗透、结合、发展而成的一门新的技术科学,是酶学、微生物学的基本原理与化学工程有机结合而产生的边缘科学技术。 2.化学酶工程:指自然酶、化学修饰酶、固定化酶及化学人工酶的研究和应用 3.生物酶工程:是酶学和以基因重组技术为主的现代分子生物学技术结合的产物,亦称高级酶工程。 4.酶工程的组成部分? 答:酶工程主要指自然酶和工程酶(经化学修饰、基因工程、蛋白质工程改造的酶)在国民经济各个领域中的应用。内容包括:酶的产生;酶的分离纯化;酶的改造;生物反应器。5.酶的结构特点? 答:虽然少数有催化活性的RNA分子已经鉴定,但几乎所有的酶都是蛋白质,因而酶必然具有蛋白质四级结构形式。其中一级结构是指具有一定氨基酸顺序的多肽链的共价骨架;二级结构为在一级结构中相近的氨基酸残基间由氢键的相互作用而形成的带有螺旋、折叠、转角、卷曲等细微结构;三级结构系在二级结构基础上进一步进行分子盘区以形成包括主侧链的专一性三维排列;四级结构是指低聚蛋白中各折叠多肽链在空间的专一性三维排列。具有低聚蛋白结构的酶(寡聚酶)必须具有正确的四级结构才有活性。具有活性的酶都是球蛋白,即被广泛折叠、结构紧密的多肽链,其氨基酸亲水基团在外表,而疏水基团向内。 6.酶活性中心:是酶结合底物和将底物转化为产物的区域,通常是整个酶分子中相当小的一部分,它是由在线性多肽链中可能相隔很远的氨基酸残基形成的三维实体。 7.酶作用机制有哪几种学说? 答:锁和钥匙模型、诱导契合模型 8.酶催化活力的影响因素? 答:底物浓度、酶浓度、温度、pH等。 9.酶的分离纯化的初步分离纯化的步骤? 答:(一)材料的选择和细胞抽提液的制备 1.材料的选择:目的蛋白含量要高,而且容易获得 2.细胞破碎方法及细胞抽提液的制备。为了确保可溶性细胞成分全部抽提出来,应当使用类似于生理条件下的缓冲液。动物组织和器官要尽可能除去结缔组织和脂肪、切碎后放人捣碎机中。完全破碎酵母和细菌细胞。 3.膜蛋白的释放:膜蛋白存在于细胞膜或有关细胞器的膜上。按其所在位置大体可分为外周 蛋白和固有蛋白两种类型 4.胞外酶的分离:胞外酶是在微生物发酵时分泌到发酵液中的。发酵后可通过离心或过滤将菌体从发酵液中分离弃去,所得发酵清液通常要适当浓缩,然后再作进一步纯化。目前常用的浓缩方法是超滤法。 (二)蛋白质的浓缩和脱盐 浓缩方法主要有:沉淀法、吸附法、干胶吸附法、渗透浓缩法、超滤浓缩法
动物生物化学试题(A) 2006.1 一、解释名词(20分,每小题4分) 1. 氧化磷酸化 2.限制性核酸内切酶 3. Km 4.核糖体 5.联合脱氨基作用 二、识别符号(每小题 1 分,共 5 分) 1.SAM 2.Tyr 3.cDNA 4.PRPP 5.VLDL 三、填空题(15分) 1.蛋白质分子的高级结构指的是( 1分), 稳定其结构的主要作用力有(2分)。 2.原核生物的操纵子是由(1分 ) 基因,(1分 ) 基因及其下游 的若干个功能上相关的( 1 分)基因所构成。 3.NADH呼吸链的组成与排列顺序为 ( 3 分)。 4.酮体是脂肪酸在肝脏中产生的不完全分解产物,包括( 1分), ( 1 分)和( 1 分),在肝外组织中
利用。 5.脂肪酸的氧化分解首先要( 1 分)转变成脂酰辅酶A,从胞浆转入线粒 体需要一个名为( 1 分)的小分子协助;而乙酰辅酶 A 须经过 ( 1 分)途径从线粒体转入胞浆合成脂肪酸。
四、写出下列酶所催化的反应,包括所需辅因子,并指出它所在的代谢途径 (10分) 1. 氨甲酰磷酸合成酶I 2.谷丙转氨酶 五、问答题(50分) 1.什么是蛋白质的变构作用(4 分),请举例说明( 4 分)。(8 分) 2. 以磺胺药物的抗菌作用为例( 4 分),说明酶的竞争抑制原理( 4 分)。(8 分) 3. 一摩尔的乙酰辅酶A经过三羧酸循环完全氧化分解可以生成多少ATP?( 3 分)请说 明理由( 5 分)。(8分) 4. 比较在原核生物DNA复制过程中DNA聚合酶III和聚合酶I 作用的异同。(8分) 5.真核基因有什么特点,简述真核生物mRNA转录后的加工方式。(8分) 6.简述由肾上腺素经PKA途径调控糖原分解代谢的级联放大机制。(10分)
实验部分 稀释倍数意思就是你得到的最后的活性要换算成最初样品的活性。比如粗酶液是30ml,再取1ml稀释到10ml(最后用移液枪取10ul做微量活性测定)。那么稀释倍数就是 10/1*30=300。 公式里面就有两个体积,一个是反应总体积,一个是酶样液体积。反应总体积是指你最后测定时候,每个试管最终的体积3 ml酶样液体积是你加入试管的SOD的体积,比如微量法就是0.01ml(10ul)。 样液速率是30秒的,需乘以2。 理论部分复习题大纲 (给大家的只是复习的大纲,还有一些由于时间仓促,上课时强调的重点内容有些没在这个大纲上,但仍然是考试内容,希望大家能认真复习。) 一.名词解释8个,每题3分 1.酶工程 2.凝胶过滤层析 3.离子交换层析 4.亲和层析 5.酶的生产 6.酶的改性 7.生物酶工程 8.化学酶工程 9.酶分解代谢物阻遏作用 10.酶生物合成的诱导作用 11.酶生物合成的反馈阻遏作用 12.密度梯度离心 13.等密度梯度离心 14.酶分子修饰: 15.酶大分子结合修饰 16.酶侧链基团修饰 17.酶反应器 18.流化床反应器鼓 19.泡式反应器 20.定点诱变技术 21.蛋白质工程 二.填空每空1分10分 1.化学酶工程研究的主要内容是(酶的制备)、(酶的分离纯化)、(酶与细胞的固定化技术)、(酶分子修饰)、(酶反应器)和(酶的应用)。 2.在酶的发酵生产中,为提高产酶率和缩短发酵周期,最理想的合成模式是(延续合成型)。 3.常用的酶或蛋白质干燥的方法有真空干燥、(冷冻干燥)、气流干燥、(喷雾干燥)和吸附干燥。
4.(葡萄唐氧化酶)是一种有效地食品除氧保鲜剂。 5. 通过检测()的酶活性,可以诊断癌症。 6.(X-射线衍射法)是测定蛋白质晶体结构的极其重要方法。 7.确定蛋白质分子在溶液中结构信息的方法是(核磁共振技术)。 8.酶反应器的操作方式可分为()反应器、()反应器和流加分批式反应器。 9.细胞固定化的方法有(吸附法)和(包埋法)。 10.1982年,Thomas R.Cech等人发现四膜虫细胞的26S rRNA前体具有自我剪接功能,将这种具有催化活性的天然RNA称为( )。 11.酶的生产方法主要有(),()和()。 12 微生物发酵产酶中使用的两种培养基是()和()。 13 针对胞内酶的分离提取,细胞破碎的方法有()、物理破碎、() 和()。 14.利用有机溶剂沉淀法分离酶或蛋白质时常用有机溶剂有丙酮、()、 ()和()。 15.离子交换剂由()、()和()构成。 16.凝胶过滤层析中常用的凝胶材料有()、()和 ()。 17. 常用的蛋白质序列数据库英文简写:()和()。 18.1926年,美国康乃尔大学的Sumner博士从刀豆中提取出( )结晶,并证明 具有蛋白质的性质。 19.常见产酶微生物种类()、()、()和()。 18. 酶的主要提取方法有酸提取法、()、()和()。 19. 吸附层析中常用的强吸附剂:()和()。 20.离子交换层析中常用的阳离子交换基团是()和 ()。 21.典型的双水相萃取系统:()和()。22. 常用的基因组数据库英文简写:()、()和 ()。 23.过滤分离的种类有、、和。 24.根据酶分子大小、形状的不同可选择的分离方法有、 或。 25.酶的固定化方法有、、和。 26. 固体发酵产酶的方法有、和。 27. 密度梯度离心常用的梯度介质是和。 28. 凝胶过滤层析中凝胶可分为凝胶、凝胶和凝胶。 29. 典型的双水相萃取系统:和。 30. 根据酶分子电荷性质的不同可选择的分离法是或。 31. 酶制剂有四种类型即液体酶制剂,酶制剂,酶制剂和 酶制剂。 32.CO2超临界萃取的临界温度,临界压力。 33.1902年,亨利根据蔗糖酶催化蔗糖水解的实验结果,提出()学说。 34.1960年,雅各和莫诺德提出了()学说,阐明了酶生物合成的基本调节机制。三.选择(5个,每个2分)
一、选择题 1.下列有关mRAN的论述,正确的一项是() A、mRNA是基因表达的最终产物 B、mRNA遗传密码的阅读方向是3′→5′ C、mRNA遗传密码的阅读方向是3′→5′ D、mRNA密码子与tRNA反密码子通过A-T,G-C配对结合 E、每分子mRNA有3个终止密码子 2.下列反密码子中能与密码子UAC配对的是() A、AUG B、AUI C、ACU D、GUA 3.下列密码子中,终止密码子是() A、UUA B、UGA C、UGU D、UAU 4.下列密码子中,属于起始密码子的是() A、AUG B、AUU C、AUC D、GAG 5.下列有关密码子的叙述,错误的一项是() A、密码子阅读是有特定起始位点的 B、密码子阅读无间断性 C、密码子都具有简并性 D、密码子对生物界具有通用性 6.密码子变偶性叙述中,不恰当的一项是() A、密码子中的第三位碱基专一性较小,所以密码子的专一性完全由前两位决定 B、第三位碱基如果发生了突变如A G、C U,由于密码子的简并性与变 偶性特点,使之仍能翻译出正确的氨基酸来,从而使蛋白质的生物学功能不变 C、次黄嘌呤经常出现在反密码子的第三位,使之具有更广泛的阅读能力,(I-U、I-C、I-A)从而可减少由于点突变引起的误差 D、几乎有密码子可用或表示,其意义为密码子专一性主要由头两个 碱基决定 7.关于核糖体叙述不恰当的一项是() A、核糖体是由多种酶缔合而成的能够协调活动共同完成翻译工作的多酶复合体 B、核糖体中的各种酶单独存在(解聚体)时,同样具有相应的功能 C、在核糖体的大亚基上存在着肽酰基(P)位点和氨酰基(A)位点 D、在核糖体大亚基上含有肽酰转移酶及能与各种起始因子,延伸因子,释放因 子和各种酶相结合的位点 8.tRNA的叙述中,哪一项不恰当() A、tRNA在蛋白质合成中转运活化了的氨基酸 B、起始tRNA在真核原核生物中仅用于蛋白质合成的起始作用 C、除起始tRNA外,其余tRNA是蛋白质合成延伸中起作用,统称为延伸tRNA D、原核与真核生物中的起始tRNA均为fMet-tRNA 9.tRNA结构与功能紧密相关,下列叙述哪一项不恰当() A、tRNA的二级结构均为“三叶草形” B、tRNA3′-末端为受体臂的功能部位,均有CCA的结构末端 C、TyC环的序列比较保守,它对识别核糖体并与核糖体结合有关
2.与苯丙酮尿症不符的临床特征是(1)。 A 患者尿液有大量的苯丙氨酸 B 患者尿液有苯丙酮酸 C 患者尿液和汗液有特殊臭味 D 患者智力发育低下 E 患者的毛发和肤色较浅 3.细胞在含BrdU的培养液中经过一个复制周期,制片后经特殊染色的中期染色体()两条姊妹染色单体均深染 4.DNA分子中脱氧核糖核苷酸之间连接的化学键是()磷酸二酯键 5.HbH病患者的可能基因型是(5)。 A ――/―― B -a/-a C ――/aa D -a/aa E aacs/―― 6.下列不符合常染色体隐性遗传特征的是(4)。 A.致病基因的遗传与性别无关,男女发病机会均等 B.系谱中看不到连续遗传现象,常为散发 C.患者的双亲往往是携带者 D.近亲婚配与随机婚配的发病率均等 E.患者的同胞中,是患者的概率为1/4,正常个体的概率约为3/4 7.人类a珠蛋白基因簇定位于(5)。 A 11p13 B 11p15 C 11q15 D 16q15 E 16p13 8.四倍体的形成可能是由于(3)。
A 双雄受精 B 双雌受精 C 核内复制 D 不等交换 E 部分重复9.在蛋白质合成中,mRNA的功能是(3)。 A 串联核糖体 B 激活tRNA C 合成模板 D 识别氨基酸 E 延伸肽链10.在一个群体中,BB为64%,Bb为32%,bb为4%,B基因的频率为(4)。 A B C D E 11.一个个体中含有不同染色体数目的三种细胞系,这种情况称为(3)。 A 多倍体 B 非整倍体 C 嵌合体 D 三倍体 E 三体型 12.某基因表达的多肽中,发现一个氨基酸异常,该基因突变的方式是(5)。 A 移码突变 B 整码突变 C 无义突变 D 同义突变 E 错义突变13.一种多基因遗传病的群体易患性平均值与阈值相距越近(1)。 A 群体易患性平均值越高,群体发病率也越高 B 群体易患性平均值越低,群体发病率也越低 C 群体易患性平均值越高,群体发病率越低 D 群体易患性平均值越低,群体发病率迅速降低 E 群体易患性平均值越低,群体发病率越高 14.染色质和染色体是(4)。
动物生物化学试题(中国农业周顺伍) 一、填空题(每空1分,共30分) 1.核酸的基本组成单位是_____,它由____、____和____三部分组成。2.单纯蛋白质的基本组成单位是_______。 3.多肽链的序列测定常采用___________法。 4.聚糖一级结构铁测定可选择_______、___________和_____等多种仪器分析方法。 5.蛋白聚糖是由______和_______通过共价键连接所形成的糖复合物。6.维生素PP即搞癞皮病因子,它包括_______和_______。 7._____是唯一含金属的,而且是相对分子质量最大,结构最复杂的维生素。8.糖原是人体内糖的贮存形式,主要存在于______和______中。 9.食物中脂质物质主要包括______、_____、____及____,以_____最多。 10.人体含有的不饱和脂肪酸主要有_______、______、_____、____以及_____。 11.胆固醇是环戊烷多氢菲的衍生物,在体内主要以_______和______两种形式存在。 12.氨基酸分解代谢最首要的反应是____________。 13.DNA指导的_______________是RNA合成中最主要的酶类。 二、列举题(每题5分,共25分) 1.列举DNA分子的一级结构? 2.列举蛋白质的一级结构? 3.列举常见的酶的必需基团? 4.列举生物氧化的特点? 5.列举DNA分子的碱基组成? 三、名词解释(每题5分,共20分) 1.蛋白质的氨基酸组成: 2.维生素;
3.核酸的一级结构: 4.免疫球蛋白: 四、问答题(每题5分,共25分) 1.变性蛋白质有哪些表现? 2.温度对酶反应速度有哪些影响? 3.柠檬酸循环的特点? 4.胆固醇的生物合成途径可分为哪三个阶段?5.肝脏在脂类代谢中的作用有哪些?
细胞工程复习题 一、名词解释(每小题3分,共21分)1.酶工程: 2.继代培养 3.人工种子: 4.单倍体培养: 5.微细胞: 6.胚胎工程: 7.克隆: 8.蛋白质工程: 9.外植体: 10.动物细胞与组织培养: 11.组织工程: 12.雌核发育: 13.胚胎融合: 14.转基因动物: 15.生物化学工程: 16.愈伤组织: 17.看护培养: 18.细胞固定化: 19.染色体工程 20.细胞重组: 21.基因工程技术: 二、简答题 1.细胞工程的重要应用体现在哪些方面
2.何为植物细胞两相培养技术建立植物细胞的两相培养系统必须满足的条件是什么 3.动物细胞体外培养有哪些特点 4.动物器官培养技术中,传统的器官培养方法主要有哪些 5.什么是细胞核移植技术以鱼类细胞核移植为例,其技术要点有哪些方面6.植物组织培养与植物细胞培养有什么区别 7.何为细胞悬浮培养怎样做到悬浮培养细胞的同步化 8.动物细胞生物反应器培养生产的生物制品主要有哪些种类 9.什么是试管动物试管动物技术主要包括哪几个主要技术环节 10.何为体细胞克隆技术多莉羊是怎样培育出的 11.芦荟组织培养快速繁殖中,通过哪些途径可以得到完整的植株 12.人工种子利用有何优势 13.用于动物细胞与组织培养的生物反应器应具备哪些基本要求
14.何为胚胎移植主要包括哪些关键技术 15.转基因动物技术的应用主要体现在哪几个方面 三、论述题 1.请阐述单克隆抗体的制备过程 2.植物组织培养技术主要包括哪些环节各环节的主要工作内容有哪些 3.请阐述原生质的分离,纯化和活力鉴定的技术过程 四、计算题 μ和ppm浓度各是什么1.有一培养基的IAA浓度是1.5/ mg L,问其/ mol L (分子量) 2.培养基的配方是 2.0/0.5/ +++水解酪蛋白 MS BA mg L NAA mg L 500mg/L+3%蔗糖+%琼脂粉。MS母液的浓度分别是:大量元素10倍,微量元素100倍,铁盐100倍,有机物100倍;BA母液浓度ml,NAA母液浓度ml。要配制800ml 该培养基,需要吸取各种母液各多少ml分别称取蔗糖、琼脂粉各多少克 3.要配制1mol/L的 NaOH100ml, 要称取98%的固体NaOH多少克要配制1mol/L的HCl1000 ml,要量取浓HCl多少ml(NaOH分子量40,HCl分子量,浓HCl含量38%,比重) 五、填空题 1.生物工程操作的对象是什么这是与化学工程等其他工程类学科最明显的不同
第一章蛋白质化学复习题 一、填充 1.在生理条件下(pH 7.0左右),蛋白质分子中的赖氨酸侧链和精氨酸侧链几乎完全带正电荷,但是组氨酸侧链则带部分正电荷。 2. 脯氨酸和羟脯氨酸与茚三酮反应产生黄色的物质,而其他氨基酸与茚三酮反应产生蓝紫色的物质。 3.范斯莱克(van Slyke)法测定氨基氮主要利用α- 氨基与亚硝酸作用生成羟酸和N2 。 4.实验室常用的甲醛滴定是利用氨基酸的氨基与中性甲醛反应,然后用碱(NaOH)来滴定N+H3基上放出的H+ 。 5.常用的肽链N端分析的方法有 2,4-二硝基氟苯法、丹磺酰氯法、本异硫氰酸法和氨肽酶 法。C端分析的方法有肼解法和羧肽酶 法等。 6.蛋白质的超二级结构是指二级结构的基本单位(α螺旋、β折叠等)相互聚集形成有规律的二级结构的聚合体,其基本组合形式为αα结构、βαβ结构、 Rossmann折叠(βαβαβ结构)、β发夹结构(ββ结构)、β曲折结构和希腊钥匙结构等。
7.蛋白质的二级结构有酰胺平面、α螺旋结构、β折叠结构、β转角结构和Ω环等几种基本类型。 8.确定蛋白质中二硫键的位置,一般先采用酶水解原来的蛋白质,然后用离子交换层析技术分离水解后的混合肽段。P107~109 9.通常可用紫外分光光度法测定蛋白质的含量,这是因为蛋白质分子中的苯丙氨酸、酪氨酸和色氨酸三种氨基酸的共轭双键有紫外吸收能力。 10.两条相当伸展的肽链(或同一条肽链的两个伸展的片段)之间形成氢键的结构单元称为。 11.在蛋白质分子中相邻氨基酸残基的β-碳原子如具有侧链会使α螺旋不稳定。因此当脯氨酸、甘氨酸和异亮氨酸三种氨基酸相邻时,会破坏α螺旋。 12.在α螺旋中C=O和N—H之间形成的氢键最稳定,因为这三个原子以平行排列。 13.氨基酸的结构通式为。 14.组成蛋白质分子的碱性氨基酸有精氨酸、组氨酸和赖氨酸。酸性氨基酸有天冬氨酸和谷氨酸。 15.在下列空格中填入合适的氨基酸名称。 (1) 酪氨酸是带芳香族侧链的极性氨基酸。
蛋白质组学相关试题及答案 解释 1. Proteome(蛋白质组):由一个细胞或者组织的基因组所表达的全部相应的蛋白质,称为蛋白质组。 2. Proteomics(蛋白质组学):指应用各种技术手段来研究蛋白质组的一门新兴学科,即研究细胞在不同生理或病理条件下蛋白质表达的异同,对相关蛋白质进行分类和鉴定。更重要的是蛋白质组学的研究要分析蛋白质间相互作用和蛋白质的功能. 3. Mass Spectrometer(质谱仪):质谱仪是一个用来测量单个分子质量的仪器,但实际上质谱仪提供的是分子的质量与电荷比(m/z or m/e)。分离和检测不同同位素的仪器。即根据带电粒子在电磁场中能够偏转的原理,按物质原子、分子或分子碎片的质量差异进行分离和检测物质组成的一类仪器。质谱仪最重要的应用是分离同位素并测定它们的原子质量及相对丰度。 4. Proteome sample holographic preparation(蛋白组样品的全息制备):(1)keep protein information (2)adapted to separation and identification methods (3)different samples,different extraction. 蛋白质样品制备是蛋白质组研究的第一步,也是最关键的一步。因为这一步会影响蛋白质产量、生物学活性、结构完整性。因此要用最小的力量使细胞达到最大破坏程度同时保持蛋白质的完整性。原则是,保持蛋白质的所有信息;选择合适的分离和鉴定方法;对于不同的样品要用不同的提取方法。 5. Post translational modification(蛋白质翻译后修饰) 肽链合成的结束,并不一定意味着具有正常生理功能的蛋白质分子已经生成。已知很多蛋白质在肽链合成后还需经过一定的加工(processing)或修饰,由几条肽链构成的蛋白质和带有辅基的蛋白质,其各个亚单位必须互相聚合才能成为完整的蛋白质分子。 6. De novo sequencing(从头测序) 从头测序为蛋白质组研究提供了一种不用借助于任何蛋白质序列数据库信息,直接解读串联质谱数据的方法。其基本算法主要由4个部分组成:质谱图的构建、
第二章核酸 一、比较mRNA 、tRNA、rRNA的分布,结构特点及功能 mRNA主要分布在是以游离状态的存在于细胞质中,tRNA主要分布在细胞核中,rRNA是核糖体的组成部分。 1.mRNA的结构与功能:mRNA是单链核酸,其在真核生物中的初级产物称为HnRNA。大多数真核成熟的mRNA分子具有典型的5?-端的7-甲基鸟苷三磷酸(m7G)帽子结构和3?-端的多聚腺苷酸(polyA)尾巴结构。mRNA的功能是为蛋白质的合成提供模板,分子中带有遗传密码。原核生物的mRNA一般是多顺反子。真核生物的mRNA一般是单顺反子。 2. tRNA的结构与功能:tRNA是分子最小,但含有稀有碱基最多的RNA。tRNA 的二级结构由于局部双螺旋的形成而表现为“三叶草”形,故称为“三叶草”结构,可分为:①氨基酸臂:3?-端都带有-CCA-顺序,可与氨基酸结合而携带氨基酸。 ②DHU臂/环:含有二氢尿嘧啶核苷。③反密码臂/环:其反密码环中部的三个核苷酸组成三联体,在蛋白质生物合成中,可以用来识别mRNA上相应的密码,故称为反密码(anticoden)。④TψC臂/环:含保守的TψC顺序。⑤可变环。3. rRNA的结构与功能:rRNA是细胞中含量最多的RNA,可与蛋白质一起构成核蛋白体,作为蛋白质生物合成的场所。原核生物中的rRNA有三种:5S,16S,23S。真核生物中的rRNA有四种:5S,5.8S,18S,28S。 二.简述DNA双螺旋结构模型要点 1两条平行的多核苷酸链,以相反的方向(即一条由5…—3?,另一条由3…—5?)围绕同一个(想像的)中心轴,以右手旋转方式构成一个双螺旋。 2疏水的嘌呤和嘧啶碱基平面层叠于螺旋的内侧,亲水的磷酸基和脱氧核糖以磷酸二酯键相连形成的骨架位于螺旋的外侧。 3内侧碱基成平面状,碱基平面与中心轴相垂直,脱氧核糖的平面与碱基平面几乎成直角。每个平面上有两个碱基(每条链各一个)形成碱基对。相邻碱基平面在螺旋轴之间的距离为0.34nm,旋转夹角为36度。每十对核苷酸绕中心旋转一圈,故螺旋的螺距为3.4nm. 4双螺旋的直径为2nm.沿螺旋的中心轴形成的大沟和小沟交替出现。DNA双螺旋之间形成的沟为大沟,两条DNA链之间的沟为小沟。 5两条链被碱基对之间形成的氢键稳定地维系在一起。双螺旋中,碱基总是腺嘌呤与胸腺嘧啶配对,鸟嘌呤与胞嘧啶配对。 第三章蛋白质
《生物制药工艺学》复习思考题 第一章生物药物概论 1、生物药物有哪几类?DNA重组药物与基因药物有什么区别? 2、生物药物有哪些作用特点? 3、DNA重组药物主要有哪几类?举例说明之。 4、术语:药物与药品,生物药物,DNA重组药物,基因药物,反义药物,核酸疫苗,RNAi 第二章生物制药工艺技术基础 1、生物活性物质的浓缩与干燥有哪些主要方法? 2、简述生物活性物质分离纯化的特点和分离纯化的主要原理。 3、怎样保存微生物菌种?何谓菌种退化?如何检查菌种退化? 4、诱变育种的总体流程是怎样的?选择出发菌需注意哪些事项? 5、生物制药工艺中试放大的目的是什么? 6、酶固定化的方法有哪些类别? 7、术语:冷冻干燥,喷雾干燥,薄膜浓缩,自然选育,诱变育种,蛋白质工程,转基因动物,蛋白质组学,酶工程,immobilized enzyme,抗体酶,模拟酶,组合生物合成,药物基因组学,DNA Shuffling,定向进化,甘油冷冻保藏法,液氮保藏法,斜面保藏法,沙土管保藏法 第三章生物材料的预处理 1、去除发酵液中杂蛋白有哪几种方法? 2、去除发酵液中钙、镁、铁离子的方法有哪些? 3、影响絮凝效果的主要因素有哪些? 4、细胞破碎有哪些方法?各有什么特点? 5、超声波破碎细胞的原理? 6、术语:凝聚作用,絮凝作用,渗透压冲击法,错流过滤,超声波破壁,酶法破壁,高压匀浆法,高速珠磨法,反复冻融法,渗透压冲击法,液氮研磨法,丙酮粉 第四章萃取法 1、溶剂萃取法的基本原理,其特点是什么? 2、溶剂萃取法按操作方式不同,可分为哪几类?各有什么特点? 3、影响有机溶剂萃取的因素有哪些?萃取剂的选择需遵循哪些原则? 4、使用有机溶剂萃取时,改变pH值将如何影响酸性或碱性抗生素的分配系数? 5、乳化剂为何能使乳状液稳定? 6、破坏乳状液的方法有哪些?
习题——蛋白质化学
一、选择题 1、蛋白质一级结构的主要化学键是( C ) A.氢键B.疏水键C.肽键D.二硫键 2、蛋白质变性后可出现的现象是( D ) A.一级结构发生改变B.构型发生改变 C.分子量变小D.构象发生改变 3、血红蛋白的氧合曲线呈(A) A.S形曲线B.抛物线C.双曲线D.直线4、蛋白质变性后出现的变化是(D ) A.一级结构发生改变B.溶解度变大 C.构型发生改变D.构象发生改变 5、每分子血红蛋白可结合氧的分子数为( D ) A.1 B.2 C.3 D.4 6、不会导致蛋白质变性的方法有(A) A.低温盐析B.常温醇沉淀 C.用重金属盐沉淀D.用三氯乙酸沉淀 7、下列不具有手性碳原子的氨基酸是( D ) A.丝氨酸B.丙氨酸C.亮氨酸D.甘氨酸8、下列氨基酸中,含有吲哚环的是( C ) A.蛋氨酸B.苏氨酸C.色氨酸D.组氨酸9、某一蛋白质分子中一个氨基酸发生变化,这个蛋白质(A) A.二级结构一定改变B.二级结构一定不变 C.三级结构一定改变D.功能一定改变 10、煤气中毒主要是因为煤气中的一氧化碳( C ) A、抑制了巯基酶的活性,使巯基酶失活 B、抑制了胆碱酯酶的活性,使乙酰胆碱累积,引起神经中毒的症状 C、和血红蛋白结合后,血红蛋白失去了运输氧的能力,使患者因缺氧而死亡 D、抑制了体内所有酶的活性,使代谢反应不能正常进行 11、肌红蛋白的氧合曲线呈(A)
A.双曲线B.抛物线C.S形曲线D.直线 12、测定蛋白质含量必需有完整的肽键的方法是( C ) A.紫外吸收B.凯氏定氮法C.双缩脲法D.茚三酮反应13、下列氨基酸是必需氨基酸的为(C ). A.丙氨酸B.精氨酸C.赖氨酸D.谷氨酰氨14、维持蛋白质三级结构主要靠( D ) A.范德华力B.氢键C.盐键D.疏水相互作用15、氨基酸与蛋白质共有的性质是(C ) A.胶体性质B.变性性质C.两性性质D.双缩脲反应16、可分开抗体IgG分子的重链和轻链(-S-S-相连)的试剂是( B ) A.胃蛋白酶B.巯基乙醇C.尿素D.乙醇胺17、Sanger试剂是指(B ) A.PITC B.DNFB C.DNS-C1 D.对氯苯甲酸18、蛋白质变性是由于(A) A.氢键被破坏B.肽键断裂 C.蛋白质降解D.水化层被破坏及电荷被中和 19、Edman试剂是指(A) A.PITC B.DNFB C.DNS-C1 D.对氯苯甲酸20、下列氨基酸中,含有咪唑基的是( D ) A.蛋氨酸B.苏氨酸C.色氨酸D.组氨酸 21、下列是非必需氨基酸的是(B ) A.亮氨酸B.丙氨酸C.赖氨酸D.异亮氨酸 22、氨基酸有的性质是(C ) A.胶体性质B.变性性质C.两性性质D.双缩脲反应23、蛋白质在等电点时,应具有的特点是( D ) A.不具有正电荷B.不具有负电荷 C.既不具有正电荷也不具有负电荷D.在电场中不泳动 24、以下说法错误的是(A) A. pH增加,血红蛋白与氧的亲和力增加 B. 二氧化碳分压增加,血红蛋白与氧的亲和力下降
生物化学期末复习题 一.名词解释: 1. 酶: 是由活细胞产生的、能对特异底物进行高效率催化的生物催化剂 ,其化学本质是蛋白质。 2. 蛋白质的变性: 在某些物理或化学因素的作用下 ,蛋白质严格的空间结构被破坏(不包括肽键的断裂) ,从而引起蛋白质若干理化性质和生物学性质的改变 ,称为蛋白质的变性。 3. 冈崎片段: DNA在复制时 ,由随从链所形成的一些子代DNA短链称为冈崎片段。 4. 蛋白质的沉淀:蛋白质分子相互聚集而从溶液中析出的现象称为沉淀。 5. 翻译:蛋白质的生物合成过程 ,将DNA传递给mRNA的遗传信息 ,再具体转译为蛋白质中氨基酸排列顺序的过程 ,这一过程被称为翻译。 6. 复制:以亲代DNA的每一股链作为模板 ,合成完全相同的两个双链子代DNA链。 7. 等电点:氨基酸分子带有相等正、负电荷时 ,溶液的pH值称为该氨基酸的等电点(pI)。 8. 核酸的变性:在理化因素作用下 ,DNA双螺旋的两条互补链松散而分开成为单链 ,从而导致DNA的理化性质及生物学性质发生改变 ,这种现象称为DNA的变性。 9. 酶的活性中心:酶分子上具有一定空间构象的部位 ,该部位化学基团集中 ,直接参与将底物转变为产物的反应过程 ,这一部位就称为酶的活性中心。 10. 转录: 在RNA聚合酶的催化下 ,以一段DNA链为模板合成RNA ,从而将DNA所携带的遗传信息传递给RNA的过程称为转录。 11. 维生素:维生素是指一类维持细胞正常功能所必需的 ,但在生物体内不能自身合成而必须由食物供给的小分子有机化合物。 12. 转录单位: 特定起始点和特定终止点之间的DNA链构成一个转录单位 13.简并密码:同一氨基酸存在多个不同的遗传密码的现象称为遗传密码的简并性。 14专一性:一种酶只能作用一类或一种底物(反应物)的性质称为酶作用的专一性。 15.底物:在酶促反应中 ,被酶催化的物质称为底物 16.领头链: 以3’→5’方向的亲代DNA链作模板的子代链在复制时基本上是连续进行的 ,其子代链的聚合方向为5’→3’ ,这一条链被称为领头链。 17.随从链: 以5’→3’方向的亲代DNA链为模板的子代链在复制时则是不连续的 ,其链的聚合方向也是5’→3’ ,这条链被称为随从链。 18.模板链:能够转录RNA的那条DNA链称为模板链。 19.编码链:与模板链互补的另一条DNA链称为编码链。 20.核心酶:原核生物中的RNA聚合酶全酶由五个亚基构成 ,即α2ββ'σ。σ亚基与转录起始点的识别有关 ,在转录合成开始后被释放;余下的部分(α2ββ')被称为核心酶 21.转录因子: 在反式作用因子中 ,直接或间接参与转录起始复合体的形成的蛋白因子被称为转录因子。 22.DNA的复性:将变性DNA经退火处理 ,使其重新形成双螺旋结构的过程 ,称为DNA的复性。 23.Tm:加热DNA溶液 ,使其对260nm紫外光的吸收度突然增加 ,达到其最大值一半时的温度 ,就是DNA的变性温度(融解温度 Tm)。 24.hnRNA:mRNA在真核生物中的初级产物称为HnRNA 25.同义密码子:对应于同一种氨基酸的不同密码子称为同义密码子。 二.简答题 1.核酸的基本单位是什么? 答:RNA和DNA都是以单核苷酸为基本单位所组成的多核苷酸长链。 2.核苷酸之间的连接方式是什么? 答:通过脱水可形成3',5'-磷酸二酯键 ,从而将两分子核苷酸连接起来。
宁夏大学 2017年攻读博士学位研究生入学考试初试试题卷 考试科目:高级动物生物化学 适用专业:动物遗传育种与繁殖动物生产系统与工程 (不用抄题,答案写在答题纸上,写明题号,答案写在试题卷上无效) 一、Explain the Following Biochemical Terms in Chinese or in English(20分), (每题4分) 1.Operon 2.hyperchromic effect 3.cis-acting element 4.salting out 5.citriate shuttle 二、简述题(40分)(每题10分) 1.举例说明核酸结构(构象)多态性及其生物学意义? 2、胞浆中的NADH如何参加氧化磷酸化过程?试述其具体机制。 3.试述DNA复制的特点。 4.氨在血液中如何转运? 三、论述题(40分) 1.论述糖的有氧氧化代谢途径、产能及生理意义。(20分) 2.如何利用蛋白质的性质进行蛋白质的分离纯化?(20分)
宁夏大学 2018年攻读博士学位研究生入学考试初试试题卷 考试科目:高级动物生物化学 适用专业:动物遗传育种与繁殖动物生产系统与工程 (不用抄题,答案写在答题纸上,写明题号,答案写在试题卷上无效) 一、简答题(共8小题,每小题8分,共64分) 1.比较蛋白质的变性与沉淀。(8分) 2.比较酶的别构调节与共价修饰。(8分) 3.肌肉内代谢产生的乳酸在肌肉内不能异生为糖,乳酸会产生积累,机体是如何处理的?简述代谢过程。(8分) 4.氨基酸一般分解代谢有哪些途径?产物是什么?哪条途径是氨基酸分解代谢的主要途径?为什么?(8分) 5.比较脂肪酸β氧化与生物合成的异同。(8分) 6.何谓基因文库?何谓cDNA文库?两者有何不同?(8分) 7.核酸有无营养价值?如果供给动物缺乏核酸的食物,动物能否生存?为什么?(8分) 8.分析DNA复制、修复和重组之间的关系。(8分) 二、论述题(共2小题,共36分) 1.以反刍动物为例,当机体处于低血糖生理状态时,三大营养物质的代谢关系如何?阐述代谢过程。(20分) 2.如何看待RNA功能的多样性?它的核心作用是什么?(16分)
-第一章蛋白质化学测试题-- 一、单项选择题 1.测得某一蛋白质样品的氮含量为0.40g,此样品约含蛋白质多少? A.2.00g B.2.50g C.6.40g D.3.00g E.6.25g 2.下列含有两个羧基的氨基酸就是: A.精氨酸 B.赖氨酸 C.甘氨酸 D.色氨酸 E.谷氨酸 3.维持蛋白质二级结构的主要化学键就是: A.盐键 B.疏水键 C.肽键 D.氢键 E.二硫键 4.关于蛋白质分子三级结构的描述,其中错误的就是: A.天然蛋白质分子均有的这种结构 B.具有三级结构的多肽链都具有生物学活性 C.三级结构的稳定性主要就是次级键维系 D.亲水基团聚集在三级结构的表面 E.决定盘曲折叠的因素就是氨基酸残基 5.具有四级结构的蛋白质特征就是: A.分子中必定含有辅基 B.在两条或两条以上具有三级结构多肽链的基础上,肽链进一步折叠,盘曲形成 C.每条多肽链都具有独立的生物学活性 D.依赖肽键维系四级结构的稳定性 E.由两条或两条以上具在三级结构的多肽链组成 6.蛋白质所形成的胶体颗粒,在下列哪种条件下不稳定: A.溶液pH值大于pI B.溶液pH值小于pI C.溶液pH值等于pI D.溶液pH值等于7.4 E.在水溶液中 7.蛋白质变性就是由于: A.氨基酸排列顺序的改变 B.氨基酸组成的改变 C.肽键的断裂 D.蛋白质空间构象的破坏 E.蛋白质的水解 8.变性蛋白质的主要特点就是:
A.粘度下降 B.溶解度增加 C.不易被蛋白酶水解 D.生物学活性丧失 E.容易被盐析出现沉淀 9.若用重金属沉淀pI为8的蛋白质时,该溶液的pH值应为: A.8 B.>8 C.<8 D.≤8 E.≥8 10.蛋白质分子组成中不含有下列哪种氨基酸? A.半胱氨酸 B.蛋氨酸 C.胱氨酸 D.丝氨酸 E.瓜氨酸 二、多项选择题(在备选答案中有二个或二个以上就是正确的,错选或未选全的均不给分) 1.含硫氨基酸包括: A.蛋氨酸 B.苏氨酸 C.组氨酸 D.半胖氨酸 2.下列哪些就是碱性氨基酸: A.组氨酸 B.蛋氨酸 C.精氨酸 D.赖氨酸 3.芳香族氨基酸就是: A.苯丙氨酸 B.酪氨酸 C.色氨酸 D.脯氨酸 4.关于α-螺旋正确的就是: A.螺旋中每3.6个氨基酸残基为一周 B.为右手螺旋结构 C.两螺旋之间借二硫键维持其稳定 D.氨基酸侧链R基团分布在螺旋外侧 5.蛋白质的二级结构包括: A.α-螺旋 B.β-片层 C.β-转角 D.无规卷曲 6.下列关于β-片层结构的论述哪些就是正确的: A.就是一种伸展的肽链结构 B.肽键平面折叠成锯齿状 C.也可由两条以上多肽链顺向或逆向平行排列而成 D.两链间形成离子键以使结构稳定 7.维持蛋白质三级结构的主要键就是: A.肽键 B.疏水键 C.离子键 D.范德华引力 8.下列哪种蛋白质在pH5的溶液中带正电荷? A.pI为4、5的蛋白质 B.pI为7、4的蛋白质 C.pI为7的蛋白质 D.pI为6、5的蛋白质 9.使蛋白质沉淀但不变性的方法有:
第三章蛋白质化学样题 一、选择题 1.蛋白质分子的一级结构概念主要是指() A、组成蛋白质多肽链的氨基酸数目。 B、氨基酸种类及相互比值。 C、氨基酸的排列顺序。 D、二硫键的数目和位置。 2.下列何种结构不属蛋白质分子构象() A、右手双螺旋 B、α-螺旋 C、β-折叠 D、β-转角 3. 在蛋白质三级结构中可存在如下化学键,但不包括() A、氢键 B、二硫键 C、离子键 D、磷酸二酯键 4. 下列关于蛋白质四级结构的有关概念,何者是错误的() A、由两个或两个以上亚基组成。 B、参与形成四级结构的次级键多为非共价键。 C、所有蛋白质分子只有具有四级结构,才表现出生物学活性。 D、组成四级结构的亚基可以是相同的,也可以是不同的。 5. 蛋白质变性是由于() A、蛋白质一级结构的改变 B、组成蛋白质的共价键发生变化 C、蛋白质空间构象的破坏 D、辅基的脱落 6. 维系蛋白质一级结构的化学键() A、盐键 B、肽键 C、氢键 D、分子间作用力 7. 对具有四级结构的蛋白质进行一级结构分析时()
A、只有一个自由的α-氨基和一个自由的α-羧基。 B、只有自由的α-氨基,没有自由的α-羧基。 C、有一个以上的自由α-氨基和α-羧基。 D、既无自由的α-氨基,也无自由的α-羧基。 8. 蛋白质分子中的α-螺旋和β片层都属于() A、一级结构 B、二级结构 C、三级结构 D、四级结构 9. 维系蛋白质分子中α-螺旋的化学键是() A、肽键 B、离子键 C、二硫键 D、氢键 10. α-螺旋每上升一圈相当于几个氨基酸() A、2.5 B.2.7 C.3.0 D、3.6 11. 谷氨酸的等电点是3.22,下列描述正确的是() A、谷氨酸是碱性氨基酸 B、谷氨酸是酸性氨基酸 C、谷氨酸在pH=7的溶液中带正电荷 D、谷氨酸分子中含有一个氨基和一个羧基 12. 肽键是() A、属于维系蛋白质二级结构的重要化学键 B、属于次级键 C、可以自由旋转 D、由肽键形成的肽平面包含了6个原子 13. 关于蛋白质二级结构的描述正确的是() A、属于蛋白质的空间构象
第一章蛋白质结构基础复习题 1、蛋白质工程、构型与构象、交错构象、Ramachandra构象图、多肽链的构象角、氨基酸残基、肽单位、螺旋偶极子、两亲性螺旋、π螺旋、疏水内核、结构模体、基因、蛋白质折叠、分子伴侣 2、蛋白质工程的主要步骤包括哪些? 3、蛋白质工程的基本目标、基本途径及中心问题是什么? 4、二十种常见氨基酸按侧链性质可分为极性氨基酸和疏水氨基酸,其中疏水氨基酸包括A1a、Val、Leu 、Ile、Met 、Pro、Phe . Gly(极性or非极性);极性氨基酸又可分为极性不带电荷Ser、Thr、Asn、Gln、Cys、Tyr 、Trp(有时归于非极性氨基酸)和His,极性带正电荷Arg、Lys,极性带负电荷Asp、G1u。 5、芳香族氨基酸包括Tyr、Trp、Phe,具有哪两种特性。光谱特性和紫外线吸收特性 6、强烈倾向于形成α螺旋的氨基酸残基包括Ala、Glu、Leu和Met;非常不利于α螺旋形成的残基有Pro、Gly 、Tyr和Ser。 7、平行β层和反平行β层的区别。 8、简述环肽链及环肽链结构库的意义。 10、结构域的定义及其特征。 13、写出下列字母或词组的中文含义: PDB-----蛋白质结构数据库protein data bank,PDB
coiled-coil αhelix------线绕式α螺旋 domain------结构域 loop----环肽链 codon----密码子 14、蛋白质在体内形成的两个阶段以及蛋白质工程设计和制造新蛋白质的基础性困难是什么? 15、蛋白质工程中增加蛋白质稳定性的基本途径有哪些? 第二章蛋白质分子设计复习题 1、内核假设、二元模式 2、简述蛋白质设计的目的及存在问题。 3、一般来说蛋白质设计循环包含哪几个步骤。 5、为什么说蛋白质工程是一个具有反向生物学性质的新课题。 6、何谓全新蛋白质设计。 9、在自然界惟一用于肽链交叉连接的方法是? 10、蛋白质功能设计的途径有哪些? 第三章蛋白质的修饰和表达复习题 1、蛋白质修饰的化学途径包括哪两种? 2、、重叠延伸、盒式突变法、质粒不相容性 4、写出下列词的中文含义:DTT、PCR、Tet 、Amp、E.coli、 5、利用基因融合技术表达外源基因的缘由有哪些? 6、为什么说大肠杆菌表达体系是外源基因表达的首选体系?