
A n n e x i n V检测细胞凋亡
实验原理
Annexin V 是检测细胞凋亡的灵敏指标之一。它是一种磷脂结合蛋白,可以与早期凋亡细胞的胞膜结合,而细胞质膜的改变是细胞发生凋亡时最早的改变之一。在细胞发生凋亡时,膜磷脂酰丝氨酸(PS) 由质膜内侧翻向外侧。Annexin V 与磷脂酰丝氨酸有高度亲和力,因而与细胞外侧暴露的磷脂酰丝氨酸结合。由于在发生凋亡时,磷脂酰丝氨酸外翻的发生早于细胞核的改变,因此,与DNA 碎片检测比较,使用Annexin V 可以更早地检测到凋亡细胞。因为细胞坏死时也会发生磷脂酰丝氨酸外翻,所以Annexin V 常与鉴定细胞死活的核酸染料(如PI 或7-AAD)合并使用,来区分凋亡细胞(Annexin V+/核酸染料-) 与死亡细胞(Annexin V+/核酸染料+)。
实验用品
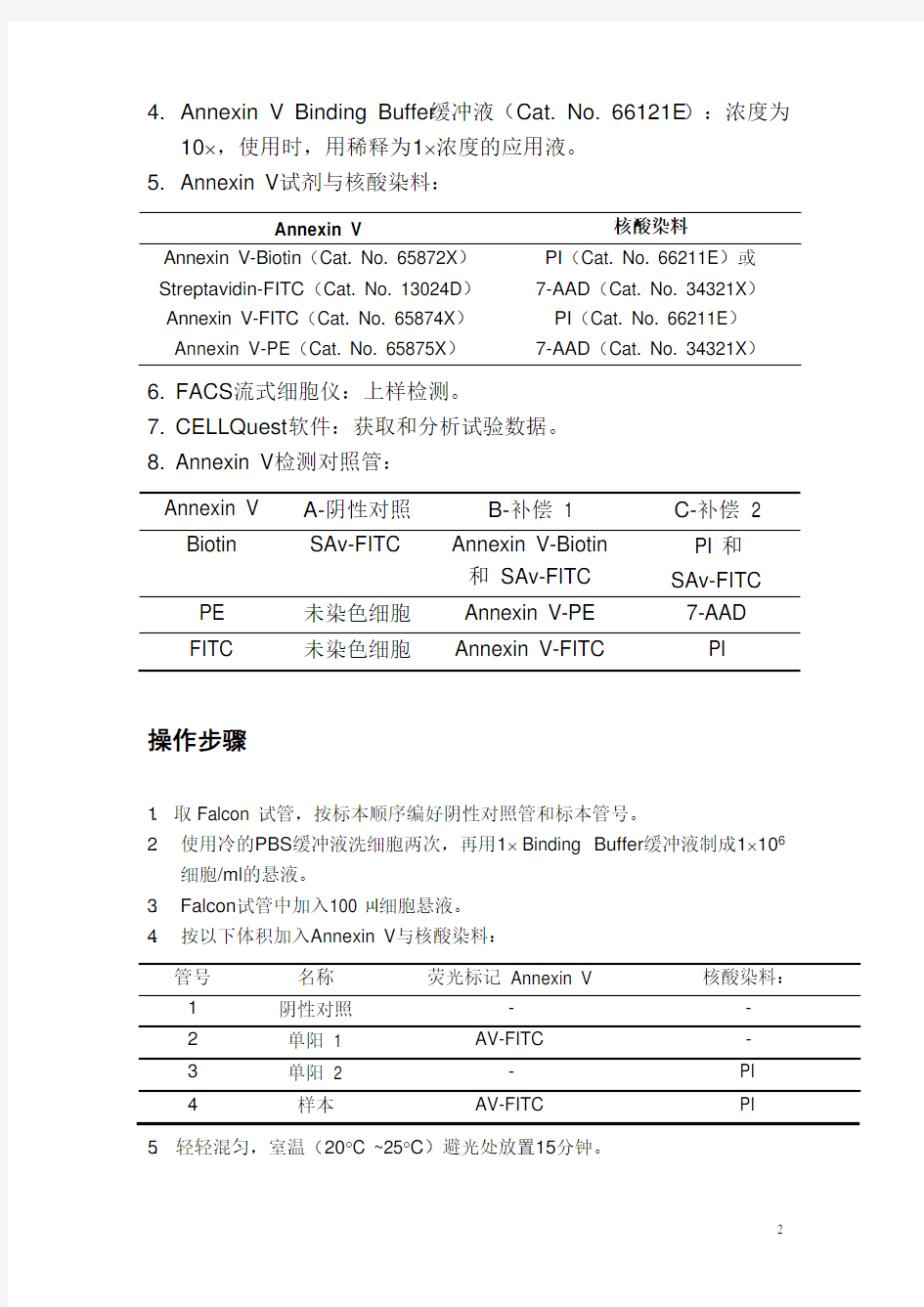
1. 一次性12?75mm Falcon试管。
2. PBS缓冲液:含0.1%NaN3,过滤后2-8?C保存。
3. 微量加样器和加样头。
4. Annexin V Binding Buffer缓冲液(Cat. No. 66121E):浓度为
10?,使用时,用稀释为1?浓度的应用液。
5. Annexin V试剂与核酸染料:
Annexin V 核酸染料
Annexin V-Biotin(Cat. No. 65872X)Streptavidin-FITC(Cat. No. 13024D)
PI(Cat. No. 66211E)或7-AAD(Cat. No. 34321X)
Annexin V-FITC(Cat. No. 65874X)PI(Cat. No. 66211E)Annexin V-PE(Cat. No. 65875X)7-AAD(Cat. No. 34321X)
6. FACS流式细胞仪:上样检测。
7. CELLQuest软件:获取和分析试验数据。
8. Annexin V检测对照管:
Annexin V A-阴性对照B-补偿1 C-补偿2
Biotin SAv-FITC Annexin V-Biotin
和SAv-FITC
PI 和SAv-FITC
PE 未染色细胞Annexin V-PE 7-AAD
FITC 未染色细胞Annexin V-FITC PI
操作步骤
1.取Falcon 试管,按标本顺序编好阴性对照管和标本管号。
2.使用冷的PBS缓冲液洗细胞两次,再用1?Binding Buffer缓冲液制成1?106
细胞/ml的悬液。
3.Falcon试管中加入100 μl细胞悬液。
4.按以下体积加入Annexin V与核酸染料:
1阴性对照--
2单阳1 AV-FITC -
4样本AV-FITC PI 5.轻轻混匀,室温(20?C ~25?C)避光处放置15分钟。
流式细胞仪实验方法 一、实验准备 1.标本制备: 2.最小化非特异性结合: 二、凋亡 1.凋亡的检测方法:和其它 2.PI染色法 3.Annexin V 法 4.TUNNEL法 三、细胞因子 1.激活的细胞因子 2.CBA 四、血小板 1.活化 2.活化检测 3.网织血小板 五、红细胞 1.网织红细胞 2.PNH 3.胎儿红细胞 六、肿瘤学 1.DNA 细胞周期 2.蛋白 3.多药耐药 4.微小残留白血病
第一部分标本处理 一、流式细胞术常规检测时的样品制备 (一)直接免疫荧光标记法 取一定量细胞(约1X106细胞/ml),在每一管中分别加入50μl的HAB,并充分混匀,于室温中静置1分钟以上(),再直接加入连接有荧光素的抗体进行免疫标记反应(如做双标或多标染色,可把几种标记有不同荧光素的抗体同时加入),。孵育20-60分钟后,用PBS(pH7.2—7.4)洗1-2次,加入缓冲液重悬,上机检测。本方法操作简便,结果准确,易于分析,适用于同一细胞群多参数同时测定。虽然直标抗体试剂成本较高,但减少了间接标记法中较强的非特异荧光的干扰,因此更适用于临床标本的检测。 (二)间接免疫荧光标记法 取一定量的细胞悬液(约1X106细胞/ml),先加入特异的第一抗体,待反应完全后洗去未结合抗体,再加入荧光标记的第二抗体,生成抗原—抗体—抗抗体复合物,以FCM检测其上标记的荧光素被激发后发出的荧光。本方法费用较低,二抗应用广泛,多用于科研标本的检测。但由于二抗一般为多克隆抗体,特异性较差,非特异性荧光背景较强,易影响实验结果。所以标本制备时应加入阴性或阳性对照。另外,由于间标法步骤较多,增加了细胞的丢失,不适用测定细胞数较少的标本。 二、最小化非特异性结合的方法 1.荧光标记的抗体的浓度应该合适,如果浓度过高,背景会因为非特异性的相互作用的增加而增加。 2.在使用第一抗体之前,将样品与过量的蛋白一起培育,如小牛血清蛋白(BSA),脱脂干奶酪,或来自于同一寄主的正常血清来作为标记的第二抗体。这个步骤通过阻断第一抗体和细胞表面或胞结构的非特异性的交互作用来降低背景。 3.在使用第一抗体之后,将样品与5%至10%的来自于同一寄主的正常血清和作为标记的第二抗体一起培育。这个步骤会减少不必要的第二抗体与第一抗体、细胞表面或胞结构之间的交互作用。 通过用来自于同样的样品的血清稀释标记过的抗体可以略过此步骤。此步骤适用于很多方面,但有时候它也会导致已标记的第二抗体和正常血清中的免疫球蛋白的免疫复合体的形成。这种复合体会优先与一些细胞结构进行结合,或者它们最终会导致期望得到的抗体活性的丢失。 4.使用F(ab’)2片段会使背景决定于第一或第二抗体与FC受体的全分子结合。大多数的第二抗体的F(ab’)2片段容易利用。而第一抗体的F(ab’)2 存在的条件下,将新鲜组织或片段一般是不能利用或很难制作。因此,在NaN 3
精品文档,放心下载,放心阅读 流式细胞仪常用的几种检测方法(转载) 一、测定用乙醇固定的DNA的含量 1、培养细胞的DNA含量的测定精品文档,超值下载 制备单细胞悬液于200μl的PBS缓冲液中; 加入2ml预冷的70%乙醇,4℃保存; 附:细胞固定的一般步骤 1) 取单细胞悬液1~2×106个细胞于PBS(PH=7.2)缓冲液中; 2) 300g离心5分钟,弃上清,反复两次; 3) 重悬细胞于0.5ml PBS缓冲液中; 4) 将细胞悬液放置于2~3ml冷70%乙醇中,混匀,保存于4℃,至少30分 钟。在4℃条件下可保存2~3周。 注意: 2根据实验的要求,固定剂也可选用1~3%多聚甲醛; 2将乙醇作为固定剂时,乙醇应预冷至0~4℃; 2细胞在固定时,固定剂应缓慢滴入细胞悬液中,使固定剂的浓度缓慢增加,并不断震摇,以免细胞成团(特别是用乙醇固定时)。 2 300g离心5分钟,去上清,再重悬于400μl PBS中; 2显微镜下观察,若有明显的黏附,须再用筛网过滤; 2加入PI(含Rnase),避光孵育30分钟; 2上机检测。 2、新鲜组织的DNA含量的测定 1) 用200mg湿重组织用机械法制成单细胞悬液; 2) 500g离心5分钟; 3) 弃上清,重悬于10ml染色-去污剂中; 4) 再过滤,用200目的筛网或70~80μm的筛网过滤; 5) 上机检测。 3、石蜡包埋组织切片的DNA含量的测定 1) 从石蜡包埋切取切片50 μm厚,2~3片,制成单细胞悬液; 2) 用PBS缓冲液洗涤,500g离心5分钟,弃上清; 3) 加入PI液1ml室温避光30分钟; 4) 调整细胞浓度为1×106/ml; 5) 上机检测。
1.每天开机后需要检测校准;把测试模块两面涂好耦合剂后,放入骨密度仪测试位置,模块突出部放入仪器圆弧槽,有字的面朝上后,准备进行检测校准。 2.检测仪开机后,进入测试界面,然后点击“设置”,再点击右边“开始测试”;“系统检查成功结束”后,再点击“开始测试”,此过程需要重复做3次。 3.“开始测试”3次测完后,点击“主画面”,然后点击“测定”进入界面后,姓名输入:mk和成人的出生年月;然后点击右上角的“开始测试”,界面显示正在测试,当测试成功后取出模块,点击右上角“下一个”查看校准结果,校准值要接近模块的SOS标记值,例如,SOS:1665。 4. 当显示结果SOS值接近标记值,OI值上方显示有黑点,然后点击“主画面”,然后在患者信息里,输入姓名和出生年月、性别以及测试脚的信息后,点击右上角的“开始测试”,根据脚的大小在界面显示区域时选择对应脚垫后,点击右上角的“开始测试”,界面显示正在测试,测试成功后取出脚,点击右上角“下一个”查看测试结果。 5.点击右上角的“打印”显示打印结果,(当连接好的打印机开机时)然后再点击显示界面左上角的“打印机图标”,就会打印出图示的结果。 测试过程中注意事项: 1.耦合剂涂到皮囊测试脚的位置,要均匀适量多;脚慢慢滑入到测试位置,小心不要踩坏或者划破皮囊。 2.脚的大小根据界面图示,垫对应的脚垫。 3.请将第二足趾定位于脚踏板的正中线。 4.将第二足趾与鼻尖、身体中线和膝盖定位于一条直线。 5.将双手轻轻的放到测量足的膝盖上,轻微的倾斜身体,坐稳后开始测试。 6.在测量过程中不要动腿、动脚。 7.请仔细阅读说明书。 请遵循上述详细信息,如不遵守,可能影响结果。
流式细胞仪常用的几种检测方法(转载) 一、测定用乙醇固定的DNA的含量 1、培养细胞的DNA含量的测定 制备单细胞悬液于200μl的PBS缓冲液中; 加入2ml预冷的70%乙醇,4℃保存; 附:细胞固定的一般步骤 1) 取单细胞悬液1~2×106个细胞于PBS(PH=7.2)缓冲液中; 2) 300g离心5分钟,弃上清,反复两次; 3) 重悬细胞于0.5ml PBS缓冲液中; 4) 将细胞悬液放置于2~3ml冷70%乙醇中,混匀,保存于4℃,至少30分 钟。在4℃条件下可保存2~3周。 注意: 2根据实验的要求,固定剂也可选用1~3%多聚甲醛; 2将乙醇作为固定剂时,乙醇应预冷至0~4℃; 2细胞在固定时,固定剂应缓慢滴入细胞悬液中,使固定剂的浓度缓慢增加,并不断震摇,以免细胞成团(特别是用乙醇固定时)。 2 300g离心5分钟,去上清,再重悬于400μl PBS中; 2显微镜下观察,若有明显的黏附,须再用筛网过滤; 2加入PI(含Rnase),避光孵育30分钟; 2上机检测。 2、新鲜组织的DNA含量的测定 1) 用200mg湿重组织用机械法制成单细胞悬液; 2) 500g离心5分钟; 3) 弃上清,重悬于10ml染色-去污剂中; 4) 再过滤,用200目的筛网或70~80μm的筛网过滤; 5) 上机检测。 3、石蜡包埋组织切片的DNA含量的测定 1) 从石蜡包埋切取切片50 μm厚,2~3片,制成单细胞悬液; 2) 用PBS缓冲液洗涤,500g离心5分钟,弃上清; 3) 加入PI液1ml室温避光30分钟; 4) 调整细胞浓度为1×106/ml; 5) 上机检测。 二、细胞凋亡检测及相关分子检测 1、细胞DNA含量分布(由细胞DNA降解方式检测细胞凋亡)
X、丫射线骨密度仪质量控制操作细则 为规范实施X、丫射线骨密度仪质量控制,参照《X、丫射线骨密度仪检定规程》JJG 1050—2009,结合我单位检测模体四肢体模和腰椎体模,制定X、丫射线骨密度仪质量控制操作细则。 环境温度:15C?30C;湿度:应不超过80%RH。 1、重复性 单光子骨密度仪 在正常使用条件下,对四肢体模骨筒样品BMC在(0.3?0.7g/cm和(1.4? 2.0)g/cm范围内,各选一个骨筒样品连续测量n次(n=10)o骨横径和骨矿含量重复性用相对标准偏差V表示,V按式(1)计算: 双能X射线骨密度仪 在正常使用条件下,将腰椎体模放在测量位置,对骨密度接近于lg/cm2的骨筒样品连续测量n次(n=10)。重复性用相对标准偏差V表示,V按式(1)计算,但式中XI为第I次BMD (g/cm2)测量值,次为n次BMD (g/cm2)平均值。 2骨密度测量结果的误差 单光子骨密度仪骨横径 在正常使用条件下,将四肢体模放在测量位置上,对每一个骨筒样品测量三次。BW测量值的误差用相对误差E表示,按(2)计算: 单光子骨密度仪骨矿含量 在正常使用条件下,将四肢体模放在测量位置上,对每一个骨筒样品测量三次,
三次取平均值。BMC测量值的误差用相对误差E表示,按式(3)计算: 双能X射线骨密度仪骨密度 在正常使用条件下,对腰椎体模中每一个椎骨样品测量三次,三次取平均值。仪器BMD测量值的误差用相对误差E表示,按式(4):计算: 若单光子骨密度仪骨横径和骨矿含量,'以及双能X射线骨密度仪骨密度超差时,允许对测量结果进行线性校正(线性校正方法见附录C)后重新计算测量误差。 3、单光子骨密度仪短期稳定性 在正常使用条件下,将四肢体模放于测量位置,在8h内,对四肢体模骨筒样品BMC在(0.3?0.7)g/cm和(1.4?2.0)g/cm范围内各选一个骨筒样品连续测量n次(n=10),测量时间间隔不应大于lh。然后用式⑸ 分别计算BW和BMC (g/cm)短期稳定性。 4、辐射防护性能 单光子骨密度仪 用X、丫射线辐射防护仪测量与单光子骨密度仪机房相近环境的电离辐射本底,用空气比释动能率表示。然后测量骨密度仪可接近表面任何一点的空气比释动能率,计算测量结果与环境本底之差。 双能X射线骨密度仪
流式检测细胞凋亡 Annexin V 检测细胞凋亡 (2) 实验原理 (2) 实验用品 (2) 操作步骤 (3) Annexin V Blocking (5) 凋亡细胞的DNA 断裂片段分析 (7) 实验原理 (7) 实验用品 (8) 操作步骤 (9) BrdU Flow Kits 检测细胞增殖 (12) 实验原理 (12) BrdU Flow Kits 试剂盒 (12) 结果分析 (17) 流式仪器设置指南 (18) 线粒体膜电位变化检测细胞凋亡 (22) 实验原理 (22) 实验用品 (22) 样本制备 (23) 结果分析 (24) 注意事项 (24) Active Caspase-3 检测细胞凋亡 (26) 实验原理 (26) 实验步骤 (27) 结果分析 (28)
Annexin V 检测细胞凋亡 实验原理 Annexin V 是检测细胞凋亡的灵敏指标之一。它是一种磷脂结合蛋白,可以与早期凋亡细胞的胞膜结合,而细胞质膜的改变是细胞发生凋亡时最早的改变之一。在细胞发生凋亡时,膜磷脂酰丝氨酸(PS) 由质膜内侧翻向外侧。Annexin V 与磷脂酰丝氨酸有高度亲和力,因而与细胞外侧暴露的磷脂酰丝氨酸结合。由于在发生凋亡时,磷脂酰丝氨酸外翻的发生早于细胞核的改变,因此,与DNA 碎片检测比较,使用Annexin V 可以更早地检测到凋亡细胞。因为细胞坏死时也会发生磷脂酰丝氨酸外翻,所以Annexin V 常与鉴定细胞死活的核酸染料(如PI 或7-AAD)合并使用,来区分凋亡细胞(Annexin V+/核酸染料-) 与死亡细胞(Annexin V+/核酸染料+)。 实验用品 1. 一次性12×75mm Falcon试管。 2. PBS缓冲液:含0.1%NaN ,过滤后2-8°C保存。 3 3. 微量加样器和加样头。
FACSCalibur流式细胞仪操作规程 一、编号:YQ0606 二、标题:FACSCalibur流式细胞仪操作规程 三、关键词:流式细胞仪操作规程 四、目的:保证流式细胞仪的安全及有效操作 五、背景知识:流式细胞术(Flow CytoMeter,FCM)是一种在功能水平上对单细胞或其他生物粒子进行定量分析和分选的检测手段,它可高速分析上万个细胞,并能同时从一个细胞中测得多个参数,与传统荧光镜检查相比,具有速度快、精度高、准确性好等优点,成为当代最先进的细胞定量分析技术。 六、原理 待测细胞染色后制成单细胞悬液,用一定压力将待测样品压入流动室,不含细胞的磷酸缓冲液在高压下从鞘液管喷出,鞘液管入口方向与待测样品流成一定角度,这样鞘液就能够包绕着样品高速流动,组成一个圆形的流束,待测细胞在鞘液的包被下单行排列,依次通过检测区域。 流式细胞仪通常以激光作为发光源。经过聚焦整形后的光束,垂直照射在样品流上,被荧光染色的细胞在激光束的照射下,产生散射光和激发荧光。这两种信号同时被前向光电二极管和90°方向的光电倍增管接收。光散射信号在前向小角度进行检测,这种信号基本上反映了细胞体积的大小;荧光信号的接受方向与激光束垂直,经过一系列双色性反射镜和带通滤光片的分离,形成多个不同波长的荧光信号。 这些荧光信号的强度代表了所测细胞膜表面抗原的强度或其核内物质的浓度,经光电倍增管接收后可转换为电信号,再通过A/D转换器,将连续的电信号转换为可被计算机识别的数字信号。计算机把所测量到的各种信号进行计算机处理,将分析结果显示在计算机屏幕上,液可以打印出来,还可以数据文件的形式存储在硬盘上以备日后的查询或进一步分析。 检测数据的显示视测量参数的不同由多种形式可供选择。单参数数据以直方图的形式表达,其X轴为测量强度,Y轴为细胞数目。一般来说,流式细胞仪坐标轴的分辨率有512或1024通道数,这视其模数转换器的分辨率而定。对于双
2.2.2.5 流式细胞术检测细胞周期 2.2.2.5.1 实验原理 用流式细胞仪检测细胞周期,通常用碘化丙啶(propidium iodide,PI)染细胞核。PI在一定波长的光下发出荧光,其强度与DNA含量成正比。通过流式细胞仪分析各时期的细胞百分数,可检测细胞的增殖、凋亡。 2.2.2.5.2流式细胞仪检测A549细胞周期步骤 收集对数生长期细胞,计数,以(1~5)×105/孔接种于6孔板,置37℃,5%CO2条件下培养过夜,使细胞贴壁。次日更换培养液,各孔分别加入含有0、80、400、2000、10000 mg/L不同浓度茶氨酸的细胞培养液2 mL/孔,继续常规培养;每24 h同法换液一次。每个浓度设3个重复。 48 h后,中止培养,胰酶消化后,收集细胞于流式管1000 r/min离心5min,弃上,冷PBS洗涤细胞3次,离心去上清; 一边震荡一边向细胞沉淀中加入70%预冷乙醇混匀,4℃固定18 h以上;离心,弃去乙醇上清,加入预冷的PBS洗沉淀1次,离心去上清; 加入RNA酶(50 mg/L)10 μL/孔和PI(50 mg/L)300 μL/孔,震荡混匀。室温、避光反应30 min; 流式细胞仪进行DNA检测,用Modifit软件分析各时相细胞周期的比例。 2.2.2.6流式细胞仪检测A549细胞凋亡 2.2.2.6.1实验原理 在正常细胞中,磷脂酰丝氨酸(PS)只分布在细胞膜脂质双层的内侧,而在细胞凋亡早期,细胞膜中的磷脂酰丝氨酸(PS)由脂膜内侧翻向外侧。AnnexinV 是一种分子量为35~36 kD的Ca2+依赖性磷脂结合蛋白,与磷脂酰丝氨酸有高度亲和力,故可通过细胞外侧暴露的磷脂酰丝氨酸与凋亡早期细胞的胞膜结合。因此AnnexinV被作为检测细胞早期凋亡的灵敏指标之一。 碘化丙啶(PI)是一种核酸染料,它不能透过完整的细胞膜,但对凋亡中晚期的细胞和死细胞,PI能够透过细胞膜而使细胞核染红。因此将AnnexinV与PI匹配使用,就可以将处于不同凋亡时期的细胞区分开来。 2.2.2.6.2 结果判断 凋亡细胞对所有用于细胞活性鉴定的染料如PI 有抗染性,坏死细胞则不能。 细胞膜有损伤的细胞的DNA 可被PI着染产生红色荧光,而细胞膜保持完好的细胞则不会有红色荧光产生。因此,在细胞凋亡的早期PI 不会着染而没有红色荧光信号。正常活细胞与此相似。在双变量流式细胞仪的散点图上,左下象
一、开机程序: 1.检查鞘液桶和废液桶。确认鞘液充满状态(鞘液为鞘液桶体积的3/4位 置,可以连续工作3个小时左右)、盖紧黑盖、管道畅通、废液桶有足 够空间容纳本批标本排弃的废液。如果要添加鞘液,要先释放鞘液桶中 气压。 2.依次打开流式细胞仪FACSCalibur稳压器、主机开关、电脑开关,打印 机。 3.气压阀置于加压位置,待流式细胞仪处于STANDBY状态,做Prime,以 排除管路中气泡。 二、运行FACSComp软件、检查仪器状况 1.制备三色标准微球样本。一般情况向1ml鞘液(或过滤PBS)中加入 1滴质控小微球,也可以根据实际情况调节浓度。 2.机器预热5 min,打开FACSComp软件,选择保持路径。选择所需校 正内容,如果使用的微球是新一批产品要输入微球的批号。 3.在软件界面左侧Assay Selection选项中选择质控类型,即实验过 程中是否需要清洗样品。 4.上样品,微球溶液上样之前要充分混匀。功能键设置在“RUN”。 5.仪器自动检查,并做电压、补偿等设置。 6.FACSComp软件运行完毕,显示结果通过测试。 7.做Set up。 8.打印校正结果,退出FACSComp程序。 备注:在质控过程中,如果提示收集细胞速度慢可以提高细胞收集速度,但是在调节灵敏度(Sens)时,一定要用“Low”的状态上样,保证仪器灵敏度的准确。在使用仪器过程中要养成好的习惯,在上样品过程中,仪器保持在“Low”“Standby”状态。 三、样品分析软件:CellQuest Pro 软件,选择“联机”。 1.
(2)对实验样本进行命名; (3)对实验通道进行预设(FSC,SSC,FL1-FL4)。 备注:如果界面被关闭,重新调出步骤: 2.调出质控模板。 3.画图 选择画图工具(一般选择散点图),Inspect 界面会自动弹出,对几个常用选项进行设定:将散点图选中(用鼠标点击散点图边框才能够 选中图形),将 更改横纵坐 备注:第一个散点图横坐标为FSC,纵坐标为SSC 。 (1一般获取10000个细胞。 (2 ( 3)将所有补偿调为0 (4)将非 52 (5)FSC和SSC (6 4.上阴性对照 将阴性对照管混匀,上机,功能键设置在“RUN”,散点图出现细胞信 号,第一个图:让细胞信号出现在自己看上去舒服的区域;其他三个 散点图,要将细胞信号调整到阴性区域,即左下角区域。通过移动通
流式细胞术实验方法 PI 染色操作步骤 1、将单细胞悬液加入2ml圆底离心管中,离心,1500rpm , 5min,弃上清液。 2、加入PBS 1ml离心洗涤1次,弃上清。 3、加入2ml预冷的70%酒精,4℃固定30min,或是-20℃固定过夜。 4、离心,弃上清液。 5、用1×PBS 1ml洗涤1次,离心。 6、加入RNase A (工作浓度20ug/ml)于500ul 1×PBS中,37℃孵育30min,离心。 7、用1×PBS 1ml洗涤1次,离心。 8、加入PI(工作浓度50ug/ml) 于500ul 1×PBS中,室温避光孵育30min。 9、混匀,过300目筛网,置流式管中, 4℃冰箱保存,待测。 GFP PI染色操作步骤 1、将单细胞悬液加入2ml圆底离心管中,离心,1500rpm , 5min,弃上清液。 2、加入PBS 1ml离心洗涤1次,弃上清。 3、加入2ml预冷PFA,PFA的浓度根据细胞的特点进行调节,4℃固定30min。 以下步骤同PI 染色操作步骤的(4-9) 细胞表面直接免疫荧光染色操作步骤 1、将单细胞悬液加入2ml圆底离心管中,离心,1500rpm , 5min,弃上清液。 2、以冷PBA 1ml,离心洗涤,弃上清液。 3、加入用PBA稀释的荧光素标记的抗体200ul。用微量移液器轻轻吹打混匀,4℃或置冰上孵育30min-1h。 4、离心弃上清液。 5、加入冷PBS1ml,离心洗涤2次,以除去未结合的多余抗体成分。 6、向细胞中加入冷PBS 500ul,吹打混匀,置流式管中,4℃避光保存,待测。 细胞表面间接免疫荧光染色操作步骤 1-2、同细胞表面直接免疫荧光染色操作步骤 3、用PBA稀释的第一抗体200ul,对照管加入对应于一抗的正常实验动物IgG,轻轻吹打混匀,4℃或置冰上孵育1、5-2h。离心,弃上清。 4、 BS1ml离心洗涤1次,以去除多余的未结合的特异性抗体。 5、 PBA适当稀释的荧光素标记的第二抗体200ul。吹打混匀,4℃或置冰上孵育30min,避光。 6、 PBS 1ml离心洗涤2次。
细胞分选的简要操作步骤 一、上样前的准备 FACSCalibur可以分选细胞进行培养或功能性研究,而这些研究需要清洁环境以保持分选后细胞不受污染继续培养,因此在样本制备,上机检测分选等过程中需严格按无菌技术操作。 1、应用无菌技术制备下列无菌工作液。 ●3L 70% 乙醇(用无菌蒸馏水配制) ●5L 无菌蒸馏水 ●5L 无菌PBS 2、在干净的鞘液筒中加入3L 70% 乙醇。盖紧盖子,振摇鞘液筒,确保桶内壁被乙醇充 分洗涤。安好鞘液筒。 3、将过滤器短接,否则乙醇将破坏滤膜。。 4、用70%乙醇冲洗收集管接口处,并喷洒进样口处的空气。 5、在收集管接口处安装2支BD 50ml收集管(若不使用浓缩器)。 6、放上一支装有70 % 乙醇的进样管。 7、设分选门(画一个空门使机器进行分选操作)。 9、从Acquire menu选择SortSetup 。在Sort Gate菜单中选择步骤7设定的分选门。 按液流控制键RUN。 10、在Setup方框中打叉,点击Acquisition Control菜单中Acquire。。 11、跑乙醇直至2支收集管注满(每管注满需要9min),点击Pause,Abort。 12、再重复上述步骤2次,共需要1h。 13、断开鞘液筒,在鞘液筒中加入500mL 无菌蒸馏水,振摇鞘液筒,倒掉液体,反复 操作直至洗净桶内壁残余乙醇。 14、在鞘液筒中加入3L无菌蒸馏水,盖紧盖子。安好鞘液筒。 15、在收集管接口处安装2支新的收集管。 16、放上一支装有无菌蒸馏水的进样管。 17、点击Acquisition Control菜单中Acquire。 18、跑无菌蒸馏水直至2支收集管注满(每管注满需要9min),点击Pause,Abort。 19、再重复上述步骤2次,共需要1h。 20、断开鞘液筒,在鞘液筒中加入3L 无菌PBS,盖紧盖子。安好鞘液筒。 21、在收集管接口处安装2支新的收集管。 22、放上一支装有无菌PBS的进样管。 23、点击Acquisition Control菜单中Acquire。 24、第一支收集管(最左)中收集15 mL PBS后取下,使PBS由左至右流入下一收集管。 重复操作至2个管都收集了15 mL PBS为止。点击Pause,Abort。 25、在收集管接口处安装2支新的收集管。若要分选动物细胞,则应用无菌技术,用无 菌PBS/4 % BSA缓冲液过夜包被50mL锥型管,将包被好的锥型管安置于收集接口。
利用流式细胞仪检测细胞周期和凋亡 1.细胞按每孔 4×105个的密度接种于 60 mm 细胞培养皿内,培养过夜后,用相应药物处理 细胞。 (设置实验组和对照组,实验组依辛伐他汀浓度分为 3 组,2μ mol/L、5μ mol/L、10μ mol/L 辛伐他汀组 正常对照组 (NC 组):胰岛素终浓度 0.058mg/L A 组:辛伐他汀终浓度2μ mol/L+胰岛素终浓度0.058mg/L ; B 组:辛伐他汀终浓度5μ mol/L+胰岛素终浓度0.058mg/L ; C 组:辛伐他汀终浓度10μ mol/L+胰岛素终浓度0.058mg/L ; 于 37℃, 5%CO2 培养箱中孵育 48h) 2. 胰酶消化收集细胞,并用 1 mL PBS 缓冲液清洗剩余细胞一次,全部加入15ML 管中。 3.800 rpm 离心 5 分钟,去除上清,加 5 mL PBS 缓冲液重悬细胞,再次离心弃上清,重复 两次,最后重悬细胞于0.5mL PBS 中。 4.用低速振荡器边震动边加入5 mL 预冷的 70%乙醇,固定, 4℃过夜。 5.次日将固定好的细胞以 1000 rpm 的转速离心 5 分钟,弃上清,加入 4 mL PBS 清洗一次,用 0.4 mL PBS 重悬细胞。 6. 加入 5 μL RNaseA( 10 mg/ml ) 37℃消化 1 (propidium iodide PI )4℃避光染色过夜(或者小时,加入终浓度50 mg/mL碘化丙啶37℃避光染色 1 小时),在 EPICS XL 流 式细胞仪上分析。 利用流式细胞抗体检测检测细胞膜表面蛋白的变化 1.细胞按每孔 4×105个的密度接种于 60 mm 细胞培养皿内,培养过夜后,用相应药物处理 细胞。 2.胰酶消化收集细胞,并用 1 mL PBS 缓冲液清洗剩余细胞一次,全部加入15ML 管中。 3 . 800 rpm 离心 5 分钟,去除上清,加 5 mL PBS 缓冲液重悬细胞,再次离心弃上清,重复 两次,最后重悬细胞于0.1mL PBS中,并转移到 1.5 mL离心管中。 4. 按照1:100加入1UL一抗(如下图对应),置于垂直混合液上室温孵育1-2小时。 5. 1500rpm ,小型离心机离心 5 分钟,去除上清,加 1 mL PBS 缓冲液重悬细胞,再次离心弃上清,重复 3 次,最后将洗好的细胞重悬于0.1mL PBS 中。
流式细胞仪检测细胞周期操作步骤 取对数生长期的A549细胞,按1×106 cells/mL以1mL接种于 100mm培养皿内 ↓ 24h后,进行所需的处理(比如加药,照射) ↓ 特定时间后终止培养,进行下一步的实验 ↓ 收集原培养液,洗后的PBS和消化后的细胞,将三者混匀放入15ml 离心管中 ↓ 1000rpm离心5min(短时低速离心) ↓ 弃上清,用1.5ml预冷PBS,1000rpm离心5min后去除PBS和细胞 悬液内的细胞碎片 ↓ 加入1.5ml预冷PBS,在涡旋状态下加入3.5ml无水乙醇,混匀后,于4℃固定30min,或-20℃长期保存。 ↓ 1000r/min,离心5min ↓
将乙醇吸除,加PBS清洗混匀 ↓ 1000r/min,5min再离心一遍,将残留在细胞上的乙醇除去 ↓ 吸除离心管内PBS,加入200ul PBS和2ul的RNA酶(0.25mg/ml)(37℃下孵育30min) ↓ 加入0.5ml的50ug/ml的PI溶液室温下避光染色30min ↓ 将离心管内的细胞过滤(300um尼龙网膜)至含有PBS的EP管中(PI 具有很强的粘附性,容易使细胞聚团),标记EP管 ↓ 提前一天网上预约 ↓ 开机(先开仪器后开软件) ↓ 流式细胞仪的结构一般分为5部分:①流动室及液流驱动系统;②激光光源及光束成形系统;③光学系统;④信号检测、存贮、显示、分析系统;⑤细胞分选系统。 ↓ 检测前先涡旋使细胞混匀悬浮呈单个细胞,然后插入流式细胞仪上
↓ 流动室内充满鞘液,细胞排成单列由喷嘴中心喷出,形成细胞液柱 ↓ 液柱与激光束相交,细胞上的荧光染料被激发产生荧光(488nm激 发光源) ↓ 荧光信号变成电信号输出到计算机,软件分析(荧光染料和细胞DNA分子特异性结合,可以检测出细胞周期各时相细胞比例) ↓ 在用第三方软件分析之前,将流式结果按如下所示导出 结果分析——Modfit软件分析
流式细胞仪的使用方法及相关资料 仪器名称:流式细胞仪 生产厂家:美国贝克曼库尔特有限公司 使用方法: 一.开机程序 1.检查稳压器电源,打开电源,稳定5分钟。 2.打开储液箱,倒掉废液, 并在废液桶中加入400ml漂白水原液。打开压力阀,取出鞘液桶,将鞘液桶加至4/5满(一般可用三蒸水,做分选必须用PBS或FACSFlow),合上压力阀。确实盖紧桶盖,检查所有管路是否妥善安置。 3.将FACSCalibur开关打开,此时仪器功能控制钮的显示应是STANDBY,预热5-10分钟。排出过滤器内的气泡。 4.如果需要打印,打开打印机电源。 5.打开电脑,等待屏幕显示出标准的苹果标志。 6.执行仪器PRIME功能一次,以排除Flow cell中的气泡。 7.分析样品时,先用FACAFlow 或PBS进行HIGH RUN约2分钟。 做过分选后,每次开机后需冲洗管道:向分选装置上装上两个50ml离心管,不接通浓缩系统,摁下右下角白色按钮开始冲洗。待自动停止后接通浓缩装置,同上法冲洗一次。 二.预设获取模式文件(Acquisition Template Files) 1.从苹果标志中选择CELLQuest见一个新视窗,可利用此视窗编辑一个获取模式文件。 2.选取屏幕左列绘图工具中的Dot plot,绘出一个或多个Dot Plots(点图)。从Dot Plot对话框中选取Acquisition作为图形资料来源,并确定适当的x轴和y轴参数。 3.选取屏幕左列绘图工具中的Histogram,同上法可绘出Histogram(直方图)。4.将此视窗命名后储存于FACStation G3\BD Applications \CELLQuest Folder \EXP文件夹中,下次进行相同实验时可直接调用。 本计算机中已设定两个模式文件:ACQ和EXP,储存于FACStation G3\BD Applications \CELLQuest \EXP文件夹中,ACQ用于细胞DNA检测,EXP用于细胞表面标志分析。 三.用CELLQuest进行仪器的设定和调整 1.从苹果画面中选取CELLQuest,进入CELLQuest后在File指令栏中打开合适的获取模式文件。 2.从屏幕上方Acquire指令栏中,选取Connect to Cytometer(快捷键:+B)进行电脑和仪器的连机。将出现的Acquisiton Control对话框移至合适位置。3.从Cytometer指令栏中,开启Detectors/Amps、Threshold、Compensation、Status 等四个对话框,并将它们移至屏幕右方,以便获取数据时随时调整获取条件。也可以用+1,2,3,4获得此四个对话框。 4.在Detectors/Amps对话框中,先为每个参数选择适当的倍增模式(amplifier mode):线性模式Lin或对数模式Log。一般进行细胞表面抗原分析如分析外周
Attune NxT流式细胞仪标准操作规程 一、启动Attune NxT流式细胞仪 1、依次打开电脑主机电源、显示器及仪器电源。电脑用户名为INSTR-ADMIN, 密码为INSTR-ADMIN(全部大写)。 2、双击Attune软件图标,用户名为admin,密码为password1(全部小写)。 3、检查仪器内四个液体容器,清空“waste”桶中的废液,确认“Focusing fluid”、 “Wash solution”和“Shutdown solution”三个桶中的液体量是否满足实验要求(液面较高)。 4、点击startup,等待机器启动,整个过程大约需要3分钟。仪器指示灯显示为 绿色,软件左下角出现绿色对勾即为启动完成。 5、点击performance test,在2mL鞘液中滴入3滴performance tracking beads, 混匀后上机,点击Run Performance test。Performance test每天运行1次。这个过程大约耗时3分钟。 二、检测样品 1、点击new experiment新建一个实验,选择tube或plate实验,输入实验名称, 采用默认的Workspace和仪器设置参数,输入Tube Groups和Tube Samples 的数量,点击OK。 2、双击软件右侧Experiment下的Compensation,在弹出的对话框中选择相应的 荧光通道,点击OK。 3、双击UC后上样,点击Run,并调节电压,电压调好后点击Record,依次将 每个单染色的样本上样,并点击Record记录其荧光信号。 4、荧光补偿调好之后双击sample,上样后点击Run即可得到样本的荧光信号。 根据需要建立散点图并建门。 三、关闭Attune NxT流式细胞仪 1、确认”wash solution”和”shutdown solution”桶中液面高度至少在桶高的一半以 上,清空“waste”桶。 2、点击shutdown,选择Quick、Standard或Full,样品管内加入3ml 10% bleach 液,点击next启动关机程序,此时请勿关闭软件或者终止shutdown过程,关
1、流式细胞术(英文flow cytometry)是一种生物学技术,用于对悬浮于流体中的微小颗粒进行计数和分选。这种技术可以用来对流过光学或电子检测器的一个个细胞进行连续的多种参数分析。 目录 * 1 原理 * 2 流式细胞仪(flow cytometer) * 3 应用 * 4 参见 原理 一束单色光(通常是激光)照到流体力学聚焦的一股流体上。若干个检测器瞄向流束和激光相交的这个点,其中一个和激光在同一直在线(称作前散射(FSC)),其它几个和激光垂直(旁散射(SSC)和一个或几个荧光监测器)。当每个悬浮颗粒通过光束时会按某种方式把光散射,同时所带有的荧光化合物被激发并发射出频率低于激发光的荧光。这些散射光和荧光的组合数据被检测器记录,根据各检测器亮度的波动(每个细胞会显出一个散射或荧光的峰)就能够推算出每个颗粒的物理和化学性质。前散射与细胞体积相关,而旁散射取决于颗粒的内部复杂程度(比如核的形状、胞质内颗粒的种类或者末的粗糙程度)。 可以检测的参数有: 细胞的体积和形态复杂程度、细胞中的色素、DNA(细胞周期分析、细胞动力学、细胞增殖等)、RNA 染色体分析和分选(文库构建、染色体涂染)、蛋白质、细胞表面抗原(CD标记)、胞内抗原(各种细胞因子(cytokine)、次级媒介等)、核抗原、酶活性、pH,胞内离子化的钙、镁,膜电势、膜流动性细胞凋亡(apoptosis)(定量检测DNA降解、线粒体膜电位、通透性变化)、细胞存活能力、监测细胞电通透性、氧爆作用(oxidative burst) 、研究癌细胞中的多重耐药性(multi-drug resistance, MDR) 、谷胱甘肽、各种组合(DNA/表面抗原等等) 流式细胞仪(flow cytometer) 流式细胞仪又称荧光激活细胞分选器、荧光活化细胞分类计(FACS,Fluorescence Activated Cell Sorter)。现代的流式细胞仪每秒可以实时检测几千个颗粒,并且可以主动分离具有不同特性的颗粒。 流式细胞仪和显微镜比较像,但能够对大量的单个细胞利用一组参数进行高通量的自动量化。固体组织需要在检测前制备成单细胞的悬浮液。 一个流式细胞仪包括五个组成部分: * 细胞流动系统:液流(鞘液(sheath fluid))携带细胞,使颗粒以串流形式通过光束。 * 光源:有通常的灯(汞或氙)、高功率水冷的激光源(氩、氪、染料激光)、低功率气冷激光(氩(488nm),红氦氖(633nm),绿氦氖,氦镉(紫外))、偶极激光(蓝、绿、红、紫)。 * 检测和模数转换(analogue-to-digital conversion, ADC)系统:产生前散射、旁散射光和荧光的信号。 * 放大系统,线性或对数放大。 * 计算机,用于分析信号。 早期的流式细胞仪主要是实验设备,但目前仪器和相关的试剂有了很广的市场。不同厂商的仪器特性也不同,主要的厂商和品牌如下: * Beckman-Coulter (ex-Coulter): Epics XL/XL-MCL; Epics Altra (Hypersort) (IBM-PC compatible platforms) * Becton, Dickinson: (FACS's): FACSCAlibur, FACScan, FACSort, FASCSVantage (Mac OS platform) FACS Canto, LSRII, Aria, DiVa (PC PLatform) * Cytomation: MoFlo, Cyan (IBM-PC platform) * Partec/Dako: Galaxy; PAS; CCA; PA (IBM-PC compatible platforms) 应用 流式细胞术在很多领域中都有应用,包括分子生物学、病理学、免疫学和海洋生物学等。在分子生物学中,
第四部分流式细胞术分析血小板 流式细胞术分析血小板 血栓性疾病、出血性疾病、心血管疾病以及自身免疫性血小板减少症等疾病的病理生理过程与血小板相关。血小板功能检测包括黏附、聚集和活化功能试验。使用流式细胞仪检测全血中血小板表面相关标志物是一种新技术,它拓宽了血小板相关疾病的诊断与功能研究方法,丰富了血小板功能评估指标。 一、流式细胞仪血小板分析应用范围 1.通过分析信号传递、细胞骨架结构、颗粒释放、糖蛋白构形、膜磷脂、与抗凝因子的结合和微粒形成,分析血小板活化,血小板对刺激物的反应性。 2. 通过分析受激后表面结合蛋白触发凝血链式反应和表面糖蛋白缺陷检测,分析血小板止血功能的 获得性和遗传性缺陷。 3. 结合血小板大小,检测血小板RNA含量,分析血小板成熟度,计数网织血小板。 4. 发现血小板抗体,做定性和定量分析。 二、血小板分析的临床意义 1. 血栓性疾病:活化血小板的检测能预测冠状血管成形术后发生急性缺血事件的危险性,非风湿 性心房纤颤患者栓塞和栓塞前期均有血小板活化,胰岛素依赖性糖尿病,子痫前期,外周血管疾病等均可测出血小板活力增加和(或)循环中存在活化血小板,而早产儿的血小板对凝血酶、二磷酸腺苷(ADP)、TXA2的体外激活能力降低。 2. 血小板缺陷性疾病:全血法流式细胞术提供了一个简单、迅速的方法来诊断血小板膜糖蛋白缺 陷性疾病,如巨大血小板综合征,血小板无力症等。前者是由于GPIb-IX复合物先天缺陷所致的血小板形态巨大,功能异常的出血性疾病。后者由于GPⅡb/Ⅲa复合物先天缺陷,导致血小板聚集功能障碍 3. 贮存池疾病:原发性贮存池疾病(δ-SPD)常规用血小板聚集法检测,但特异性和灵敏度均不理想。 检测血小板致密颗粒的阿的平荧光显微镜法,主观性大,操作繁琐,而且一次检测的血小板数目有限。 全血法流式细胞术为δ-SPD的诊断提供了一个简单、迅速的方法,一次能定量检测5 000个以上阿的平染色的血小板。与正常人相比,δ-SPD患者阿的平染色显著下降(从49%降至15%)。常在骨髓增殖异常综合征和晚期肾衰中出现的获得性致密颗粒贮存池疾病,也能用全血法流式细胞术进行检测和诊断。 4. 血小板减少性疾病:破坏过多或生成减少均能导致血小板减少。血小板相关抗体(PAIg)是反 映血小板的破坏的指标,虽然其临床意义仍有争议。PAIg的检测有多种方法,但流式细胞术法有其优越性。流式细胞仪能测定单个血小板上的PAIg,只要测定104甚至103个血小板,在统计学上就能精确地得出PAIg的平均水平,因而用血量少,只要1 ml血液制备的血小板就足够。流式细胞术还能同时测定其他一些反映血小板破坏的指标,如PAIgG、PAIgM、C3等。血小板的生成与巨核细胞有
流式细胞术及其应用 作者:贾宇臣 第一部分流式细胞术的一般介绍 概念 流式细胞术(Flow Cytometry,FCM)利用流式细胞仪对处在快速、直线、流动状态中的单细胞或生物颗粒进行多参数、快速定量分析,同时对特定群体加以分选的现代细胞分析技术。 流式细胞仪(Flow Cytometer)集激光技术、电子物理技术、光电测量技术、电子计算机技术、细胞荧光化学技术、单克隆抗体技术为一体的一种新型高科技仪器。 流式细胞仪特点
FACSCalibur 临床型(台式机) 特点: 光路调节系统固定 自动化程度高 操作简便 使用寿命长 配备1-2根激光 细胞分选速度慢,主要用于细胞分析
BD LSR
FACS Vantage DiVa 科研型(大型机) 特点: 多数字化 适用用各类细胞分选 4路分选
FACSAria 科研型 特点: 分辨率高 选配多种波长和类型激光器 可把感兴趣细胞分选到特定培养孔或板上(4路和24孔板)适用于高速分选和多色分析 流式细胞仪检测范围
临床研究 淋巴细胞亚群测定、血小板分析、网织红细胞分析、白血病和淋巴瘤免疫分型、HLA-B27分析、PNH诊断、人类同种异体器官移植中应用、细胞因子测定、AIDS诊断与治疗和疗效评价、flow-FISH法测定端粒长度 基础研究 淋巴细胞功能、树突状细胞(DC)研究、造血干细胞研究、细胞周期分析、细胞凋亡分析、凋亡相关蛋白分析、细胞功能研究、多药耐药基因研究(MDR)、肿瘤相关基因表达研究、RNA测定、DNA测定、总蛋白测定、癌基因和抑癌基因表达产物测定、血管内皮细胞研究 流式细胞仪的工作原理 -光学系统 激光光源 光收集系统 -液流系统 流动室 液流驱动系统 -电子系统 光电转换 数据处理系统 -细胞分选系统 激光光源 单波长、高强度、高稳定性 多采用氩离子激光器或氦氖激光器
查看文章 流式细胞仪-细胞凋亡检测Ⅰ 2008-11-01 10:20 一PI单染色法 基本原理 其原理主要是根据细胞凋亡时在细胞、亚细胞和分子水平上所发生的特征性改变。这些改变包括细胞核的改变、细胞器的改变、细胞膜成分的改变和细胞形态的改变等,其中细胞核的改变最具特征性,主要包括以下几个方面: 1. 细胞核的改变:由于凋亡细胞核的改变,造成各种染色体荧光染料对凋亡细胞DNA可染性发生改变。研究表明,用各种染色体荧光染料对经固定的凋亡细胞进行染色,其DNA可染性降低。许多学者把这种DNA可染性的降低认为是凋亡细胞的标志之一。 2. 光散射特性:凋亡细胞形态上的改变影响它们的光散射特性。在流式细胞仪上,前散射光与细胞的大小有关,而侧散射光反映的是光在细胞内的折射作用,与细胞内的颗粒多少有关。在细胞凋亡时,细胞固缩,体积变小,故前散射光降低,这一特性往往被认为是凋亡细胞的特点之一。此外细胞凋亡时由于染色体降解,核破裂形成,细胞内颗粒往往增多,故凋亡细胞侧散射光常增加。细胞坏死时,由于细胞肿胀,其前散射光增大;侧散射光在细胞坏死时也增大,因此可根据前散射光和侧散射光区别凋亡细胞和坏死细胞。但需要注意的是,根据前散射光和侧散射光判断凋亡细胞的可靠性受被检测细胞形态上的均一性和核胞浆比率影响很大。因此在某些淋巴细胞凋亡中,用光散射特性检测凋亡的可靠性较好,而在肿瘤细胞凋亡中,其可靠性就较差。根据光散射特性检测凋亡细胞最主要的优点是可以将光散射特性与细胞的表面免疫荧光分析结合起来,用以区别经这些特殊处理发生选择性凋亡的淋巴细胞亚型。也可用于活细胞的分类。 试剂与仪器 l PBS溶液(配制方法见附录); l PI染液:将PI溶于PBS(pH7.4)中,终浓度为100ug/ml。用棕色瓶4℃避光保存。 l 70%乙醇 l 400目筛网 l 流式细胞仪 实验步骤 1. 收集细胞{数目约(1~ 5)×106个/mL},500 ~ 1000 r/min离心5min,弃去