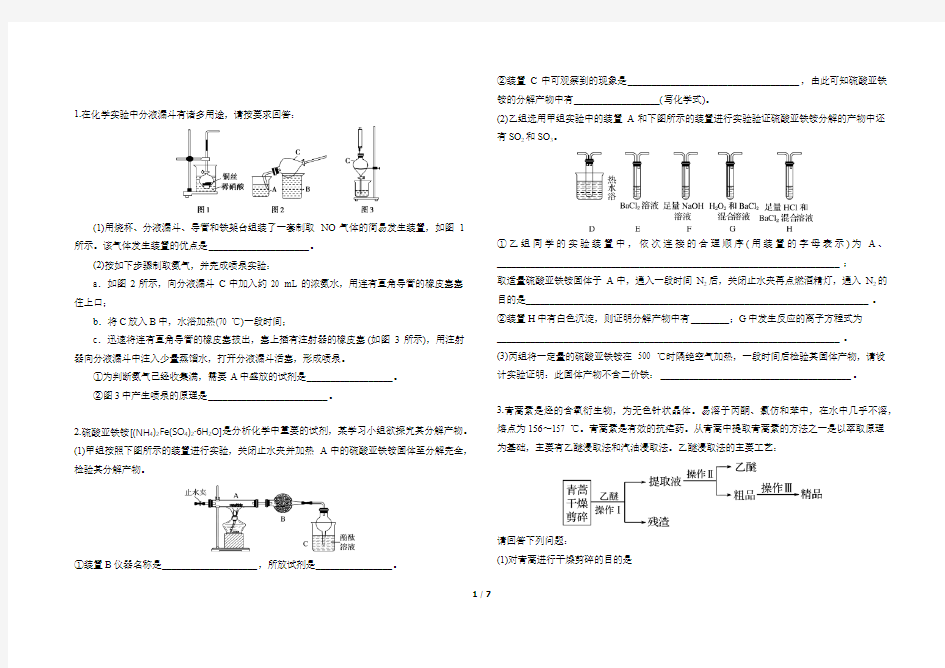

1.在化学实验中分液漏斗有诸多用途,请按要求回答:
(1)用烧杯、分液漏斗、导管和铁架台组装了一套制取NO气体的简易发生装置,如图1所示。该气体发生装置的优点是_____________________。
(2)按如下步骤制取氨气,并完成喷泉实验:
a.如图2所示,向分液漏斗C中加入约20 mL的浓氨水,用连有直角导管的橡皮塞塞住上口;
b.将C放入B中,水浴加热(70 ℃)一段时间;
c.迅速将连有直角导管的橡皮塞拔出,塞上插有注射器的橡皮塞(如图3所示),用注射器向分液漏斗中注入少量蒸馏水,打开分液漏斗活塞,形成喷泉。
①为判断氨气已经收集满,需要A中盛放的试剂是__________________。
②图3中产生喷泉的原理是_________________________。
2.硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]是分析化学中重要的试剂,某学习小组欲探究其分解产物。
(1)甲组按照下图所示的装置进行实验,关闭止水夹并加热A中的硫酸亚铁铵固体至分解完全,检验其分解产物。
①装置B仪器名称是____________________,所放试剂是________________。②装置C中可观察到的现象是____________________________________,由此可知硫酸亚铁铵的分解产物中有__________________(写化学式)。
(2)乙组选用甲组实验中的装置A和下图所示的装置进行实验验证硫酸亚铁铵分解的产物中还有SO2和SO3。
①乙组同学的实验装置中,依次连接的合理顺序(用装置的字母表示)为A、________________________________________________________________________;
取适量硫酸亚铁铵固体于A中,通入一段时间N2后,关闭止水夹再点燃酒精灯,通入N2的目的是________________________________________________________________________。
②装置H中有白色沉淀,则证明分解产物中有________;G中发生反应的离子方程式为
________________________________________________________________________。
(3)丙组将一定量的硫酸亚铁铵在500 ℃时隔绝空气加热,一段时间后检验其固体产物,请设计实验证明:此固体产物不含二价铁:________________________________________。
3.青蒿素是烃的含氧衍生物,为无色针状晶体。易溶于丙酮、氯仿和苯中,在水中几乎不溶,熔点为156~157 ℃。青蒿素是有效的抗疟药。从青蒿中提取青蒿素的方法之一是以萃取原理为基础,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺:
请回答下列问题:
(1)对青蒿进行干燥剪碎的目的是
1 / 7
________________________________________________________________________。
(2)操作Ⅰ的名称是____________________,操作Ⅱ名称是__________________。
(3)用下列实验装置测定青蒿素的分子式,将28.2 g青蒿素放在硬质玻璃管C中充分燃烧:
①装置E中盛放的物质是________,装置F中盛放的物质是________。
②该实验装置可能产生误差,造成测定含氧量偏低,改进方法是__________________。
③已知青蒿素是烃的含氧衍生物,用合理改进后的装置进行实验,称得:
青蒿素的最简式是________。
(4)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与________(填字母)具有相似的性质。
A.乙醇
B.乙酸
C.乙酸乙酯
D.葡萄糖
E.溴乙烷
4.某校化学课外学习小组在实验探究中发现将镁粉投入氯化铵溶液中,两者立即发生反应,产生大量气泡。经检验该过程产生两种气体,其中一种气体有刺激性气味。
(1)请你根据所学的知识分析生成的气体可能为______和________(填化学式)。(2)①请你设计简单的实验方案检验上述实验中有刺激性气味的气体:____________。
②实验开始时用校准过的pH传感器测定纯水的pH,发现纯水的pH总是在7.30左右,其原因可能是________________________________________________________________。
③实验中0.2 mol·L-1氯化铵溶液的pH为 5.90,请用离子方程式解释原因:________________________________________________________________________。
(3)该小组同学对实验中产生这两种气体的原因进行了假设,请你完成下面的假设。
假设一:________________________________________________________________。
假设二:是氯化铵溶液中的铵根离子造成的。
实验探究选用了三种溶液:氯化铵溶液、盐酸溶液、醋酸铵溶液。这三种溶液分别和镁粉进行反应,实验过程、现象和实验图像记录在下面的表格中。
反应明显,有气泡产生
实验结果分析:①上述探究实验二选用的盐酸为______(填字母)。
a.1 mol·L-1
b.pH=1.0
c.0.2 mol·L-1
d.pH=5.90
2 / 7
②通过上述探究实验对比,你能从中得出什么合理性的结论?
________________________________________________________________________。
5.肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4·H2O):
CO(NH2)2+2NaOH+NaClO===Na2CO3+N2H4·H2O+NaCl
实验一:制备NaClO溶液(实验装置如图所示)
(1)配制30%NaOH溶液时,所需的玻璃仪器除量筒外,还有________(填标号)。
A.容量瓶 B.烧杯
C.烧瓶 D.玻璃棒
(2)锥形瓶中发生反应的化学方程式是_____________。
(3)因后续实验需要,需利用中和滴定原理测定反应后锥形瓶内混合溶液中NaOH的浓度。请选用所提供的试剂,设计实验方案:__________________________________。
提供的试剂:H2O2溶液、FeCl2溶液、0.100 0 mol·L-1盐酸、酚酞试液
实验二:制取水合肼(实验装置如图所示)。
控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114 ℃馏分。
(4)分液漏斗中的溶液是________(填标号)。
A.CO(NH2)2溶液
B.NaOH和NaClO混合溶液
选择的理由是________________________________________________________。
反之可能发生的反应是 ________________________________________________
实验三:测定馏分中水合肼的含量。
称取馏分5.000 g,加入适量NaHCO3固体,加水配成250 mL溶液,移取25.00 mL,用0.100 0 mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5 左右。
(已知:N2H4·H2O+2I2===N2↑+4HI+H2O)
(5)滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是_______________。
(6)实验测得消耗I2溶液的平均值为18.00 mL,馏分中水合肼(N2H4·H2O)的质量分数为________。
6.氰化物有剧毒,冶金工业会产生大量含氰化物的废水,其中氰化物以CN-等形式存在于废水中。某化学兴趣小组的同学对含氰化物的废水处理进行研究。
Ⅰ.查阅资料:含氰化物的废水破坏性处理方法。
利用强氧化剂将氰化物氧化为无毒物质,如以TiO2为催化剂用NaClO将CN-氧化成CNO-(CN-和CNO-中N元素均为-3价),CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等。
Ⅱ.实验验证:破坏性处理CN-的效果。
化学兴趣小组的同学在密闭系统中用下图装置进行实验,以测定CN-被处理的百分率,实验步骤如下:
3 / 7
步骤1:取一定量废水进行加热蒸发、浓缩。
步骤2:取浓缩后含CN-的废水与过量NaClO溶液的混合液共200 mL(设其中CN-的浓度为0.2 mol·L-1)倒入甲中,塞上橡皮塞。
步骤3:_________________________________________。
步骤4:打开甲上的橡皮塞和活塞a,使甲中溶液全部放入乙中,关闭活塞a。
步骤5:打开活塞K,通一段时间N2,关闭活塞K。
步骤6:实验完成后测定干燥管Ⅰ(含碱石灰)的质量m2[实验前干燥管Ⅰ(含碱石灰)的质量m1]。回答下列问题:
(1)在破坏性处理方法中,在酸性条件下NaClO和CNO-反应的离子方程式为
______________________________________________________________________。
(2)完成步骤3:________________________________________________________。
(3)丙装置中的试剂是_______________,丁装置的目的是_________________。
(4)干燥管Ⅱ的作用是__________________________________________________。
(5)请简要说明实验中通入N2的目的是
____________________________________________________________。
(6)若干燥管I中碱石灰增重1.408 g,则该实验中测得CN-被处理的百分率为
__________________________________________________。
7. 某兴趣小组设计SO2实验方案做以下化学实验。
Ⅰ.实验方案一
(1)将SO2通入水中形成“SO2-饱和H2SO3溶液”体系,此体系中存在多个含硫元素的平衡,分别用平衡方程式表示为________________________。
(2)已知:葡萄酒中有少量SO2可以作抗氧化剂[我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L]。
利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3。设计如图实验:
实验结论:干白葡萄酒不能使品红溶液褪色,原因为_______________。
Ⅱ.实验方案二
如图是在实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。
(1)装置B中试剂X是______ __,装置D中盛放NaOH溶液的作用是__ ____。可优化为_____ _
(2)关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体,检验SO2与Na2O2反应是否有氧气生成的方法是_______________________。
(3)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F中,能说明I-还原性弱于SO2的现象为________,发生反应的离子方程式是________。
Ⅲ.实验方案三
用电化学法模拟工业处理SO2。将硫酸工业尾气中的SO2通入如图装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电解。
(1)M极发生的电极反应式为_____________________________。
4 / 7
5 / 7
(2)若使该装置的电流强度达到2.0 A ,理论上每分钟应向负极通入标准状况下气体的体积为________L 。(已知:1个e -
所带电量为1.6×10
-19
C)
8.氯化铝为共价化合物,熔点、沸点都很低,且会升华,极易潮解,遇水放热并产生白色烟雾。请回答下列问题:
(1)甲组同学按照如图一所示装置,通过实验制备AlCl 3固体。装置B 中滴入浓硫酸后发生的反应为2NaCl +H 2SO 4(浓)=====△
2HCl ↑+Na 2SO 4。装置C 中所盛装的试剂是________,点燃D 处酒精灯时,装置D 中发生反应的化学方程式为_____________________。
装置F 的作用是______________________。
安装好仪器后需要进行的操作有:①向装置B 中滴加浓硫酸;②点燃B 处酒精灯;③点燃D 处酒精灯。这三项操作的正确顺序为________(填序号)。
(2)乙组同学认为甲组同学的装置设计存在不安全因素,因此乙组同学对甲组同学所设计的装置D 、E 进行了改进(如图二所示),装置E 改为带支管的烧瓶,该烧瓶的名称为________,改进后的优点是________________________。
(3)设计实验证明:
①AlCl 3能够水解:____________________。
②AlCl 3是共价化合物:___________________________。
参考答案:
1、(1)实现随开随用、随关随停的目的;控制NO 的生成量,以减少污染(答案合理即可) (2)①滴有酚酞的水溶液 ②C 中NH 3溶于水,导致C 内压强迅速减小,外界大气压将烧杯
中的水压入分液漏斗中,形成喷泉。
2、答案(1)①干燥管碱石灰
②溶液由无色变为红色NH3
(2)①D、H、E、G、F排尽装置中的空气(或O2),防止对SO2的验证产生干扰②SO3 SO2+H2O2+Ba2+===BaSO4↓+2H+
(3)取少量固体于试管中,加稀硫酸溶解,再滴入KMnO4溶液,KMnO4溶液不褪色(或取少量固体于试管中,加稀硫酸溶解,再滴入K3[Fe(CN)6]溶液,不产生蓝色沉淀)
3、答案(1)增大青蒿素与乙醚的接触面积,提高青蒿素的浸取率
(2)过滤蒸馏
(3)①无水CaCl2或P2O5碱石灰(或其他合理答案)②除去装置左侧通入的空气中的CO2和水蒸气,在装置F后加一个防止空气中的CO2和水蒸气进入F的装置③C15H22O5
(4)CE
4、答案(1)H2NH3
(2)①将湿润的红色石蕊试纸放在试管口看是否变蓝,如果变蓝,则有氨气生成,否则没有氨气生成(或者用蘸有浓盐酸的玻璃棒放在试管口,看是否有白烟生成,如果有白烟生成,则有氨气,否则没有氨气,答案合理即可)②因为气温低于25 ℃时,K w小于1.0×10-14,纯水的pH略大于7③NH+4+H2O=NH3·H2O+H+
(3)是氯化铵溶液中的氢离子造成的①d②pH相同的盐酸与镁粉几乎不反应,说明不是氢离子的作用;而同浓度且呈中性的醋酸铵与镁粉反应,说明主要是铵根离子的作用(其他合理答案也可)
5、答案(1)BD
(2)Cl2+2NaOH===NaClO+NaCl+H2O
(3)取一定量锥形瓶内的混合溶液,加入适量的H2O2溶液后,滴加2~3滴酚酞试液,用
0.100 0 mol·L-1盐酸滴定,重复上述操作2~3次
(4)B如果将氢氧化钠和次氯酸钠的混合溶液装在烧瓶中,反应生成的水合肼会被次氯酸钠
氧化;N2H4·H2O+2NaClO===N2↑+3H2O+2NaCl
(5)NaHCO3会与滴定过程中产生的HI反应
(6)9%
6、[标准答案](1)2CNO-+6ClO-+8H+===2CO2↑+N2↑+3Cl2↑+4H2O(2分)
(2)点燃酒精灯对丁装置加热(2分)
(3)浓硫酸(2分)除去Cl2(2分)
(4)防止空气中的水蒸气和CO2进入干燥管Ⅰ中影响对CO2的测量(2分)
(5)使装置中的CO2全部到干燥管Ⅰ中被吸收,减小误差(2分)
(6)80%(3分)
7、[答案]Ⅰ.(1)SO2(g) =SO2(aq)、SO2+H2O=H2SO3、H2SO3=H++HSO-3、
HSO-3 =H++SO2-3
(2)干白葡萄酒中二氧化硫或亚硫酸含量太少
Ⅱ.(1)浓硫酸吸收未反应的SO2,防止污染空气,增加一个防倒吸的装置
(2)将带火星的木条放在D试管口处,看木条是否复燃
(3)E中溶液蓝色褪去SO2+I2+2H2O===2I-+SO2-4+4H+
Ⅲ.(1)SO2+2H2O-2e-===SO2-4+4H+
(2)0.014
8、[答案](1)浓硫酸2Al+6HCl(g)=====
△
2AlCl3+3H2防止空气中的水蒸气进入装置E①②③
6 / 7
(2)蒸馏烧瓶防止凝华的AlCl3堵塞D、E之间的导气管
(3)①取少量AlCl3溶液,用pH试纸测其pH,pH<7②做AlCl3熔融状态下的导电实验
7 / 7