
溶解度曲线习题
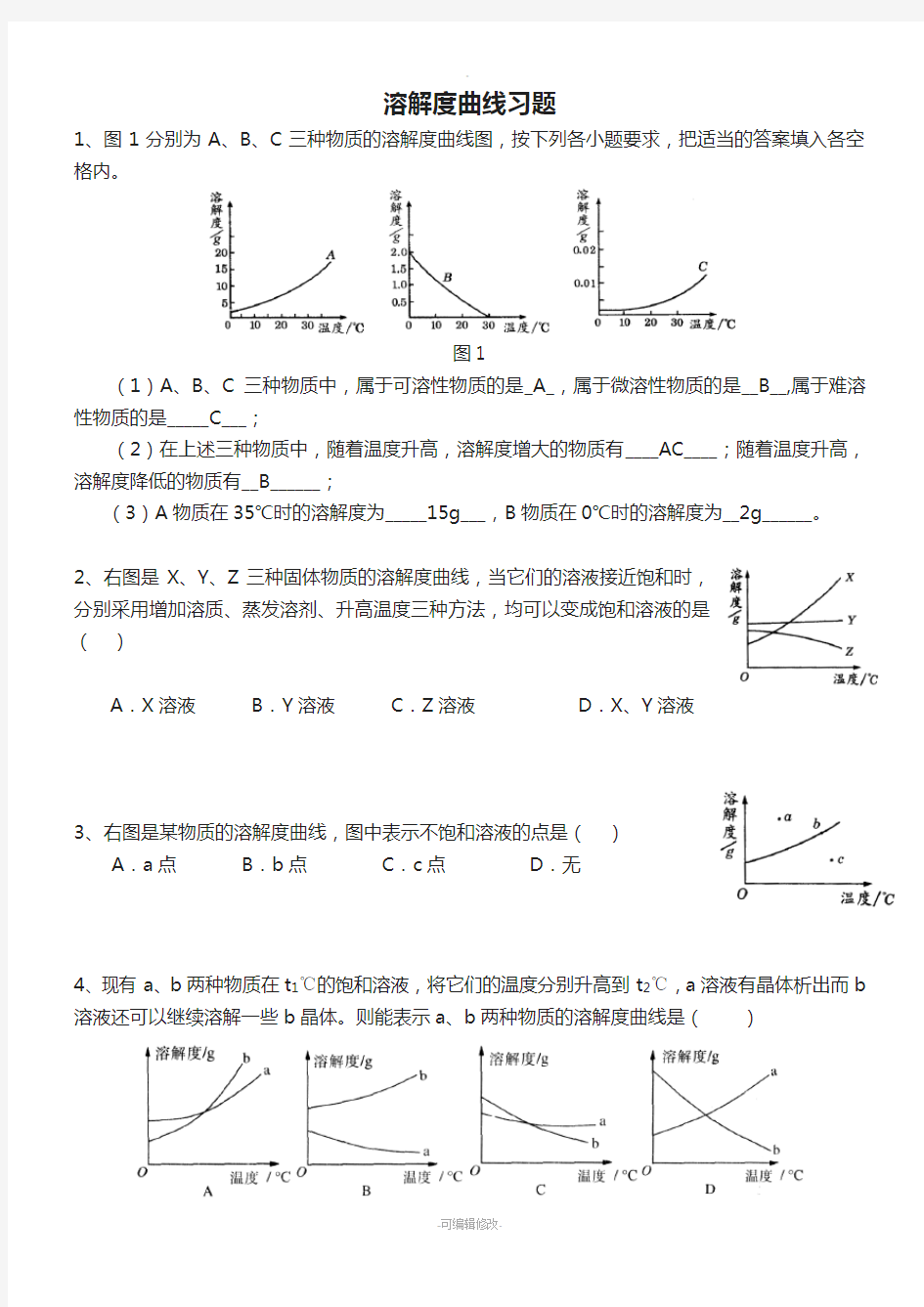
1、图1分别为A、B、C三种物质的溶解度曲线图,按下列各小题要求,把适当的答案填入各空格内。
图1
(1)A、B、C三种物质中,属于可溶性物质的是_A_,属于微溶性物质的是__B__,属于难溶性物质的是_____C___;
(2)在上述三种物质中,随着温度升高,溶解度增大的物质有____AC____;随着温度升高,溶解度降低的物质有__B______;
(3)A物质在35℃时的溶解度为_____15g___,B物质在0℃时的溶解度为__2g______。
2、右图是X、Y、Z三种固体物质的溶解度曲线,当它们的溶液接近饱和时,
分别采用增加溶质、蒸发溶剂、升高温度三种方法,均可以变成饱和溶液的是
()
A.X溶液B.Y溶液C.Z溶液D.X、Y溶液
3、右图是某物质的溶解度曲线,图中表示不饱和溶液的点是()
A.a点B.b点C.c点D.无
4、现有a、b两种物质在t1℃的饱和溶液,将它们的温度分别升高到t2℃,a溶液有晶体析出而b 溶液还可以继续溶解一些b晶体。则能表示a、b两种物质的溶解度曲线是()
5、图5是A、B两种物质的溶解度曲线,根据图示回答下列问题:
(1)在____t1____℃时,A和B物质的溶解度相等。在
t℃时,
2
A物质的溶解度比B物质的溶解度____大____(填“大”或“小”);
(2)当A物质的溶液接近饱和时,采用__降温__、__蒸发溶
剂___、__加溶质__三种方法均可使其变为饱和溶液。
6、根据溶解度曲线回答问题.
(1)溶解度随温度升高而增大的物质是____ ____.
(2)t2℃时,溶解度相等的是___ _____.
(3)t2℃时,100 g水中加入20 g a物质,溶液不饱和,为使其饱和,可再加入a物质________g,或使其温度降到__ ______℃.
7、右图是a、b、c三种物质的溶解度曲线,据图回答:
(1)当温度是℃,a、b两种物质的溶解度相等;
(2)t3 ℃时三种物质的溶解度由大到小的顺序是
8、甲乙两种固体的溶解度曲线如右图所示。在一个大烧杯中装着含有甲和乙的两种饱和溶液,而且杯中还有少量甲和乙的固体存在。现将温度由80℃降到20℃。下列说法正确的是()A.杯中固体甲和固体乙都减少
B.杯中固体甲减少、固体乙增多
C.溶液中甲、乙溶液都减少
D.溶液中溶质甲减少、溶质乙增多
9、右图为A、B、C三种物质的溶解度曲线,试回答下列问题:
(1)温度为t1℃时,A、B、C三种物质溶解度由大到小的顺序为;
(2)t 2℃时A 和B 两种物质的 相等; (3)若A 中混有少量的B ,欲从此混合物中分离出A 可采取的方法是 。
10、右图是A 、B 、C 三种物质的溶解度曲线。
(1)20℃时,A 、B 、C 三种物质溶解度由大到小的顺序
是 。
(2)35℃时,A 、B 、C 的饱和溶液各w g ,均冷却至20℃
时,析出晶体最多的是 ,最少的是 ,没有晶体析出的
是 。
(3)30℃时,a 点表示100g 水中溶解A 物质的质量,要使其变为30℃的饱和溶液,需要加入A 物质的质量是 。
11、现有M 、N 两物质在室温下的饱和溶液,升温后,M 溶液有晶体析出,而N 溶液还可以再溶
解N 晶体,则能正确表示M 、N 两种物质溶解度曲线的是B
12、右图是A 、B 、C 三种物质的溶解度曲线,据图回答:
(1)P 点表示t 1℃时 物质的溶解度相等。
(2)溶解度随温度升高而减小的物质是 。
(3)t 2℃时,三种物质的溶解度由大到小的顺序是 。
(4)t 1℃时A 的溶解度 t 2℃时A 的溶解度;(填“大于”、“小于”或“等于”,下同)
(5)t 2℃时,B 的饱和溶液中溶质的质量分数 A 的饱和溶液中溶质的质量分数。
13、
(1)t 3℃时A 的溶解度为 。 (2)P 点的的含义 。
(3)N 点为 ,可通过 ,
的方法使它变为饱和。
(4)t 1℃时A 、B 、C 、溶解度由大到小的顺序 。 (5)从A 溶液中获取A 晶体可用 的方法获取晶体。
0 温度/℃ 溶解度/g M N 0 温度/℃ 溶解度/g M N 0 温度/℃ 溶解度/g M N 0 温度/℃ 溶解度/g M N A . B . C . D .
0 t 1 t 2 t 3
N t S P A B C 80
(6)从B 的溶液中获取晶体,适宜采用 的方法获取晶体
(7)t 2℃ 时A 、B 、C 的饱和溶液各W 克,降温到t 1℃会析出晶体的有 晶体
析出的有
(8)除去A 中的泥沙用 法;分离A 与B (含量少)的
混合物,用 法。
14、右图是甲、乙两种物质的溶解度曲线,下列说法正确的是B
A .甲的溶解度受温度影响比乙小
B .15℃时甲、乙的溶解度相等
C .30℃时乙的溶解度为30g
D .升高温度可使接近饱和....的甲溶液变为饱和..
15、右图是A 、B 两种物质的溶解度曲线。在t 1℃时往两个盛有100克水的烧杯中分别加入a 克
A 物质和b 克
B 物质,充分搅拌后都加热到t 2℃。下列说法正确的是( )
A .t 1℃时,A
B 两物质的溶解度相等。两杯溶液均是不饱和溶液
B .t 1℃时,AB 两物质的溶解度相等,A 溶液为饱和溶液,B 溶液为不
饱和溶液
C .t 2℃时,A 的溶解度比B 的溶解度大,两杯溶液均是不饱和溶液
D .t 2℃时,A 的溶解度比B 的溶解度大,A 溶液为不饱和溶液,B
溶液为饱和溶液
16、右图为A 、B 两种不带结晶水的固体物质溶解度曲线,下列说
法不正确的是 ( )
A .30℃时,A 物质的溶解度为20g
B .20℃时,A 和B 的溶解度相同
C .10℃时,等质量的A 和B 饱和溶液中,B 的溶剂最少
D .等质量的A 、B 的饱和溶液从30℃降到20℃时,B 析出的晶体最多
17、根据下列几种物质溶解度曲线图,得到的结论正确的是( )
A
B C 0 t 1 20 t 2 温度/℃
g 40
溶解度
A .硝酸钾中混有少量氯化钠,采用蒸发结晶进行提纯
B .氢氧化钙饱和溶液降低温度后有晶体析出
C .80℃时,氯化钾与硫酸镁的溶解度相等
D .所有物质的溶解度均随温度的升高而增大或随温度的降低而减小
18、右图是甲、乙、丙三种物质的溶解度曲线.下列说法正确的是( )
A .在t 1℃时,三种物质的溶解度由大到水的顺序是甲>乙>丙
B .在t 2℃时,甲、乙两物质的溶解度相等
C .甲、乙、丙三种物质的饱和溶液升温都会转化为不饱和溶液
D .当乙的饱和溶液中混有少量丙时,可采用降温结晶的方法析出丙
19、右图是甲、乙两种固体物质的溶解度曲线。据此判断
下列说法不正确的是:( )
A.t2℃时,甲、乙的溶解度相等
B. t3℃时,将60g 乙加入100g 水中可得l60g 溶液
C .乙的溶解度受温度影响很小
D .tl ℃时,乙的溶解度大于甲的溶解度 20、下图为A 、B 、C 三种物质的溶解度曲线,据图回答:
⑴ t20C 时,A 、B 、C 三种物质的溶解度由大到小顺序A>B>C 。
⑵ 将t20C 时三种物质等质量的饱和溶液分别降温到00C 时,析
出溶质最多的是 A ,无溶质析出的是 C
⑶ 20℃时,将30g A 物质放入50g 水中,充分搅拌,所得溶液
的质量是 70 g 。
21、右图是甲、乙两种固体物质的溶解度曲线。请回答:甲物质在45℃
时的溶解度为__50g_____;甲、乙两物质的溶解度相等时的温度是
__25__℃;要使甲的不饱和溶液变为饱和溶液应____降温_(填“升高”、“降低”)温度;常压下,CO2在水中的溶解度随温度的变化应类似于__乙__(填“甲”、“乙”)曲线。
22、小明同学绘制了如右图所示A、B两种固体物质的溶液度曲线:
(1)当温度为40 ℃时,A物质与B物质的溶解度相等。
(2)若将B物质从溶液中结晶析出,宜采用的方法是蒸发结
晶。
(3)我国有许多盐碱湖,湖中溶有大量的NaCl和Na2CO3,那
里的人们“冬天捞碱,夏天晒盐。”据此你认为图中A
(填“A”或“B”)物质的溶解度曲线与纯碱的相似。
23、右图是某实验小组的同学绘制的两种固体物质的溶解度曲线图。请你根据图示回答问题: (1)t1℃时,a物质的溶解度< b 物质的溶解度(填“>”、“<”
或“=”)。
(2)将t2℃时a、b两种物质相同质量的饱和溶液,分别冷却到t1℃,
析出晶体最多的是物质。
(3)溶解度曲线图中的任何一点都表示溶液的一种特定状
态。图中A、B两个状态中,溶液属于不饱和状态的
是,状态最不稳定的是。
24、右图是某固体物质的溶解度曲线。
(1)30℃时,该物质的溶解度为g。
(2)50℃时,将40g该物质加入到l00g水中,搅拌后得到的是不饱和(填
“饱和"或“不饱和”)溶液;将该溶液降温到20℃时可析出晶体g
25、运用溶解度表与溶解度曲线回答下列问题:
⑴B是的溶解度曲线。
⑵60℃时,100g水中加入100g硝酸钾,所得溶液是(填“饱和”或“不饱和”)溶液,
当60℃的该溶液降温到30℃时,析出晶体的质量为g。
26、下表列出了固体物质A在不同温度时的溶解度:
溶解度曲线的意义及其应用 溶解度曲线的意义与应用可从点、线、面和交点四方面 来分析。 1.点 溶解度曲线上的每个点表示的是某温度下某种物质的溶 解度。即曲线上的任意一点都对应有相应的温度和溶解度。温度在横坐标上可以找到,溶解度在纵坐标上可以 找到。溶解度曲线上的点有三个方面的作用: (1)根据已知温度查出有关物质的溶解度; (2)根据物质的溶解度查出对应的温度; (3)比较相同温度下不同物质溶解度的大小或者饱和溶液中溶质的质量分数的大小。 2.线 溶解度曲线表示某物质在不同温度下的溶解度或溶解度 随温度的变化情况。曲线的坡度越大,说明溶解度受温 度影响越大;反之,说明受温度影响较小。溶解度曲线也有三个方面的应用: (1)根据溶解度曲线,可以看出物质的溶解度随着温度的变化而变化的情况。 (2)根据溶解 度曲线,比较在一定温度范围内的物质的溶解度大小。(3)根据溶解度曲线,选择分离某些可溶性混合物的方法。 3.面 对于曲线下部面积上的任何点,依其数据配制的溶液为
对应温度时的不饱和溶液;曲线上部面积上的点,依其数据配制的溶液为对应温度时的饱和溶液,且溶质有剩余。如果要使不饱和溶液(曲线下部的一点)变成对应温度下 的饱和溶液,方法有两种:第一种方法是向该溶液中添加溶质使之到达曲线上;第二种方法是蒸发一定量的溶剂。4.交点 两条溶解度曲线的交点表示该点所示的温度下两物质的 溶解度相同,此时两种物质饱和溶液的溶质质量分数也 相同。 例题(98年广西区)X、Y、Z三种固体物质的溶解度曲线见右图。 下列说法中,不正确的是( )。 (A)分别将X、Y、Z的饱和溶液的温度从t ℃降低到t ℃,只有Z无晶体析出 (B) t℃时,用l00克水配制相同质量、相同溶质质量分数的X、Y、Z的溶液,所需溶质质量最多不超过S (C)当X中含有少量Y时,可用结晶法提纯X (D) t℃时,三种物质的饱和溶液中溶质的质量分数XYZ 解析这是一道难度较大的综合选择题,它综合了饱和溶液、不饱和溶液、蒸发结晶、物质的提纯及质量分数与 溶解度的换算等知识。解题的关键是看懂溶解度曲线图 并明确溶解度曲线的意义。
初三化学:溶解度知识点归纳 1.固体物质的溶解度 (1)定义:一种物质溶解在另一种物质里的能力叫溶解性.溶解性的大小与溶质和溶剂 的性质有关.根据物质在20℃时溶解度的大小不同,把物质的溶解性通常用易溶、可溶、 微溶、难溶等概念粗略地来描述. (2)固体的溶解度概念:在一定温度下,某固体物质在100g溶剂里达到饱和状态时 所溶解的质量,叫做这种物质在这种溶剂里的溶解度. 在理解固体的溶解度概念时,要抓住五个要点: ①“在一定温度下”:因为每种固体物质的溶解度在一定温度下有一个对应的定值,但这定值是随温度变化而变化的,所以给某固体物质的溶解度时,必须指出在什么温度下的溶解度才有意义. ②“在100g溶剂里”:溶剂质量有规定的值,统一为100g,但并不是100g溶液,在 未指明溶剂时,一般是指水. ③“饱和状态”:所谓饱和状态,可以理解为,在一定温度下,在一定量的溶剂里,溶质的溶解达到了最大值. ④“所溶解的质量”:表明溶解度是有单位的,这个单位既不是度数(°),也不是质量分数(%),而是质量单位“g”. ⑤“在这种溶剂里”:就是说必须指明在哪种溶剂里,不能泛泛地谈溶剂.因为同一种物质在不同的溶剂里的溶解度是不相同的. (3)影响固体溶解度大小的因素 ①溶质、溶剂本身的性质.同一温度下溶质、溶剂不同,溶解度不同.
②温度的高低也是影响溶解度大小的一个重要因素.固体物质的溶解度随温度的不同而不同.大多数固态物质的溶解度随温度的升高而升高;少数物质(如氯化钠)的溶解度受温度的影响很小;也有极少数物质(如熟石灰)的溶解度随温度的升高而降低. (4)固体物质溶解度的计算 a根据:温度一定时,饱和溶液中溶质、溶剂的质量与饱和溶液质量成正比.
初三化学溶解度曲线知识点(完整)
溶解度t/℃ 21m m 溶解度曲线知识点 一、正确理解溶解度曲线的含义 溶解度曲线就是在直角坐标系中,用来描述物质的溶解度随温度变化而变化的曲线。根据溶解度曲线可进行溶液的配制,混合物的分离与提纯,以及进行物质结晶或溶解的计算。下面,我们从溶解度曲线的特点入手,对溶解度作进一步的理解。 (一)点 1.曲线上的点:表示对应温度下该物质的溶解度。如:下图中a 表示A 物质在t 1℃时溶解度为m 1g 。 2.曲线上方的点:表示在对应温度下该物质的饱和溶液中存在不能继续溶解的溶质。如:图中b 表示在t 1℃时,A 的饱和溶液中有(m 2-m 1)g 未溶解的溶质。
3.曲线下方的点:表示在对应温度下该物质的不饱和溶液。如:图中C 表示在t 1℃时,A 的不饱和溶液中,还需要加入(m 1-m 3)g A 物质才达到饱和。 4.曲线交点:表示在对应温度下不同物质的溶解度相同。如图中d 表示在t 2℃,A 、B 两物质的溶解度都为m 4g 。 (二)线 如图中A 物质的溶解度随温度升高而明显增大,A 曲线为“陡升型”。如KNO 3等大多数固体物质。 图中B 物质的溶解度随温度变化不大,B 曲线为“缓升型”,如NaCl 等少数固体物质。 图中C 物质的溶解度随温度升高而减小,C 曲线为“下降型”,如气体及Ca(OH)2等极少数固体物质。 二、掌握溶解度曲线的应用 溶解度
1.溶解度曲线上的每一点,代表着某温度下某物质的溶解度,因此利用溶解度曲线可以查出某物质在不同温度下的溶解度,并根据物质的溶解度判断其溶解性。 2.可以比较在同一温度下不同物质溶解度的相对大小。 3.根据溶解度曲线的形状走向,可以看出某物质的溶解度随温度的变化情况。并根据此情况可以确定从饱和溶液中析出晶体或进行混合物分离提纯的方法。例如:某物质的溶解度曲线“陡”,表明该物质溶解度随温度变化明显,提纯或分离该物质时适合采用降温结晶法。某物质溶解度曲线“平缓”,提纯或分离该物质时适合采用蒸发溶剂法。 4.从溶解度曲线上的交点,可以判断哪些物质在该点所示的温度下具有相同的溶解度。 5.利用溶解度曲线可以确定一定质量的某物质的饱和溶液降温时析出晶体的质量。
溶解度曲线练习题 一.选择题(共9小题) 1.如图是甲、乙两种物质(不含结晶水)的溶解度曲线.下列说法中正确的是() A.甲的溶解度大于乙的溶解度 B.t1℃时,50g甲的饱和溶液中有含有15g甲 C.t2℃时甲的溶液和乙的溶液溶质质量分数相等 D.当甲中含有少量乙时,可以用降温结晶的方法提纯甲 2.如图,是甲、乙两种固体物质的溶解度曲线,下列说法正确的是() A.甲的溶解度比乙大 B.40℃时,甲的饱和溶液中溶质质量分数为50% C.40℃时,将50g乙物质全部溶于水中,恰好能得到150g乙的饱和溶液D.将130g 20℃甲的饱和溶液升温到40℃,最多还能溶解甲物质20g 3.如图是A、B两种物质的溶解度曲线,下列叙述中错误的是() A.A物质的饱和溶液从30℃降温到10℃,变成不饱和溶液 B.30℃时,向100g水中加入25gA物质,充分溶解后所得溶液是饱和溶液C.B物质的饱和溶液从30℃降温到20℃,其溶质质量分数减小 D.30℃时,将B物质的不饱和溶液转变为饱和溶液,可以采取恒温蒸发溶剂的方法 4.(2018?嘉定区一模)甲、乙两种固体的溶解度曲线如图所示,下列说法正确
的是() A.20℃时,甲溶液中的溶质质量一定小于乙溶液 B.20℃时,可配制溶质质量分数为30%的乙溶液 C.20℃时,50g水中加入20 g乙可得到饱和溶液70g D.50℃时,100 g水中加入20 g乙并降温至20℃,溶液中溶质的质量分数不变5.如图是甲、乙两种物质(不含结晶水)的溶解度曲线.下列说法中正确的是() A.甲的溶解度大于乙的溶解度 B.t1℃时,50g甲的饱和溶液中有15g甲 C.t2℃时甲的饱和溶液降温至t1℃变为不饱和溶液 D.当甲中含有少量乙时,可以用降温结晶的方法提纯甲 6.25℃时,向下列4只均盛有100g水的烧杯中,分别加入不同质量的KCl固体,充分溶解。下列有关说法不正确的是() A.①烧杯中溶液的质量为110 g B.②烧杯中溶液的溶质质量分数约为16.7% C.4只烧杯中形成的溶液为饱和溶液的是③④
初三化学专题------有关溶解度计算题 (一)关于溶解度的计算的类型 1. 已知一定温度下,饱和溶液中溶质的质量和溶剂的质量。求该温度下的溶解度。 例1:把50克20℃时的硝酸钾饱和溶液蒸干,得到12克硝酸钾。求20℃时硝酸钾的溶解度。 练1.把20℃时53.6克氯化钾饱和溶液蒸干,得到13.6克氯化钾。求20℃时,氯化钾的溶解度? 2. 已知某温度时物质的溶解度,求此温度下饱和溶液中的溶质或溶剂的质量。 例2:把100克20℃时硝酸钾的饱和溶液蒸干,得到24克硝酸钾。则: (1)若配制350克20℃的硝酸钾的饱和溶液,需硝酸钾和水各多少克? (2)若将78克硝酸钾配成20℃时的饱和溶液,需水多少克? 【典型例题】 [例1] 已知氯化铵在30℃时的溶解度为45.8克。30℃时将68.7克氯化铵配制成400克的溶液,通过计算: (1)溶液是否饱和? (2)若不饱和,为了使其饱和,可用下面的方法: ①蒸发溶剂法:需蒸发多少克水才能成为饱和溶液? ②加溶质法:需再加入多少克氯化铵,溶液才能成为饱和溶液?
[例2] t℃时,NaNO3的溶解度是25g,现向盛有200g 10%NaNO3溶液的烧杯中,加入30g NaNO3固体,则此时烧杯中() A. 溶液质量是230g B. 溶质质量是50g C. 溶剂质量是170g D. 溶质质量是45g [例3] 将两杯20℃时的食盐饱和溶液,甲为500g,乙为1000g,在温度不变的情况下分别蒸发掉15g水,析出的食盐晶体的质量() A. 甲=乙 B. 甲<乙 C. 甲>乙 D. 无法判断 [例4] 现有500g20℃的A物质溶液,若保持温度不变,蒸发掉20g水后,有5gA 析出,若再蒸发掉20g水后,又有7gA 析出,则在20℃时A物质的溶解度是________。 [例5] t℃,将一定量A(不含结晶水)的不饱和溶液分成三等份,分别加热蒸发水,然后冷却至t℃,已知三份溶液分别蒸发水10g、20g、30g,析出A依次为ag、bg、cg,则a、b、c三者之间的关系是() A. c=a+b B. c=2b-a C. c=2a+b D. c=2a-b [例6] 20℃时,将一定质量的NH4NO3完全溶解于100g水中,将所得溶液分成两等份,其中一份蒸发18.75g水,可使溶液饱和,另一份加入36g NH4NO3也达饱和,求⑴20℃时,NH4NO3的溶解度。⑵原溶液中NH4NO3的质量。 [例7] t℃时,向硫酸铜的饱和溶液中加入ag无水硫酸铜,析出bg硫酸铜晶体,则(b-a)g是() A. 饱和溶液失去溶剂的质量 B. 减少的饱和溶液的质量 C. 析出无水物的质量 D. 饱和溶液失去溶质的质量 【模拟试题】 一. 选择题(每小题有1-2个正确答案,将正确答案填在题后的括号里)
(2018中考说明题型示例第189页32题)1.下表是Ca(OH)2和NaOH 的溶解度随温度变化的数据。请回答下列问题: 温度/°C 0 20 40 60 80 100 溶解度/g Ca(OH)20.19 0.17 0.14 0.12 0. 09 0.08 NaOH 31 91 111 129 313 336 (1)根据上表数据,绘制Ca(OH)2和NaOH的溶解度曲线,下图中能表示NaOH溶解度曲线的是(选填“A”或“B”)。 (2)要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,具体措施有: ①加入氢氧化钙;②升高温度;③降低温度;④加入水;⑤蒸发水后再恢复到原温度;⑥加入生石灰。 其中措施正确的是(填序号)。 A.②④⑥ B.③④ C.①③⑤⑥ D.①②⑤⑥ (3)20°C时,将191g饱和NaOH溶液蒸发掉10 g水后,再降温到20°C,可析出NaOH晶体的质量为。(4)现有20°C时Ca(OH)2的饱和溶液甲,向其中加入一定量CaO后得到溶液乙,此时乙溶液中溶质的质量分数(选填“>”“?”或“=”)20°C时甲溶液中溶质的质量分数。 (5)现有60°C时含Ca(OH)2和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH晶体,应采取的物理方法是。 【答案】(1)A (2)D (3)9.1g (4)?(5)降温结晶,过滤 补充选题 1.如图是A、B、C三种物质的溶解度曲线。请回答: (1)交点K的含义是。 (2)t2℃的C物质的饱和溶液变到t1℃时,是 (选填“饱和”或“不饱和”)溶液。 (3)三种物质的溶解度为B>C>A时的温度范围是 ℃。 (4)在t3℃时,将40gC物质放入50g水中,充分溶解,所得溶液溶质质量分数为。 【答案】(1)t3℃时,A、C两种物质的溶解度相等(答案补充:t3℃时,A、C两种物质的饱和溶液的溶质质量分数相等)(2)不饱和(3)t2~t3(4)37.5% 2.根据图一的甲、乙溶解度曲线和图二实验现象回答下列问题: (1)图一中,甲物质的四种溶液状态“a、b、c、d”中,处于不饱和状态的是 (填写编号)。 (2)90g甲的饱和溶液从t3℃冷却到t2℃点,析出的无水晶体质量是g。 (3)在某温度范围内,将等质量的甲、乙两种固体物质溶解在水中,所得现象如图二所示,则两溶液质量分数甲(填“>”或“<”)乙,实验时控制温度t的范围是时,均能出现这种现象。 【答案】(1)b(2) 15 (3)<小于t2℃ 3.NaCl、KNO3、Ca(OH)2三种物质的溶解度曲线如图1与图2所示。请回答:
溶解度/g t/℃ 21m m m m 溶解度曲线知识点 一、正确理解溶解度曲线的涵义 溶解度曲线就是在直角坐标系中,用来描述物质的溶解度随温度变化而变化的曲线。根据溶解度曲线可进行溶液的配制,混合物的分离与提纯,以及进行物质结晶或溶解的计算。 点 ① 曲线上的点:表示对应温度下该物质的溶解度。如:下图中a 表示 A 物质在t 1℃时溶解度为m 1g 。 曲线上方的点:表示在对应温度下该物质的饱和溶液中存在 不能继续溶解的溶质。如:图中b 表示在t 1℃时,A 的饱和溶液中有 (m 2-m 1)g 未溶解的溶质。 曲线下方的点:表示在对应温度下该物质的不饱和溶液。如: 图中C 表示在t 1℃时,A 的不饱和溶液中,还需要加入(m 1-m 3)gA 物质才达到饱和。 ②曲线交点:表示在对应温度下不同物质的溶解度相同。如图中d 表示在t 2℃,A 、B 两物质的溶解度都为m 4g 。 2、线 如图中A 物质的溶解度随温度升高而明显增大,A 曲线为“陡升型”。 如KNO 3等大多数固体物质: 图中B 物质的溶解度随温度变化不大,B 曲线为“缓升型”, 如NaCl 等少数固体物质。 图中C 物质的溶解度随温度升高而减小,C 曲线为“下降型”,如气体及Ca(OH)2等极少数固体物质。 二、掌握溶解度曲线的应用 1. 溶解度曲线上的每一点,代表着某温度下某物质的溶解度,因此利用溶解度曲线可以查出某物质在不同温度下的溶解度,并根据物质的溶解度判断其溶解性。 2. 可以比较在同一温度下不同物质溶解度的相对大小。 3. 根据溶解度曲线的形状走向,可以看出某物质的溶解度随温度的变化情况。并根据此情况可以确定从饱和溶液中析出晶体或进行混合物分离提纯的方法。例如:某物质的溶解度曲线“陡”,表明该物质溶解度随温度变化明显,提纯或分离该物质时适合采用降温结晶法。某物质溶解度曲线“平缓”,提纯或分离该物质时适合采用蒸发溶剂法。 4. 从溶解度曲线上的交点,可以判断哪些物质在该点所示的温度下具有相同的溶解度。 5. 利用溶解度曲线可以确定一定质量的某物质的饱和溶液降温时析出晶体的质量。 溶解度曲线专题练习 溶解度/g 度
中考化学溶解度及溶解度曲线专题复习 1. X 、Y 、Z三种物质的溶解度曲线如图所示。将t2℃ 时三种物质的饱和溶液降 温至t1℃ ,溶液中溶质质量分数大小关系正确的是 ( 第1题图 A.X>Y>Z B.Y>Z>X C.Z>Y>X D.X=Y>Z 【答案】B 2.我国古代劳动人民常将草木灰(主要成分K2CO3和生石灰在水中混合,用上层清 液漂白丝帛。清液的主要成分及溶解度如图所示。 (1)t1 ℃时3种物质的饱和溶液中溶质质量分数由小到大的顺序是。 (2)20 ℃时,向4个盛有50 g水的烧杯中,分别加入一定质量的氢氧化钾并充 分溶解。4组实验数据如下: 实验序号 A B C D 加入氢氧化钾的质量 7 14 56 70 /g
溶液质量/g 57 64 106 106 第2题图 由上述实验数据可知: ① 所得溶液是不饱和溶液的是(填序号); ②20℃时,将C继续恒温蒸发25 g水,过滤,得到质量为 g的固体。 【答案】(1)Ca(OH2 KOH K2CO3 (2 ①AB ② 28 3.下表是Ca(OH2 和NaOH的溶解度数据。请回答下列问题: 温度/℃0 20 40 60 80 100 溶解度/g Ca(OH2 0.19 0.17 0.14 0.12 0.09 0.08 NaOH 31 91 111 129 313 336
(1)依据上表数据,绘制Ca(OH2 和NaOH的溶解度曲线,下图中能表示NaOH溶 解度曲线的是(填“A”或“B”)。 第3题图 (2)要想把一瓶接近饱和的Ca(OH2溶液变成饱和溶液,可采取措施有(填序 号)。 ① 蒸发水② 升高温度③ 降低温度④ 加入水⑤ 加入氢氧化钙 (3)现有60 ℃时含有Ca(OH2 和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH晶体,应采取的物理方法是。 (4)现有20 ℃时Ca(OH2的饱和溶液(甲溶液),向其中加入一定量CaO后恢复20 ℃,得到乙溶液,溶液中溶质的质量分数的关系为甲乙(填“>”、“<”或“=”)。 【答案】(1) A ( 2 ①②⑤ (3)冷却热饱和溶液(4) = 4.溶液在生产和生活中有重要意义,某兴趣小组为了研究物质的溶解和结晶,做了如下所述过程的实验:
1.2Mg+O2点燃或Δ2MgO 化学反应现象:剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟应用:白色信号弹
2.2Hg+O2点燃或Δ2HgO 化学反应现象:银白液体、生成红色固体 应用:拉瓦锡实验 3.4Al+3O2Δ2Al2O3 化学反应现象:银白金属变为白色固体 4.3Fe+2O2点燃Fe3O4 化学反应现象:剧烈燃烧、火星四射、生成黑色固体、放出大量热 5.C+O2点燃CO2 化学反应现象:剧烈燃烧、白光、放热、使石灰水变浑浊 6.S+O2点燃SO2 化学反应现象:剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰 7.2H2+O2点燃2H2O 化学反应现象:淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水) 应用:高能燃料 8.4P+5O2点燃2P2O5 化学反应现象:剧烈燃烧、大量白烟、放热、生成白色固体 应用:证明空气中氧气含量 9.CH4+2O2点燃2H2O+CO2 化学反应现象:蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)应用:甲烷和天然气的燃烧 10.2KClO3 MnO2Δ 2KCl +3O2↑ 化学反应现象:生成使带火星的木条复燃的气体 应用:实验室制备氧气 11.2KMnO4Δ K2MnO4+MnO2+O2↑ 化学反应现象:紫色变为黑色、生成使带火星木条复燃的气体 应用:实验室制备氧气 12.2HgOΔ2Hg+O2↑ 化学反应现象:红色变为银白、生成使带火星木条复燃的气体 应用:拉瓦锡实验 13.2H2O通电2H2↑+O2↑ 化学反应现象:水通电分解为氢气和氧气 应用:电解水 14.Cu2(OH)2CO3Δ2CuO+H2O+CO2↑ 化学反应现象:绿色变黑色、试管壁有液体、使石灰水变浑浊气体 应用:铜绿加热 15.NH4HCO3ΔNH3↑+ H2O +CO2↑ 化学反应现象:白色固体消失、管壁有液体、使石灰水变浑浊气体 应用:碳酸氢铵长期暴露空气中会消失 16.Zn+H2SO4=ZnSO4+H2↑ 化学反应现象:有大量气泡产生、锌粒逐渐溶解 应用:实验室制备氢气 17.Fe+H2SO4=FeSO4+H2↑ 化学反应现象:有大量气泡产生、金属颗粒逐渐溶解 18.Mg+H2SO4 =MgSO4+H2↑ 化学反应现象:有大量气泡产生、金属颗粒逐渐溶解 19.2Al+3H2SO4=Al2(SO4)3+3H2↑ 化学反应现象:有大量气泡产生、金属颗粒逐渐溶解 20.Fe2O3+3H2Δ 2Fe+3H2O 化学反应现象:红色逐渐变为银白色、试管壁有液体
初三化学中考专题(5)溶解度曲线练习及答案 1.a、b两种物质的溶解度曲线如图所示。下列说法不正确的是 A.将t1℃时b的饱和溶液加水可变为不饱和溶液 B.将t2℃时a的饱和溶液降温至t1℃,溶液质量不变 C.t2℃时,两种物质的饱和溶液中溶质质量分数a>b D.将t2℃时a、b的饱和溶液分别降温至t1℃,两溶液的溶质质量分数相等 2.下图是甲、乙、丙三种固体物质的溶解度曲线,下列说法错误的是 A.t2℃时,甲、乙两种物质的溶解度相等 B.甲的溶解度随温度的升高而增大 C.分别将t3℃时甲、乙、丙的饱和溶液降温至t1℃,则所得的三种溶液中溶质的质量分数大小关系是 乙>甲>丙 D.t1℃时,丙的饱和溶液中溶质的质量分数为40% 3.下图是甲、乙、丙三种固体物质的溶解度曲线,将甲、乙、丙三种物质t2℃时的饱和溶液降温至t1℃, 所得溶液的溶质质量分数关系正确的是 A.甲>乙>丙 B.甲=乙=丙 C.甲=乙>丙 D.丙>甲=乙 4.(多选)甲、乙两固体物质的溶解度曲线如图所示,下列说法正确的是 A.t1℃时,甲物质的溶解度为20g B.t1℃时,30g甲加入到50g水中最多可得70g溶液 C.t2℃时,乙物质的饱和溶液升温变成不饱和溶液 D.t2℃时,甲乙两物质的饱和溶液分别降温到t1℃时,所得溶液溶质质量分数的大小关系是:甲<乙 5.(多选)甲、乙两种固体物质的溶解度曲线如图所示。20℃时,进行了如下图所示的实验,下列叙述正 确的是
A.甲的溶解度大于乙的溶解度 B.实验过程中,属于不饱和溶液的是A溶液和C溶液 C.实验过程中,只有B溶液和D溶液属于饱和溶液 D.实验过程中,B溶液与E溶液中溶质的质量分数相同 6.(多选)甲、乙、丙三种不含结晶水的固体物质的溶解度曲线如图所示,下列说法中正确的是 A.t2℃时将50g甲物质放入50g水中,充分搅拌后得到100g甲溶液 B.t2℃时配制等质量的三种物质的饱和溶液,甲所需要的水最少 C.分别将t2℃时三种物质的饱和溶液降温到t1℃,所得溶液中溶质的质量分数的大小关系是乙>甲> 丙 D.分别将t2℃时三种物质的饱和溶液降温到t1℃,甲溶液中析出的晶体最多丙溶液中无晶体析出 7.甲、乙、丙三种物质的溶解度曲线如下图所示。据图回答: (1)50℃时,乙物质的溶解度是 g; (2)30℃时,三种物质的溶解度由大到小的顺序为; (3)要使接近饱和的丙物质溶液变为饱和,可采取的一种措施是; (4)当溶液的浓度都用溶质的质量分数(m)表示时,下列说法中不正确的 是(选填序号)。 A.t1℃时,甲、丙两种物质的溶解度相等,两种溶液浓度也相等 B.t2℃时,甲、乙、丙三种溶液的浓度可能相等 C.将t2℃的甲、乙、丙三种饱和溶液的温度为降至t1℃时,甲溶液中析出的晶体最多 D.将t2℃的甲、乙、丙三种饱和溶液的温度分别降至t1℃时,所得溶液浓度的大小顺序为m(乙)> m(甲)=m(丙) E.将t1℃的甲、乙、丙三种溶液分别升温,其浓度可能都不发生变化 F.将t2℃的甲、乙、丙三种溶液分别降温,其浓度都可能发生变化
溶解度曲线练习题 1. (2015安徽)甲、乙两种物质的溶解度曲线如图所示。下列说法正确的是( ) A . 甲的溶解度大于乙的溶解度 B . 两种物质的溶解度都随温度升高而增大 C . t 1℃时,甲、乙两种物质的溶液中,溶质质量分数相等 D . t 2℃时,甲的饱和溶液溶质质量分数为50% 2. (2015南昌)如图是甲、乙两种物质的溶解度曲线。下列说法正确的是( ) A. 甲的溶解度大于乙的溶解度 B. t 1℃时等质量甲、乙两物质的饱和溶液中溶质质量相等 C. t 2℃时等质量甲、乙两物质的饱和溶液降温至t 1℃时,两溶液中溶质质量分数相等 D. 氧气的溶解度随温度变化的规律与图中的甲相似 3. (2017重庆B 卷)下图是甲、乙两种固体物质在水中的溶解度曲线。下列说法不正确的是( ) A. 10℃时,甲、乙两种物质的饱和溶液浓度相同 B. 保持20℃,蒸发溶剂可使接近饱和的 乙溶液变成饱和溶液 C. 30℃时,将40 g 甲物质加入50 g 水中,充分溶解后溶液的质量为80 g D. 10℃时,将两种饱和溶液升温至30℃,溶液中溶质的质量分数都增大4. (2017连云港)如图表示的是KNO 3和NaNO 3的溶解度曲线,下列说法正确的是( ) A. t 2℃时,KNO 3溶液的浓度一定等于NaNO 3溶液的浓度 B. t 1℃时,在50 g 水里加入 15 gKNO 3固体,充分溶解,可得到65 g 溶液 C. t 1℃时,往180 gNaNO 3饱和溶液中加入620 g 水可配成质量分数为10%的NaNO 3溶液 D. 若KNO 3中混有少量NaNO 3,可用蒸发溶剂的方法提纯 5. (2016孝感)如图是a 、b 、c 三种物质的溶解度曲线,下列说法错误的是( ) A. t 2℃时a 、b 、c 三种物质的溶解度由大到小的顺序是a > b > c B. P 点表示t 1℃时,a 、c 两种物质的溶解度相等 C. 将c 的饱和溶液变为不饱和溶液,可采用
专题五溶解度曲线 1.a、b两种物质的溶解度曲线如图所示。下列说法不正确的是 A.将t1℃时b的饱和溶液加水可变为不饱和溶液 B.将t2℃时a的饱和溶液降温至t1℃,溶液质量不变 C.t2℃时,两种物质的饱和溶液中溶质质量分数a>b D.将t2℃时a、b的饱和溶液分别降温至t1℃,两溶液的溶质质量分数相等 2.下图是甲、乙、丙三种固体物质的溶解度曲线,下列说法错误的是 A.t2℃时,甲、乙两种物质的溶解度相等 B.甲的溶解度随温度的升高而增大 C.分别将t3℃时甲、乙、丙的饱和溶液降温至t1℃,则所得的三种溶液中溶质的质量分 数大小关系是乙>甲>丙 D.t1℃时,丙的饱和溶液中溶质的质量分数为40% 3.下图是甲、乙、丙三种固体物质的溶解度曲线,将甲、乙、丙三种物质t2℃时的饱和溶液 降温至t1℃,所得溶液的溶质质量分数关系正确的是 A.甲>乙>丙 B.甲=乙=丙 C.甲=乙>丙 D.丙>甲=乙 4.(多选)甲、乙两固体物质的溶解度曲线如图所示,下列说法正确的是 A.t1℃时,甲物质的溶解度为20g B.t1℃时,30g甲加入到50g水中最多可得70g溶液 C.t2℃时,乙物质的饱和溶液升温变成不饱和溶液 D.t2℃时,甲乙两物质的饱和溶液分别降温到t1℃时,所得溶液溶质质量分数的大小关 系是:甲<乙 5.(多选)甲、乙两种固体物质的溶解度曲线如图所示。20℃时,进行了如下图所示的实验,
下列叙述正确的是 A.甲的溶解度大于乙的溶解度 B.实验过程中,属于不饱和溶液的是A溶液和C溶液 C.实验过程中,只有B溶液和D溶液属于饱和溶液 D.实验过程中,B溶液与E溶液中溶质的质量分数相同 6.(多选)甲、乙、丙三种不含结晶水的固体物质的溶解度曲线如图所示,下列说法中正确 的是 A.t2℃时将50g甲物质放入50g水中,充分搅拌后得到100g甲溶液 B.t2℃时配制等质量的三种物质的饱和溶液,甲所需要的水最少 C.分别将t2℃时三种物质的饱和溶液降温到t1℃,所得溶液中溶质的质量分数的大小关 系是乙>甲>丙 D.分别将t2℃时三种物质的饱和溶液降温到t1℃,甲溶液中析出的晶体最多丙溶液中无 晶体析出 7.甲、乙、丙三种物质的溶解度曲线如下图所示。据图回答: (1)50℃时,乙物质的溶解度是 g; (2)30℃时,三种物质的溶解度由大到小的顺序为; (3)要使接近饱和的丙物质溶液变为饱和,可采取的一种措施是; (4)当溶液的浓度都用溶质的质量分数(m)表示时,下列说法中不正确的
《溶液》知识点 一、溶液的形成 二、溶解度 1、固体的溶解度 (1)溶解度定义:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量 四要素:①条件:一定温度②标准:100g溶剂③状态:达到饱和④质量:单位:克 (2)溶解度的含义: 20℃时NaCl的溶液度为36g含义: 在20℃时,在100克水中最多能溶解36克NaCl 或在20℃时,NaCl在100克水中达到饱和状态时所溶解的质量为36克 (3)影响固体溶解度的因素:①溶质、溶剂的性质(种类)②温度 大多数固体物的溶解度随温度升高而升高;如KNO 3 少数固体物质的溶解度受温度的影响很小;如NaCl 极少数物质溶解度随温度升高而降低。如Ca(OH) 2 (4)溶解度曲线 ℃时A的溶解度为 80g 例:(1)t 3 (2)P点的含义在该温度时,A和C的溶解度 相同 (3)N点为 t ℃时A的不饱和溶液,可通过加 3 入A物质,降温,蒸发溶剂的方法使它变为饱和 (4)t ℃时A、B、C、溶解度由大到小的顺序C>B>A 1
(5)从A溶液中获取A晶体可用降温结晶的方法获取晶体。(6)从B的溶液中获取晶体,适宜采用蒸发结晶的方法获取晶体。 (7)t 2℃时A、B、C的饱和溶液各W克,降温到t 1 ℃ 会析出晶体的有A和B 无晶体析出 的有 C,所得溶液中溶质的质量分数由小到大依次为 A 中考化学化学溶解度(大题培优) 一、初中化学溶解度 1.常温下进行下列各组对比实验,说法正确的是()。 A.对比实验①和②,可研究相同溶质在不同溶剂里的溶解性 B.对比实验①和③,可研究不同溶质在相同溶剂里的溶解性 C.对比实验②和④,可研究不同溶质在相同溶剂里的溶解性 D.对比实验③和④,可研究相同溶质在不同溶剂里的溶解性 【答案】D 【解析】 【分析】 在设计对比实验时,一定要注意控制变量。 【详解】 A、对比实验①和②,没有控制水和汽油的量相等,选项A不正确; B、对比实验①和③,同样没有控制水的量相等,选项B不正确; C、对比实验②和④,没有控制碘和高锰酸钾的量相等,选项C不正确; D、对比实验③和④,符合控制变量的要求,可研究相同溶质在不同溶剂里的溶解性,选项D正确。故选D。 2.下图是甲、乙两种固体物质(不含结晶水)的溶解度曲线,下列有关说法正确的是 () A.t2℃时,在两个各盛有100g水的烧杯中,分别加入50g的甲、乙两种固体,充分搅拌,所得甲、乙溶液中溶质的质量不等 B.t1℃时,等质量甲、乙溶液中所含溶剂的质量甲等于乙 C.乙中含有少量甲,可以用冷却热饱和溶液的方法提纯甲 D.t2℃时,将甲、乙的饱和溶液降温至t1℃,甲溶液析出晶体的质量大于乙 【答案】A 【解析】 试题分析:A、从溶解度曲线可看出,t2℃时,甲的溶解度=50g,而乙的溶解度<50g,故在两个各盛有l00g水的烧杯中,分别加入50g的甲、乙两种固体,充分搅拌,甲能全部溶解,而乙有剩余,故所得甲、乙溶液中溶质的质量不等,正确,B、t1℃时,甲、乙物质的溶解度相等,但没有指明是饱和溶液,故等质量甲、乙溶液中所含溶剂的质量甲不一定等于乙,错误, C、从溶解度曲线可看出,甲的溶解度随温度的升高变化较大,而乙的溶解度随温度的升高而变化较小,故乙中含有少量甲,可以用冷却热饱和溶液的方法提纯乙,错误,D、没有指明高温时的溶液是否是等质量,故无法判断析出晶体量的多少,错误,故选A 考点:溶解度曲线的意义 3.20℃时,将等质量的a、b两种不含结晶水的固体物质,分别加入到盛有100g水的烧杯中,充分搅拌后,现象如图1;然后升温到50℃时,现象如图2;a、b两种物质的溶解度曲线如图3.由这一过程可知() A.30℃时a、b溶液溶质质量分数不相等 B.40℃时a、b溶液溶质质量分数大小无法比较 C.从20℃到50℃,b溶液质量分数不变 D.图3中表示a的溶解度曲线是N 【答案】C 【解析】 【分析】 根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的. 【详解】 图1中,溶剂质量相等,甲中物质溶解的质量小于乙中物质,所以M表示的是a物质的溶解度曲线,N表示的是b物质的溶解度曲线; A、30℃时,甲、乙溶液是否达到饱和状态不能确定,所以甲、乙溶液溶质质量分数也不能确定,错误; 【化学】溶液溶解度考点+例题_全面解析 一、溶液选择题 1.下图为两种固体物质(不含结晶水)的溶解度曲线,下列说法正确的是( ) A.40℃恒温蒸发甲、乙两物质的饱和溶液,析出的乙比甲多 B.20℃~40℃时,乙中含有少量甲,可用升温的方法提纯乙 C.35℃,等质量的甲、乙溶液中,溶质的质量分数相等 D.50℃向 100g25%的甲溶液中加入12.5g甲,溶液刚好饱和 【答案】D 【解析】A、甲、乙两物质的饱和溶液的质量不确定,错误;B、由溶解度曲线可知,20℃~40℃时,甲、乙的溶解度都随温度的升高而增大,且乙受温度的影响变化较大,故20℃~40℃时,乙中含有少量甲,可用降温的方法提纯乙,错误;C、由溶解度曲线可知,35℃时,甲、乙的溶解度相等,故35℃,等质量的甲、乙饱和溶液中,溶质的质量分数相等,错误;D、由溶解度曲线可知,50℃时,甲的溶解度为50g,即100g水中最多溶解50g甲物质,那么75g水中最多溶解37.5g甲物质。100g25%的甲溶液中溶质的质量为100g×25%=25g,溶剂的质量为75g。故50℃向100g25%的甲溶液中加入12.5g甲,溶液刚好饱和,正确。故选D。 点睛:重点是抓住溶解度的实质结合溶解度曲线进行分析即可解决。 2.如图是KNO3、MgSO4、NaCl三种物质的溶解度曲线。下列说法正确的是() A.t2℃时,把40g KNO3放入50g水中能得到KNO3饱和溶液,其中溶质和溶液的质量比为4:9 B.t3℃时,图中三种物质的饱和溶液降温至t1℃,所得溶液中溶质质量分数大小关系为NaCl>MgSO4>KNO3 C.t4℃时,其他条件不变,把MgSO4饱和溶液升温到t5℃,在此操作过程中溶液里无明显现象 D.KNO3中含有少量的NaCl杂质,采用蒸发结晶法提纯 中考化学试题分类汇编——溶液 1、(安徽)甲、乙两种物质的溶解度曲线如右图所示。下列说法 正确的是 A.甲的溶解度大于乙的溶解度 B.两种物质的溶解度都随温度升高而增大 C.t1℃时,甲、乙两种物质的溶液中,溶质质量分数相等 D.t1℃时,甲饱和溶液溶质质量分数为50% 2. (福州)实验室用硝酸钾固体配制100.0 g溶质质量分数为 3.0% 的硝酸钾溶液,下列说法正确的是 A. 用50mL量筒量水 B. 将固体放于托盘天平的右盘称取 C. 将固体直接投人童筒中溶解 D. 将配好的溶液装人贴有标签(如图4)的试剂瓶中,塞好瓶塞 3. (呼和浩特)20℃时,将等质量的a、b两种固体,分别加入到盛有lO0g水的烧杯中,充分搅拌后现象如图甲,升温到50℃时,现象如图乙,a、b两种固体的溶解度曲线如图丙。下列说法正确的是,X,X,K] A.图丙中M表示b的溶解度曲线 B.图甲溶液中溶质的质量分数a大于b C.图乙中a、b溶液一定是不饱和溶液 D. 30℃时a、b溶液溶质质量分数不相等 4. (苏州)实验室配制50g溶质质量分数为15%的氯化钠溶液。下列说法中错误的是 A.实验的步骤为计算、称取、量取、溶解、转移 B.溶解过程中玻璃棒的作用是搅拌,以加快氯化钠的溶解速率 C.把配制好的氯化钠溶液倒入刚用蒸馏水润洗过的试剂瓶中,并贴上标签 D.量取水时,用规格为50mL的量筒量取42.5mL蒸馏水 5. (苏州)A、B、C三种物质的溶解度曲线如图5所示。下 列分析正确的是 A.t1℃时,A、C两种物质的饱和溶液中溶质的质量相等 B.t2℃时,把50gA放入50g水中能得到A的饱和溶液, 其中溶质和溶液的质量比为1∶3 C.将t2℃时,A、B、C三种物质的饱和溶液降温至t1℃, 所得溶液的溶质质量分数的大小关系是B>C=A D.将C的饱和溶液变为不饱和溶液,可采用升温的方 法 6. (重庆B卷) 下图是甲、乙两种固体物质在水中 初中化学中溶解度的计算 一定温度下,一定量的溶剂中所溶解物质的质量是一定的,反之,任意量的饱和溶液里溶质质量与溶剂质量或溶质质量与溶液的质量比是一定的,如果把一定温度下溶剂的量规定为100g,此时所溶解溶质形成饱和溶液时的质量称为溶解度。由此可得以下关系: 溶解度————100g溶剂————100+溶解度 (溶质质量) (溶剂质量) (饱和溶液质量) 可得出以下正比例关系: 式中W溶质、W溶剂、W饱和溶液分别表示饱和溶液中溶质、溶剂和溶液的质量,S表示某温度时该溶质的溶解度。 在以上的比例式中,100是常量,其它3个量中只要知道其中2个量就可求出另外一个量。由此,不仅明确了溶解度的解题的基本思路就是比例关系,从而避免质量混淆的现象,而且也使学生明确溶解度计算的一题多种解法,并从中找出最佳解法。 一、已知一定温度下某物质饱和溶液里的溶质和溶剂的质量,求溶解度 例1 在一定温度下,ng某物质恰好溶于一定量的水中形成mg饱和溶液,求该物质在此温度下的溶解度。解;由题意可知,W溶液=W溶质+W溶剂,因此mg该物质的饱和溶液中含水的质量为:(m-n)g,此题可代入分式(1): 设某温度下该物质的溶解度为Sg 也可代入分式(2) 二、已知一定温度下某物质的溶解度,求此温度下一定量的饱和溶液中含溶质和溶剂的质量 例2 已知在20℃时KNO3的溶解度为31.6g。现要在20℃时配制20gKNO3饱和溶液,需KNO3和H2O各几克? 解:设配制20℃20g硝酸钾饱和溶液需硝酸钾的质量为xg。 此题若代入公式(1),列式为: 若代入公式(2),列式为: 需水的质量为20-4.8=15.2g 答:配制20℃时20gKNO3的饱和溶液需KNO34.8g和水15.2g。 三、已知一定温度下某物质的溶解度,求一定量溶质配制成饱和溶液时,所需溶剂的质量 例3 已知氯化钠在20℃的溶解度是36g,在20℃时要把40g氯化钠配制成饱和溶液,需要水多少克?解:从题意可知,在20℃时36g氯化钠溶于l00g水中恰好配制成氯化钠的饱和溶液。 设20℃时40g氯化钠配制成氯化钠饱和溶液需要水为xg 答:在20℃时,40g氯化钠配制成饱和溶液需要水111g。 四、计算不饱和溶液恒温变成饱和溶溶需要蒸发溶剂或加入溶质的质量 例4 已知硝酸钾在20℃的溶解度为31.6g,现有150g20%的硝酸钾溶液,欲想使其恰好饱和,应加入几克硝酸钾或蒸发几克水? 解:先计算150g20%的KNO3溶液里含KNO3的量为150×20%=30g,含水为150-30=120g,则欲使之饱和,所要加进溶质或蒸发溶剂后的量之比与饱和溶液中溶质和溶剂之比相等进行列式。 设要使20℃150克20%KNO3溶液变为饱和溶液需加入x克KNO3或蒸发yg水,依题意列式: 答:要使20℃150g20%的KNO3溶液变为饱和溶液需加入KNO37.92g,或蒸发25.1g水。 五、计算温度升高时变成饱和溶液需加入溶质或蒸发溶剂的质量 例5 将20℃时263.2g硝酸钾饱和溶液温度升至60℃需加入几克硝酸钾或蒸发几克水才能变为饱和溶液?(20℃硝酸钾溶解度为31.6g,60℃为110g) 设将20℃时263.2gKNO3饱和溶液升至60℃时需加入xgKNO3或蒸发yg水后才能变成饱和溶液。 先计算20℃此饱和溶液中含溶质和溶剂的量,设含溶质为ag 2016年初三化学复习材料 溶解度曲线知识点 一、正确理解溶解度曲线的涵义 溶解度曲线就是在直角坐标系中,用来描述物质的溶解度随温度变化而变化的曲线。根据溶解度曲线可进行溶液的配制,混合物的分离与提纯,以及进行物质结晶或溶解的计算。 占 八、、 ① 曲线上的点:表示对应温度下该物质的溶解度。如:下图中a表示 I 1 A物质在tJC时溶解度为mg。 曲线上方的点:表示在对应温度下该物质的饱和溶液中存在 不能继续溶解的溶质。如:图中b表示在tJC时,A的饱和溶液中有 (m2-m i)g未溶解的溶质。 曲线下方的点:表示在对应温度下该物质的不饱和溶液。如: 图中C表示在t i C时,A的不饱和溶液中,还需要加入(m i-mh)gA物质才达到饱 ②曲线交点:表示在对应温度下不同物质的溶解度相同。如图中d表示在t2C, A、B 两物质的溶解度都为mg 2、线 如图中A物质的溶解度随温度升高而明显增大, A曲线为“陡升型” 如KNO等大多数固体物质: 图中B物质的溶解度随温度变化不大,B曲线为“缓升型”,如NaCI等少数固体物质。 图中C物质的溶解度随温度升高而减小,C曲线为“下降型”,如气体及Ca(OH)等极少数固体物质。 二、掌握溶解度曲线的应用 1?溶解度曲线上的每一点,代表着某温度下某物质的溶解度,因此利用溶解度曲线可以查出某物质在不同温度下的溶解度,并根据物质的溶解度判断其溶解性。 2. 可以比较在同一温度下不同物质溶解度的相对大小。 3. 根据溶解度曲线的形状走向,可以看出某物质的溶解度随温度的变化情况。并根据此情况可以确定从饱和溶液中析出晶体或进行混合物分离提纯的方法。例如:某物 溶解度曲线及其应用 1.溶解度曲线上每一点表示该物质在不同温度下的不同的溶解度。 2.溶解度曲线上的任意一点表示在该温度下某物质的溶解度是多少克。 3.不同物质溶解度曲线的交点处,表示不同物质在相对应的同一温度下的溶解度相同。 4.溶解度曲线上方的一点,表示在指定温度下,溶液中的溶质质量已超过该物质的溶解度,溶液是过饱和的;溶解度曲线下方的一点,表示在指定温度下,溶液中溶质质量还没有达到溶解度的量,溶液是不饱和的。 5.溶解度曲线的特征是: (1)大部分固体物质的溶解度曲线左低右高,溶解度随温度的升高而增加; (2)少数固体物质的溶解度曲线较平缓,溶解度受温度的影响小,如食盐; (3)极少数固体物质的溶解度曲线是左高右低,溶解度随温度的升高而降低,如熟石灰。 6.溶解度曲线的应用: (l)由已知温度查某物质对应的溶解度; (2)由物质的溶解度查该物质所处的温度; (3)比较同一温度下不同物质的溶解度; (4)设计混合物分离或提纯的方法,例如提纯NaCl可用蒸发溶剂法,分离NaCl 和NaNO3可用降温结晶法。 下面举一例来说明溶解度曲线的应用。 图中曲线a、b、c分别表示a、b、c三种物质的溶解度曲线,试回答: (1)t1℃时,a、b、c溶解度大小的顺序是______。 (2)m点表示在t3℃下,a溶液是______溶液,b溶液是______溶液,c溶液是______ 溶液。 (3)n点表示在t2℃时,______和______物质的______相同。 (4)在t3℃时,a、b、c分别在50g水里达到饱和,冷却到t1℃,析出晶体最多的是______。 (5)从a的热饱和溶液中提取a最好的方法是______;要从c溶液中提取c最好采用的方法是______。 (6)为了从混有少量的c物质的a物质的溶液中提取纯净的a可采用的方法是______。 溶解度练习题 一、溶液的形成 1、溶液 (1)溶液的概念: (2)溶液的基本特征:均一性、稳定性 注意:a、溶液不一定无色,如CuSO4溶液为蓝色FeSO4溶液为浅绿色Fe2(SO4)3溶液为黄色中考化学化学溶解度(大题培优)
【化学】溶液 溶解度考点+例题_全面解析
2018中考化学试题溶液和溶解度曲线汇编
初中化学中溶解度的计算
初三化学溶解度曲线知识点及习题
溶解度曲线及其应用(1)汇总