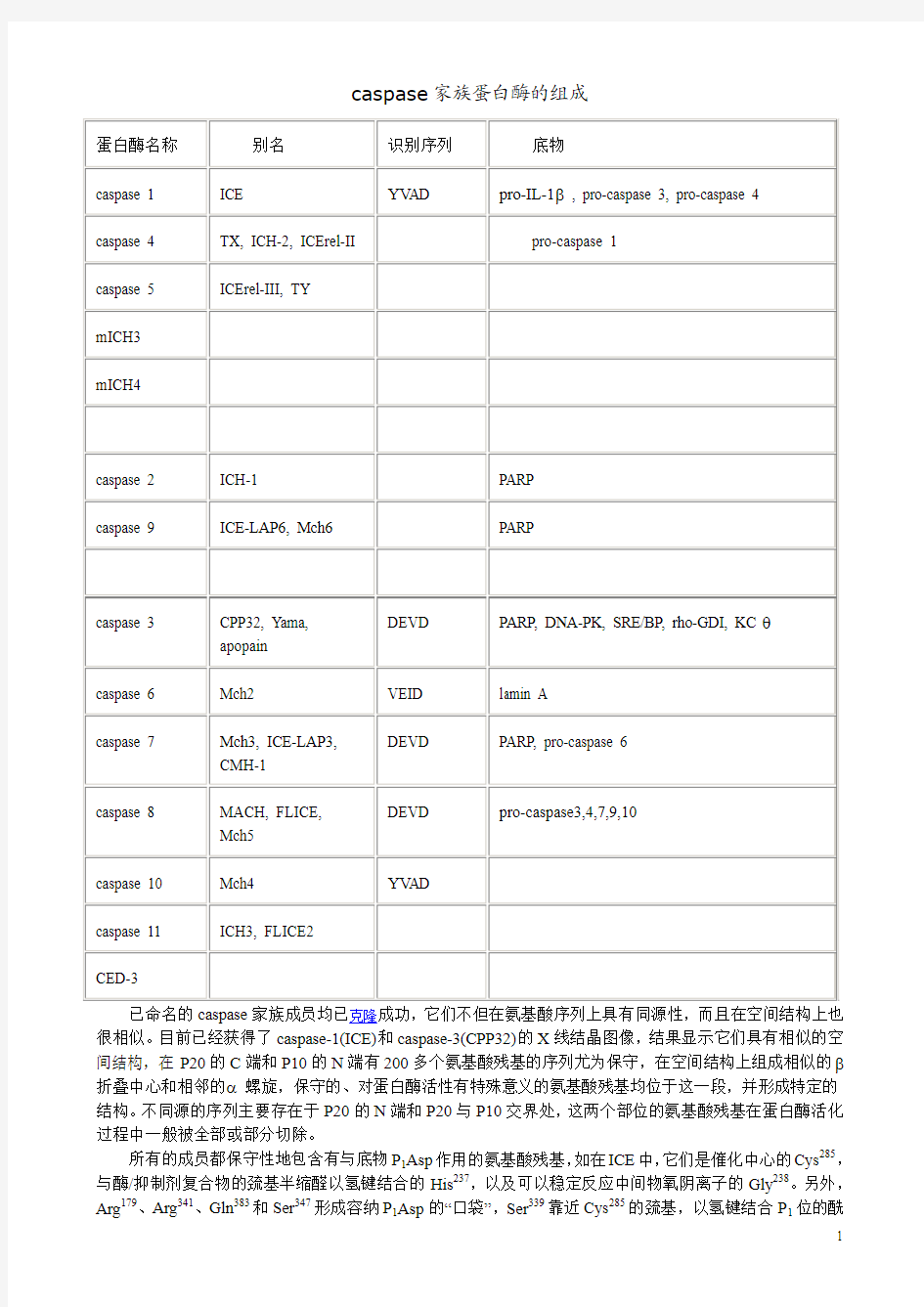

caspase家族蛋白酶的组成
已命名的caspase家族成员均已克隆成功,它们不但在氨基酸序列上具有同源性,而且在空间结构上也很相似。目前已经获得了caspase-1(ICE)和caspase-3(CPP32)的X线结晶图像,结果显示它们具有相似的空间结构,在P20的C端和P10的N端有200多个氨基酸残基的序列尤为保守,在空间结构上组成相似的β折叠中心和相邻的α螺旋,保守的、对蛋白酶活性有特殊意义的氨基酸残基均位于这一段,并形成特定的结构。不同源的序列主要存在于P20的N端和P20与P10交界处,这两个部位的氨基酸残基在蛋白酶活化过程中一般被全部或部分切除。
所有的成员都保守性地包含有与底物P1Asp作用的氨基酸残基,如在ICE中,它们是催化中心的Cys285,与酶/抑制剂复合物的巯基半缩醛以氢键结合的His237,以及可以稳定反应中间物氧阴离子的Gly238。另外,Arg179、Arg341、Gln383和Ser347形成容纳P1Asp的“口袋”,Ser339靠近Cys285的巯基,以氢键结合P1位的酰
胺。与P2~P4作用的氨基酸残基则变异比较大,这可能是各个成员识别不同底物的特异性之所在。在活性Cys周围的氨基酸序列也很保守,一般都有Gln-Ala-Cys-Arg-Gly(QACRG)五肽序列,在caspase-8、caspase-10中为QACQG,在caspase-9中是QACGG,这三个成员都有一个氨基酸残基的变异,但这种变异不影响蛋白酶的剪切活性和特异性。
未活化的caspase家族蛋白酶是以酶原形式存在的,酶原的氨基端有一段被称为“原结构域”(pro-domain)的序列。酶原活化时不但要将原结构域切除,并且要将剩余部分剪切成一大一小两个亚基,分别称为P20和P10,活性酶就是由这两种亚基以(P20/P10)2的形式组成的。这种活化反应也是Asp特异的,剪切发生在酶原中保守序列的Asp与其后的氨基酸残基之间,一般是先切下羧基端的小亚基,然后再从大亚基的氨基端切去原结构域。这种剪切可以是酶原及中间活性酶自我催化,也可以是其它ICE家族蛋白酶的作用,还有其它酶类如颗粒酶B参与。二caspase家族蛋白酶的结构与功能
按照结构同源性的大小,可以将caspase蛋白酶分为三个组,分别以caspase-1、caspase-2和caspase-3为代表。其中最重要的是caspase-1、caspase-3 和caspase-8。
(一)caspase-1(ICE)
1. ICE的结构与生物学作用
ICE即IL-1β转化酶(IL-1β converting enzyme),是单核细胞合成的一种蛋白酶,可以将34kD的IL-1β前体(pro-IL-1β )剪切为17kD的成熟IL-1β,这种剪切对于IL-1β活性的发挥是必须的。不表达ICE的细胞系转化IL-1β基因后可以产生pro-IL-1β,但不能分泌有活性的成熟IL-1β;ICE特异性抑制剂可以阻断金黄色葡萄球菌刺激引起的IL-1β的分泌。ICE属于半胱氨酸蛋白酶,活性中心有高活性的巯基,对氧化剂很敏感,但对丝氨酸蛋白酶、金属蛋白酶或天冬氨酸蛋白酶的抑制剂不敏感。
(1)ICE活化时的剪切过程:ICE基因定位于11q13-23,编码的ICE前体(pro-ICE)全长404aa,约45kD,蛋白酶活性中心是位于283~287位置的Gln-Ala-Cys-Arg-Gly(QACRG)五肽序列,其中Cys285是发挥酶切活性的关键残基。在活化过程中pro-ICE在4个位点Asp103~Ser104、Asp119~Asn120、Asp297~Ser298和Asp316~Ala317进行自我催化剪切形成两个片段P20和P10,P20和P10首先形成异源二聚体,然后两个P20/P10异源二聚体再通过P10小亚基多聚化形成同源二聚体,所以ICE的活性形式是(P20/P10)2。pro-ICE活化过程中的剪切并不是在四个酶切位点同时进行的,最先被剪切的是第三个位点(Asp297~Ser298),形成P35和P12两个片段,P35的酶切活性比pro-ICE要高,它既可以进一步在第三个酶切位点剪切其它pro-ICE,还可以剪切其它三个酶切位点,形成P20和P10两个片段,再由P20和P10形成四聚体。四聚体形式的ICE酶切活性非常强,实验证明即使在单核细胞大量分泌IL-1β时,细胞浆中活性形式的ICE也仅占很小的比例。从pro-ICE上剪切下来的原结构域可以抑制ICE的进一步剪切,这可能是一种反馈机制。
(2)ICE识别的剪切位点和特异性抑制剂:ICE识别的剪切位点是一个四肽序列,除了在P1位置的Asp 外,还要求在P4位置的氨基酸残基具有一个较大的疏水性集团,P2和P3位置上的氨基酸的变异则较大,P1’位置上一般是一个较小的疏水性氨基酸。根据这一研究结果,人们合成了ICE的人工特异性四肽底物YV AD,醛化的YV AD(Ac-YV AD-CHO)是ICE的特异可逆抑制剂,醯酮化YV AD(Ac-YV AD-CMK)是特异性不可逆抑制剂。YV AD抑制剂可以抑制单核细胞中成熟IL-1β的释放,而对其它细胞因子的释放没有作用,在体的实验也有同样的结果,说明这些特异性抑制可能具有一定的临床实用前景。
牛痘病毒产生的一种38kD的蛋白质CrmA(cytokine response modifier A)与丝氨酸蛋白酶抑制剂(serpin)很相似,但它并不抑制丝氨酸蛋白酶的活性,反而抑制ICE的活性。研究发现这是因为CrmA的氨基酸序列中有LV AD四肽结构,与ICE的特异性抑制剂YV AD很相似,可以作为假底物结合ICE,阻断ICE对pro-IL-1β的剪切,从而降低IL-1β的分泌。所以CrmA在病毒感染时可以干扰宿主的炎症反应,促进病毒在体内的复制。
(3)ICE的空间构型:利用不可逆的抑制剂Ac-YV AD-CMK,Walker等于1994年获得了活性ICE的X 线结晶图像。分析发现,ICE是首先由P20/P10构成一个完整的结构域,然后两个相同的结构域再通过P10结合成一个蛋白酶。在P20/P10异源二聚体中,中心位置是由6个β折叠股组成,其中4个来自于P20呈平行排列,另两个来自P10,其中一个与P20的4个折叠股平行排列,另一个则呈反平行排列。β折叠股
形成的核心周围是由分别来自P20和P10的α螺旋所包围。两个P20/P10异源二聚体以反平行方式通过P10结合在一起,在外表形成一个可以容纳底物P1Asp侧链羧基基团的“口袋”。这个“口袋”由P20的Arg179、Gln283和P10的Arg341、Ser347组成,Gly238和His237也参与这种构型的维持,活性中心的Cys285通过氢键与底物结合。对ICE/CED-3家族其它成员的研究发现,在ICE中形成活性中心的氨基酸序列和形成容纳底物的“口袋”的四个氨基酸都很保守,提示它们可能具有相似的空间结构。
2. ICE在细胞凋亡中的作用
Yuan等于1993年将CED-3基因克隆出来,发现它所编码的蛋白质的与人ICE很相似,在一级结构上有28%的同源性。CED-3包含503个氨基酸残基,有100aa富含丝氨酸,与ICE的同源性主要表现在非富含丝氨酸的区域,尤其是羧基端的115aa,与ICE同源性高达43%,其中也包含活性中心QACRG(361~365)。CED-3可能象ICE一样,也是一种半胱氨酸蛋白酶,通过剪切底物蛋白来参与细胞凋亡。ICE是人体中CED-3的同源物,可以发挥与CED-3相似的作用,参与人体细胞的凋亡过程。用A TP或过量内素毒素刺激单核细胞,可以通过活化ICE增加IL-1β的分泌,这些刺激同时也可以促进细胞凋亡。将ICE cDNA转染入大鼠成纤维细胞系中过量表达ICE可以引起细胞凋亡,这种凋亡可以被牛痘病毒蛋白CrmA或细胞凋亡拮抗蛋白BCL-2所抑制;如果在转染前将ICE基因中编码酶切活性中心的氨基酸残基(Cys285、Gly287)突变,则不能诱导细胞发生凋亡;将CrmA导入鸡背根神经节细胞可以阻断撤除神经生长因子而引起的神经元细胞的凋亡过程。
但是有些研究与上述结果不相吻合:稳定高表达IL-1β的细胞系并不自动发生凋亡;ICE基因剔除的小鼠虽然不能分泌成熟IL-β,但其发育并不受影响,也不发生自身免疫性疾病,这些小鼠的胸腺细胞和巨噬细胞在受到特定信号刺激后仍能发生凋亡;在具有ICE活性的细胞中用YV AD抑制ICE活性后,细胞凋亡过程也不受影响;凋亡的鸡细胞DU249的细胞提取液不具有剪切pro-IL-1β的能力,但凋亡的DU249细胞提取液的另一种成分prICE(proteolytic resembling ICE)则可以将不能作为ICE底物的PARP剪切成典型的凋亡片段。这些结果说明ICE本身可能不是人体细胞凋亡的真正效应剂,至少不是最主要的因素,在人体中可能有其它更重要的ICE样的蛋白酶参与细胞凋亡过程。
(二)caspase-3
1994年Fernandez-Alnemri等在BenBank表达序列标记(expression sequence tag, EST)数据库中找到一段ICE/CED-3活性中心同源的序列,用它合成探针后,筛选人Jurkat T淋巴细胞cDNA文库,从中克隆到一种新基因,因其编码分子量为32kD的半胱氨酸蛋白酶而称之为CPP32(cysteine protease protein, 32kD)。随后,其它学者独立地将这一蛋白基因克隆出来,并分别命名为prICE、apopain(凋亡素)和Yama(印度传说中的死亡之神)。1996年这种蛋白酶被命名为caspase-3。现在一般认为caspase-3是细胞凋亡过程中最主要的终末剪切酶,也是CTL细胞杀伤机制的重要组成部分。
1. caspase-3的结构
pro-caspase-3含有277个氨基酸残基,分子量约32kD,与ICE有30%同源性,与CED-3有35%同源,是caspase家族中与CED-3同源性最高的,不论从结构同源性还是从底物特异性来看都与CED-3很相似,所以有人认为它是CED-3在哺乳动物中的同源蛋白。caspase-3的原结构域明显短于ICE只有28个氨基酸残基,但蛋白酶活性中心和与结合底物有关的保守的氨基酸均与ICE一致。pro-caspase-3在活化过程中从Asp28~Ser29和Asp175~Ser176两处被剪切,形成P17(29~175)和P10(182~277)两个片段,相当于ICE的P20和P10,两种亚基再组成活性形式的caspase-3。pro-caspase-3本身并没有催化活性,在活化时首先由颗粒酶B(GrzB)或caspase-10在D175剪切下小片段后它才被部分活化,随后则可进行下一步的自我催化。在剪切原结构域时可能还有其它caspase如ICE的参与。
2. caspase-3的活化和参与细胞凋亡
caspase-3在细胞凋亡中起着不可替代的作用,caspase-3基因转染昆虫Sf9细胞后引起细胞凋亡,这个过程可以被BCL-2阻断;在发生凋亡的细胞提取液中去除caspase-3后,这些提取液就失去了诱导细胞凋亡的能力;再加入纯化的caspase-3它就又恢复了致凋亡的功能。
caspase-3可以被多种因素活化,在CTL细胞的杀伤作用中,它既可被Fas/FasL途径活化,也可以通过颗粒酶B途径活化。颗粒酶B是CTL细胞颗粒中的一种丝氨酸酯酶,是哺乳动物中caspase蛋白酶外唯一的在Asp后剪切的蛋白酶,它可以特异性剪切ICE家族蛋白酶催化亚单位C端的IxxD序列,并活化
caspase 2、3、6、7、8、9、10。ICE也可以被颗粒酶剪切,但剪切后并不被活化。
3. caspase-3引起细胞凋亡的机制
caspase-3最主要的底物是多聚(ADP-核糖)聚合酶PARP(poly(ADP-ribose) polymerase),该酶与DNA修复、基因完整性监护有关。在细胞凋亡启动时,116kD的PARP在Asp216-Gly217之间被caspase-3剪切成31kD 和85kD两个片段,使PARP中与DNA结合的两个锌指结构与羧基端的催化区域分离,不能发挥正常功能。结果使受PARP负调控影响的Ca2+/Mg2+依赖性核酸内切酶的活性增高,裂解核小体间的DNA,引起细胞凋亡。这种裂解过程可被caspase-3的特异性抑制剂Ac-DEVD-CHO所抑制,但不能被CrmA抑制。caspase 3还可以剪切U1-70K、DNA-PK、PKCδ和PKCθ。PKCδ和PKCθ都属于新型PKC(novel PKC, nPKC),当被caspase 3剪切后,可以切除调节区域,而成为活性形式的PKC,另外实验还证明,过量表达PKCδ和PKCθ均可以引起细胞凋亡,说明它们都参与了细胞凋亡的诱导。
(三)caspase-8
在caspase-8发现之前,人们虽然知道多种细胞膜外的因素可以引起细胞凋亡,而且知道caspase家族蛋白是这种细胞凋亡过程中的效应物质,但对凋亡信号如何由细胞膜外转递到细胞浆,并如何引起caspase 蛋白酶活化的过程却知之甚少。含有死亡结构域的胞浆信号蛋白的发现,证明死亡信号是通过这些蛋白质向胞浆内部传递,并最终引起caspase蛋白酶的活化的。
1995年Enari等证明CrmA可以阻断Fas与TNFRI引起的细胞凋亡,并且发现在Fas和TNFRI活化时有caspase-3和caspase-7的活化,而CrmA在阻断细胞凋亡的同时也抑制了caspase-3和caspase-7的活化,这说明caspase-3、caspase-7等ICE家族蛋白酶参与了Fas和TNFRI引起的细胞凋亡过程,并且提示CrmA可以通过抑制caspase-3、caspase-7的上游ICE样蛋白酶来阻断凋亡过程。之后Kischkel等发现Fas 活化时可以与至少4种蛋白相连,分别称为CAP1(cytotoxicity-dependent APO-1-associated proteins 1)、CAP2、CAP3和CAP4,这4种蛋白与活化的Fas受体一起被称为死亡诱导信号复合物(death-inducing signaling complex, DISC)。随后的研究证实CAP1和CAP2是不同形式丝氨酸磷酸化的FADD蛋白,CAP3和CAP4则被证明是一种新蛋白的两种不同剪接形式,这个蛋白被命名为FLICE(FADD-like ICE)。同年,另两组研究者分别用酵母双杂交系统和根据蛋白的同源性也发现了这个蛋白,分别将其命名为MACH(MORT1-associated CED-3 homolog)和Mch5(mammalian Ced homolog 5),这个蛋白质就是后来统一命名的caspase-8。
1. caspase-8的结构和分布
Caspase-8前体共有479aa,分子量为55kD,其显著的特点是在N端有2个70aa左右的结构域,与FADD 的N端的死亡效应结构域(death effector domain, DED)同源,这种同源的结构域可以发生相互聚合,提供了caspase-8与FADD相互结合的一个部位。caspase-8的C端与ICE结构同源,它的活性中心与其它ICE家族蛋白酶活性中心有所不同,不是通常的QACRG,而是由QACQG五肽组成,但这样的结构不影响其蛋白酶活性的发挥。caspase-8一级结构中其它与结合底物有关的氨基酸残基都很保守。caspase-8分布于胎儿和成人的各种组织中,但在胎脑中没有分布。在外周血白细胞中水平较高,可能与白细胞的凋亡有关。
2. caspase-8的活化和参与细胞凋亡
caspase-8可以自我活化,也可以在颗粒酶B的剪切下活化。caspase 8特异性识别的序列是DEVD,活化的caspase-8不但可以剪切PARP,而且还参与其它ICE家族蛋白酶,如caspase-3和caspase-7的活化过程。用caspase-8基因转染MCF-7乳腺癌细胞系,可以引起细胞凋亡,出现典型的形态变化。caspase-8引起的细胞凋亡可以被广谱的ICE家族蛋白酶抑制z-V AD-fmk所阻断,也可以被CrmA阻断,提示它可能是CrmA的靶蛋白。
3. caspase-8参与细胞凋亡的机制
由于caspase-8具有FADD样DED结构域,并且能够通过DED结构域与FADD结合,所以caspase-8可以在凋亡过程中间接与细胞膜受体发生联系,从而将细胞膜事件转化为细胞浆事件。他们认为,在非活化情况下caspase-8的两个FADD样DED结构是互相结合在一起的。当细胞膜表面的Fas与其配体FasL 或相应的单抗结合后,受体发生多聚化,引起FADD与受体胞浆区死亡结构域互相结合。这种结合使FADD 的DED结构域发生变构,变构后的DED可以与胞浆中caspase-8的一个DED结构域结合,使caspase-8的两个DED结构域分开,同时使caspase-8的ICE同源区解放出来,恢复蛋白酶活性,通过自我催化生成
活性形式的caspase-8蛋白酶,后者再作用于胞浆中其它ICE家族蛋白酶,使它们发生逐级活化。
(四)其它caspase蛋白酶
1. caspase-2
Kumar等首先在小鼠胚脑中发现了一种称为Nedd-2(neuronally-expressed, developmentally downregulated)的蛋白酶,这种蛋白酶随着动物的成熟其表达水平逐步下降,在成年鼠脑中找不到Nedd-2的表达。Wang等利用鼠Nedd-2作为探针,筛选人胚脑cDNA文库,获得两条与鼠Nedd-2高度同源的cDNA 序列,并命名为ICH-1(ICE and CED-3 homolog 1)。由于不同剪接,ICH-1可以编码两个基因产物:ICH-1L 长435aa,其中原结构域长123aa,301~305有以半胱氨酸为中心的活性位点QACRG,含有与ICE和CED-2相似的序列,分别有28%和27%同源性,高表达可引起哺乳动物细胞凋亡;另一种基因产物ICH-1S长312aa,高表达则能抑制细胞凋亡。ICH-1L促凋亡的作用可以被BCL-2所阻断,但不被CrmA所阻断。Northern Blot 和反转录-PCR证实,caspase-2的表达与组织的发育阶段有关。ICH-1L和ICH-1S均表达于心脏、肾和脑,但ICH-1S在胚脑中表达最高,而ICH-1H在成年胸腺中表达最高。
在细胞发生凋亡时,48kDa的caspase-2首先被一种caspase-3样蛋白酶在Asp316剪切成p33和p14,然后再缓慢地在Asp152和Asp330处剪切为p18和p12组成的活性蛋白酶,后一过程要在2~3h后才能完成。caspase-2可能参与CTL细胞的杀伤作用,但它并不能被颗粒酶B直接活化,必须被一种caspase-3样蛋白酶活化。
2. caspase-4
caspase-4是1995年Kamens等在松驰杂交(low stringency hybridization)的条件下用人ICE基因探针筛选人胸腺细胞cDNA文库,找到的一个与ICE和CED-3同源的基因,当时将它命名为ICH-2(ICE and CED-3 homolog 2)。同年另外两组科学家也分别独立地发现了这个基因,并分别命名为TX和ICErel-II。caspase-4基因定位于人染色体11q22.2-22.3,所编码的蛋白包含377aa,分子量约43kD,一级结构与ICE有53%的同源性,在切除104aa的原结构域后同源性更高达60%,所有与酶活性中心(QACRG)和与结合底物有关的氨基酸残基都得到了保留。caspase-4分布较广,除脑组织外在所有检测的组织中都有表达。
虽然caspase 4与ICE高度同源,但它并不能催化pro-IL-1 为成熟分子,但可以活化ICE前体及其自
身的前体。caspase 4不能剪切DNA-PK,ICE敏感的抑制剂YV AD-CHO可以阻断caspase 4的活性,但其敏感性仅为ICE的1/20。caspase-4的活性形式也是由P20和P10两种亚基组成。将caspase-4基因转染Sf9昆虫细胞系可以引起典型的凋亡变化,提示caspase-4在细胞凋亡中起一定的作用。
3. caspase-5
caspase 5是Munday等发现caspase 4(ICErel-II)时同时发现的一种蛋白,当时命名为ICErel-III,另外一组研究者则命名为TY。caspase-5包含418aa,分子量47.7kD,与ICE有51%的同源性,并具有保守的活性中心QACRG。但caspase-5不能剪切pro-IL-1β,在过量表达时可以诱导凋亡的发生。
4. caspase-6
caspase 6是通过搜索有保守的QACRG活性中心和GSWFI保守的抑制剂结合位点的方法用PCR的手段找到的,命名为Mch2,与caspase-3有38%同源性,可以在昆虫细胞中引起细胞凋亡。随后的研究证明,caspase 6可以剪切层蛋白B,而且其活性对Zn2+敏感,这是唯一一个可以剪切层蛋白的caspase。caspase 识别的序列也是VEID。它不能剪切U1-70K和DNA-PK,但可以部分剪切PARP,并可活化caspase 3。
5. caspase-7
caspase 7是通过PCR扩增caspase保守序列得到的,称为Mch3(mammalian Ced homolog 3),另外也被称为ICE-LAP3(ICE like apoptotic protease 3)和CMH1(CPP32/Mch2 homolog 1)。caspase-7包含304aa,分子量35kD,caspase-7是与caspase-3同源性最高的成员,有58%的同源性,与其它caspase有35%的同源性。caspase-7与caspase-3的同源区主要在具有酶活性的亚单位区,它也保留了QACRG(184~188)五肽活性中心,与底物结合的氨基酸残基也都存在。caspase-7可以分别在Asp23~Ala24、Asp198~Ser199和Asp206~Ala207之间被剪切,形成P20/P12形式的caspase-7。caspase-7分布很广泛,在脑中也有少量存在。用抗caspase-7的单抗发现caspase-7在Jurkat细胞中主要分布于胞浆和近膜结构中,细胞核中未见分布。
用caspase-7基因转染乳腺癌细胞系发现全长蛋白不能引起细胞凋亡,但去除氨基端53aa (其中包括原结构域)的caspase-7则可以引起细胞凋亡。进一步研究证明去除原结构域的caspase-7具有自催化作用,可以自动催化成P10/P12形式。酶活性中心的半胱氨酸对caspase-7的这种作用十分重要,突变为Ala后就失去致凋亡作用。当Fas和TNF引起的细胞凋亡时细胞内caspase-7也被活化,CrmA可以阻断caspase-7引起的细胞凋亡。caspase 7不能剪切pro-IL-1β,但它可以剪切PARP和固醇调节元件,caspase-7对PARP 的剪切可以被DEVD-CHO所阻断,但不能被ICE敏感的YV AD-CHO所阻断。caspase- 7对DEVD-CHO 抑制剂的敏感性只有caspase-3的1/3,对CrmA则很不敏感。
6. caspase-9
通过搜索人类基因组数据库中与caspase-7同源的序列,Duan等找到一个命名为ICE-LAP6的基因序列,编码414aa,分子量46kD。序列分析表明它也属于ICE/CED-3家族,在相当于ICE活性部分的序列中,caspase-9与其它成员有30%左右的同源性,它的原结构域很长,与caspase-3相似。在caspase-9中与结合底物有关的6个氨基酸残基都得到了保留,但它的酶活性中心的五肽序列与其它ICE/CED-3蛋白酶的QACRT不同,是QACGG,这是继caspase-8的QACQG之后出现的另一种活性中心变异,这种变异也不影响蛋白酶的酶切活性。
caspase-8的分布很广泛,在许多胚胎和成人组织中都有分布。颗粒酶B可以活化caspase-8,活化后可以剪切PARP。乳腺癌细胞系MCF7转染caspase-8基因后出现凋亡,这种作用可以被z-V AD fmk所阻断。当活性中心的半胱氨酸被突变后,caspase-8失去促凋亡的作用。
7. caspase-10
Alnemri等于1996年通过在GenBank中寻找caspase-3的表达序列标记,从人Jurkat T淋巴细胞cDNA 文库中同时克隆出caspase-8和caspase-10,分别命名为Mch5和Mch4。caspase-10含有497aa,分子量55kD,与其它成员有30~50%的同源性。caspase-10分子结构的显著特点是其N端也有两个FADD氨基端样结构域,所以它也可能与caspase-8一样是将细胞膜事件转化为细胞浆事件的一个环节。caspase-10的酶活性中心也与caspase-8一样,是QACQG,而不是一般的QACRG五肽序列。caspase-10分布广泛,基因定位于2p12,基因转染昆虫细胞系Sf9中可以引起细胞凋亡,其活性可以被DEVD-CHO所抑制。
8. caspase-11
Yuan等于1996年从小鼠胸腺细胞cDNA文库中发现,命名为ICH-3。373aa,42kDa,与ICE有46%同源性,活性中心为QACRG,ICE中与催化活性有关的氨基酸残基得到了保留,包括His206、Gly207和Cys254,
与P1结合有关的氨基酸残基也保守,包括Arg148、Gln252、Arg310和Ser316。caspase-11表达于许多组织,与ICE表达模式相似,并可以被LPS所诱导。在Rat-1细胞中过量表达caspase-11可以引起细胞凋亡,CrmA 和BCL-2可以阻断这种凋亡。caspase-11可以被颗粒酶B剪切并活化。caspase-11虽不能剪切IL-1β前体,但可以活化ICE,通过ICE再活化IL-1β。所以在细胞凋亡中,caspase-11可能作用于ICE上游,在受LPS 刺激后首先活化,然后再通过活化ICE,一方面剪切IL-1β,引起炎症反应,另一方面还可以在有些细胞中引起细胞凋亡。
9. mICH-3和mICH-4
通过松驰杂交方法也发现了另两种鼠的ICE同源蛋白,分别称为mICH-3和mICH-4。MICH-3在静止细胞表达水平很低,但LPS刺激后上调,基因剔除的小鼠可以抵抗LPS引起的致命的影响,所以推测它屯炎症过程有关。MICH-3不能剪切pro-IL-1β,但过量表达时可以引起细胞凋亡。
caspase家族及在细胞凋亡中的作用 admin 注:本文仅是基础知识,目前这方面进展十分快,需要更新更多的知识。如caspase家族目前发现至少14种。这里仅介绍几种常见的成员。目的是让大家了解到caspase家族的概况,以及在细胞凋亡中的作用。 一caspase家族蛋白酶的组成 未活化的caspase家族蛋白酶是以酶原形式存在的,酶原的氨基端有一段被称为“原结构域”(pro-domain)的序列。酶原活化时不但要将原结构域切除,并且要将剩余部分剪切成一大一小两个亚基,分别称为P20和P10,活性酶就是由这两种亚基以(P20/P10) 2 的形式组成的。这种活化反应也是Asp特异的,剪切发生在酶原中保守序列的Asp与其后的氨基酸残基之间,一般是先切下羧基端的小亚基,然后再从大亚基的氨基端切去原结构域。这种剪切可以是酶原及中间活性酶自我催化,也可以是其它ICE家族蛋白酶的作用,还有其它酶类如颗粒酶B 参与。 表5. caspase家族蛋白酶的识别序列及作用底物 蛋白酶名称别名识别序 列 底物 caspase 1ICE YVAD pro-IL-1 , pro-caspase 3, pro-caspase 4 caspase 4TX, ICH-2, ICErel-II pro-caspase 1 caspase 5ICErel-III, TY mICH3 mICH4 caspase 2ICH-1PARP caspase 9ICE-LAP6, Mch6PARP
caspase 3CPP32, Yama, apopain DEVD PARP, DNA-PK, SRE/BP, rho-GDI, KCθ caspase 6Mch2VEID lamin A caspase 7Mch3, ICE-LAP3, CMH-1 DEVD PARP, pro-caspase 6 caspase 8MACH, FLICE, Mch5DEVD pro-caspase3,4,7,9,10 caspase 10Mch4YVAD caspase 11ICH3, FLICE2 CED-3 已命名的caspase家族成员均已克隆成功,它们不但在氨基酸序列上具有同源性,而且在空间结构上也很相似。目前已经获得了caspase-1(ICE)和caspase-3(CPP32)的X线结晶图像,结果显示它们具有相似的空间结构,在P20的C端和P10的N端有200多个氨基酸残基的序列尤为保守,在空间结构上组成相似的β折叠中心和相邻的α螺旋,保守的、对蛋白酶活性有特殊意义的氨基酸残基均位于这一段,并形成特定的结构。不同源的序列主要存在于P20的N 端和P20与P10交界处,这两个部位的氨基酸残基在蛋白酶活化过程中一般被全部或部分切除。 所有的成员都保守性地包含有与底物P 1 Asp作用的氨基酸残基,如在ICE中,它们是催化中心的Cys285,与酶/抑制剂复合物的巯基半缩醛以氢键结合的His237,以及可以稳定反应中间物氧 阴离子的Gly238。另外,Arg179、Arg341、Gln383和Ser347形成容纳P 1 Asp的“口袋”,Ser339靠近 Cys285的巯基,以氢键结合P 1位的酰胺。与P 2 ~P 4 作用的氨基酸残基则变异比较大,这可能是各 个成员识别不同底物的特异性之所在。在活性Cys周围的氨基酸序列也很保守,一般都有Gln-Ala-Cys-Arg-Gly(QACRG)五肽序列,在caspase-8、caspase-10中为QACQG,在caspase-9中是QACGG,这三个成员都有一个氨基酸残基的变异,但这种变异不影响蛋白酶的剪切活性和特异性。
细胞凋亡和细胞坏死的区别 高考频度:★★★☆☆难易程度:★★☆☆☆ 脑缺氧、心缺血、急性胰腺炎、动脉粥样硬化等疾病都是由细胞坏死引起的。近日,厦门大 学生命科学学院韩家淮教授课题组的一项研究表明,存在于人体内的一种名为RIP3的蛋白 激酶,能够将细胞凋亡转换成细胞坏死,通过调控这种酶的合成,就可以调控细胞的死亡方式。下列有关叙述错误的是 A.从以上分析可知细胞坏死过程中存在基因的选择性表达 B.—些细胞的坏死对人体也有益处,比如被病原体感染的细胞在免疫系统的作用下死亡 C.抑制RIP3的活性,能在一定程度上对急性胰腺炎起治疗、防御的作用 D.在人体的癌细胞中,也可能存在控制RIP3合成的基因 【参考答案】B 【试藍翼祈】由细运碍亡特銮弟鈿迸环芒寸虽该追越白基医逵淫土爰注'A正聽:由越丹熄思繆不出譎縫琢死痔身徳有莖,B 樂唳;抑割该薛的洁席.则毅別条锻坏死,C正碍:艳籍踰胞前全寵惟,号令鑰無占的基因鑫是一縊的尸D正菇’ ■ ”推荐 -------------- ” 1有关细胞凋亡和细胞坏死的叙述正确的是 A.细胞凋亡的速率会因其功能不同而不同 B.被病毒侵染的细胞的清除属于细胞坏死 C.细胞凋亡和细胞坏死都有利于个体的生长发育 D.细胞凋亡和细胞坏死都受环境影响较大,机体难以控制 2.下列关于细胞凋亡和细胞坏死的叙述中,错误的是 A.细胞凋亡是一种自然的生理过程 B.细胞坏死是一种病理性变化
C.被病原体感染的细胞的清除是通过细胞坏死完成的 D.蝌蚪尾的消失,是由基因决定的细胞自动结束生命的过程 3?下列关于细胞凋亡和细胞坏死的叙述中,错误的一项是 A.细胞凋亡是主动的,细胞坏死是被动的 B.细胞凋亡是生理性的,细胞坏死是病理性的 C.细胞凋亡是基因调控的,细胞坏死是外界因素引起的 D.细胞凋亡是急性的,细胞坏死是慢性的 4?细胞凋亡也称为细胞编程性死亡,其大致过程如图所示。下列有关叙述错误的是 A.细胞皱缩、染色质固缩表明细胞处于衰老状态 B.图示过程只发生在胚胎发育过程中 C.吞噬细胞吞噬凋亡小体与细胞膜的流动性密切相关 D.细胞凋亡是由遗传物质控制的,与细胞坏死有明显区别 5?香烟中含有大量的有害物质,如尼古丁等会造成吸烟者肺部细胞的死亡。这种细胞的死亡过程属于 A.生理性死亡 B.正常衰亡 C.细胞坏死 D.细胞凋亡 1.【答案】A 【解析】功能不同的细胞凋亡速率不同,如神经细胞可能一生都不凋亡,口腔上皮细胞 则在短时间内发生凋亡,A正确;被病毒侵染的细胞的清除属于细胞凋亡,B错误;细胞凋亡是指由基因控制的细胞自动结束生命的过程,有利于个体的生长发育;细胞坏死是 1E常细 胞 细胞皱缩细胞励SL吞噬细胞 核染色质分解战多个包袅、呑噬 凋亡小体凋亡小体
细胞凋亡与衰老 (作者:___________单位: ___________邮编: ___________) 【关键词】细胞凋亡;衰老 衰老是指增龄过程中机体出现的多器官渐进性功能减退,其确切机制并不清楚,有多种学说,如自由基学说、端粒学说和细胞凋亡学说等。以啮齿类动物为研究对象,肌肉、脑、心脏等多种衰老组织中均存在细胞凋亡异常〔1〕。细胞凋亡参与多种与衰老相关的病理过程,如骨质疏松、阿尔茨海默病等。目前细胞凋亡在衰老中的作用成为国内外研究热点,本文就二者的最新研究进展作综述。 1 细胞凋亡 细胞凋亡涉及一系列基因的激活、表达及调控,是机体为更好地适应环境采取的主动死亡,其参与许多重要生命活动,如胚胎发育、免疫防御和维持组织稳态等,对维持细胞增殖与死亡的平衡有重要意义。 1.1 细胞凋亡途径 1.1.1 外源性途径又称死亡受体途径,是由膜受体介导的细胞死亡过程。死亡受体是属于肿瘤坏死因子受体超家族的跨膜受体,其中研究较透彻的是Fas/FasL系统。Fas广泛分布于胸腺、肝、心、肾等
组织细胞表面。当Fas与其配体FasL结合后发生多聚化,与胞浆内死亡结构域结合蛋白(FADD)结合,活化胞浆caspase8,再活化凋亡执行者caspase3,水解蛋白质,启动核酸内切酶剪切DNA,造成凋亡。这是发育过程和免疫系统中最主要的凋亡途径。通过该途径可清除发育过程及免疫反应中活化的淋巴细胞。增龄过程中Fas表达呈上升趋势。衰老大鼠胸腺细胞和脾细胞凋亡速度加快,可能造成衰老机体免疫功能下降。 1.1.2 内源性途径以线粒体为核心,又称线粒体途径。该途径凋亡信号来自体内各种应激,如DNA损伤、氧化应激、紫外线、生长因子缺乏等。凋亡信号引起前凋亡蛋白Bax活化,Bax诱导线粒体释放细胞色素c(Cyt c)。进入胞质的Cyt c与凋亡蛋白激活因子(Apaf1)、caspase9前体组成凋亡体,激活caspase9,再活化caspase3引起细胞凋亡。线粒体也可释放凋亡诱导因子(AIF)和内切核酸酶G进入胞浆,二者转移到细胞核,断裂DNA。随着年龄增长,内源性凋亡途径逐渐变得活跃。 1.1.3 内质网应激介导的细胞凋亡内质网(ER)参与蛋白质合成及翻译后加工修饰。当非折叠或错折叠蛋白质在ER内堆积超过处理能力时,引起ER应激。ER应激的一个后果是细胞凋亡。位于ER膜上的Bak、Bax发生构象变化形成多聚体,使Ca2+进入ER,活化caspase12,引起下游级联反应,活化caspase9和caspase3。机体具有应对ER应激的保护措施,如使翻译起始因子eIF2去磷酸化,减少蛋白质合成。但衰老机体应对ER应激能力降低,eIF2磷
(一)caspase家族 Caspases是近年来发现的一组存在于胞质溶胶中的结构上相关的半胱氨酸蛋白酶,它们的一个重要共同点是特异地断开天冬氨酸残基后的肽键。Caspase一词是从Cysteine aspartic acid specific protease 的字头缩写衍生而来,就反映了这个特征,而这种高度的特异性,在蛋白酶中是很少见的。由于这种特异性,使caspase能够高度选择性地切割某些蛋白质,这种切割只发生在少数(通常只有1个)位点上,主要是在结构域间的位点上,切割的结果或是活化某种蛋白,或使某种蛋白失活,但从不完全降解一种蛋白质。 Caspase的研究源于线虫(C. elegans)细胞程序化死亡的研究。线虫在发育过程中,有131个细胞将进入程序化死亡;研究发现有11个基因与PCD 有关,其中ced3和ced4基因是决定细胞凋亡所必需的,ced9基因抑制PCD。线虫细胞程序化死亡的研究促进了其他动物特别是哺乳类动物中细胞凋亡的研究。人们发现哺乳类细胞中存在着Ced3的同源物ICE(interleukin-1b converting enzyme),它催化白介素-1b的活化,即从其前体上将IL-1b 切割下来。在大鼠成纤维细胞中过量表达ICE和Ced3都会引起细胞凋亡,表明了ICE和Ced3在结构和功能上的相似性;然而敲除ICE基因的小鼠其表现型正常,并未发现细胞凋亡发生明显改变。进一步的研究发现,另一个ICE成员,后来被称为apopain,CPP32或Yama的半胱氨酸蛋白酶,催化poly(ADP-ribose)Polymerase(PARP),即聚(ADP-核糖)聚合酶的裂解,结果导致细胞的凋亡,因而认为apopain执行着与线虫中的ced3相同的功能。Apopain被称为是“死亡酶”,而PARP被认为是“死亡底物”。 Apopain/CPP32/Yama是在1995年由两个实验室分别同时报导,时间上只有两周之差。Ced4的哺乳类同源物则迟迟未能发现,直到1997年,才被证明是Apaf-1(即一种细胞凋亡蛋白酶活化因子apoptosis protease activating factor)。而Ced 9的哺乳类对应物则较早地被证明是BCL-2,这一问题将在以后的部分述及。 现已确定至少存在11种caspase: 这些caspases中,caspase 1和caspase 11,以及可能还有caspase 4被认为不直接参与凋亡信号的转导,它们主要参与白介素前体的活化;而caspase 2,caspase 8,caspase 9和caspase 10参与细胞凋亡的起始;参与细胞凋亡执行的则是caspase 3,caspase 6和caspase 7,其中caspase 3和7具有相近的底物和抑制剂特异性,它们降解PARP,DFF-45(DNA fragmentation factor-45),导致DNA修复的抑制并启动DNA的降解。而
细胞坏死necrosis、细胞凋亡apoptosis、 细胞程序性死亡programmed cell death(PCD) 死亡是生命的普遍现象,但细胞死亡并非与机体死亡同步,在正常的组织中,经常发生“正常”的细胞死亡,它是维持组织机能和形态所必需的;细胞死亡的方式通常有3种:即①细胞坏死(necrosis)。②细胞凋亡(apoptosis)。③细胞程序性死亡(programmed cell death,PCD)。 Ⅰ.细胞坏死 细胞坏死是细胞受到化学因素(如强酸、强碱、有毒物质)、物理因素(如热、辐射)和生物因素(如病原体)等环境因素的伤害,引起细胞死亡的现象。坏死细胞的形态改变主要是由下列2种病理过程引起的,即酶性消化和蛋白变性;参与此过程的酶,如来源于死亡细胞本身的溶酶体,则称为细胞自溶(autolysis);若来源于浸润坏死组织内白细胞溶酶体,则为异溶(heterolysis)。 细胞坏死初期,胞质内线粒体和内质网肿胀、崩解,结构脂滴游离、空泡化,蛋白质颗粒增多,核发生固缩或断裂。随着胞质内蛋白变性、凝固或碎裂,以及嗜碱性核蛋白的降解,细胞质呈现强嗜酸 性,故坏死组织或细胞在苏木精 /伊红染色切片中,胞质呈均一 的深伊红色,原有的微细结构消 失。在含水量高的细胞,可因胞 质内水泡不断增大,并发生溶 解,导致细胞结构完全消失,最 后细胞膜和细胞器破裂,DNA 降解,细胞内容物流出,引起周 围组织炎症反应(图1)。 图1细胞坏死与凋亡的形态区别
Ⅱ.细胞凋亡 细胞凋亡(cell apoptosis)是借用古希腊语,表示细胞象秋天的树叶一样凋落的死亡方式,1972年Kerr最先提出这一概念,他发现结扎大鼠肝的左、中叶门静脉后,其周围细胞发生缺血性坏死,但由肝动脉供应区的实质细胞仍存活,只是范围逐渐缩小,其间一些细胞不断转变成细胞质小块,不伴有炎症,后在正常鼠肝中也偶然见到这一现象。 凋亡是一个形态学概念,是指为维持内环境稳定,由基因控制的细胞自主的有序的死亡现象,不是一件被动的过程,而是主动过程,是为更好地适应生存环境而主动争取的一种死亡过程,涉及一系列基因的激活、表达以及调控等的作用。 凋亡细胞的主要特征见表1,共有:①染色质聚集、分块、位于核膜上,胞质凝缩,最后核断裂,细胞通过出芽的方式形成许多凋亡小体(图1、2);②凋亡小体内有结构完整的细胞器,还有凝缩的染色体,可被邻近细胞吞噬消化,因始终有膜封闭,没有内溶物释放,故不会引起炎症;③凋亡细胞中仍需要合成一些蛋白质,但是在坏死细胞中ATP和蛋白质合成受阻或终止;④核酸内切酶活化,导致染色质DNA在核小体连接部位断裂,形成约200bp整数倍的核酸片段,凝胶电泳图谱呈梯状;⑤凋亡通常是生理性变化,而细胞坏死是病理性变化。 表1细胞凋亡和细胞坏死的区别 区别点细胞凋亡细胞坏死 起因生理或病理性病理性变化或剧烈损伤 范围单个散在细胞大片组织或成群细胞 细胞膜保持完整,一直到形成凋亡小体破损 染色质凝聚在核膜下呈半月状呈絮状 细胞器无明显变化肿胀、内质网崩解 细胞体积固缩变小肿胀变大 凋亡小体有,被邻近细胞或巨噬细胞吞噬无,细胞自溶,残余碎片被 巨噬细胞吞噬 基因组DNA 有控降解,电泳图谱呈梯状随机降解,电泳图谱呈涂抹 状 蛋白质合成有无 调节过程受基因调控被动进行 炎症反应无,不释放细胞内容物有,释放内容物。
第六章细胞的生命历程 第3节细胞的衰老和凋亡教学设计 一、教材分析 细胞像生物体一样也要经历出生、生长、成熟、繁殖、衰老、死亡的过程,所以细胞的分裂、分化、衰老、死亡是生命的必然。那么个体衰老与细胞衰老的关系呢?细胞衰老有哪些表现呢?细胞衰老的原因是什么?细胞的衰老和凋亡是生命活动中必不可少的过程,衰老和凋亡有什么关系?这一连串的问题构成本节内容的主线。对于细胞衰老和凋亡的学习,能使学生对细胞的整个生命过程有个完整的认识。同时细胞衰亡机制的研究与生物科技的发展息息相关。对细胞衰 亡知识的学习,有助于培养学生的科学兴趣,培养学生的创新意识。 二、教学目标 1.知识与技能 (1)个体衰老与细胞衰老的关系。 (2)描述细胞的衰老的特征和原因。 (3)简述细胞凋亡的含义及与细胞坏死的区别。 2.过程与方法 (1)培养学生联系实际灵活应用知识的能力。 (2)学会进行与社会老龄化相关问题的分析。 3?情感态度与价值观 (1)探讨细胞的衰老和凋亡与人体健康的关系,关注老年人健康状况和生活状况
(2)通过有关衰老问题的讨论,树立科学的发展观。 三、教学重点难点 学习重点:1?细胞衰老的概念及特征。2?细胞凋亡的含义。 学习难点:细胞衰老与细胞凋亡的区别和联系。 四、学情分析 学生已经学习了细胞的增殖、分化的内容,对本节的内容已经有了初步的认识和理解,明确了细胞的分化、衰老和凋亡是一个自然的生命过程。本节的内容接近现实生活,可利用现实生活中的例子加以说明,培养学生知识的应用能力和知识的迁移能力。 五、课型:新授课教学方法:教学基本环节:情境导入、展示目标→合作探究、精讲点拨→反思总结、当堂检测→布置作业及预习 六、课前准备布置学生在课前预习细胞衰老与凋亡内容。教师制作课件。 七、课时安排:1课时 八、教学过程 【情景导入、展示目标】 教师展示刘德华的电影一一童梦奇缘的剧照:谁曾经没有幻想过一夜长大?谁又在垂暮之年没有产生过如果生命可以重来的念头?但是如果真的有那么一种方式,可以让你体验一下一夜长大的感觉,你会为此付出青春的代价嘛? 问题1:人的一生必然要经历哪些生命历程:出生→生长→成熟→繁殖→→的生命历程。(学生思考回答)
·397· 中华普通外科学文献(电子版)2013年10月第7卷第5期Chin Arch Gen Surg(Electronic Edition),October 2013,Vol.7,No.5 ·综述· 线粒体自噬在肝相关疾病中的作用 王超臣 张培建 DOI:10.3877/cma.j.issn.1674-0793.2013.05.016 基金项目:扬州市科技攻关项目(YZ2009051,YZ2010087)作者单位:225002 扬州大学第二临床医学院普通外科研究室 线粒体是细胞内氧化磷酸化的场所,为细胞生命活动提供能量,在细胞生存和死亡中扮演着重要角色。通过氧化磷酸化产生ATP 是线粒体最为重要的功能之一,线粒体通过氧化磷酸化高效产生ATP 的同时,还伴随产生O 2、H 2O 2等,线粒体外膜如果因受ROS 攻击而破裂,会使线粒体向胞质内释放细胞色素C 凋亡诱导因子(apoptosis-inducing factor, AIF)等凋亡相关蛋白,从而诱导细胞进入凋亡途径。细胞主要通过自噬机制选择性地清除受损伤或不需要的线粒体,这一过程被称为线粒体自噬(mitochondrial autophagy,mitophagy)[1]。但是,线粒体自噬可以作为一种防御机制能清除损伤的线粒体和过量产生的ROS,确保细胞内线粒体功能稳定,促进应激环境中细胞的存活;反之,如果线粒体自噬的防御功能得不到充分发挥,过量产生的ROS 将诱导细胞进入凋亡等途径,导致细胞死亡[2]。早在1962年就有 文献报道通过电镜观察发现了很多被膜结构包裹的线粒体,并且这些线粒体随后会被溶酶体降解掉。但线粒体自噬这一概念由Lemasters 于2005年正式提出[3],他观察到线粒体膜电位降低和线粒体通透性膜孔开放能引起线粒体自噬,并认为线粒体自噬可能在减少由衰老引起的线粒体DNA 突变中起着重要的作用。越来越多的研究表明线粒体的清除是一个选择性的过程,线粒体自噬的研究是目前细胞生物学和线粒体研究领域的热点。近来有大量文献显示线粒体自噬参与多个肝脏相关疾病,本文就线粒体自噬及其在肝脏疾病中的作用综述如下。 一、线粒体能量代谢与肝脏功能 线粒体是真核细胞中一种非常重要的细胞器,与肝脏的生物合成、代谢和解毒功能密不可分。三羧酸循环、脂肪酸β-氧化、氧化磷酸化及鸟氨酸循环等均在线粒体内进行[4]。此外,线粒体在调节细胞内钙离子浓度、信息传递及细胞死亡等过程中也具有重要作用。线粒体是肝细胞内较敏感的细胞器之一,多种急、慢性肝病均存在线粒体结构和功能的异常[5-6]。当线粒体受损时,ATP 【摘要】 细胞自噬是细胞依赖溶酶体的分解代谢过程,能降解受损蛋白、衰老或损伤的细胞器等细胞结构,来维持细胞内稳态。众所周知,线粒体调节异常是许多疾病的发病机制。本文主要探讨线粒体自噬在肝相关疾病如非酒精性脂肪肝病、肝癌和肝缺血再灌注损伤中的作用。 【关键词】 线粒体自噬;非酒精性脂肪肝病;肝癌;缺血再灌注损伤 Targeting mitophagy for the treatment of liver diseases WANG Chao-chen, ZHANG Pei-jian. General Surgery, Yangzhou No.1 People's Hospital, the Second Clinical Medical College, Yangzhou 225002, China 【Abstract】 Autophagy is a lysosomal degradation pathway that can degrade bulk cytoplasm and superfluous or damaged organelles, such as mitochondria, to maintain cellular homeostasis. It is known that dysregulation of mitochondrial autophagy can cause pathogenesis of numerous human diseases. Here, we discuss the critical roles that mitochondrial autophagy plays in the pathogenesis of liver diseases such as non-alcoholic and alcoholic fatty liver, liver cancer, and hepatic ischemia reperfusion injury. 【Key words】 Mitochondrial autophagy; Nonalcoholic fatty liver disease; Liver cancer; Ischemia-reperfusion injury
caspase家族蛋白酶的组成 已命名的caspase家族成员均已克隆成功,它们不但在氨基酸序列上具有同源性,而且在空间结构上也很相似。目前已经获得了caspase-1(ICE)和caspase-3(CPP32)的X线结晶图像,结果显示它们具有相似的空间结构,在P20的C端和P10的N端有200多个氨基酸残基的序列尤为保守,在空间结构上组成相似的β折叠中心和相邻的α螺旋,保守的、对蛋白酶活性有特殊意义的氨基酸残基均位于这一段,并形成特定的结构。不同源的序列主要存在于P20的N端和P20与P10交界处,这两个部位的氨基酸残基在蛋白酶活化过程中一般被全部或部分切除。 所有的成员都保守性地包含有与底物P1Asp作用的氨基酸残基,如在ICE中,它们是催化中心的Cys285,与酶/抑制剂复合物的巯基半缩醛以氢键结合的His237,以及可以稳定反应中间物氧阴离子的Gly238。另外,Arg179、Arg341、Gln383和Ser347形成容纳P1Asp的“口袋”,Ser339靠近Cys285的巯基,以氢键结合P1位的酰
胺。与P2~P4作用的氨基酸残基则变异比较大,这可能是各个成员识别不同底物的特异性之所在。在活性Cys周围的氨基酸序列也很保守,一般都有Gln-Ala-Cys-Arg-Gly(QACRG)五肽序列,在caspase-8、caspase-10中为QACQG,在caspase-9中是QACGG,这三个成员都有一个氨基酸残基的变异,但这种变异不影响蛋白酶的剪切活性和特异性。 未活化的caspase家族蛋白酶是以酶原形式存在的,酶原的氨基端有一段被称为“原结构域”(pro-domain)的序列。酶原活化时不但要将原结构域切除,并且要将剩余部分剪切成一大一小两个亚基,分别称为P20和P10,活性酶就是由这两种亚基以(P20/P10)2的形式组成的。这种活化反应也是Asp特异的,剪切发生在酶原中保守序列的Asp与其后的氨基酸残基之间,一般是先切下羧基端的小亚基,然后再从大亚基的氨基端切去原结构域。这种剪切可以是酶原及中间活性酶自我催化,也可以是其它ICE家族蛋白酶的作用,还有其它酶类如颗粒酶B参与。二caspase家族蛋白酶的结构与功能 按照结构同源性的大小,可以将caspase蛋白酶分为三个组,分别以caspase-1、caspase-2和caspase-3为代表。其中最重要的是caspase-1、caspase-3 和caspase-8。
Caspase家族 Caspases是近年来发现的一组存在于胞质溶胶中的结构上相关的半胱氨酸蛋白酶,它们的一个重要共同点是特异地断开天冬氨酸残基后的肽键。Caspase一词是从Cysteine aspartic acid specific protease 的字头缩写衍生而来,就反映了这个特征,而这种高度的特异性,在蛋白酶中是很少见的。 由于这种特异性,使caspase能够高度选择性地切割某些蛋白质,这种切割只发生在少数(通常只有1个)位点上,主要是在结构域间的位点上,切割的结果或是活化某种蛋白,或使某种蛋白失活,但从不完全降解一种蛋白质。 Caspase的研究源于线虫(C. elegans)细胞程序化死亡的研究。线虫在发育过程中,有131个细胞将进入程序化死亡;研究发现有11个基因与PCD有关,其中ced3和ced4基因是决定细胞凋亡所必需的,ced9基因抑制PCD。线虫细胞程序化死亡的研究促进了其他动物特别是哺乳类动物中细胞凋亡的研究。人们发现哺乳类细胞中存在着Ced3的同源物ICE (interleukin-1b converting enzyme),它催化白介素-1b的活化,即从其前体上将IL-1b切割下来。在大鼠成纤维细胞中过量表达ICE和Ced3都会引起细胞凋亡,表明了ICE和Ced3在结构和功能上的相似性;然而敲除ICE基因的小鼠其表现型正常,并未发现细胞凋亡发生明显改变。进一步的研究发现,另一个ICE成员,后来被称为apopain,CPP32或Yama的半胱氨酸蛋白酶,催化poly(ADP-ribose)Polymerase(PARP),即聚(ADP-核糖)聚合酶的裂解,结果导致细胞的凋亡,因而认为apopain执行着与线虫中的ced3相同的功能。Apopain被称为是“死亡酶”,而PARP被认为是“死亡底物”。 Apopain/CPP32/Yama是在1995年由两个实验室分别同时报导,时间上只有两周之差。Ced4的哺乳类同源物则迟迟未能发现,直到1997年,才被证明是Apaf-1(即一种细胞凋亡蛋白酶活化因子apoptosis protease activating factor)。而Ced 9的哺乳类对应物则较早地被证明是BCL-2,这一问题将在以后的部分述及。 现已确定至少存在11种caspase: 这些caspases中,caspase 1和caspase 11,以及可能还有caspase 4被认为不直接参与凋亡信号的转导,它们主要参与白介素前体的活化;而caspase 2,caspase 8,caspase 9和caspase 10参与细胞凋亡的起始;参与细胞凋亡执行的则是caspase 3,caspase 6和caspase 7,其中caspase
Caspases are a family of cysteine proteases that act in concert in a cascade triggered by apoptosis signaling. The culmination of this cascade is the cleavage of a number of proteins in the cell, followed by cell disassembly, cell death, and, ultimately, the phagocytosis and removal of the cell debris. The Caspase cascade is activated by two distinct routes: one from cell surface and the other from mitochondria (Ref.1). The pathway leading to Caspase activation varies according to the apoptotic stimulus. Initiator Caspases (including 8, 9, 10 and 12) are closely coupled to pro-apototic signals. Pro-apoptotic stimuli include the FasL (Fas Ligand), TNF (Tumor Necrosis Factor), Granzyme-B, GRB (Growth Factor Receptor-Bound Protein), DNA damage, Ca2+ (Calcium) channels and ER (Endoplasmic Reticulum) stress. Once activated, these Caspases cleave and activate downstream effector Caspases (including 3, 6 and 7). Caspase8 cleaves BID (BH3 Interacting Death Domain). tBID (Truncated BID) disrupts the outer mitochondrial membrane to cause release of the pro-apoptotic factors CytoC (Cytochrome-C) which is crucial for activating pro-Caspase9. CytoC that is released from the intermembrane space binds to APAF1 (Apoptotic Protease Activating Factor-1), which recruits Caspase9 and in turn can proteolytically activate Caspase3. SMAC (Second Mitochondria-Derived Activator of Caspase)/DIABLO is also released from the mitochondria along with CytoC during apoptosis, and it functions to promote caspase activation by inhibiting IAP (Inhibitor of Apoptosis) family proteins. ER stress leads to the Ca2+-mediated activation of Caspase12 (Ref.2). Fas and the TNFR (TNF Receptor) activate Caspases8 and 10. Cell death caused by activation of the TNFR or Fas receptors is brought about by the recruitment of the adaptor protein FADD (Fas Associated Death Domain). In the case of the TNFR1, FADD recruitment requires prior binding of TRADD (TNFR-Associated Death Domain Protein). FADD in turn recruits ProCaspase8. The TNFR1 receptor can also mediate activation of Caspase2 via the recruitment of a death-inducing signaling complex. In this case RIP (Receptor-Interacting Protein) acts as an adaptor for the recruitment of RAIDD (RIP-Associated ICH-1/CED-3-homologous protein with a Death Domain), which subsequently binds to ProCaspase2. TNFR also activates Caspase3, 6,7 via TRADD, TRAF2 (TNF Receptor-Associated Factor-2) and RICK (RIP-like Interacting Clarp Kinase). TNF not only induces apoptosis by activating Caspase8 and 10, but can also inhibit apoptosis signaling via NF-KappaB (Nuclear Factor-KappaB), which induces the expression of IAP, an inhibitor of Caspases3, 7 and 9 (Ref.3). GRB (Growth Factor Receptor-Bound Protein), Granzyme B and perforin proteins released by cytotoxic T-Cells induce apoptosis in target cells, forming transmembrane pores, and triggering apoptosis, perhaps through cleavage of Caspases, although Caspase-independent mechanisms of Granzyme-B mediated apoptosis have been suggested (Ref.4). After activation, down stream Caspases cleave cytoskeletal and nuclear proteins (structural, signaling proteins or kinases) like PARP (Poly ADP-Ribose Polymerase), DNA-PK (DNA-Dependent Protein Kinase), Rb (Retino Blastoma Tumor Supressor Protein), PAK1 (p21-Activated Kinase-1), GDID4, Fodrin, Lamin-A, Lamin-B1, Lamin-B2, thus inducing apoptosis. Caspase3 cleaves ICAD (Inhibitor of CAD) to free CAD (Caspase-Activated DNase) to cause DNA fragmentation. The events culminating in Caspase activation and the subsequent disassembly of the cell are the subject of intense study because of their role in many neurodegenerative disorders such as Parkinson's and Alzheimer’s diseases, autoimmune disorders, and tumorigenesis. References: 1. Srinivasula SM,Ahmad M,Fernandes-Alnemri T,Alnemri ES. Autoactivation of procaspase-9 by Apaf-1-mediated oligomerization. Mol Cell. 1998 Jun;1(7):949-57. 2. Pirnia F,Schneider E,Betticher DC,Borner MM. Mitomycin C induces apoptosis and caspase-8 and -9 processing through a caspase-3 and Fas-independent pathway. Cell Death Differ. 2002 Sep;9(9):905-14.
第十七讲细胞凋亡、细胞坏死和细胞癌变 常见考法: 1、以选择题的形式考查细胞生命历程个过程的实质、特点。 2、以选择题的形式考查细胞凋亡和细胞坏死的区别。 1.1下列有关人体细胞生命历程的叙述,不正确的是( ) A. 细胞分化形成不同功能的细胞,但这些细胞也有相同的蛋白质 B. 衰老的细胞内多种酶活性降低,但有的基因还在表达 C. 癌细胞不能进行正常地分化,机体清除癌细胞与细胞凋亡有关 D. 细胞的分裂、分化、衰老和坏死对生物体均有积极的意义 1.2下列关于细胞分化、衰老、凋亡和癌变的叙述,正确的是( ) ①个体发育过程中细胞的衰老对生物体都是有害的 ②正常细胞癌变后在体外培养可无限增殖 ③由造血干细胞分化成红细胞的过程是不可逆的 ④癌细胞容易在体内转移,与其细胞膜上糖蛋白等物质减少有关 ⑤人胚胎发育过程中尾的消失是细胞坏死的结果 ⑥原癌基因和抑癌基因的变异是细胞癌变的内因 ⑦低温引起的细胞冻伤和死亡属于细胞凋亡. A. 1项 B. 2项 C. 3项 D. 4项 任务2、个体衰老和细胞衰老有什么关系?细胞衰老的特征和原因是什么?? 关系:单细胞生物体的衰老或死亡就是个体的衰老或死亡。但多细胞生物体总是在不断更新,总有一部分细胞处于衰老或走向死亡。总体来说,个体的衰老的过程也是细胞普遍衰老的过程。细胞衰老特征:一大(细胞核体积增大)一小(细胞体积变小)一多(色素增多)三低(水分减少;酶活性降低;膜通透性改变,运输功能降低)
细胞衰老原因:自由基学说和端粒学说 2.1下列有关衰老细胞特征的叙述,错误是( ) A、膜通透性改变,物质运输功能下降 B、酶活性降低,呼吸减弱,代谢减慢 C、染色质收缩,遗传信息表达受影响 D、细胞体积增大,水分增加,色素积累 任务3、细胞凋亡的含义、实例、原因、发生时期、意义? 细胞凋亡含义(课本P123) 实例:胎儿手的发育,蝌蚪尾巴的消失 原因:由遗传机制决定的程序性调控 时期:个体发育全过程 意义:保证多细胞生物体完成正常发育;维持内部环境的稳定;抵御外界各种因素的干扰。 3.1细胞凋亡大致过程如图所示.下列有关叙述不正确的是 ( ) A. 图示该过程只发生在胚胎时期 B. 与凋亡相关的基因是机体固有的 C. 吞噬细胞吞噬凋亡小体与水解酶有关 D. 细胞凋亡过程与基因的选择性表达有关 3.2下列有关衰老细胞特征和细胞凋亡的叙述,错误是( ) A: 细胞凋亡是由细胞内的遗传物质决定的 B 细胞的功能不同,凋亡的速率也不同 C: 细胞凋亡对生物体维持内部环境的稳定起关键作用 D: 在人体神经系统的发育过程中,神经细胞发生凋亡的数量很少 任务4、细胞癌变的主要特征?原癌基因和抑癌基因的功能是什么?细胞癌变的外因和内因是什么?癌症都是不治之症吗?是遗传病吗?癌变是可遗传的变异吗?如何防癌? 主要特征:①“不死”:无限增殖;②“变态”:形态结构改变;③“扩散”:糖蛋白减少,粘着性降低,易分散和转移 原癌基因和抑癌基因的功能(课本P126) 癌变外因:致癌因子;内因:原癌基因和抑癌基因发生基因突变 癌症是不治之症,不是遗传病,癌变是可遗传的变异。 防癌:远离致癌因子,健康的饮食和生活习惯,良好心态 4.1下列关于原癌基因和抑癌基因的说法,不正确的是( ) A. 两者和细胞周期的调控有关 B. 只有在癌细胞中才存在这两种基因 C. 原癌基因和抑癌基因突变过程中存在累积效应 D. 原癌基因的脱氧核苷酸序列改变可导致遗传信息的变化 4.2、2011年4月15日~21日是第17届全国肿瘤防治宣传周,主题为“科学抗癌,关爱生命”。下列相关叙述不正确的是( ) A、放射性治疗可以引发癌细胞凋亡
中国法医学杂志CH I N J FO R EN S I C M ED 2006年第21卷第2期 【基金项目】国家自然科学基金资助项目(30271347);教育部留学归国基金资助项目(教外留司[2000]367号) 【作者简介】韩阳(1980-),男,山东省德州人,硕士研究生,主要从事皮肤损伤愈合机制的研究。 【通讯作者】官大威(1963-),男,教授,博士生导师,主要从事皮肤损伤愈合机制及钝力性心脏外伤研究。综 述 cas pase-8及其研究进展 韩 阳,官大威,侯震寰,赵 锐,路 斌 (中国医科大学法医学院法医病理学教研室,辽宁沈阳110001) 【摘要】细胞凋亡是细胞生理性自主死亡的过程,一组被称为cas pase的蛋白酶蛋白水解系统是该过程的核心。Fas(AP O-1/C D95)是一种跨细胞膜受体,其活化后会引发细胞凋亡。在Fas引发的凋亡过程中一系列cas pase级联式地活化,其中cas pase-8的活化是其第一步反应。活化后的cas pase-8会引发包括cas pase-9在内的下游cas pase活化,进而诱导细胞凋亡。cas pase-8与人类的诸多疾病及损伤的病理变化有关,如癌症、神经退化性疾病、寄生虫病及创伤等。随着对cas pase-8的结构、功能和调控等方面研究的不断深入,将会发现更多有关cas pase-8的生物学作用。 【关键词】法医病理学;cas pase-8;凋亡;死亡受体;损伤 【文献标识码】A 【文章编号】100125728(2006)02-0094-03 Ca spa se-8and its advances i n rel a ted stud i es/(△HAN Yang,G UAN Da2wei,HOU Zhen2huan,et al./△D epart m ent of Forensic Pathology,China M edical U niversity School of Forensic M edicine,Shenyang 110001,China) 【Abstract】Apop t osis is a physi ol ogical p r ocess of cellular aut odestructi on.The central component of this machinery is a p r oteolytic syste m involving a fa m ily of p r oteases called cas pases.Fas(AP O-1/CD95) is a trans me recep t or p r otein which induces apop t osis upon activati on.I n apop t osis triggered by Fas, a subset of cas pases is activated.Among the m,cas pases-8(F L I CE/MACH)is the first step in the cas2 cade of apop t otic events induced by Fas.Cleavaged cas pase-8then activates other downstrea m cas pases including cas pase-9,thereby comm iting the cell t o undergo apop t osis.Many studies show that cas pase-8 is related t o the pathogenesis of certain diseases and injuries such as cancers,neur odegenerative diseases, parasit osis,trau ma and s o on in hu man beings. W ith the continuous researches in the structure,functi on and regulati on of cas pase-8,more as pects on cas pase-8and its bi ol ogical functi ons will be underst ood. 【Key words】Forensic pathol ogy;Cas pase-8;Apop t osis;Death recep t or;I njury 细胞凋亡(apop t osis)是基因控制的细胞自主性死亡。cas pase(cystine containing as parate s pecific p r otease)意为含半胱氨酸的天冬氨酸特异水解酶,是凋亡的主要执行者。已发现的14种cas pase均以酶原(p r ocas pase)形式合成并定位于细胞内不同的亚细胞部位。cas pase分为3大类型:启动型、效应型和炎症型。启动型cas pase包括cas pase-2、-8、-9、-10,通过自身活化启动凋亡并调节效应型cas pase;效应型cas pase 包括cas pase-3、-6、-7,能分解细胞蛋白,执行凋亡;炎症型cas pase包括cas pase-1、-4、-5等。cas pase的结构可分为前结构域(p r odomain)、大亚基和小亚基[后二者统称为催化域(catalytic domain)][1]三部分。在p r ocas pase被切割为大、小两个片段(约20k Da和10k Da,分别为p20和p10)及一个N-端前区后,两大两小共4个片段聚合成为含有两个位点活化了的cas pase。 1 cas pase-8参与细胞凋亡的机制 cas pase-8也称MACH、F L I CE、Mch5,1996年被克隆成功。cas pase-8基因C ASP8与c-F L I P(cellular F L I CE inhibi2 t ory p r otein)基因及cas pase-10基因C ASP10共同位于染色体2q33-34。cas pase-8以无活性的酶原(p r ocas pase-8)形式存在于成人及除胎儿脑组织外的各种组织中,在外周血白细胞中分布较高。p r ocas pase-8有479个氨基酸,分子量为55k D,其8种异构体(is of or m s)中2种有完整的酶活性,能启动死亡受体介导的凋亡。这2种p r ocas pase-8的N-端的两个前后串联的70个氨基酸左右死亡效应结构域(death effect domain,DE D)与适配蛋白(adap ter p r otein,如fas-ass ociated death domain,F ADD)N-端的DE D同源,所以p r ocas pase-8可与F ADD结合。C-端的大小两个亚基是蛋白水解酶区域, ? 4 9 ?