
《物质结构与性质》强化训练一
1、联氨(N 2H 4)可以用于处理高压锅炉水中的氧,防止锅炉被腐蚀,其中一种可能的反应机理如图所示。回答下列问题:
(1)Cu 2+
基态核外电子排布式为 。
(2)1 mol N 2H 4·H 2O 含σ键的数目为 。
(3)Cu 2O 与NH 3·H 2O 反应能形成较稳定的Cu(NH 3)2+
的原因是 。 (4)N 2H 4的晶体类型是 。N 2H 4与O 2的相对分子质量相近,但N 2H 4的熔点 (2℃)、沸点(114℃)分别远远高于O 2的熔点(-218℃)、沸点(-183℃),原因是 。 (5)NaClO 发生水解可生成HClO 。HClO 的空间构型是 ,中心原子的杂化类型是 。
(6)已知Cu 2O 晶胞的结构如右图所示: ①在该晶胞中,Cu +
的配位数是 。
②已知该晶体密度为d g/cm 3
,N A 表示阿伏伽德罗常数的数值, 则晶胞参数a 为 nm (用含d 和N A 的代数式表示)。 2.钙和铜合金可用作电解制钙的阴极电极材料,回答下列问题: (1)基态铜原子的价电子排布式为_________________。
(2)CaCO 3高温分解可制得CaO 。CaO 与 C 在一定条件下可生成CaC 2,CaC 2与水反应生成 Ca(OH)2
和一种 4 原子气体分子。
①CaCO 3中阴离子的空间构型为______________。
②该气体分子中 σ 键与π键的数目之比为_____________。 ③写出 2 种与 2-
2C 互为等电子体的分子的化学式______________。
(3)工业上电解 CaCl 2制Ca 而不采用电解 CaO 的原因是____ ___________。 (4)在碱性溶液中,缩二脲 HN( CONH 2)2与 CuSO 4反应得到一种特征紫色物质,其结构如图所示,该反应原理可用于检验蛋白质或其他含键的化合物。缩二脲分子中碳原子与氮原子的杂化类型分别为__________、________。
(5)一种钙铜合金的结构可看作图a 、b 两种原子层交替堆积排列而成c ,其晶胞如图d 。
①a 图Ca-Ca 间距离为x pm ,c 图中Ca-Ca 间距离为y pm 。已知原子拥有的尽可能多的相邻原子的个数叫该原子的配位数,则晶胞c 中Ca 原子的配位数(Cu 原子)为______ _。
②设阿伏加德罗常数的值为 N A ,则该钙铜合金的密度是___ ____g?cm -3(列出计算表达式)。
3.氟代硼酸钾(KBe 2BO 3F 2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。回答下列问题:
(1)氟代硼酸钾中各元素原子的第一电离能大小顺序是F >O >_______ 。基态K +
电子占据最高能级的电子云轮廓图为________形。
(2)NaBH 4是有机合成中常用的还原剂,其中的阴离子空间构型是___ ____,中心原子的杂化
形式为_______。NaBH 4中存在__ ___(填标号)。 a. 离子键 b. 氢键 c. σ键 d. π键
(3)BeCl2中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的BeCl2的结构式为____ ____,其中Be的配位数为
____ ___。
(4)第三周期元素氟化物的熔点如下表:
化合物NaF MgF 2AlF3SiF4PF5SF6
熔点/℃993 1261 1291 -90 -83 -50.5
解释表中氟化物熔点变化的原因:_____________________。
(5)CaF2的一种晶胞如图所示。Ca2+占据F-形成的空隙,其空隙率是_____ ___。
若r(F-)=x pm,r(Ca2+)=y pm,设阿伏加德罗常数的值为N A,
则CaF2的密度ρ=_________ g·cm-3(列出计算表达式)。
4.Cr、Co、Al的合金及其相关化合物用途非常广泛。
(1) Cr3+基态核外电子排布式为___________。
(2)1951年Tsao最早报道用LiAlH4还原腈,如反应:
。
①LiAlH4中三种元素的电负性从大到小的顺序为___________。
②分子中碳原子的轨道杂化类型为__________,
1mol该分子中含σ键的物质的量为__________。
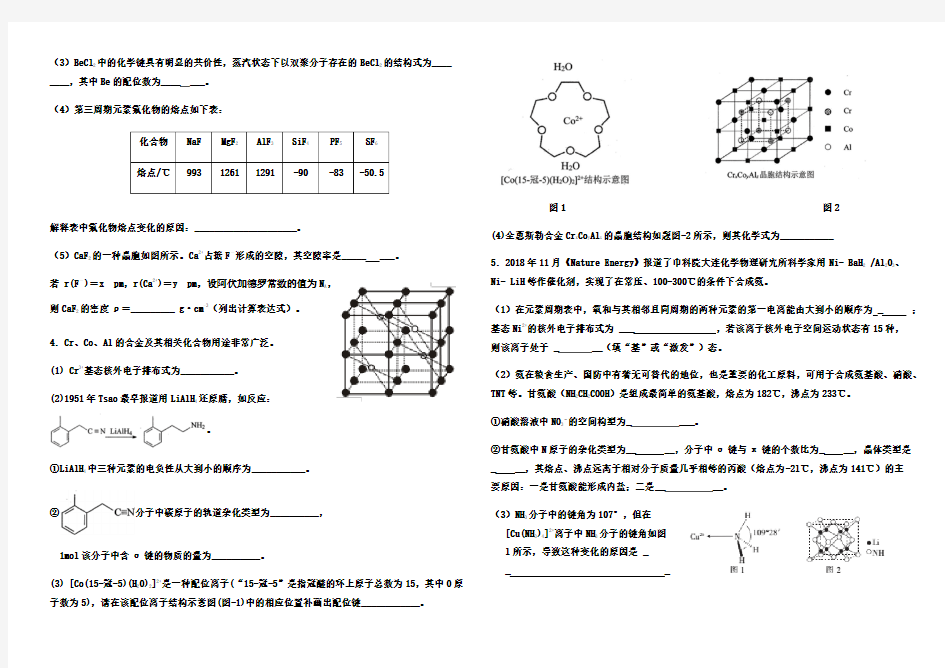
(3) [Co(15-冠-5)(H2O)2]2+是一种配位离子(“15-冠-5”是指冠醚的环上原子总数为15,其中O原子数为5),请在该配位离子结构示意图(图-1)中的相应位置补画出配位键____________。
图1 图2
(4)全惠斯勒合金Cr x Co y Al z的晶胞结构如题图-2所示,则其化学式为___________
5.2018年11月《Nature Energy》报道了巾科院大连化学物理研究所科学家用Ni- BaH2 /Al2O3、
Ni- LiH等作催化剂,实现了在常压、100-300℃的条件下合成氨。
(1)在元素周期表中,氧和与其相邻且同周期的两种元素的第一电离能由大到小的顺序为 _ ;基态Ni2+的核外电子排布式为 ___ ,若该离子核外电子空间运动状态有15种,
则该离子处于 _ __(填“基”或“激发”)态。
(2)氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸(NH2CH2COOH)是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
①硝酸溶液中NO3?的空间构型为_ ___。
②甘氨酸中N原子的杂化类型为__ __,分子中σ键与π键的个数比为_ __,晶体类型是_ __,其熔点、沸点远高于相对分子质量几乎相等的丙酸(熔点为-2l℃,沸点为141℃)的主
要原因:一是甘氨酸能形成内盐;二是__ __。
(3)NH3分子中的键角为107°,但在
[Cu(NH3)4]2+离子中NH3分子的键角如图
l所示,导致这种变化的原因是 _
_ _
(4)亚氨基锂(Li2NH)是一种储氢容量高、安全性能好的固体储氢材料,其晶胞结构如图2所示,若晶胞参数为d pm,密度为ρg/cm3,则阿伏加德罗常数N A
=___ _(列出表达式)
mol-l 。
6.氮(N)、硝(P)、砷(As)等第VA族元素的化合物在研究和生产中有重要用途,请回答下列问题:
(1)基态砷原子的价电子排布图___________ _,第三周期元素原子中,第一电离能大于磷原子的
有__ __种。
(2)氮族元素氯化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷
数的变化趋势如图所示,则Y轴可表示的氢化物(RH3)性质可能有
________________(填序号)。
A.稳定性
B.沸点时
C.R-H键之间的键角
D.分子间作用力
E.还原性
(3)经测定发现,某种N2O5固体由NO2+和NO3-两种离子组成,阳离子中N原子的杂化方式是
________________杂化,阴离子的空间构型为________________。
(4)乙二胺(H2N-CH2-CH2-NH2)与CuCl2溶液可形成配离子
(结构如图)。
Cu2+的配位数为________________,1mol该配离子中含σ键
为________________mol,乙二胺和三甲胺[N(CH3)3]均属于胺,
但乙二胺比三甲胺的沸点高得多,其原因是________________。
(5)通常认为Cu3N是离子晶体,其晶格能可通过图1的Born-Haber循环计算得到。通过图1中
数据__________(填“能”或“不能”)计算出Cu原子的第一电离能,Cu3N晶格能为
____________kJ·mol-1。
(6)Cu3N晶胞如图2所示,Cu+的半径为apm,N3-的半径为bpm,Cu3N晶胞的密度为____
______g·cm-3(列出计算式即可,阿伏加德罗常数的值用N A表示)。
7.教材插图具有简洁而又内涵丰富的特点。请回答以下问题:
(1)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有_____
种不同运动状态的电子。
(2)如图2所示,每条折线表示周期表ⅣA ~ⅦA 中的某一族元素氢化物的沸点变化。每个小黑点
代表一种氢化物,其中a点代表的是___________。判断依据是_____ 。
(3)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于_____________晶体。
(4)第一电离能介于Al、P之间的第三周期元素有__ __种。 GaCl3中中心原子的杂化方式为
____ _____,写出与GaCl3结构相同的一种等电子体(写离子)______________。
(5)冰、干冰、碘都是分子晶体,冰的结构具有特殊性,而干冰、碘的晶体
具有相似的结构特征,干冰分子中一个分子周围有__________个紧邻分子。
D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是 ___________(填
字母标号)。
a.极性键 b.非极性键 c.配位键 d.金属键
(6)Fe 的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A~D 图中正确的是_____(填字母标号)。
铁原子的配位数是____________,假设铁原子的半径是r cm ,该晶体的密度是ρg/cm 3 ,则铁的相对原子质量为________________(设阿伏加德罗常数的值为N A )。
8.教材插图是对教材内容高度概括的体现,也是为说明、理解、深化文字内容服务的。请回答下列问题:
(1)图一为构造原理示意图,其含义是从H 原子开始随着原子核电荷数递增,原子核每增加一个质子,核外便增加一个电子,电子大多按如图顺序填充。第四周期中,基态4s 能级半充满的元素有__ _种,其中原子序数最大的基态原子的外围电子排布式为
__ _。
(2)图二中,每条折线代表周期表中IVA-VIIA 某一族元素简单氢化物的沸点变化,其他三条折线与x 所在折线变化趋势不完全相同的原因为_ __;与x 点对应的简单氢化物互为等电子体的离子为_ __(写一种)。
(3)图三为卟啉配合物叶绿素的结构示意图,1号N 原子和3号N 原子与Mg 2+形成的化学键类型为__ _;5号C 原子和6号C 原子的杂化方式分别为__ _、__ _;该分子中所含
非金属元素的电负性由小到大的顺序为_ __。
(4)从石墨晶体结构示意图中截取石墨的晶胞如图所示,设阿伏加德罗常数为N A ,已知sin60°=
3),石墨晶体的密度为__ _g·cm -3
(列出计算式)。