
《钠及其化合物》复习案例
教学目标:1、了解钠及其化合物的性质;
2、学以致用,培养学生的理解水平。
课时分配1课时钠
2课时Na2O和Na2O2
3课时Na2CO3和NaHCO3、碱金属元素
4课时相关钠的化合物计算专题
第1课时钠
一、钠的存有形式和原子结构
二、钠的性质
1.物理性质
颜色硬度导电性密度与水相比熔点
银白色质软良好比水小较低
[问题]钠与上述三种物质反应,其对应的现象是什么?并判断正误。
①1mol钠与足量的氧气分别生成氧化钠和过氧化钠,失去电子的数目均为N A
②1mol氧气分别与足量的钠反应,生成氧化钠和过氧化钠,得到的电子数目均为2 N A
③钠与氧气反应分别生成1mol氧化钠和1mol过氧化钠,转移的电子的数目均为2N A
(2)与水反应
①离子方程式:2Na+2H2O ====== 2Na++2OH-+H2↑
②钠与含有酚酞的水反应的实验现象及解释:
○浮—密度比水小。○熔—反应放热,钠的熔点低。
○游—产生气体。○响—反应剧烈。
○红—生成了碱(NaOH)。
(3)与酸反应离子方程式:2Na+2H+====== 2Na++H2↑
[探讨]a、将物质投入到下列物质中,①水②无水乙醇③冰醋酸,比较其反应剧烈水准?
b、0.2moLNa 投入100mL1moL·L1-的盐酸溶液中,反应放出氢气的质量是多少?
(4)与盐溶液反应:先与水反应生成碱,再考虑碱与盐的反应(如与CuSO4溶液)
2Na+CuSO4+2H2O======Cu(OH) 2↓+Na2SO4+H2↑
[问题]将少量钠投入到下列物质的饱和溶液中,既有气体又有沉淀的是①FeCl3②NaHCO3 ③NaCl
3.工业制法和用途
第2课时氧化钠和过氧化钠
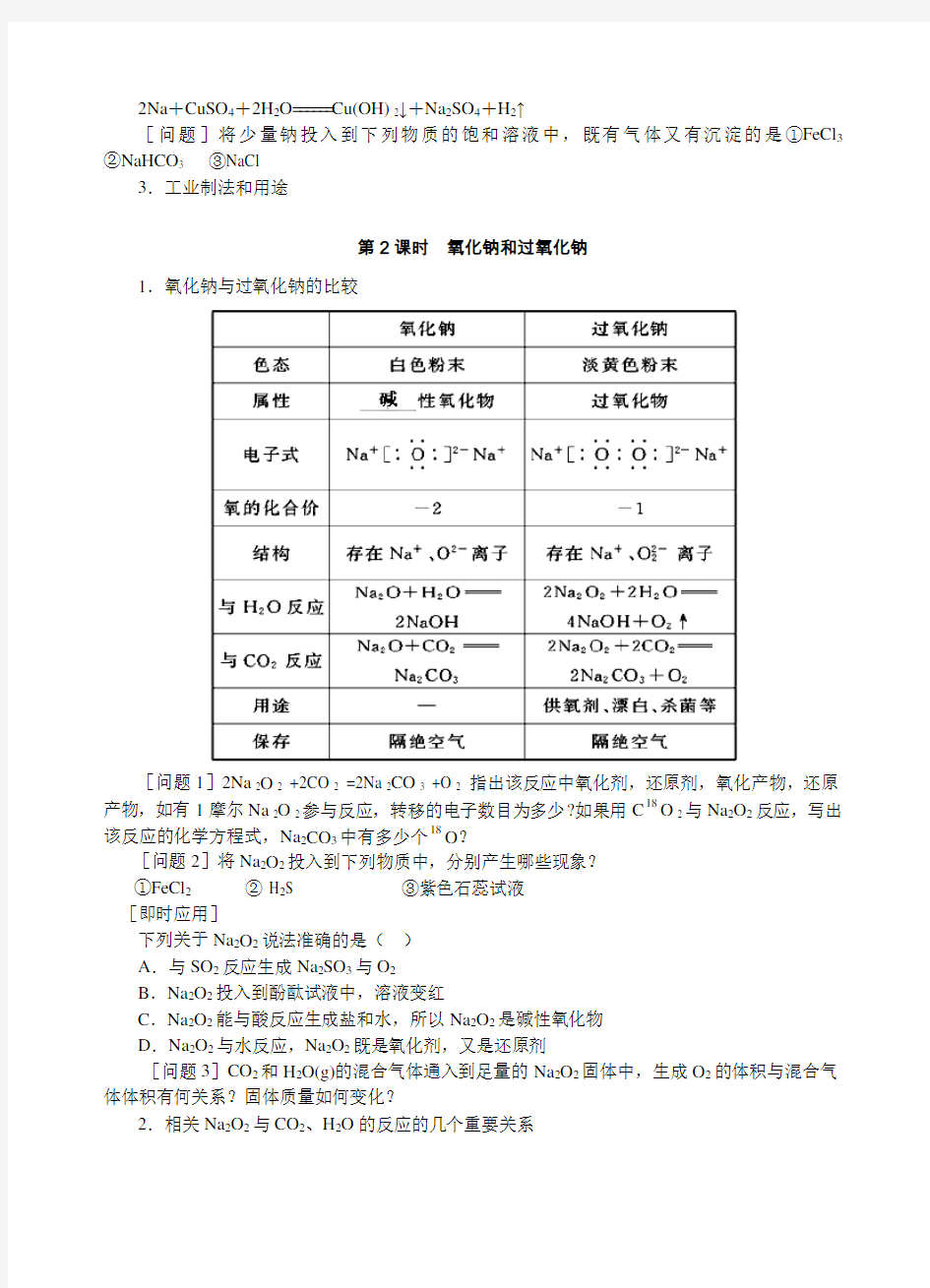
1.氧化钠与过氧化钠的比较
[问题1]2Na 2O 2 +2CO 2 =2Na 2CO 3 +O 2指出该反应中氧化剂,还原剂,氧化产物,还原产物,如有1摩尔Na 2O 2参与反应,转移的电子数目为多少?如果用C18O 2与Na2O2反应,写出该反应的化学方程式,Na2CO3中有多少个18O?
[问题2]将Na2O2投入到下列物质中,分别产生哪些现象?
①FeCl2② H2S ③紫色石蕊试液
[即时应用]
下列关于Na2O2说法准确的是()
A.与SO2反应生成Na2SO3与O2
B.Na2O2投入到酚酞试液中,溶液变红
C.Na2O2能与酸反应生成盐和水,所以Na2O2是碱性氧化物
D.Na2O2与水反应,Na2O2既是氧化剂,又是还原剂
[问题3]CO2和H2O(g)的混合气体通入到足量的Na2O2固体中,生成O2的体积与混合气体体积有何关系?固体质量如何变化?
2.相关Na2O2与CO2、H2O的反应的几个重要关系
(1)先后顺序关系
一定量的Na2O2与一定量的CO2和H2O(g)的混合物的反应,可视作Na2O2先与CO2反应,待CO2反应完成后,Na2O2再与H2O发生反应。
(2)物质的量的关系
无论是CO2或H2O的单一物质还是二者的混合物,通过足量的Na2O2时,CO2或H2O与放出O2的物质的量之比均为2∶1。
(3)气体体积关系
若CO2和水蒸气的混合气体(或单一气体)通过足量Na2O2,气体体积的减少量等于原混合气体体积的且等于生成氧气的体积。
(4)电子转移关系
当Na2O2与CO2、H2O反应时,物质的量关系为2Na2O2~O2~2e 。
(5)固体质量关系
相当于固体Na2O2只吸收了CO2中的“CO”,H2O中的“H2”;能够看作发生相对应的反应:
增重的质量正好等于原CO和H2的质量。
[规律]分子通式符合(CO)m H n的化合物(主要是指CH3OH、HCHO等有机化合物),其燃
烧产物通过足量的Na2O2后,固体增重的质量等于原化合物的质量。中学阶段常见的符合这个关系的物质有:CO、H2、CO和H2混合气、CH4O(甲醇)、CH2O(甲醛)、CH3COOH(乙酸)、HCOOCH3(甲酸甲酯)、C6H12O6(葡萄糖)、CH3CHOHCOOH(乳酸)等。
[即时应用]
取a g 某物质在O2中完全燃烧,将生成物水与足量Na2O2固体完全反应,反应后,固体质量恰好也增加了a g,下列物质不能满足上述结果的是( )
A.H2B.CO C.C6H12O6D.C12H22O11
第3课时Na2CO3和NaHCO3 碱金属元素
一、碳酸钠与碳酸氢钠的比较
[探究1]鉴别Na2CO3和NaHCO3的方法
(1)(固体)分别加热:有气体生成(能使澄清的石灰水变浑浊)的是NaHCO3;Na2CO3无此性质。(溶液中NaHCO3受热难分解)。
(2)(浓溶液)分别加入稀盐酸:向Na2CO3溶液中逐滴加入稀盐酸,开始无气体产生,当稀盐酸滴加到一定量后有气体产生;而向NaHCO3中滴加稀盐酸,立即产生无色无味的气体。
(3)同温同浓度下,比较Na2CO3溶液和NaHCO3溶液的pH:Na2CO3>NaHCO3。
(4)CaCl2稀溶液:CaCl2溶液滴加到Na2CO3溶液中能产生白色沉淀;滴加到稀的NaHCO3溶液中无白色沉淀生成。
[探究2]Na2CO3、NaHCO3与盐酸反应:
①谁放出CO2气体较快?
②向Na2CO3和NaHCO3混合液中滴加盐酸,H+先与什么离子反应?为什么?
③等物质的量的Na2CO3、NaHCO3分别与足量盐酸反应,产生CO2的量是否相等?若是等质量的Na2CO3、NaHCO3呢,又如何?
④不用任何试剂,如何区别盐酸和Na2CO3两瓶无色溶液?写出相关的离子方程式。
[即时应用]
下列叙述中准确的是( )
A.向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成
B.向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1∶2
C.等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同D.向Na2CO3饱和溶液中通入CO2,有NaHCO3结晶析出
【解析】向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,仅生成NaHCO3,无CO2气体放出,
B错误;等质量的NaHCO3和Na2CO3,NaHCO3的物质的量多,与足量盐酸反应时,放出的CO2多,C错误;D项发生的反应为:Na2CO3+CO2+H2O======2NaHCO3↓,因为NaHCO3的溶解性较小,反应后溶液中有晶体析出,准确。
二、碱金属(Li、Na、K、Rb、Cs)
三、焰色反应
第4课时相关钠及其化合物计算
1.钠的化合物与盐酸反应相关图象计算
[例](1)向NaOH溶液中通入一定量CO2,结晶后得到白色固体,该白色固体的组成可能是
A.NaOH和Na2CO3;B.___________________;
C.___________________;D.___________________。
(2)向50mL NaOH溶液中逐渐通入一定量的CO2(假
设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,
并向此稀释后的溶液中逐滴加入0.1 mol·L1-的盐酸,产生
CO2气体的体积(标准状况下)与所加入的盐酸的体积关系
如图所示。
①写出OA段所发生反应的离子方程式:
_____________________________________________________________
②NaOH在吸收CO2后,所得溶液的溶质为____________,其物质的量浓度之比为
____________。
③产生的CO2体积(标准状况下)为____________。
④原NaOH溶液的物质的量浓度为____________。
[解析](1)NaOH与CO2反应发生的反应有
CO2少量:2NaOH+CO2==== Na2CO3+H2O
CO2少量:NaOH+CO2==== NaHCO3
在数轴上表示反应后产物成分:
得出的成分有:A.NaOH,Na2CO3 B.Na2CO3
C.Na2CO3,NaHCO3 D.NaHCO3
(2)由上述各成分可知,它们与盐酸反应的图像如下:
由此可知该题为A这种情况,则OA段反应为:
H++OH-=H2O CO2
3-+H+=HCO
3
-
[即时应用]
将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L1 稀盐酸。下列图象能准确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
【解析】此题考查了元素化合物、图象数据的处理知识。向NaOH和Na2CO3混合溶液中滴加盐酸时,首先和NaOH反应生成水和氯化钠,当滴入0.1 L时,两者恰好反应完全;继续滴加时,盐酸和Na2CO3开始反应,首先发生:HCl+Na2CO3==== NaHCO3+NaCl,不放出气体,当再加入0.1 L时,此步反应实行完全;继续滴加时,发生反应:NaHCO3+HCl==== NaCl+H2O+CO2↑,此时开始放出气体,分析图象,可知选C。
【点评】准确理解向NaOH和Na2CO3溶液中滴加盐酸反应的先后,是先跟碱反应再跟盐反应。与Na2CO3反应是分步实行的,首先发生的是HCl+Na2CO3NaHCO3+NaCl;实行完全后,再发生:NaHCO3+HCl ==== NaCl+H2O+CO2↑
2.关于测定混合物中Na2CO3的质量分数的计算
[例](2011·北京高考)下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是()
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀盐酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH) 2溶液充分反应,过滤、洗涤、洪干,得b克固体
解析:A项,采用差量法,减少的质量为碳酸氢分解生成的二氧化碳和水的质量,由此可求出碳酸氢钠的质量,进而求出碳酸钠的质量分数;B项,b克固体为生成的氯化钠的质量,根据钠原子守恒和混合物的总质量可列式计算出碳酸钠的质量,进而求出碳酸钠的质量分数;C项,碱石灰增加的质量为盐与酸反应生成的二氧化碳和水的质量及溶液中挥发出来的水蒸气的质量,所以不能通过数据准确计算出碳酸钠的质量分数;D项,沉淀的质量即为碳酸钡的质量,根据碳酸钡的质量和混合物的总质量能够列式求出碳酸钠的质量,进而求出碳酸钠的质量分数。
答案:C
3.相关Na2O2和NaHCO3混合物加热反应的计算
[例]1 mol 过氧化钠与2 mol 碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是( )
A.Na2CO3 B.Na2O2、Na2CO3 C.NaOH、Na2CO3D.Na2O2、NaOH、Na2CO3解析:加热混合固体时,可将Na2O2先与CO2反应,再与H2O反应;
若设
()
()
n
x
n
=
3
22
NaHCO
Na O
,x值不同,反应后固体成分,气体成分也会不同,可总结如下:(注: