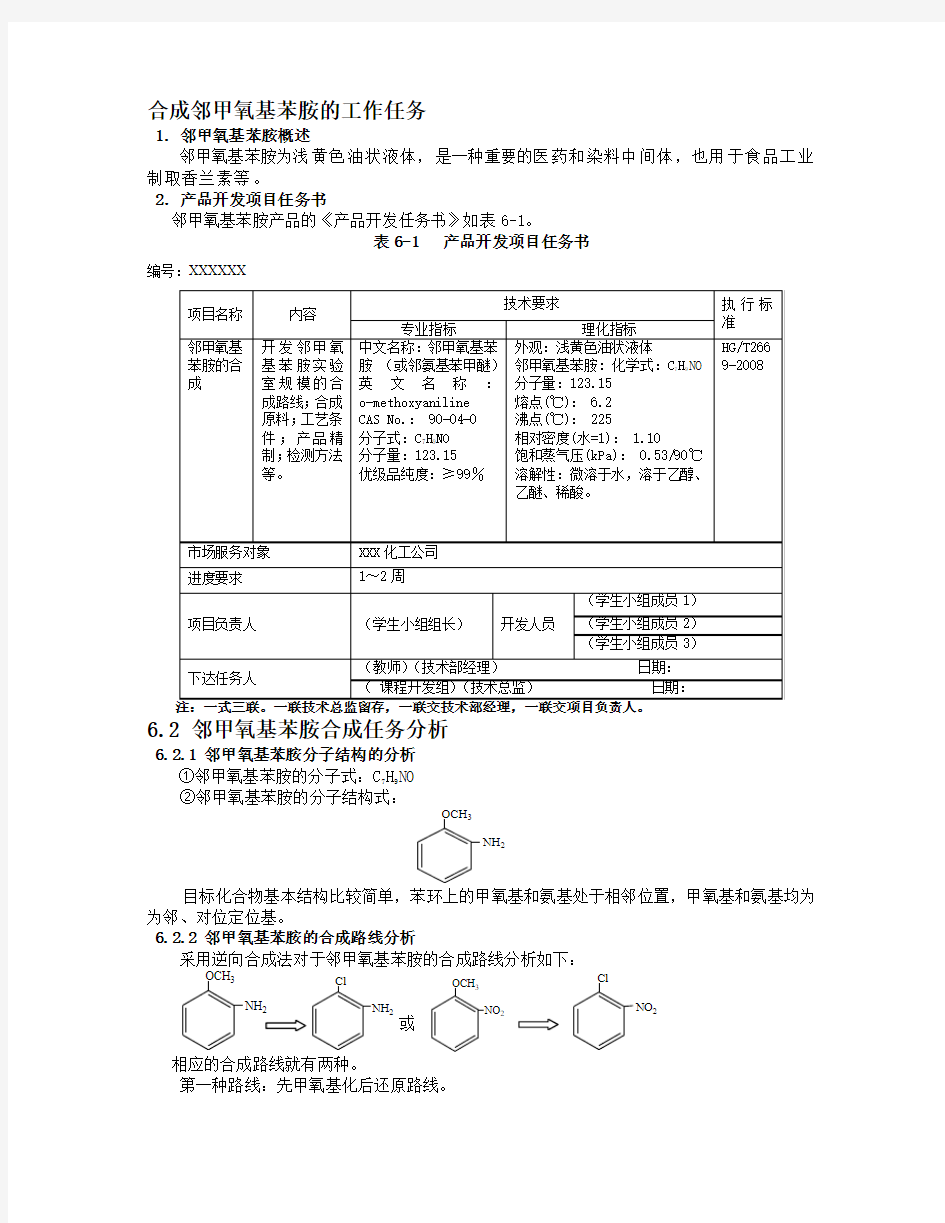

合成邻甲氧基苯胺的工作任务
1. 邻甲氧基苯胺概述
邻甲氧基苯胺为浅黄色油状液体,是一种重要的医药和染料中间体,也用于食品工业制取香兰素等。
2.产品开发项目任务书
邻甲氧基苯胺产品的《产品开发任务书》如表6-1。
表6-1 产品开发项目任务书
编号:XXXXXX
6.2 邻甲氧基苯胺合成任务分析
6.2.1 邻甲氧基苯胺分子结构的分析
①邻甲氧基苯胺的分子式:C
7
H
9
NO
②邻甲氧基苯胺的分子结构式:
OCH3
NH2
目标化合物基本结构比较简单,苯环上的甲氧基和氨基处于相邻位置,甲氧基和氨基均为为邻、对位定位基。
6.2.2 邻甲氧基苯胺的合成路线分析
采用逆向合成法对于邻甲氧基苯胺的合成路线分析如下:
OCH3
NH2
Cl
NH2
OCH3
NO2
Cl
NO2
相应的合成路线就有两种。
第一种路线:先甲氧基化后还原路线。
或
Cl
NO 2
OCH 3NO 2
OCH 3
NH 2
第二种路线:先还原后甲氧基化路线。
Cl
NO 2
Cl
NH 2
OCH 3
NH 2
因此要想从这些合成路线中确定最理想的一条路线,并成为工业生产上可用的工艺路线,则需要综合各方面情况加以全面地考察,择优选用。
从反应机理上看,甲氧基化反应是苯环上的亲核取代反应(参考芳香族卤化物水解引入羟基的反应机理及影响因素),苯环上接有吸电子基团(-NO 2)对反应有利,而接有给电子基团(-NH 2)则对反应不利,因此路线1要优于路线2。 6.2.3文献中常见的邻甲氧基苯胺合成方法
从文献资料上可以查出,目前邻甲氧基苯胺的合成路线与上面设计的路线相同。即以邻硝基氯苯为原料经甲氧基化和还原反应合成。
下面我们将从此成路线出发,将合成过程中需要考虑的各种因素进行剖析,找出一条相对合适的合成方案,并按此方案进行合成来实际检验方案的可行性。假如采用其它的合成路线,请同学们沿此思路自己剖析,应该不难找出合适的合成的方案。 6.2.4 邻甲氧基苯胺合成过程单元反应及其控制分析
不难看出,甲氧基化反应和还原反应是合成过程实施的关键反应。欲在合成中做好甲氧基化反应和还原反应,就必须对甲氧基化反应和还原反应过程的情况作详细了解。 6.2.4.1邻硝基氯苯的甲氧基化反应及其控制 1.甲基化反应和甲基化试剂 (1)甲基化反应
在有机化合物分子中引入甲氧基(-OCH 3)的反应称为甲基化反应。脂肪族卤代烷与甲醇钠作用,卤素被甲氧基取代生成醚,反应式如下。
RX+CH 3ONa →ROCH 3+NaX
卤代烷、烯丙基型卤化物、卤化苄、α-卤代酸等都可以和甲醇钠反应,生成相应的醚,这是制备甲基醚的主要方法。醇和酚羟基上的氢也可被甲基取代,羟基即转变为甲氧基,这也是制备甲基醚的重要方法。 (2)甲基化试剂
甲醇、甲醇钠(或钾)都可作为甲氧基化试剂。由于甲醇钠(或钾)的成本太高,在要求不太高的情况下(特别是水对反应的影响不是太大的情况下),通常采用甲醇与NaOH (或KOH )反应而得。
CH 3OH + NaOH CH 3ONa + H 2O
该反应为可逆平衡反应,要使平衡向正方向移动可增加甲醇和碱的浓度。甲醇有毒,操作中要注意个人防护。
2.邻硝基氯苯的甲氧基化反应机理
邻硝基氯苯的甲氧基化反应是苯环上的亲核取代反应,历程如下(参见情境5):
CH 3ONa 为强亲核试剂,亲核质点为CH 3O -
(烷氧负离子)。由于邻硝基氯苯中氯原子的电负性很大,会使苯环上与氯原子相连的碳原子带部分正电荷。该碳原子能受到亲核质点烷氧负离
CH 3OH NaOH
[H] [H]
CH 3OH
NaOH
子的亲核进攻,先生成加成产物芳负离子(也可称为配合物负离子);芳负离子再消除氯基,生成亲核取代产物邻甲氧基苯胺。生成芳负离子的一步反应速率慢,芳负离子脱去氯基的一步反应速率快,第一步为反应速率控制步骤。反应历程为芳香族亲核取代反应中的加成-消除历程,因为该反应历程的反应速率控制步骤必须有底物分子与亲核试剂分子参与,故为双分子历程。
由于邻硝基氯苯中苯环为环状共轭体系,能将与氯原子相连的带部分正电荷的碳原子上的
O-正电荷分散到苯环其他碳原子上,故与氯原子相连的碳原子所带正电荷不多,亲核质点CH
3
向该碳原子发动亲核进攻比较困难,甲氧基化时需要较为苛刻的反应条件。
3.影响甲氧基化反应的因素
(1)邻硝基氯苯的反应性质
邻硝基氯苯为黄色结晶,熔点:32.5℃,沸点:245.5℃;相对密度(水=1)1.30;不溶于水,溶于乙醇、苯;一般状况下性质较稳定。有毒。
由于苯环上接有吸电子基团硝基,苯环上的电子云密度降低,相对提高了苯环上与氯原子相连的碳原子的正电性,该碳原子亲电性增强,有利于甲氧基团(即CH
O-)对该碳原子的亲核
3
进攻,使得邻硝基氯苯的甲氧基化能力有所提高。
(2)氢氧化钠浓度的影响
氢氧化钠与甲醇作用生成甲醇钠,由于反应可逆,氢氧化钠的浓度越高对生成甲醇钠越有利。水的存在不利于甲醇钠的生成,同时也可能引起水解的副反应,对甲氧基化不利。可以考虑用固体氢氧化钠参加反应。
(3)原料配比的影响
理论上,甲醇钠与邻硝基氯苯的摩尔数之比为1:1,考虑到水分的影响,甲醇钠的比例应略过量。
(4)溶剂的影响
甲氧基化反应通常用无水甲醇作为溶剂,一方面甲醇的极性很高,可以溶解甲醇钠和邻硝基氯苯,另一方面甲醇是低沸点的溶剂,反应后可以很方便地分离。
(5)温度、压力的影响
由于邻硝基氯苯的亲电性较低,甲氧基化反应需要较高的温度,另一方面,甲醇钠的碱性较强,相对有利于甲氧基化反应的进行,因此反应温度是这两种因素综合作用的结果。资料表明,邻硝基氯苯的甲氧基化反应温度控制在100℃左右较为合适。
由于在常压下甲醇的沸点为64.7 ℃,因此反应必须在加压下进行。在100℃时,相应的甲醇蒸汽的压力应在0.3Mpa左右。
(6)主要的副反应分析
在强碱存在下,反应体系中水的存在可能使邻硝基氯苯发生水解,产生副产物邻硝基苯酚。
4.甲氧基化反应的监控分析
(1)甲氧基化反应的反应体系构建要点
①由于反应需要在加压下完成,宜采用液-液低压反应釜进行。
②低压反应釜需配置有进料系统,加温、冷却系统,搅拌系统,排汽冷凝接收装置,出料
)接入口等。
取样系统,惰性气体(如N
2
③低压反应釜耐压范围0~16Mpa。
(2)反应控制策略
甲氧基化反应成败的关键之一在于甲醇钠溶液的质量,因此在制备甲醇钠溶液时,要密切注意甲醇钠溶液的浓度、水分的含量。氢氧化钠在甲醇中溶解速度较慢,应在回流的温度下溶
能导致甲醇钠解,可先制备浓度较稀的甲醇钠溶液,然后再浓缩至适当的浓度。由于空气中CO
2
溶液失效,故反应时应用新制的甲醇钠溶液。
低压反应釜起压前应注意将釜内空气排尽,这样起压后,釜内的压力与温度才能大致对应。应以控制反应温度为主,控制反应压力为辅。
),方能继当反应结束后降温时,应等表压降到接近0时通入一定压力的惰性气体(如N
2
续降温。否则釜内会产生负压,或吸入空气有可能造成不必要的麻烦。
(3)反应终点的控制
可测定反应体系中甲醇钠的浓度。当甲醇钠浓度降低到一定程度,较长时间维持不变时,反应即达终点。也可取样用薄层色谱或气相色谱(或高效液相色谱)等来判定测定产物含量。
6.2.4.2 邻硝基苯甲醚的还原反应其控制
1. 还原方法和还原剂的选择
硝基还原为氨基的常用方法主要有在电解质溶液中的铁屑还原法和硫化物还原法。在电解质溶液中用铁屑还原硝基化合物是一种古老的方法。铁屑价格低廉、工艺简单、适用范围广、副反应少、对反应设备要求低,无论国内或国外都曾长期采用铁屑法生产芳胺。由于铁屑法排出大量含苯胺的铁泥和废水,从环境保护和减轻劳动强度出发,该法基本上已被加氢还原法所取代。但对不少生产吨位较小的芳胺,尤其是生产含水溶性基团的芳胺,铁屑还原法仍是硝基还原的一种重要方法。现以铁屑在电解质溶液中对芳香族硝基化合物进行还原为例,来讨论该反应的有关问题。
2. 邻硝基苯甲醚还原反应的机理
铁屑和酸(如硫酸、盐酸、醋酸等)共存时或在盐类电解质(如FeCl2、NH4Cl等)的水溶液中对于硝基是一种强还原剂,可以将硝基还原成氨基。芳香族硝基化合物用铁屑还原时,可能有两种反应历程,一种是根据所生成的中间产物提出的化学历程,另一种是按照电子理论提出的电子历程。
(1)铁屑在电解质溶液中使芳香族硝基化合物还原的反应历程
铁屑在金属盐如FeCl2、NH4Cl等存在下在水中使硝基化合物还原,由下列两个基本反应来完成:
生成的二价铁和三价铁按下式转变成黑色的磁性氧化铁(Fe3O4):
整理上述反应式得到总还原方程式:
(2)铁屑在盐酸中使芳香族硝基化合物还原的反应历程
在电解质溶液中的铁屑还原反应是个电子得失的转移过程。铁屑是电子的供给者,电子向硝基转移,使硝基化合物产生负离子自由基,然后与质子供给者(如水)提供的质子结合形成还原产物。其过程如下:
ArNO2→ArNO→ArNOH→ArNH2
N原子得到电子,其化合价由+3→+1→-1→-3变化,中间产物ArNO、ArNOH比底物ArNO2更容易被还原,所以不易分离,难以检测。
3. 邻硝基苯甲醚还原反应的影响因素
(1)邻硝基苯甲醚的性质
邻硝基苯甲醚为无色结晶或微红色液体,熔点9.6℃,沸点276.8℃,不溶于水,溶于乙醇、乙醚等多数有机溶剂,化学性质较稳定,属于有毒化学品。
对于不同结构的芳香族硝基化合物,采用铁屑还原时,反应条件不同。具有类似结构(Ⅰ)的化合物,取代基的吸电子效应使硝基中的氮原子上的电子云密度降低,亲电能力增加,有利于还原反应的进行、反应温度可较低。具有类似结构(Ⅱ)的化合物,取代基的给电子效应使硝基中的氮原子上的电子云密度增加,使氮原子的亲电能力减弱,不利于还原反应的进行。
(Ⅰ) (Ⅱ) 显然,邻硝基苯甲醚结构类似(Ⅱ),相对需要有较强的还原反应条件。 (2)铁屑的组成与细度
铁屑的物理状态和化学状态对反应有很大的影响。工业上常用洁净、粒细、质软的灰铸铁作还原剂,而熟铁粉、钢粉及化学纯的铁粉效果极差。因为灰铸铁中富含碳,并含有少量的硅、锰、磷等元素,在电解质水溶液中可形成很多微电池,促进铁的电化学腐蚀,有利于还原反应的进行。另一方而,灰铸铁脆性大,在搅拌过程中易被粉碎,增大了与反应物的接触面积,有利于还原反应的进行。1mol 硝基物理论上需要2.25mol 的铁屑(9÷4=2.25),实际用量为3~4mol ,过量多少与铁屑质量及粒度大小有关。铁屑细度一般以60~100目为宜。
铁屑在还原前,通常需要用电解质进行预蚀处理。如工业上使用FeCl 2电解质时,是通过加入少量稀盐酸和铁屑来制成,又称为“铁屑的预蚀”过程。
(3)电解质
电解质实质上是铁屑还原的催化剂,电解质的存在可促进铁屑还原反应的进行。因为向水中加入电解质可以提高溶液的导电能力,加速铁的预蚀,利于还原反应的进行。铁的还原速度取决于电解质的性质和浓度。表7-2列出了不同电解质对还原速度的影响。
表6-2 铁在不同电解质中还原硝基苯的收率
从表6-2中可知,当其他条件相同时,所使用的电解质中,以使用NH 4Cl 的还原速度最快,氯化亚铁次之;酸性越强,对还原反应越有利。工业生产上常使用NH 4Cl 和FeCl 2为电解质。但在某些情况下,也需要选用其他电解质,如对硝基-N-乙酰苯胺还原时,为了防止酰基水解,宜用醋酸亚铁作电解质。适当增加电解质浓度,可使还原速度加快,但还原速度增加有一极限值。通常每1mol 硝基化合物物大约需要0.1~0.2mol 的电解质,其浓度在3%左右。 (4)溶剂
用铁屑还原硝基物时.可用甲醇、乙醇、冰醋酸和水等作为溶剂。用冰醋酸作为溶剂时,反应速度快,产物容易分离,但产物中含有大量氨基酰化物。
用乙醇作为溶剂时,酰化物的含量可显著减少,但还原速度明显减慢。
最常用的溶剂是水,而水同时又是还原反应中氢的来源。为了保证有效的搅拌,加强反应中的传热和传质,水一般是过量的。但水量过多时,将降低设备的生产能力和电解质的浓度,一般采用硝基物与水的物质的量之比为1:(50~100)。对于一些活性较低的化合物,可加入甲醇、乙醇等能与水相混的溶剂,以利于反应进行。 (5)温度
硝基还原时,反应温度通常为90~102℃,即接近反应液的沸腾温度。由于铁屑还原是强烈的放热反应,如果加料太快,反应过于激烈,会导致爆沸溢料。所以,反应开始阶段靠自身反应热保持沸腾,反应后期采用直接用水蒸气保持反应物料沸腾。
4.邻硝基苯甲醚还原反应的监控 (1)还原反应体系构建要点
①体系要在加热条件下进行,要配加热装置和回流冷凝装置。 ②铁屑是固体,反应体系要配有搅拌装置。 (2)还原反应控制策略
选用水为反应介质,铁粉首先进行预蚀处理,然后再加入邻硝基苯甲醚进行还原。 由于反应开始如果反应快的话,可以考虑控制加料速度。 由于Fe 2+高温时容易水解,反应过程中可用Na 2S 检查有无Fe 2+存在,若无Fe 2+存在则须补加少量的酸。补加酸最好选择非挥发性的酸或酸性电解质,以免挥发出体系。 (3)还原反应终点控制
铁粉还原过程中通常伴随一些颜色的变化,当颜色不再变化时往往达到还原反应的终点。也以采用薄层色谱或气相色谱(或高效液相色谱)等对反应进行跟踪。
6.3 邻甲氧基苯胺的合成方法选用
6.3.1邻甲氧基苯胺的合成原理
通过上面的分析,本项目可以邻硝基氯苯为原料,经甲氧基化反应和还原反应生成目标化合物,反应式如下:
Cl
NO 2
OCH 3
NO 2
OCH 3
NO 2
OCH 3
NH 2
甲氧基化反应中甲醇钠可以由甲醇和氢氧化钠制备而得,而邻硝基苯甲醚的小规模还原可以用铁粉还原法进行还原。
6.3.2邻甲氧基苯胺的合成工艺条件 1.甲氧基化反应 (1)物料配比
甲醇钠∶邻硝基氯苯≈1.1∶1。 (2)反应温度
控制温度在98-104℃为宜。
(3)压力:
控制釜内压力显示0.28~0.32Mpa (表压)。
(4)搅拌:良好。
2.铁粉还原反应 (1)物料配比
铁屑∶邻硝基苯甲醚≈3.5∶1。 (2)反应温度
控制温度在100℃左右。 (3)压力:常压下反应。 (4)搅拌:良好。
6.3.3邻甲氧基苯胺合成装置 1.甲氧基化反应的合成装置
本产品甲氧基化反应由于需要在0.28~0.32MPa 压力条件下进行,故需选用低压反应釜来进行。可选用如图6-1反应装置。
NaOH CH 3OH Fe
图6-1 甲氧基化反应低压反应釜系统装置流程图
甲醇通过液体加料泵15打入低压反应釜10中并与其中的原料邻硝基氯苯在搅拌和温度为98~104℃下进行反应,并通过减压阀2控制压力在0.28~0.32Mpa(表压)。通过取样器13监控反应的进行程度。合格的产品可以由气液分离器11排出。
2.还原反应装置
图6-2 还原反应装置图
装置由四口或三口烧瓶、搅拌器、恒压滴液漏斗、冷凝管、铁架台、加热套构成。四口或
三口烧瓶是发生反应的部位,搅拌由烧瓶正中的瓶口插入,采用机械搅拌。恒压滴液漏斗与回
流冷凝管分别插在烧瓶的两侧的瓶口。温度计插在温度计专用插口上。加温装置一般可用加热
套。有关装置要领的安装参见附录。
6.4 邻甲氧基苯胺合成中产物分离、精制、检测方法
6.4.1甲氧基化反应结束时反应的后处理
(1)体系的组成及其状态
甲氧基化反应结束后,体系的主要组成为:邻硝基苯甲醚、甲醇、氯化钠、水、过量未反应的氢氧化钠等,其中氯化钠为固体,体系为非均相混合体系。邻硝基苯甲醚溶解在甲醇中。 (2)产物的分离策略
首先考虑回收多余的原料。原料中氢氧化钠剩余很少,没有回收的价值,甲醇剩余很多,应考虑回收甲醇。
目标产物邻硝基苯甲醚不溶于水,而其他物质均能溶于水,因此可以向体系中加入水,即可很方便地将产物分离出来。为了更好地进行溶解,可以考虑加入热水或升温溶解。
考虑到氢氧化钠的碱性对分离过程可能产生影响,分离前可以用弱酸中和处理(不中和对分离过程影响不大)。
(3)粗邻硝基苯甲醚的分离流程 可参考如下的分离流程:
(4)分离装置
主要采用蒸馏装置和分液装置。
6.4.2还原反应结束时反应后处理 (1)体系的组成及其状态
还原反应结束后,体系的组成主要为:邻甲氧基苯胺及其盐、少量未还原的邻硝基苯甲醚、未反应铁粉、铁的氧化物、电解质以及水等。体系为非均相体系。邻甲氧基苯胺以油状物为主,少量溶解在溶液中,邻甲氧基苯胺的盐溶解在溶液中。 (2)产物分离策略
由于产物混合物中含有大量的固体,通常的蒸馏、过滤、萃取等方法都不太适用。邻甲氧基苯胺微溶于水,但有一定挥发性,因此可以考虑采用水蒸气蒸馏的方法进行分离。
由于还原介质为酸性,和邻甲氧基苯胺生成铵盐溶于溶液中,这部分铵盐是不能被蒸汽蒸出的,因此要将溶液碱化至pH 在8左右,使得邻甲氧基苯胺游离出来。
体系中出来的水蒸气经冷凝后,邻甲氧基苯胺会和水分层,可以通过分液装置很方便地将邻甲氧基苯胺分离出来。分离后的水层中还含有较多的邻甲氧基苯胺,可以通过盐析的方法进行分离。
(3)产物的分离流程
分离流程如下:
反应混合物
馏出物(甲醇)
中性粗产物
(4)分离装置装置
仍可采用过滤装置及水蒸汽蒸馏装置、减压蒸馏装置。
6.4.3 邻甲氧基苯胺产品的纯化及精制
由于目的产物是低熔点高沸点的有机物,可以采用减压蒸馏的方法进行纯化。也可以考虑用层析的方法进行纯化精制。但由于层析法时间较长,建议用减压蒸馏的方法进行纯化。
(1)减压蒸馏的参数:
压力P=0.0263Mpa,沸程范围:T=117~121℃
(2)减压蒸馏装置及操作:参见附录5。
6.4.4 邻甲氧基苯胺的产品检测
1.邻甲氧基苯胺的检测方法
目标产物邻氨基苯甲醚的检测可以参考HG/T2669-2008的检测方法。
2.邻甲氧基苯胺的鉴定
本项目产品的鉴定,因为结构已知,故只需采用简单的物理常数测定即可。这里建议采用红外光谱的鉴定法。
邻甲氧基苯胺的红外光谱谱图如图6-3:(来自中科院上海有机化学研究所)
图6-3 邻氨基苯甲醚的红外光谱谱图
说明:图中苯环骨架振动在1600 cm-1,1580 cm-1附近有吸收;3200~3300cm-1为氨基的振动吸收峰;2800~2900cm-1为甲氧基团的伸缩峰。
6.5 邻甲氧基苯胺合成过程的三废处理
1.废气的处理
在本项目合成实验过程中废气主要来源于有机溶剂的挥发,如甲醇等。甲醇毒性大,对环境有严重的危害,易燃,遇明火、高热或氧化剂接触,有引起燃烧爆炸的危险。由于甲醇具有很强的挥发作用,通常在水和土壤中的甲醇会很快的挥发到空气中,因此水和土壤中的甲醇会很快降低到很低的水平。如果出现泄露应尽可能切断泄漏源,防止进入下水道、排洪沟等限制性空间。小量泄漏:用砂土或其它不燃材料吸附或吸收。也可以用不燃性分散剂制成的乳液刷洗,洗液稀释后放入废水系统。
2.废液的处理
实验过程中产生的废液首先应按无机溶剂和有机溶剂分类倒入相应的废液桶中,不得直接倒入下水道,并及时处理。在本项目合成实验过程中废液主要来源于甲氧基化后剩余的废甲醇、还原反应后剩余的的铁屑和硝基氨基类化合物。
(1)废甲醇的处理
反应后有部分剩余的甲醇水溶液,如果直接排放,对环境造成的影响是非常大的。废甲醇的处理可采用以下的方法:
①将甲氧基化后的废甲醇用于下一批的反应中,即实行闭路循环利用;
②甲氧基化后部分废甲醇直接循环套用,其余废甲醇可用蒸馏的方法提纯精甲醇。
③含微量废甲醇的溶液,可通过浸没燃烧,或提浓至纯度较高的甲醇作为反应原料。
(2)废水的处理
甲氧基化反应后废水主要含有少量碱,甲醇化合物以及部分硝基化合物等。这些废水可以集中进行处理,也可以分别处理。少量碱可以以过量的醋酸水溶液中和,或用废液中和,中和后用大量水冲稀排放。甲醇化合物以及部分硝基化合物可以经蒸馏回收或活性炭吸附处理后即可排放。
3.废渣的处理
本项目实验合成过程中的废渣主要为反应中产生的铁的氧化物(铁泥)。这部分铁泥还含有目标化合物,应考虑回收其中大部分产品,如可以用少量乙醇多次清洗铁泥。回收产物后,铁泥可以放弃。
6.6 邻甲氧基苯胺的合成操作
6.6.1 合成前的准备
①明确合成任务。
②制定合成方案,画出合成流程图。
③准备合成所需仪器及药品,搭建合成装置。
④准备测试所需仪器及药品。
⑤必要时对原料或试剂进行预处理。
6.6.2邻甲氧基苯胺的合成操作过程
1.合成过程
下面是由文献资料整理的合成步骤,供各合成小组制定实验方案时参考。
(1)甲氧基化反应
在装有搅拌器的压热釜中,加入甲醇24.3g(0.758mol)。搅拌下,再加入由2.6g氢氧化钠配成的80%的碱溶液。控制温度不超过40℃。分析甲醇钠浓度为80-83g/L。分析合格后将反应液冷却至25℃,加入8.2g(0.054mol)邻硝基氯苯。加热至98-104℃,釜内压力0.28-0.32MPa 下连续搅拌,反应4h反应结束,反应液降温至25℃以下。蒸馏多余的甲醇,当釜内温度升至90℃时停止蒸馏,加入70℃热水,静置后分层。有机层水洗至中性。待用。
(2)硝基还原反应
在装有搅拌器、回流冷凝器的四口瓶中,加去离子水170m1、铁屑127g(2.26mo1)、甲酸1.5g,将反应液加热至沸腾,铁屑进行预蚀1h,搅拌下向四口瓶中慢慢加入93.5g(0.61mol)邻硝基苯甲醚,回流搅拌2h,加氢氧化钠水溶液中和。进行水蒸气蒸馏,馏出物分出油层,水层经食盐盐析还可得到一部分油层,两部分油层合并进行减压蒸馏,收集117-121℃的馏分(0.0263MPa)。产品收率约为70%(以邻硝基氯苯计算)。
2.关于产物的检测和鉴定
测定产物的熔点、含量;波谱鉴定只要求对合成产品检测其红外光谱。
3.填写产品合成报告书
见附录《产品合成报告书》。
6.7 邻甲氧基苯胺合成任务完成效果评价
仍然采用情境1中的评价方法和评价程序进行评价,即分别从合成路线及方案、合成装置、
操作及产品合成结果及职业素质的养成情况等四方面进行评价。第一项主要从原料、工艺、安全、三废等方面进行评价;第二项主要从装置搭建、反应操作、产物分离精制、产品分析检测、实验过程规范与记录及实验结束现场清理等方面进行评价;第三项主要从产品质量、产品利率或产率、安全环保及产品经济效益等进行综合评价;第四项主要从学生的职业素质养成的情况方面进行评价。参见附录中《项目合成教学评价表》。
6.8 知识拓展
6.8.1关于O-烷基化反应
醇羟基或酚羟基中的氢被烷基所取代生成醚类化合物的反应称为O-烷基化反应。
1.卤烷的O-烷基化
用卤烷的O-烷基化是亲核取代反应。对于被烷化的醇或酚来说,它们的阴离子RO-的活泼性远远大于醇或酚本身的活性。因此,在反应物中总是要加入碱性剂,例如金属钠、氢氧化纳、氢氧化钾、碳酸钠或碳酸钾等,以生成RO-阴离子。
式中R表示烷基或芳基,ALK表示芳基,X表示卤素,所用的碱也叫缚酸剂。当醇和卤素化合物都很不活泼时,要将醇先制成无水醇钠,然后与卤烷作用,以避免水解副反应。如果醇和卤烷都比较活泼,O-烷基化反应也可以在氢氧化钠水溶浓中进行。醇羟基的反应活性随碳链的增长而降低。酚羟基具有一定的酸性,一般可以用碳酸钠或碳酸钾作缚酸剂。
当烷基相同时,各种卤烷的活泼性次序是:
由于氯烷价廉易得,工业上一股使用氯烷作烷基化剂。如果氯烷不够活泼,可加入适量碘化钾(约为氯烷摩尔数的1/10-1/5)进行催化,它的作用是先通过卤素交换反应把氯烷转化为碘烷,再进行O-烷基化。
利用氯烷的O-烷基化反应可以制备一系列的二烷基醚和烷基芳基醚。现举例如下:
对于某些活泼的酚类,也可以用醇类作烷基化剂:
在KOH和相转移催化剂聚乙二醇-400存在下,酚类与卤烷的反应非常顺利:
许多芳醚的制备不宜采用烷氧基化的合成路线,而需要采用酚羟基化(即O-烷基化)的合成路线。例如2-萘乙醚的制备,如采用烷氧基化的合成路线,就要用到2-氯萘做原料,而该原料不仅难以得到,且其上的氯原子也很不活泼;若采用O-烷基化,则原料2-萘酚很容易得到。芳环上的羟基一般不够活泼,所以需要使用活泼的烷基化剂,例如氯甲烷、氯乙烷、氯乙酸、硫
酸酯、对甲苯磺酸酯和环氧乙烷等,只有在个别情况下才使用甲醇和乙醇等弱烷基化剂。
2.用酯的O-烷基化
硫酸酯及磺酸酯均是良好的烷基化剂。在碱性催化剂存在下硫酸酯与酚、醇在室温下即能顺利反应,并以良好产率生成醚类。
3.醇或酚直接脱水成醚
醇或酚的脱水是合成对称醚的通法。醇的脱水反应通常在酸性催化剂存在下进行,常用的酸性催化剂有浓硫酸、浓盐酸、磷酸、对甲苯碳酸等。
二元醇进行酸催化脱水或催化脱水均可合成环醚,如l,4-丁二醇在硫酰胺催化下进行分子内的脱水,生成四氢呋喃,产率达92%。
特殊的制醚方法主要有威廉森(Williamson)合成法,这个方法可用来合成单醚或混醚,但主要用来合成混醚。其方法是用卤烷与醇钠反应:
4.用环氧乙烷的O-烷基化
环氧化合物易与醇发生开环反应,生成羟基醚。开环反应可用酸或碱催化,但往往生成不同的产品,酸与碱催化开环的反应过程是不相同的:
此种反应在工业上的应用之一是由醇类与环氧乙烷反应生成各种乙二醇醚。
-乙醚络合物作为催化剂。当R为甲基、乙基或丁基时,可相应制取乙二醇单反应常用BF
3
甲醚、单乙醚及单丁醚等,这些产品都是重要的溶剂。高级脂肪醇和烷基酚与环氧乙烷加成生成的聚醚是非离子表面活性剂的重要品种,反应一般用碱催化。例如用十二醇为原料,通过控制环氧乙烷聚合度为20-22的聚醚,是一种优良的非离子表面活性剂,商品名为乳化剂O或匀染剂O。
将辛基苯酚与其质量分数为1%的氢氧化钠水溶液混合,真空脱水,氮气置换,于160-180℃通人环乙氧烷,中和漂白,得到聚醚产品辛基酚聚氧乙烯醚,其商品名为OP型乳化剂。
高级脂肪酸也能与环氧乙烷作用而生成聚醚类聚氧乙烯型非离子表面活性剂。例如,硬脂酸在氢氧化钾作用下制备脂肪酸聚醚:
合成邻甲氧基苯胺的工作任务 1. 邻甲氧基苯胺概述 邻甲氧基苯胺为浅黄色油状液体,是一种重要的医药和染料中间体,也用于食品工业制取香兰素等。 2.产品开发项目任务书 邻甲氧基苯胺产品的《产品开发任务书》如表6-1。 表6-1 产品开发项目任务书 编号:XXXXXX 6.2 邻甲氧基苯胺合成任务分析 6.2.1 邻甲氧基苯胺分子结构的分析 ①邻甲氧基苯胺的分子式:C 7 H 9 NO ②邻甲氧基苯胺的分子结构式: OCH3 NH2 目标化合物基本结构比较简单,苯环上的甲氧基和氨基处于相邻位置,甲氧基和氨基均为为邻、对位定位基。 6.2.2 邻甲氧基苯胺的合成路线分析 采用逆向合成法对于邻甲氧基苯胺的合成路线分析如下: OCH3 NH2 Cl NH2 OCH3 NO2 Cl NO2 相应的合成路线就有两种。 第一种路线:先甲氧基化后还原路线。 或
Cl NO 2 OCH 3NO 2 OCH 3 NH 2 第二种路线:先还原后甲氧基化路线。 Cl NO 2 Cl NH 2 OCH 3 NH 2 因此要想从这些合成路线中确定最理想的一条路线,并成为工业生产上可用的工艺路线,则需要综合各方面情况加以全面地考察,择优选用。 从反应机理上看,甲氧基化反应是苯环上的亲核取代反应(参考芳香族卤化物水解引入羟基的反应机理及影响因素),苯环上接有吸电子基团(-NO 2)对反应有利,而接有给电子基团(-NH 2)则对反应不利,因此路线1要优于路线2。 6.2.3文献中常见的邻甲氧基苯胺合成方法 从文献资料上可以查出,目前邻甲氧基苯胺的合成路线与上面设计的路线相同。即以邻硝基氯苯为原料经甲氧基化和还原反应合成。 下面我们将从此成路线出发,将合成过程中需要考虑的各种因素进行剖析,找出一条相对合适的合成方案,并按此方案进行合成来实际检验方案的可行性。假如采用其它的合成路线,请同学们沿此思路自己剖析,应该不难找出合适的合成的方案。 6.2.4 邻甲氧基苯胺合成过程单元反应及其控制分析 不难看出,甲氧基化反应和还原反应是合成过程实施的关键反应。欲在合成中做好甲氧基化反应和还原反应,就必须对甲氧基化反应和还原反应过程的情况作详细了解。 6.2.4.1邻硝基氯苯的甲氧基化反应及其控制 1.甲基化反应和甲基化试剂 (1)甲基化反应 在有机化合物分子中引入甲氧基(-OCH 3)的反应称为甲基化反应。脂肪族卤代烷与甲醇钠作用,卤素被甲氧基取代生成醚,反应式如下。 RX+CH 3ONa →ROCH 3+NaX 卤代烷、烯丙基型卤化物、卤化苄、α-卤代酸等都可以和甲醇钠反应,生成相应的醚,这是制备甲基醚的主要方法。醇和酚羟基上的氢也可被甲基取代,羟基即转变为甲氧基,这也是制备甲基醚的重要方法。 (2)甲基化试剂 甲醇、甲醇钠(或钾)都可作为甲氧基化试剂。由于甲醇钠(或钾)的成本太高,在要求不太高的情况下(特别是水对反应的影响不是太大的情况下),通常采用甲醇与NaOH (或KOH )反应而得。 CH 3OH + NaOH CH 3ONa + H 2O 该反应为可逆平衡反应,要使平衡向正方向移动可增加甲醇和碱的浓度。甲醇有毒,操作中要注意个人防护。 2.邻硝基氯苯的甲氧基化反应机理 邻硝基氯苯的甲氧基化反应是苯环上的亲核取代反应,历程如下(参见情境5): CH 3ONa 为强亲核试剂,亲核质点为CH 3O - (烷氧负离子)。由于邻硝基氯苯中氯原子的电负性很大,会使苯环上与氯原子相连的碳原子带部分正电荷。该碳原子能受到亲核质点烷氧负离 CH 3OH NaOH [H] [H] CH 3OH NaOH
Organic Syntheses, Coll. Vol. 10, p.418 (2004); Vol. 78, p.63 (2002). ULLMAN METHOXYLATION IN THE PRESENCE OF A 2,5-DIMETHYLPYRROLE -BLOCKED ANILINE : PREPARATION OF 2-FLUORO-4-METHOXYANILINE [ Benzenamine, 2-fluoro-4-methoxy- ] Submitted by John A. Ragan, Brian P. Jones, Michael J. Castaldi, Paul D. Hill, and Teresa W. Makowski 1 . Checked by Samuel W. Ridenour and David J. Hart. 1. Procedure A. 1-(2-Fluoro-4-iodophenyl)-2,5-dimethyl-1H-pyrrole . A 500-mL, single-necked, round-bottomed flask with a Teflon-coated magnetic stir bar is charged with 2-fluoro-4-iodoaniline (50.0 g, 211 mmol) (Note 1), p-toluenesulfonic acid (0.40 g, 2.1 mmol) (Note 2), 250 mL of toluene (Note 3), and acetonylacetone (29.7 mL, 253 mmol) (Note 4). A Dean-Stark trap is attached to the flask, and the solution is warmed to reflux for 1 hr (Note 5). After the solution is cooled to room temperature, it is transferred to a 500-mL separatory funnel, and washed with one 50-mL portion of aqueous saturated sodium bicarbonate (NaHCO 3), five 50-mL portions of water (Note 6), and one 50-mL portion of brine. The organic phase is dried over anhydrous magnesium sulfate (MgSO 4), filtered, and concentrated to provide a brown, free-flowing solid (67.5 g, 101.5% of theory) (Notes 7 and 8). B. 1-(2-Fluoro-4-methoxyphenyl)-2,5-dimethyl-1H-pyrrole . A 500-mL, single-necked, round-bottomed flask equipped with a condenser and Teflon-coated magnetic stir bar is flame-dried under a positive pressure of nitrogen , and charged with 1-(2-fluoro-4-iodophenyl)-2,5-dimethyl-1H-pyrrole (66.6 g, 211 mmol) , sodium methoxide (NaOMe) (34.2 g, 633 mmol) (Note 9), copper(I) chloride (3.13 g, 31.7 mmol) (Note 10), 230 mL of methanol (Note 11) and 70 mL of dimethylformamide (DMF) (Note 12). The resulting slurry is placed in an 80°C oil bath for 90 min (Note 13) so that a gentle reflux is maintained, then cooled to room temperature. The slurry is poured into a rapidly stirring mixture of 500 mL of isopropyl ether (Note 14), 220 mL of aq 5% ammonium chloride (NH 4Cl) (Note 15), and 350 mL of water in a 2-L Erlenmeyer flask, rinsing with several small portions of methanol . The resulting slurry is stirred overnight (Note 16). It is filtered through a 3"-pad of Celite in a coarse-frit glass funnel, and the filtrate is transferred to a 2-L separatory funnel. The phases are separated, and the aqueous phase is extracted with three 50-mL portions of isopropyl ether . The combined organic phases are washed with 200 mL of aqueous 10% NH 4OH (Note 17), filtered through a silica gel pad (Note 18), and concentrated to provide a brown, free-flowing solid (42.0 g, 92% crude yield) (Note 19). The crude product is recrystallized by dissolving it in 100 mL of hot hexanes and stirring overnight at room
芳亚胺类化合物的合成研究 1 前言 芳亚胺是一种重要的有机中间体,主要是用于生产酰胺类除草剂和有机磷杀虫剂,其消费量约占70%~80%。在医药行业重要用于合成消炎、解热、镇痛药双氯灭痛等,其他还用于合成青霉素类抗生素药物以及抗寄生虫类药物等。此外,它还用于生产氨基酸类化合物用于合成食品和饲料添加剂等方面[1]。芳亚胺特别是它同其他适当助剂复配后,对根茎作物、油料作物、谷物、纤维作物等多种农作物均有不同程度的增产效果。它在播种前或苗期施于土壤中,明显促进作物根系的增长。作物的根系发达,株体强大,为后期打下坚实营养基础,同时易于抵抗多种气候和病虫害的侵袭,从而收到增产效果[2]。 合成芳亚胺的常用方法是采用等摩尔苯甲醛和苯胺反应[3]。反应过程是等摩尔苯甲醛和苯胺混合,在50~60℃下搅拌1h ,后将反应液加入乙醇试剂中,冷却至30℃下,静置,过滤干燥得出产物,传统方法中反应时间过长。 微波作为一种传输介质和加热能源已被广泛应用于各学科领域。与传统加热相比, 微波加热可使反应速率大大加快, 可以提高几倍、几十倍甚至上千倍[4] , 同时由于微波为强电磁波, 产生的微波等离子体中常可存在热力学方法得不到的高能态原子、分子和离子, 因而可使一些热力学上不可能发生的反应得以发生[5]。 经文献调研,我们还未发现利用微波辐射技术使苯胺和苯甲醛缩合制备芳亚胺。本论文利用微波辐射技术使苯甲醛和苯胺缩合,进而制备一系列的芳亚胺,试图缩短反应时间、提高产率、节约成本、减少环境污染。 2 实验原理 H O +NH 2 ′R R H N ′R R +H 2 O 'R=H; OCH 3R= H; Cl; NH 2;OCH 3;CH 4 3 试剂与仪器 3.1 主要试剂: 苯甲醛 (分析纯,天津大茂化学试剂厂) 苯胺 (分析纯,天津永大化学试剂开发中心) 对甲氧基苯甲醛 (分析纯,上海天莲精细化工有限公司) 对氯苯胺 (化学纯,天津市光复精细化工研究所)
合成题 1、由苯和苯酚合成: 2、.由甲苯合成: 3、由苯和乙醛合成: 4、由丙二酸二乙酯,甲苯及其它试剂合成: 5、由甲苯合成: 6、以甲苯和乙醛为原料合成: 7、以丙二酸二乙酯和三个碳的有机物合成: 8、由苯、苯甲醛和不超过两个碳的有机物合成: 由苯、苯甲醛和不超过两个碳的有机物合成:
9、由丙烯醛合成2,3-二羟基丙醛。 10、由苯酚及三个碳以下的有机物合成: 11、以环己醇和不超过两个碳的有机物合成: 12、由苯酚和不超过三个碳的化合物合成: 13、由环己醇合成: 14、由硝基苯合成4,4′-二溴联苯。 15、由甲苯和丙二酸二乙酯合成: 16、.由苯合成1,2,3-三溴苯。 17、用邻苯二甲酰亚胺和甲苯为原料合成: 18、用苯胺为原料合成:
19、由甲苯合成2-溴-4-甲基苯胺。 20、由丙二酸二乙酯和三个碳的有机物合成环丁基甲酸。 21、由苯合成4,4′-二碘联苯。 22 、以苯为原料,经重氮盐合成: 23、由苯甲醛和苯乙酮经羟 醛缩合反应制备 24、由苯甲醛和苯乙酮制 备 25、由制备 26.用丙二 酸二 乙酯 制备 27、由 合成 28、由 合成 29、以乙酰乙酸乙酯和不超过五个碳的化合物为原 料合成 30、以苯甲醛和苯为原料合成:
31.由合成 32、以丙二酸二乙酯为原料合成2-甲基丁酸。 33、以苯为原料合成间溴苯胺。 34、以丙二酸二乙酯和甲苯为原料合成 35、由苯和丙烯为原料合成苯基丙烯基醚 36、以乙炔为原料合成Z-2-己烯(无机试剂任选) 37、以丙二酸二乙酯和甲苯为主要原料合成2-甲基-3-苯基丙酸,其他试剂任选。 38、由环己醇与乙醇合成1-乙基环己醇 39、以甲苯为主要原料合成3-苯基-1-丙醇 40、用丙二酸二乙酯和不超过一个C的有机化合物为原料,合成 41、以苯为原料,经重氮盐合成: 42、选择适当的方法完成下列转变:
4-氯邻甲苯胺化学品安全技 术说明书 第一部分:化学品名称化学品中文名称:4-氯邻甲苯胺 化学品英文名称:4-chloro-o-toluidine 中文名称2:3-氯-6-氨基甲苯 英文名称2:4-chloro-2-methylaniline 技术说明书编码:2593CAS No.: 95-69-2 分子式: C 7H 8CIN 分子量:141.6第二部分:成分/组成信息 有害物成分含量CAS No.第三部分:危险性概述健康危害:吸入、摄入或经皮肤吸收后会中毒。对眼睛、皮肤有刺激作用。受热分解释出氮氧化物和氯烟雾。本品进入体内能形成高铁血红蛋白,可致紫绀。 环境危害:对环境有危害,对水体可造成污染。燃爆危险:本品可燃,具刺激性。第四部分:急救措施皮肤接触:脱去污染的衣着,用大量流动清水冲洗眼睛接触:提起眼睑,用流动清水或生理盐水冲洗。就医。吸入:迅速脱离现场至空气新鲜处。保持呼吸道通畅。如呼吸困难,给输氧。如呼吸停止,立即进行人工呼吸。就医。食入:饮足量温水,催吐。就医。第五部分:消防措施危险特性:遇明火、高热可燃。与氧化剂可发生反应。受高热分解放出有毒的气体。若遇高热,容器内压增大,有开裂和爆炸的危险。有害燃烧产物:一氧化碳、二氧化碳、氮氧化物、氯化氢。灭火方法:消防人员须佩戴防毒面具、穿全身消防服,在上风向灭火。尽可能将容器从火场移至空旷处。喷水保持火场容器冷却,直至灭火结束。处在火场中的容器若已变色或从安全泄压装置中产生声音,必须马上撤离。灭火剂:雾状水、泡沫、干粉、二氧化碳、砂土。不宜用第六部分:泄漏应急处理 有害物成分 含量 CAS No.: 4-氯邻甲苯胺 95-69-2
2004 年2 月 Journal of Chemical Engineering of Chinese Universities Feb. 2004 文章编号:1003-9015(2004)01-0094-05 2-(4-卤代苯甲酰基)苯胺的合成研究 戴立言, 吴彩娟, 陈英奇, 吴兆立 (浙江大学材料与化工学院,浙江杭州,310027) 摘要:研究了重要的有机中间体2-(4-卤代苯甲酰基)苯胺的通用合成路线,是以邻苯二甲酸酐为原料,与卤代苯(分别为氟苯、氯苯和溴苯)进行付-克反应得到羧酸;羧酸经酰氯化、酰胺化,制得邻苯甲酰基苯甲酰胺衍生物,然后再经过霍夫曼降解合成了标题化合物。对主要步骤反应条件进行了优化,得出比较合理的条件为:付-克反应,催化剂:AlCl3,配料比:1:2.2:6.4(苯酐:AlCl3:卤代苯);同时使用卤代苯既作反应试剂,又作溶剂,未反应的卤代苯回收套用,使收率基本定量;酰胺化反应氨气流量:10mL?min?1,使反应得以室温进行,无需制冷;四步反应总收率可达70%。 关键词:2-(4-卤代苯甲酰基)苯胺; 2-(4-氟苯甲酰基)苯胺; 2-(4-氯苯甲酰基)苯胺; 2-(4-溴苯甲酰基)苯胺; 中间体; 合成 中图分类号:O621.3; TQ246.31 文献标识码:A 1 前言 2-(4-卤代苯甲酰基)苯胺(1)(X=F、Cl、Br)是重要的有机原料和医药中间体,可用于合成植物生长调节剂和园艺杀菌剂异菸碱酰替苯胺[1]和还原酶HMG-CoA的阻聚剂NK-104[2],也用于合成2-氨基-3-卤代苯甲酰基苯乙酰胺衍生物,用于治疗眼科发炎症状[3],还可用于合成4-卤代苯-2-哌嗪喹啉衍生物,目前又发现该类物质具有抗溃疡作用[4]。其主要合成路线如下: 收稿日期:2001-12-20; 修订日期:2002-05-30。 作者简介:戴立言(1971-),男,辽宁开原人,浙江大学副教授、博士。通讯联系人:戴立言,E-mail: dailiyan@https://www.doczj.com/doc/07515184.html,
万方数据
万方数据
万方数据
取代基对苯环活性的影响 作者:周子英, Zhou Ziying 作者单位:包头市第九中学 刊名: 内蒙古石油化工 英文刊名:INNER MONGULIA PETROCHEMICAL INDUSTRY 年,卷(期):2003,29(2) 参考文献(1条) 1.曾昭琼;张振权;苏永成;粱致诚, 王运武有机化学 1993 本文读者也读过(10条) 1.蔡凌云定位效应在有机合成上的应用[期刊论文]-黔东南民族师范高等专科学校学报2005,23(6) 2.分子结构与化学活性间定量关系的教学应用[期刊论文]-合肥联合大学学报2003,13(3) 3.任翻身共轭分子体系相关问题的理论探讨[期刊论文]-安庆师范学院学报(自然科学版)2010,16(2) 4.王文峰.丁开宁.李奕.李俊篯最高已占轨道电子分布图在亲电取代定位规律中的应用[期刊论文]-化学教育2005,26(7) 5.甘金文电子效应对键长、偶极矩的影响[会议论文]-2001 6.王庆伟.王昕.王佐成.孙晋苯环上取代基定位效应的简易判定法[期刊论文]-松辽学刊(自然科学版)1999(4) 7.邓旭忠.李红.杨辉荣.DENG Xu-zhong.LI Hong.YANG Hui-rong NMR在芳基亲电取代反应中的应用研究[期刊论文]-广东工业大学学报1999,16(4) 8.张玉.ZHANG Yu关于一元取代苯定位效应对称性的理论研究[期刊论文]-内蒙古石油化工2008,34(6) 9.杨永君.YANG Yong-jun一氯甲基定位效应的解析[期刊论文]-昭通师范高等专科学校学报2001,23(3) 10.邝代治.邓立.冯泳兰.张复兴.王剑秋.张志坚.KUANG Dai-zhi.DENG li.FENG Yong-lan.ZHANG Fu-xin.WANG Jian-qiu.ZHANG Zhi-jian苯氧基在二苯醚亲电取代反应中的定位效应[期刊论文]-湘南学院学报2010,31(2) 本文链接:https://www.doczj.com/doc/07515184.html,/Periodical_nmgsyhg200302006.aspx
第十章 第52讲 1.(2016·浙江卷)化合物X 是一种有机合成中间体,Z 是常见的高分子化合物,某研究小组采用如下路线合成X 和Z : 已知:①化合物A 的结构中有2个甲基; ②RCOOR′+R″CH 2COOR′――→ CH 3CH 2ONa 。 请回答: (1)写出化合物E 的结构简式:__CH 2===CH 2__,F 中官能团的名称是__羟基__。 (2)Y→Z 的化学方程式是 ――→催化剂 。 (3)G→X 的化学方程式是__ ――→CH 3CH 2ONa CH 3CH 2OH + __,反应类型是__取代反应__。 (4)若C 中混有B ,请用化学方法检验B 的存在(要求写出操作、现象和结论):__取适量试样于试管中,先用NaOH 中和,再加入新制氢氧化铜悬浊液,加热,若产生砖红色沉淀,则有B 存在(合理答案均可)__。 解析 根据框图并结合已知信息知,A 为,B 为,C 为 ,D 为CH≡CH,E 为CH 2===CH 2,F 为CH 3CH 2OH ,G 为,Y 为 CH 2===CHCl ,Z 为。(1)E 的结构简式为CH 2===CH 2,F 中的官能团为羟基。(4)C 中混有B ,要检验B 的操作要点是:先用碱溶液将C 处理成盐,使待测液呈碱性,然后再用银氨溶液或新制Cu(OH)2进行检验。 2.(2017·全国卷Ⅲ)氟他胺G 是一种可用于治疗肿瘤的药物。实验室由芳香烃A 制备G 的合成路线如下:
回答下列问题: (1)A 的结构简式为____。C 的化学名称是__三氟甲苯__。 (2)③的反应试剂和反应条件分别是__浓HNO 3、浓H 2SO 4,加热__,该反应的类型是__取代反应__。 (3)⑤的反应方程式为__――→吡啶+HCl__。吡啶是一种有机碱,其作用是__吸收反应产生的HCl ,提高反应转化率__。 (4)G 的分子式为__C 11H 11F 3N 2O 3__。 (5)H 是G 的同分异构体,其苯环上的取代基与G 的相同但位置不同,则H 可能的结构有__9__种。 (6)4-甲氧基乙酰苯胺()是重要的精细化工中间体,写出由苯 甲醚()制备4-甲氧基乙酰苯胺的合成路线:__――→浓HNO 3浓H 2SO 4、△ ――→Fe 20% HCl ――→CH 3COCl 吡啶__(其他试剂任选)。 解析 (1)根据反应①的反应条件,可推知该反应是苯环所连的烃基上的氢原子被取代,属取代反应,根据B 的分子式,可推知A 为甲苯,即,C 为三氟甲苯。(2)反应③是在C 分子的苯环上的间位引入—NO 2,属硝化反应,所以反应试剂和条件是浓硝酸、浓硫酸,加热,属取代反应。(5)由于取代基相同,只是位置不同,—CF 3和—NO 2处于邻位,另一个取代基在苯环上有3种位置;—CF 3和—NO 2处于间位,另一个取代基在苯环上有4种位置;—CF 3和—NO 2处于对位,另一个取代基在苯环上有2种位置,共有9种结构。(6)苯甲醚先与混酸反应,在对位上引入硝基,然后将—NO 2转化成—NH 2,最后在吡啶作用下与CH 3COCl 反应生成目标产物。
对氨基苯磺酰胺(磺胺)的合成 一、实验目的 1,了解氯磺化反应的原理及操作方法。 2,了解氨基的保护与原理。 二,实验原理 磺胺是磺胺药物的最基本结构,也是药性的基本结构。磺胺类药物是指具有对氨基苯磺酰胺结构的一类药物的总称,是一类用于预防和治疗细菌感染性疾病的化学治疗药物。磺胺药物种类可达数千种,其中应用较广并具有一定疗效的就有几十种。磺胺药是现代医学中常用的一类抗菌消炎药,其品种繁多,已成为一个庞大的家族了。可是,最早的磺胺却是染料中的一员。在某次偶然的机会,人们发现这种红色的染料对细菌具有很强的抑制作用,从而将它应用于药物,并在二十世纪上特别是一次与二次世界大战期间乃至到现在依然是一种应用非常广泛的抗菌药物。 磺胺(对氨基苯磺酰胺)的合成步骤有如下: 路线一:苯胺法 NHCOCH3NHCOCH3 SO2Cl NHCOCH3 SO2NH2 NH2 SO2NH 2 ClSO3H NH31)H3O 2)HCO 3 路线二:氯苯法[1] Cl SO 3 Cl SO3H HSO3 Cl Cl SO2Cl NH4OH Cl SO2NH2 NH2 SO2NH2 NH4OH Cu2O 路线三:二苯脲法[2]
NH 2 NH 2CONH 2加热NHCONH ClSO 3H NHCONH ClO 2S SO 2Cl NHCONH H 2NO 2S SO 2NH 2NH 4OH SO 2NH 2 H 2N NaOH 本实验将采用路线一。 三、实验药品与仪器: 药品:5g 乙酰苯胺,氯磺酸,浓氨水,浓盐酸,碳酸钠。 仪器:锥形瓶,抽滤瓶,烧瓶,布氏漏斗。 四、实验步骤: 1, 对乙酰氨基苯磺酰氯的制备 H 3COCHN NHCOCH 3ClO 2S ClSO 3H 将5克干燥的乙酰苯胺将入到干燥的250ml 锥形瓶中,用温火加热溶解乙酰苯胺,搅拌油状物以让溶解物附在锥形瓶底部。冰浴冷却锥形瓶使油状物固化,一次性迅速加入10ml 氯磺酸(密度1.77g/ml )。然后连接预先配置好的氢氧化钠溶液收集氯化氢气体。 将锥形瓶从冰浴中取出进行搅拌,氯化氢气体剧烈的释放出来,如果反应太过剧烈,可放冷水中进行冷却。当反应变缓后,可轻轻摇晃使固体全部溶解。待固体全部溶解后,用蒸气浴加热锥形瓶10min 至不在产生氯化氢气体为止,这过程中必须进行尾气处理。最后通风橱中冰浴冷却反应瓶。 将反应瓶充分冷却之后,在通风橱中缓慢的将冷却的混合物在快速搅拌下倒入到装有80g 碎冰的烧杯中。用冷水洗涤锥形瓶并将洗涤液倒入到烧杯中(这一步是关键,一定要慢,一定要搅拌充分)。搅拌打碎块状的沉淀物,然后真空抽滤混合物。用少量冷水洗涤粗产物乙酰胺基苯磺酰氯。抽干晶体。粗产品不必干燥或是提纯,但须很快进行下一步反应,因粗产品在酸性条件下不稳定,易分解。 2 ,对乙酰氨基苯磺酰胺 H 3COCHN NHCOCH 3ClO 2S NH3 SO 2NH 2 在通风橱中将获得的乙酰氨基苯磺酰氯加入到125ml 的锥形瓶中,然后加入
邻联甲苯胺 109-61805 第一部分:化学品名称 化学品中文名称:3,3'-二甲基联苯胺 化学品英文名称:3,3'-dimethylbenzidine 中文名称2:邻联甲苯胺 英文名称2:o-tolidine 技术说明书编码:691 CAS No.:119-93-7 分子式:C14H16N2 分子量:212.3 第二部分:危险性概述 健康危害:本品对呼吸道和眼有刺激性。对皮肤无刺激性;易经皮肤吸收。慢性影响:无长期职业性接触致慢性影响的报道。动物喂饲本品可导致肾损害甚至肾功能衰竭。 燃爆危险:本品可燃,有毒,具刺激性。 第三部分:急救措施 皮肤接触:立即脱去污染的衣着,用肥皂水和清水彻底冲洗皮肤。就医。 眼睛接触:提起眼睑,用流动清水或生理盐水冲洗。就医。 吸入:迅速脱离现场至空气新鲜处。保持呼吸道通畅。如呼吸困难,给输氧。如呼吸停止,立即进行人工呼吸。就医。 食入:饮足量温水,催吐。就医。 第四部分:消防措施 危险特性:可燃。遇明火、高热可燃。受高热分解放出有毒的气体。 有害燃烧产物:一氧化碳、二氧化碳、氧化氮。 灭火方法:采用水、泡沫、二氧化碳、砂土灭火。 第五部分:泄漏应急处理
邻联甲苯胺 应急处理:隔离泄漏污染区,限制出入。切断火源。建议应急处理人员戴防尘面具(全面罩),穿防毒服。小量泄漏:用洁净的铲子收集于干燥、洁净、有盖的容器中。大量泄漏:收集回收或运至废物处理场所处置。 第六部分:操作处置与储存 操作注意事项:密闭操作,提供充分的局部排风。操作人员必须经过专门培训,严格遵守操作规程。建议操作人员佩戴自吸过滤式防尘口罩,戴化学安全防护眼镜,穿防毒物渗透工作服,戴橡胶手套。远离火种、热源,工作场所严禁吸烟。使用防爆型的 通风系统和设备。避免产生粉尘。避免与氧化剂、酸类接触。搬运时要轻装轻卸,防止包装及容器损坏。配备相应品种 和数量的消防器材及泄漏应急处理设备。倒空的容器可能残留有害物。 储存注意事项:储存于阴凉、通风的库房。远离火种、热源。包装密封。应与氧化剂、酸类、食用化学品分开存放,切忌混储。配备相应品种和数量的消防器材。储区应备有合适的材料收容泄漏物。 呼吸系统防护:空气中粉尘浓度较高时,佩戴自吸过滤式防尘口罩。紧急事态抢救或撤离时,建议佩戴自给式呼吸器。 眼睛防护:戴化学安全防护眼镜。 身体防护:穿防毒物渗透工作服。 手防护:戴橡胶手套。 其他防护:工作现场禁止吸烟、进食和饮水。及时换洗工作服。工作前后不饮酒,用温水洗澡。实行就业前和定期的体检。 主要用途:用作染料、乌来糖树脂的交联剂、鉴定金及水中游离氯的试剂。 废弃处置方法:处置前应参阅国家和地方有关法规。建议用焚烧法处置。焚烧炉排出的氮氧化物通过洗涤器除去。 运输注意事项:运输前应先检查包装容器是否完整、密封,运输过程中要确保容器不泄漏、不倒塌、不坠落、不损坏。严禁与酸类、氧化剂、食品及食品添加剂混运。运输途中应防曝晒、雨淋,防高温。
2012年 第12期 广 东 化 工 第39卷 总第236期 https://www.doczj.com/doc/07515184.html, · 85 · 对三氟甲氧基苯胺基甲酰肼的合成 李洪侠,綦菲,吴文雷,刘英贤,栾波 (山东京博控股股份有限公司,山东 博兴 256500) [摘 要]文章介绍了一种氰氟虫腙的中间体对三氟甲氧基苯胺基甲酰肼的合成方法。该方法以低毒的有机溶剂体系合成对三氟甲氧基苯胺基甲酰肼,含量大于96 %,收率超过95 %。具有操作简单、反应速度快、收率高、利于环境保护等特点,适宜工业化大生产。 [关键词]氰氟虫腙;中间体;对三氟甲氧基苯胺基酰肼;合成 [中图分类号] [文献标识码]A [文章编号]1007-1865(2012)12-0085-01 Synthesis of 4-trifluoro Methoxy Aniline Benzoyl Hydrazine Li Hongxia, Qi Fei, Wu Wenlei, Liu Yingxian, Luan Bo (Shandong Chambroad Holding Co., Ltd., Boxing 256500, China) Abstract: The paper described a synthetic method of 4-trifluoro methoxy aniline benzoyl hydrazine(the intermediate of metaflumizone). It synthesised 4-trifluoro methoxy aniline benzoyl hydrazine in the low toxicity of organic solvent system. The purity of the product was greater than 96 % and the yield was greater than 95 %. Having the advantages of simple operation, fast response, high yield, environmental protection and other features. It was suitable for industrialized production. Keywords: metaflumizone ;intermediate ;4-trifluoro methoxy aniline benzoyl hydrazine ;synthesis 氰氟虫腙英文名称metaflumizone ,化学名称:(E+Z)-2-[2-(4-氰基苯基)-l-[3-(三氟甲基)苯基]亚乙基]-N-[4-(三氟甲氧基)苯基]-联氨羰草酰,其纯品外观为白色固体粉末[1]。 氰氟虫腙是一个作用机制独特的缩氨基脲类杀虫剂。该药主要是通过害虫取食进入其体内发生胃毒杀死害虫,触杀作用较小,无内吸作用。该药对于各龄期的靶标害虫、幼虫都有较好的防治效果,昆虫取食后该药进入虫体,通过独特的作用机制阻断害虫神经元轴突膜上的钠离子通道,使钠离子不能通过轴突膜,进而抑制神经冲动使虫体过度放松、麻痹,几个小时后,害虫即停止取食,1~3 d 内死亡。该药物杀虫谱广,可防治鳞翅目和鞘翅目害虫。经室内毒力测定和田间药效试验,结果表明氰氟虫腙240 g/L 悬浮剂对甘蓝甜菜夜蛾和小菜蛾有较好的防治效果[2]。 对三氟甲氧基苯胺基甲酰肼,纯品外观为白色片状或粉末状固体,是合成氰氟虫腙的关键中间体,其质量及收率直接决定合 成氰氟虫腙的质量及成本。 目前,国内主要是以对三氟甲氧基苯胺基甲酸甲酯和水合肼为起始原料,水合肼为反应溶剂,反应完成后直接过滤即可制得对三氟甲氧基苯胺基甲酰肼的,该反应收率只能达到90 %,水合肼又称水合联氨,具有强碱性和吸湿性,而该方法由于选用水合肼做溶剂,具有毒性大、污染环境、收率低的缺点。 文章针对现有对三氟甲氧基苯胺基甲酰肼合成技术存在的上述不足之处,提供了用少量的水合肼做反应物,廉价的与水不互溶的有机溶剂做反应体系溶剂,相转移催化剂做催化剂,合成对三氟甲氧基苯胺基酰肼的方法。采用本工艺加快了反应速度,提高了产品质量和收率,避免了高毒的水合肼的污染,具有收率高、对环境污染小、成本低的优势。 反应方程式如下: O F 3C NHCOOC 2H 5 + H 2NNH 2H 2O O F 3C NHCNHNH 2 O 1 实验 1.1 实验仪器 250 mL 四口烧瓶,100 mL 滴液漏斗,100 mL 小烧杯,100 mL 量筒,电动搅拌搅拌器,真空泵。 1.2 实验操作 在250 mL 的四口烧瓶中,加入对三氟甲氧基苯胺基甲酸乙酯25.9 g(0.1 mol),80 wt%水合肼水溶液6.25 g(0.2 mol),三氯甲烷50 mL ,四丁基氯化铵0.8 g(0.003 mol),加热至回流后反应8 h ,液谱跟踪对三氟甲氧基苯胺基甲酸乙酯反应消失,反应结束;直接加热蒸出三氯甲烷,加入50 g 水,降温至0 ℃,保温3 h ,过滤。得产品所得产品质量23.2 g ,经检测其含量96 wt%,计算其收率为95.5 %。 2 数据分析 2.1 文章对水合肼的用量进行了优化对比,三氟甲氧基苯胺基甲 酸乙酯投料量为0.1 mol ,表1为数据结果 表1 水合肼用量对比 Tab.1 The consumption of hydrazine hydrate comparison 批号 水合肼量/mol 含量/% 收率/% 1 0.5 95.5 95 2 0. 3 96 95.1 3 0.3 95.6 94.9 4 0.2 9 5 95.2 5 0.2 96.0 95 6 0.15 93 92 7 0.15 94 91.5 2.2 对四丁基氯化铵用量进行优化,表2为数据结果。 表2 四丁基氯化铵数据对比 Tab.2 Raw material proportioning comparison 批号 四丁基氯化铵∶对三氟甲氧基苯胺含量/% 收率/% 1 0.1 96 95 2 0.06 96. 3 94.9 3 0.05 96 95.2 4 0.03 96. 5 95 5 0.03 96.3 95.1 6 0.02 94 93 7 0.01 90 89 3 结果讨论 (1)水合肼与对三氟甲氧基苯胺基甲酸乙酯的的最佳配比为2∶1。 (2)相转移催化剂与对三氟甲氧基苯胺基甲酸乙酯的的最佳 配比为0.03∶1。 4 结论 综上所述,采用低毒廉价的有机溶剂做反应溶剂,反应完成 后蒸出溶剂加水过滤,避免了高毒的水合肼的污染,有利于环境 保护,同时提高了产品质量和收率,采用本法制得的对三氟甲氧基苯胺基甲酰肼,收率95 %以上,纯度达到96 %以上。 (下转第94页) [收稿日期] 2012-05-08 [作者简介] 李洪侠(1976-),女,辽宁葫芦岛人,本科,主要研究方向为农药及中间体的合成与优化。
邻联甲苯胺 1. 化学品及企业标识 中文名:邻联甲苯胺 英文名:o-Tolidine 中文别名:邻联甲苯胺;3,3'-二甲基联苯胺;4,4'-二氨基-3,3'-二甲基联苯 英文别名:o-Tolidine;3,3'-Dimethylbenzidine;4,4'-Bianisidine 推荐用途:科研限制用途:不可作为药物或其它用途。 2. 危险性概述 2.1 GHS 危险性类别: 2.2 侵入途径:经口、经皮 2.3 健康危害:本品眼和皮肤有刺激性。易经皮肤吸收。其毒性类似苯胺,可引起高铁血红蛋白血症。无长期职业性接触致慢性影响的报道。动物喂饲本品可导致肾损害甚至肾功能衰竭。 2.4 环境危害:对水生生物有毒。 2.5 燃爆危险:可燃,其粉体与空气混合,能形成爆炸性混合物。 3. 成分/组成信息 组成信息主要成分CAS RN 含量(%) 纯品邻联甲苯胺邻联甲苯胺119-93-7 无资料 4. 急救措施 4.1 皮肤接触:立即脱去污染的衣着,用大量流动清水冲洗20~30 分钟。如有不适感,就医。 4.2 眼睛接触:立即提起眼睑,用大量流动清水或生理盐水彻底冲洗10~15 分钟。如有不适感,就医。 4.3 吸入:迅速脱离现场至空气新鲜处;保持呼吸道通畅;如呼吸困难,给输氧;呼吸心跳停止,进行心肺复苏术;就医。 4.4 食入:饮足量温水,催吐。就医。 5. 消防措施 5.1 危险特性:可燃。遇明火、高热可燃。受高热分解放出有毒的气体。 5.2 有害燃烧产物:一氧化碳, 氮氧化物 5.3 灭火方法:采用雾状水、泡沫、二氧化碳、砂土灭火。 5.4 灭火注意事项及措施:如必要的话,戴自给式呼吸器去救火。 6. 泄漏应急处理 6.1 应急处理:隔离泄漏污染区,限制出入。消除所有点火源。建议应急处理人员戴防尘口罩,穿防毒服。穿上适当的防护服前严禁接触破裂的容器和泄漏物。尽可能切断泄漏源。用塑料布覆盖泄漏物,减少飞散。勿使水进入包装容器内。用洁净的铲子收集泄漏物,置于干净、干燥、盖子较松的容器中,将容器移离泄漏区。 7. 操作处置与储存 7.1 操作注意事项:密闭操作,提供充分的局部排风。操作人员必须经过专门培训,严格遵守操作规程。建议操作人员佩戴自吸过滤式防尘口罩,戴化学安全防护眼镜,穿防毒物渗透工作服,戴橡胶手套。远离火种、热源,工作场所严禁吸烟。使用防爆型的通风系统和设备。避免产生粉尘。避免与氧化剂、酸类接触。搬运时要轻装轻卸,防止包装及容器损坏。配备相应品种和数量的消防器材及泄漏应急处理设备。倒空的容器可能残留有害物。
习题解答 第1章绪论 1.价键理论和分子轨道理论都是关于分子如何构成的理论。价键理论主要关注于σ键和π键的形成,通过研究受成键情况影响的轨道形状描述分子的形状。分子轨道理论研究电子在整个分子中的运动状况,用成键轨道、非键轨道和反键轨道来描述分子的形成。 2.u=78/12+1=6, C6H6 3.均裂,发生游离基型反应,异裂,发生离子型反应。 第2章烷烃 1.(1)3-甲基戊烷(2)3-甲基-3-乙基己烷 2. 3.(1)CH 3 C CH 2 CH 3 3 CH 3 2,2- 二甲基丁烷 (2) CH 2 CH 3 C 2 H 5 C CH CH 3 CH 3 C H 3 2, 3- 二甲基3-乙基戊烷 (3) CH CHCH 3 3 CH 2 CH CH 3 CH 3 (CH 3 ) 3 C 2,2,3,5,6-五甲基庚烷 4.(1) CH 3 C CH 3 3 CH 3 (2)CH2CH2 C H 3 CH 3 CH 2 (3) CH 2 CHCH 3 3 C H 3 (4) CH 3 C CH 3 CH 3 CH 3 5. (1) 第3章烯烃与红外光谱 1.答: (1)1-己烯(2)2-己烯(3)己烯(4)2-甲基-1-戊烯(5)3-甲基-1-戊烯(6)4-甲基-1-戊烯
(7) 2-甲基-2-戊烯 (8) 3-甲基-2-戊烯 (9) 4-甲基-2-戊烯 CH 3CHC=CH 2 CH 3 3 CH 3CCH=CH 2 CH 3 CH 3CH 3C=CCH 3 3 CH 3 CH 3CH 2C=CH 2 CH 2CH 3 (10) 2,3-二甲基-1-丁烯 (11)3,3-二甲基-1-丁烯 (12) 2,3-二甲基-2-丁烯 (13) 2-乙基-1-丁烯 其中(2)、(3)、(8)、(9)有顺反异构。 2.答:(1) (2) (3) (4) (5) (6) (7) 3.答:无顺反异构 4.答: 5.答: 1) Cl I 2) 500Cl ClOH ℃ 3) OH 4) or 5) Br 第4章 炔烃与共轭双烯 1.答: (1)2,2,5-三甲基-3-己炔 (2)1,3-己二烯-5-炔 (3)5-庚烯-1,3-二炔 (4) (5) H H (6) 2. 答: (1) H H 2Na H 322T.M (2) (3) H H 2CuCl /NH Cl Br HBr/H O (4) NH Na/乙醚H H Na H CH CH Br 2HCl
余氯测定方法余氯是指水经加氯消毒,接触一定时间后,余留在水中的氯。 余氯有三种形式: ●总余氯:包括HOCl,NH2Cl,NHCl2等。 ●化合余氯:包括NH2Cl,NHCl2及其他氯胺类化合物。 ●游离余氯:包括HOCl及OCl-等。 余氯可用邻联甲苯胺比色法、邻联甲苯胺-亚砷酸盐比色法、N,N-乙基对苯胺-硫酸亚铁胺容量法测定。下面介绍较简单方便的邻联甲苯胺比色法,可测定总余氯及游离余氯。 邻联甲苯胺比色法 一、应用范围 ●本法适用于测定生活饮用水及其水源水的总余氯及游离余氯。 ●水中含有悬浮性物质时干扰测定,可用离心法去除。干扰物质的最高允许含量如下:高 铁:0.2mg/l;四价锰:0.01mg/l;亚硝酸盐: 0.2mg/l。 ●本法最低检测浓度为0.01mg/l余氯。 二、原理 在pH值小于1.8的酸性溶液中,余氯与邻联甲苯胺反应,生成黄色的醌式化合物,用目视法进行比色定量:还可用重铬酸钾-铬酸钾溶液配制的永久性余氯标准溶液进行目视比色。 三、永久性余氯比色溶液的配制 磷酸盐缓冲贮备溶液:将无水磷酸氢二钠(Na2HPO4)和无水磷酸二氢钾(KH2PO4)置于105℃烘箱内2h,冷却后,分别称取22.86g和46.14g。将此两种试剂共溶于纯水中,并稀释至1000ml。至少静置4天,使其中胶状杂质凝聚沉淀,过滤。 磷酸盐缓冲溶液(pH6.45):吸取200.0ml磷酸盐缓冲贮备溶液,加纯水稀释至1000ml。 重铬酸钾-铬酸钾溶液:称取0.1550g干燥的重铬酸钾(K2Cr2O 7)及0.4650g铬酸钾(K2CrO4),溶于磷酸盐缓冲溶液中,并定容至1000ml。此溶液所产生的颜色相当于1mg/L余氯与邻联甲苯