
高二化学选修有机化学
复习提纲
集团标准化工作小组 [Q8QX9QT-X8QQB8Q8-NQ8QJ8-M8QMN]
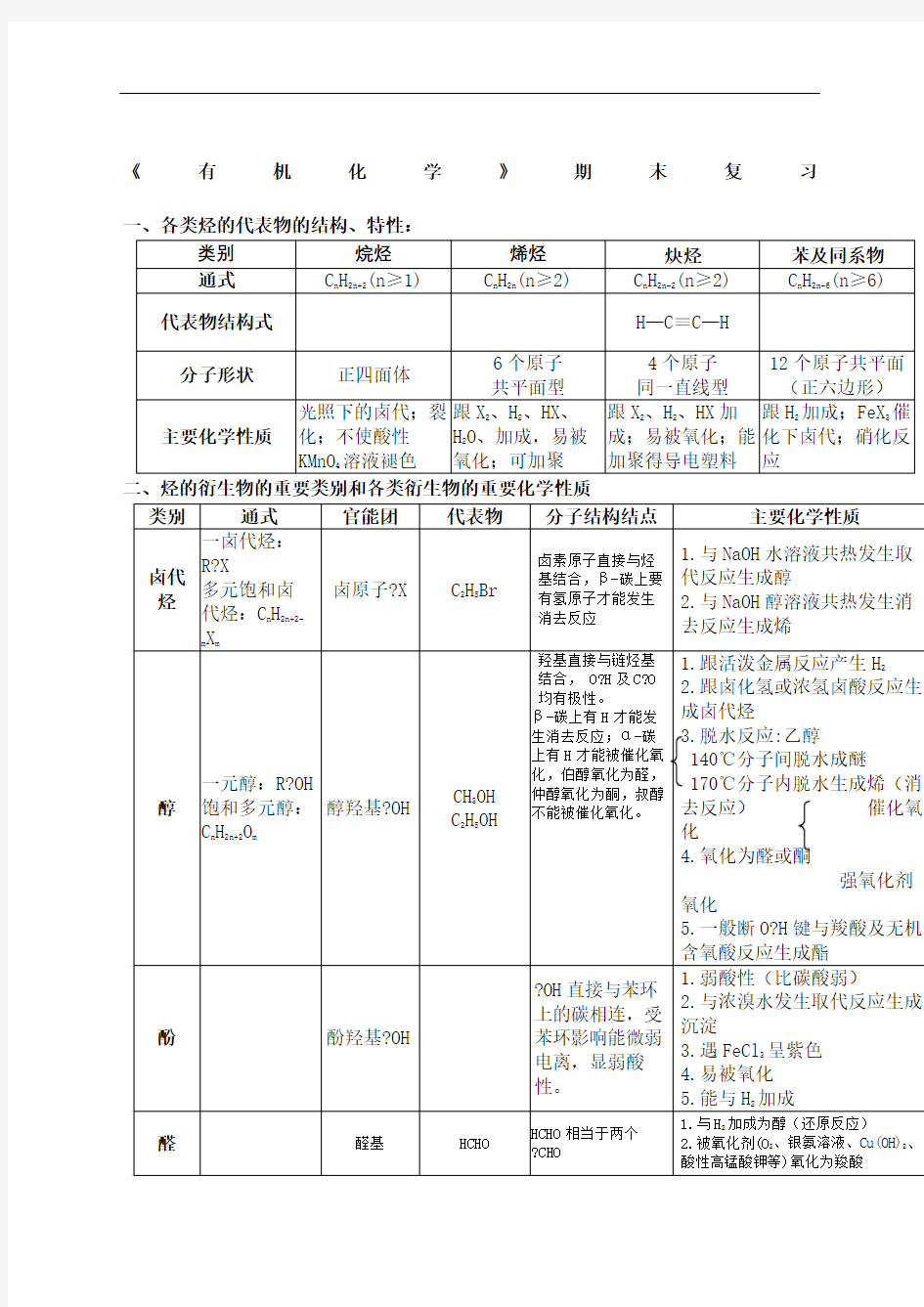
《有机化学》期末复习一、各类烃的代表物的结构、特性:
二、烃的衍生物的重要类别和各类衍生物的重要化学性质
酮羰基能加
成
与H
2
加成为醇,不能被氧化剂
氧化为羧酸
羧酸羧基受羰基影响,
O?H能电离出
H+,
受羟基影
响不能被加
成。
1.具有酸的通性
2.酯化反应时一般断羧基中的
碳氧单键,不能被H
2
加成
3.能与含?NH
2
物质缩去水生成
酰胺(肽键)
酯酯基
HCOOCH3
(Mr:60)
酯基中的碳氧
单键易断裂
1.酸性条件发生水解反应生成
羧酸和醇
2.碱性条件发生水解反应生成
羧酸盐和醇
氨基酸RCH(NH2)COOH
氨基?NH
2
羧基?COOH
H2NCH2COOH
?NH
2
能以配位
键结合
H+;?COOH能部
分电离出H+
两性化合物,能形成肽键
蛋白质结构复杂不
可用通式表
示
肽键
氨基?NH
2
羧基?COOH
酶
多肽链间有四
级结构
1.两性
2.水解
3.盐析
4.变性
5.颜色反应
6.灼烧有特殊气味
糖多数可表示
为通式:
C
n
(H
2
O)
m
羟基?OH
醛基?CHO
羰基
CH2OH(CHOH)4CHO
葡萄糖
淀粉(C
6
H
10
O
5
)
n
[C6H7O2(OH)3] n
纤维素
多羟基醛或多
羟基酮或它们
的缩合物
1.氧化反应(还原性糖)
2.加氢还原
3.酯化反应
4.多糖水解
5.葡萄糖发酵分解生成乙醇
油脂
酯基
可能有碳碳双键
酯基中的碳氧单键
易断裂;碳碳双键
能加成
1.水解反应(皂化反应)
2. 氢化反应(硬化反应)
三、重要的有机反应及类型
1.取代反应
(1) 酯化反应
(2) 水解反应
C2H5Cl+H2O C2H5OH+HCl CH3COOC2H5+H2O CH3COOH+C2H5OH (3)
(4)
(5)
2.加成反应
(烯烃与X
2、H
2
O、
HX、H
2
)3.消去反应NaOH
?
H+
浓H2SO 4 170℃乙醇?
C 2H 5OH CH 2═CH 2↑+H 2O CH 3?CH 2?CH 2Br+KOH CH 3?CH═CH 2+KBr+H 2O 4.氧化反应
(1)燃烧反应: 2C 2H 2+5O 2 4CO 2+2H 2O
(2)醇、醛的催化氧化:
2CH 3CH 2OH+O 2 2CH 3CHO+2H 2O
2CH 3CHO+O 2 (3)被弱氧化剂氧化: CH 3CHO + 2Ag(NH 3)2OH + 2Ag↓+3NH 3 + H 2O CH 3CHO + 2Cu(OH)2 + NaOH CH 3COONa + Cu 2O↓+ 3H 2O (4)被强氧化剂氧化:
烯、炔、醇、醛、酚、苯的同系物等被酸性高锰酸钾氧化 5.还原反应
(1)能与H 2加成的反应:(烯、炔、苯环、醛基、酮) 6. 聚合反应 7.中和反应 四、重要的反应
1. 能使溴水(Br 2/H 2O )褪色的物质
① 通过加成反应使之褪色:含有 、?C≡C?的不饱和化合物
② 通过取代反应使之褪色:酚类(注意:苯酚溶液遇浓溴水时,除褪色现象之外还产生白色沉淀[三溴苯酚]。)
③ 通过氧化反应使之褪色:含有-CHO (醛基)的有机物(有水参加反应) (注意:纯净的只含有—CHO (醛基)的有机物不能使溴的四氯化碳溶液褪色) 2. 能使酸性高锰酸钾溶液KMnO 4/H +褪色的物质
含有 、-C≡C -、-OH (较慢)、-CHO 的物质与苯环相连的侧链碳碳上有氢原子的苯的同系物(与苯不反应) 3.
与Na 反应的有机物: -OH 、-COOH
与NaOH 反应的有机物:酚羟基、?COOH ,加热时能与卤代烃、酯反应(取代反应) 与Na 2CO 3反应的有机物:酚羟基反应生成酚钠和NaHCO 3; -COOH 反应放出CO 2气体。 与NaHCO 3反应的有机物: ?COOH 放出CO 2气体。 4.既能与强酸,又能与强碱反应的物质: (1) Al 、Al 2O 3、Al(OH)3
(2) 弱酸的酸式盐,如NaHCO 3、NaHS 等等 (3) 弱酸弱碱盐,如CH 3COONH 4、(NH 4)2S 等等
点燃 Ag
550℃
Cu
?
(4) 氨基酸,蛋白质(有呈酸性的?COOH 和呈碱性的?NH 2,故蛋白质仍能与碱和酸反应。)
5. 银镜反应的有机物:
(1) 发生银镜反应的有机物:醛、甲酸、甲酸盐、甲酸酯、还原性糖(葡萄糖、麦芽糖等)
(2)定量关系:-CHO + 2Ag(NH 3)2OH ~2Ag HCHO + 4Ag(NH 3)2OH ~4Ag
6. 与新制Cu(OH)2悬浊液(斐林试剂)的反应 (1) 有机物:甲酸、醛、还原性糖(葡萄糖、麦芽糖) (2) 定量关系:?CHO + 2Cu(OH)2~Cu 2O
HCHO + 4Cu(OH)2~2Cu 2O
7. 能发生水解反应的有机物是:卤代烃、酯、糖类。
HX +
NaOH ══ NaX + H 2O (H)RCOOH + NaOH ══
(H)RCOONa + H 2O
或
8. 遇FeCl 3溶液显紫色的是:酚类化合物。 9. 遇I 2显蓝色的是:淀粉。
10. 遇浓硝酸显黄色的是:含苯环的天然蛋白质。 五、一些典型有机反应的比较 1.反应机理的比较
(1) 醇去氢:脱去与羟基相连接碳原子上的氢和羟基中的氢,形成
。例如: + O 2→羟基所连碳原子上没有氢原子,不能形成
,所以不
发生失氢(氧化)反应。
(2) 消去反应:脱去?X (或?OH )及相邻碳原子上的氢,形成不饱和键。例如: 与Br 相邻碳原子
上没有H ,所以不能发生消去反应。
(3) 酯化反应:羧酸分子中的羟基跟醇分子羟基中的氢原子结合成水,其余部分互相结合成酯。例如: 2.反应条件的比较
同一化合物,反应条件不同,产物不同。例如:
(1) CH 3CH 2OH CH 2=CH 2↑+H 2O (分子内脱水)
2CH 3CH 2
OH CH
3
CH 2-O-CH 2CH 3+H 2O (分子间脱水)
(2) CH 3-CH 2-CH 2Cl+NaOH CH 3CH 2CH 2OH+NaCl (取代) CH 3-CH 2-CH 2Cl+NaOH CH 3-CH=CH 2+NaCl+H 2O (消去)
(3) 一些有机物与溴反应的条件不同,产物不同。 3.有机官能团的相互影响
浓H 2
SO 4
170℃
浓H 2SO 4 140℃
H 2
O
?
乙醇
?
(1)链烃基对其他官能团的影响
①酸性 HCOOH >CH 3COOH > CH 3CH 2COOH
②甲苯的硝化反应产物是三硝基甲苯,而同样条件下的苯的硝化只能生成一硝基苯。
②烷烃和苯均不能使酸性高锰酸钾溶液褪色,而苯的同系物可使酸性高锰酸钾溶液褪色
(3)羟基对其他官能团的影响
羟基对苯环的影响——使苯环邻、对位上的氢原子更易被取代受—OH 的影响, 苯酚中苯环上的氢被取代变得更容易了 六、典型有机物间的转化关系 (1)单一官能团 (2)双官能团 (3)常见物质 (4)芳香族
七、有机物的结构 1、同系物的判断规律
(1) 一差(分子组成差若干个CH 2) (2) 两同(同通式,同结构) (3) 三注意
①必为同一类物质;
②结构相似(即有相似的原子连接方式或相同的官能团种类和数目); ③同系物间物性不同化性相似。
2、同分异构体的种类
(1) 碳链异构 (2) 位置异构 (3) 官能团异构(类别异构) 常见的类别异构
组成通式 可能的类别
典型实例
C n H 2n 烯烃、环烷烃
CH 2=CHCH 3与
C n H 2n-2 炔烃、二烯烃 CH≡C—CH 2CH 3与CH 2=CHCH=CH 2 C n H 2n+2O
饱和一元醇、醚 C 2H 5OH 与CH 3OCH 3
CnH 2n O
醛、酮、烯醇、环
醚、环醇 CH 3CH 2CHO 、CH 3COCH 3、CH=CHCH 2OH 与
C n H 2n O 2 羧酸、酯、羟基醛 CH 3COOH 、HCOOCH 3与HO —CH 3—CHO
C n H 2n-6O
酚、芳香醇、芳香醚
与 C n H 2n+1NO 2 硝基烷、氨基酸 CH 3CH 2?NO 2与H 2NCH 2?COOH C n (H 2O)m 单糖或二糖 葡萄糖与果糖(C 6H 12O 6)、蔗糖与麦芽糖(C 12H 22O 11) 3、同分异构体的书写规律
(1) 主链由长到短,支链由整到散,位置由心到边,排列邻、间、对。
(2) 按照碳链异构→位置异构→官能团异构的顺序书写,也可按官能团异构→碳链异构→位置异构
的顺序书写,不管按哪种方法书写都必须防止漏写和重写。
(3) 若遇到苯环上有三个取代基时,可先定两个的位置关系是邻或间或对,然后再对第三个取代基依次进行定位,
同时要注意哪些是与前面重复的。
(4)顺反异构的判断:
有机分子中含碳碳双键,且每个双键碳原子所连的两个基团都不相同时,就存在顺反异构现象
八、有机物的鉴别
1.有机物物理性质:
①常温下呈气态:碳原子数在四以内的烃、甲醛、一氯甲烷
②易溶于水:低碳的醇、醛、酸
③微溶于水:苯酚、苯甲酸、C
2H
5
-O-C
2
H
5
、CH
3
COOC
2
H
5
④与水分层比水轻;烃、酯(如:苯、甲苯、C
2H
5
-O-C
2
H
5
、CH
3
COOC
2
H
5
)
⑤与水分层比水重:卤代烃(溴乙烷、氯仿、四氯化碳、溴苯等)、硝基苯、液
态苯酚
⑥有芳香气味:苯、甲苯、 CH
3COOC
2
H
5
、CH
3
CH
2
OH
2. 常用的试剂及某些可鉴别物质种类和实验现象归纳如下:
有机推断中的知识归纳
有机推断的关键是确定突破口。
有机物推断的突破点。
1.从谱图中获得信息:
①红外谱图:从谱图中获得有关有机物中的化学键、官能团的信息
②核磁共振氢谱图:氢在碳架上的位置及数目(由几组峰判断几类氢原子,峰面积判断H原子数)
(1)? 遇溴的CCl
4
溶液褪色:碳碳双键、碳碳三键
(2)? 遇FeCl
3
溶液显紫色:酚羟基
(3)? 遇石蕊试液显红色:羧基
(4)? 与Na反应产生H
2
:羟基或羧基
(5)? 与Na
2CO
3
或NaHCO
3
溶液反应产生CO
2
:羧基
(6)? 与Na
2CO
3
溶液反应但无CO
2
气体放出:酚羟基
(7)发生银镜反应、新制的Cu(OH)
2
悬浊液共热产生红色沉淀:含有醛基
(9)常温下能溶解Cu(OH)
2
:含羧基
3. 从反应的特征条件突破
(1)NaOH 水溶液,发生卤代烃酯的水解反应
(2)NaOH 的醇溶液,加热,发生卤代烃的消去反应
(3)浓硫酸、加热,发生以下反应:醇消去酯化成醚硝化纤维素水解
(4)溴水或溴的CCl
4
溶液发生加成反应
(5)氢气加入催化剂(Pt或Ni),加热,发生不饱和键的加成反应
(6)稀硫酸加热,发生酯类、淀粉的水解反应
(7)氧气(Cu或Ag做催化剂)加热,或氧化铜加热,发生醇催化氧化反应
(8氧气或新制氢氧化铜悬浊液或银氨溶液,发生醛催化氧化反应
(9)KMnO
4
(H+)或[O],发生醇、甲苯被氧化为羧酸的反应
(10)光照条件下,X
2
能取代烷基上的氢
(11)FeBr
3粉作催化剂时,Br
2
能取代苯环上的氢
4.定量推断:
(1)??与X
2、HX、H
2
的反应:
取代(H ~ 1X
2
)
加成(C═C~1X
2 或 HX或H
2
;
C≡C~2X
2 2HX或2 H
2
;苯环 ~3H
2
)
(2)银镜反应:─CHO~2Ag;(注意: HCHO~4Ag)
(3)与新制的Cu(OH)
2
反应:
─CHO~2Cu(OH)
2;─COOH~1/2Cu(OH)
2
(4)与钠反应:─OH~1/2H
2
(5)与NaOH反应:
一个酚羟基~1NaOH;一个羧基~1NaOH;一个醇酯~1NaOH;
一个酚酯~2NaOH; R─X~1NaOH; C
6H
5
─X~2NaOH。
(6)与NaHCO
3:一个羧基~1CO
2
;