
第二节原子结构与元素的性质
【知识回顾】(必修2)
1. 元素周期表中的周期是指;元素周期表中的族是指
2. ,叫做元素周期律,在化学(必修2)中元素周期律主要体现在、、、等的周期性变化。
【预习导学】
写出锂、钠、钾、铷、銫基态原子的简化电子排布式和氦、氖、氩、氪、氙的电子排布
式。
锂:氦:
钠:氖:
钾:氩:
铷:氪:
銫:氙:
从中你能体会出什么来?
一、原子结构与元素周期表
1、周期系
随着元素原子的核电荷数递增,每到出现,就开始建立一个新的电子层,
随后最外层上的电子逐渐增多,最后达到8个电子,出现。然后又开始由碱金属到稀有气体,如此循环往复——这就是元素周期系中的一个个周期。可见,元素周期
系的形成是
[讨论与探究]请运用构造原理解释为什么周期系中每一周期里元素的数目并不总是一样
多(分别是多少)?
2、元素周期表的结构与原子结构的关系
请认真思考课本14~15页的6个科学探究!
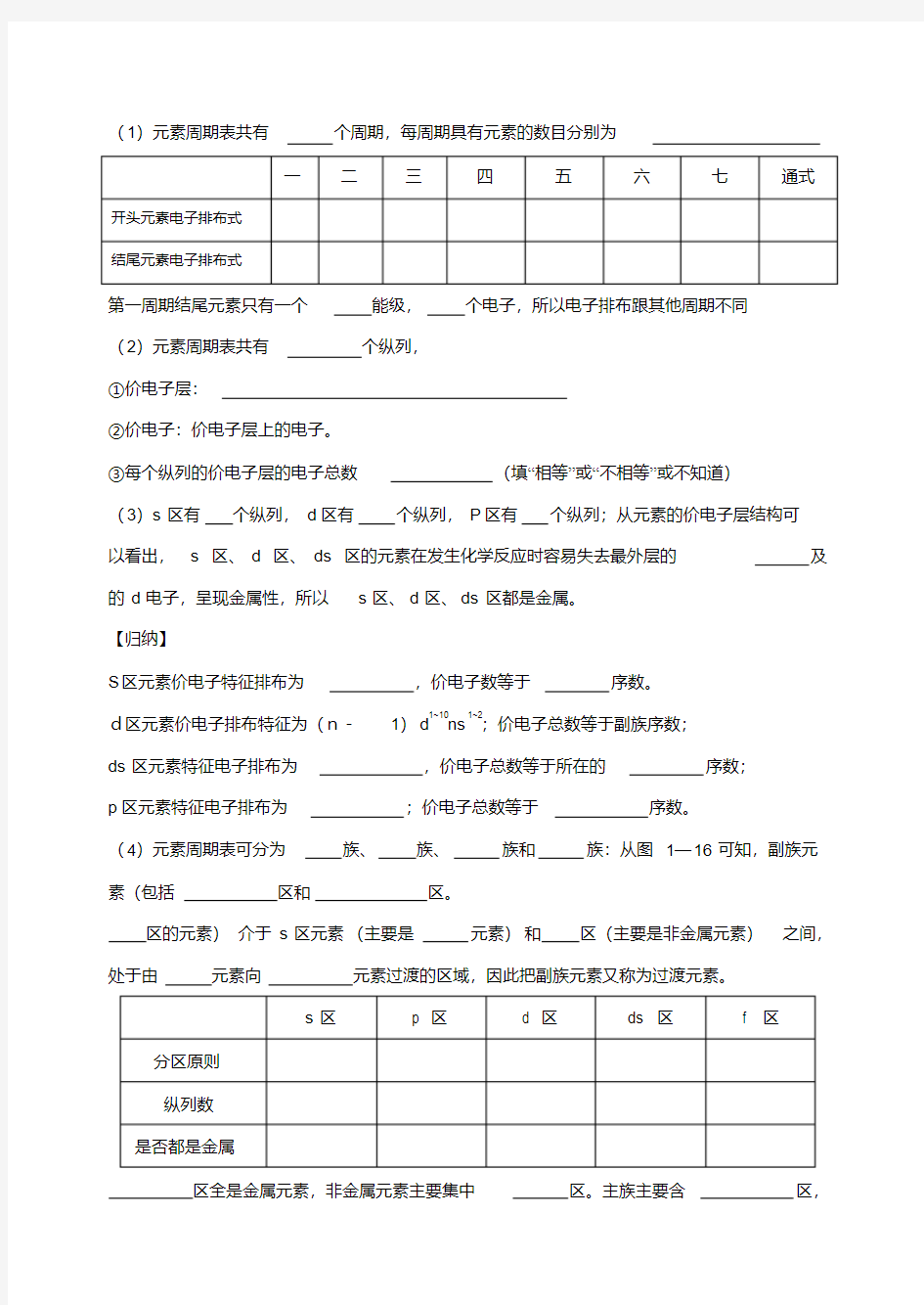
(1)元素周期表共有个周期,每周期具有元素的数目分别为
一二三四五六七通式开头元素电子排布式
结尾元素电子排布式
第一周期结尾元素只有一个能级,个电子,所以电子排布跟其他周期不同
(2)元素周期表共有个纵列,
①价电子层:
②价电子:价电子层上的电子。
③每个纵列的价电子层的电子总数(填“相等”或“不相等”或不知道)
(3)s区有个纵列,d区有个纵列,P区有个纵列;从元素的价电子层结构可
以看出,s区、d区、ds区的元素在发生化学反应时容易失去最外层的及的d电子,呈现金属性,所以s区、d区、ds区都是金属。
【归纳】
S区元素价电子特征排布为,价电子数等于序数。
d区元素价电子排布特征为(n-1)d1~10ns1~2;价电子总数等于副族序数;
ds区元素特征电子排布为,价电子总数等于所在的序数;
p区元素特征电子排布为;价电子总数等于序数。
(4)元素周期表可分为族、族、族和族:从图1—16可知,副族元素(包括区和区。
区的元素)介于s区元素(主要是元素)和区(主要是非金属元素)之间,处于由元素向元素过渡的区域,因此把副族元素又称为过渡元素。
s区p 区 d 区ds 区 f 区分区原则
纵列数
是否都是金属
区全是金属元素,非金属元素主要集中区。主族主要含区,
副族主要含区,过渡元素主要含区
(5)(为什么在元素周期表中非金属主要集中在右上角三角区内?)这是由元素的价电
子层结构和元素周期表中性质递变规律决定的,在元素周期表中,同周期元素从左到右
非金属性逐渐,逐渐减弱,同主族元素从上到下逐渐减弱,金属性逐渐,结果使元素周期表右上角三角区域的元素主要呈现出非金属性。(6)由于元素的金属性和非金属性之间并没有严格的界线,处于非金属三角区边缘的元
素既能表现出一定的非金属性,又能表现出一定的金属性,因此,这些元素常被称为半
金属或准金属。
3、元素在周期表中的位置由原子结构决定
元素在周期表中排布在哪个横行,由什么决定?元素在周期表中排在哪个列由什么决
定?
(1)原子核外决定元素所在的周期;周期数=最大数(钯除外)(2)原子的决定元素所在的族;如:29Cu 3d104s1,10+1=11尾数是1所以,是IB。
总结:元素周期表是元素原子结构以及递变规律的具体体现。
二、元素周期律
1、原子半径
(1)影响原子半径的因素有哪些?它们是如何影响半径的?我们怎样判断原子半径的大
小?
(2)元素周期表中同周期主族元素从左到右,原子半径的变化趋势如何?应如何理解这
种趋势?元素周期表中,同主族元素从上到下,原子半径的变化趋势如何?应如何理解
这种趋势?
A、同周期主族元素从左到右,原子半径逐渐。其主要原因是由于的增加使原子核对电子的引力而带来原子半径减小的趋势增加电子后电子间斥力带来的趋势。
B、同主族元素从上到下,原子半径逐渐。其主要原因是由于增加,
电子间的斥力使增大。
2、电离能
(1)什么是电离能?
A、第一电离能I1:态电性基态原子失去个电子,转化为气态基态正离子所需要的叫做第一电离能,通常叫电离能。第一电离能越大,金属活动
性越
B、如何理解第二电离能I2、第三电离能I3、I4、I5……?
同一元素的第二电离能第一电离能。
同一元素: I1 I2 I3 I4 I5……
(2)递变规律
周一周期同一族
第一电离能
(3)电离能与性质
[学与问1]、碱金属的电离能与金属活泼性有什么关系?
第一电离能越小,越易电子,金属的就越强。因此碱金属元素的越小,金属的活泼性就。
3、电负性
(1)含义:
什么是电负性?电负性的大小体现了什么性质?
键合电子:。
电负性:原子在分子中能力相对大小的量度。
[说明]:
①元素电负性的值是个相对的量,没有单位。电负性大的元素吸引电子能力强,反之就
弱。
②元素电负性的概念最先是由鲍林于1932年在研究化学键性质时提出来的。以氟的电负性为 4.0和锂的电负性为 1.0作为相对标准,然后根据化学键的键能推算其他元素的相
对电负性的数值。后人做了更精确的计算,数值有所修改
(2)变化规律:
阅读课本19页图1-22和图1-23并思考:
①同周期元素、同主族元素电负性如何变化规律?
②如何理解这些规律?
③根据电负性大小,判断氧的非金属性与氯的非金属性哪个强?
A. 金属元素越容易失电子,对键合电子的吸引能力越,电负性越小,其金属性越;非金属元素越容易得电子,对键合电子的吸引能力越,电负性越,其非金属性越强;故可以用电负性来度量金属性与非金属性的强弱。周期表从左到右,
元素的电负性逐渐变;周期表从上到下,元素的电负性逐渐变。
B. 同周期元素从左往右,电负性逐渐增,表明金属性逐渐减弱,非金属性逐渐
增。同主族元素从上往下,电负性逐渐减,表明元素的金属性逐渐减弱,非金
属性逐渐增强。
(3)电负性与性质
电负性的大小可以作为判断金属性和非金属性越的尺度:
①电负性越小,其金属性越,非金属性越强;
电负性越大,其非金属性越,金属性越强;
②金属的电负性一般小于,非金属性的电负性一般大于;位于非金属三角区边界的“类金属”的电负性则在左右,它们既有,又有。
[认真完成课本20页科学探究1]
4、“对角线“规则:
[认真完成课本20页科学探究2]
对角线规则:某些主族元素与右下方的主族元素的有些性质相似,被称为对角线原则。
请查阅电负性表给出相应的解释?
比较锂和镁在空气中燃烧的产物,铍和铝的氢氧化物的酸碱性以及硼和硅的含氧酸酸性
的强弱,说明对角线规则,并用这些元素的电负性解释对角线规则。
[解释]:锂的电负性:镁的电负性:。锂和镁在过量的氧气中燃烧,不形成过氧化物,只生成正常氧化物;
铍的电负性:铝的电负性:,两者的氢氧化物都是氢氧化物;
硼的电负性:硅的电负性:,两者的含氧酸酸性的强度很接近。
这些元素在性质上相似,可以粗略认为是它们的电负性相近的缘故。
原子结构与元素的性质
【巩固练习一】
()1.外围电子构型为4f75d16s2元素在周期表中的位置是
A 四周期ⅦB族
B 五周期ⅢB族
C 六周期ⅦB族
D 六周期ⅢB族
()2.原子序数小于18的八种连号元素,它们单质的熔
点随原子序数增大而变化的趋势如右图所示。图中X元素应属
A ⅢA族
B ⅣA族
C ⅤA族
D ⅥA族
()3.下列各组元素性质递变情况错误的是
A Li、Be、B原子最外层电子数依次增多
B P、S、Cl元素最高正化合价依次升高
C N、O、F原子半径依次增大
D Na、K、Rb的金属性依次增强
()4. 外围电子构型为4f75d16s2元素在周期表中的位置是
A、第四周期ⅦB族
B、第五周期ⅢB族
C、第六周期ⅦB族
D、第六周期ⅢB族()5. 镭是元素周期表中第七周期的ⅡA族元素。下面关于镭的性质的描述中不正
确的是
A.在化合物中呈+2价
B.单质使水分解.放出氢气
C.氢氧化物呈两性
D. 碳酸盐难溶于水
()6. 根据所学的电子排布规律及周期表判断,同周期的ⅡA和ⅢA之间的原子序数差不可能是
A.1
B.11
C.25
D.8
() 7. R元素的原子,其最外层的p能级电子数等于所有的能层s能级电子总数,则R是
A. Li
B.Be
C. S
D. Ar
8.下列元素是主族元素还是副族元素?第几周期?第几族?
(1)1s2 2s 2 2p6 3s 2 3p5
(2)[Ar]3d10 4s1
9.由下列元素在周期表中的位置,给出其原子的价电子层构型
(1)第四周期第ⅥB族
(2)第六周期第ⅡA族
10. 已知某元素的原子序数是25,写出该元素原子的电子排布式和电子排布图,并指出该元素的名称、符号以及所属的周期和族。
11. 已知某元素在周期表中位于第五周期、ⅥA族。试写出该元素的基态原子的电子排布式、元素名称、符号和原子序数。
12.完成下表空白处
原子序数电子排布式在周期表中的
位置
是金属
还是非
金属
最高价氧化物的水化
物化学式及酸碱性
气态氢化物
的化学式
15
1s22s22p63s23p4
第二周期VA族
【巩固练习二】
()1.下列元素中哪一个基态原子的第一电离能最大?
A Be
B B
C C
D N
( )2.在下面的电子结构中,第一电离能最小的原子可能是
A ns2np3
B ns2np5
C ns2np4
D ns2np6
()3.下列各组微粒按半径逐渐增大,还原性逐渐增强的顺序排列的是
A Na、K、Rb
B F、Cl、Br
C Mg2+、Al2+、Zn2+
D Cl-、Br-、I-()4.除去气态原子中的一个电子使之成为气态+1价阳离子时所
需外界提供的能量叫做该元素的第一电离能。图是周期表中短周期的
一部分,其中第一电离能最小的元素是:
( )5.元素周期表第二周期Li到Ne原子的电离势总的趋势是怎样变化的
A 从大变小
B 从小变大
C 从Li到N逐渐增加,从N到Ne逐渐下降
D 没有多大变化
( ) 6.下列第三周期元素的离子中,半径最大的是
A Na+
B Al3+
C S2-
D Cl-
()7.下列说法正确的是
A.第3周期所含的元素中钠的第一电离能最小
B.铝的第一电离能比镁的第一电离能大
C.在所有元素中,氟的电离能最大
D.钾的第一电离能比镁的第一电离能大
8. 原子半径的大小取决于二个相反因素:一是,另一个因素是。
9.不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如图所示,试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题。
(1)同主族内不同元素的E值的变化特点是。各主族中E值的这种变化特点体现了元素性质的变化规律。
(2)同周期内,随原子序数的增大,E值增大。但个别元素的E值出现反常现象,试预测下列关系中正确的是(填写编号)。
①E(砷)>E(硒)②E(砷)<E(硒)
③E(溴)>E(硒)④E(溴)>E(硒)
(3)估计1mol气态Ca原子失去最外层一个电子所需能量E值的范围:<E <。
(4)10号元素E值较大的原因是
10.设想你去外星球做了一次科学考察,采集了该星球上十种元素单质的样品,为了确
定这些元素的相对位置以便系统地进行研究,你设计了一些实验并得到了下列结果:
单质 A B C D E F G H I J
熔点/℃-150 550 160 210 -50 370 450 300 260 250 与水反应√√√√
与酸反应√√√√√√与氧气反应√√√√√√√√不发生化学反
√√
应
对于A元素
1.0 8.0 15.6 17.1 23.8 31.8 20.0 29.6 3.918.0 的原子质量
按照元素性质的周期性递变规律,试确定以上十种元素的相对位置,并填入下表:
A
B
H
【巩固练习三】
()1. 电负性的大小也可以作为判断金属性和非金属性强弱的尺度下列关于电负性
的变化规律正确的是
A.周期表从左到右,元素的电负性逐渐变大
B.周期表从上到下,元素的电负性逐渐变大
C.电负性越大,金属性越强
D.电负性越小,非金属性越强
( )2. 已知X、Y元素同周期,且电负性X>Y,下列说法错误的是
A.X与Y形成化合物是,X可以显负价,Y显正价
B.第一电离能可能Y小于X
C.最高价含氧酸的酸性:X对应的酸性弱于于Y对应的
D.气态氢化物的稳定性:HmY小于HmX
()3. 根据对角线规则,下列物质的性质具有相似性的是
A.硼和硅
B.铝和铁
C.铍和铝
D.铜和金
()4. x、y为两种元素的原子,x的阴离子与y的阳离子具有相同的电子层结构,由此可知
A.x的原子半径大于y的原子半径 B.x的电负性大于y的电负性
C.x的氧化性大于y的氧化性 D.x的第一电离能大于y 的第一电离能()5. 元素电负性随原子序数的递增而增强的是
A.Na > K > Rb B.N > P > As C.O > S > Cl D.Si > P > Cl ()6. 对Na、Mg、Al的有关性质的叙述正确的是
A.碱性:NaOH B.第一电离能:Na C.电负性:Na>Mg>Al D.还原性:Na>Mg>Al ()7. X和Y是原子序数大于4的短周期元素,X m+和Y n-两种离子的核外电子排布相同,下列说法正确的是 A.X的原子半径比Y小 B.X和Y的核电核数之差为m-n C.电负性X>Y D.第一电离能X ()8.下列有关电负性的说法中正确的是 A.主族元素的电负性越大,元素原子的第一电离能一定越大。 B.在元素周期表中,元素电负性从左到右越来越大 C.金属元素电负性一定小于非金属元素电负性。 D.在形成化合物时,电负性越小的元素越容易显示正价 ()9. 下列各元素原子排列中,其电负性减小顺序正确的是 A、K>Na>Li B、F>O>S C 、As>P>N D、 C>N>O 10. 美国化学家鲍林(L.Pauling)首先提出了电负性的概念。电负性也是元素的一种重要性 质,电负性越大,其原子吸引电子的能力越强,在所形成的分子中成为带负电荷的一方。 下表给出的是原子序数小于20的16种元素的电负性数值: 元素H Li Be B C N O F 电负性 2.1 1.0 1.5 2.0 2.5 3.0 3.5 4.0 元素Na Mg Al Si P S Cl K 电负性0.9 1.2 1.5 1.8 2.1 2.5 3.0 0.8 请仔细分析,试回答下列问题: (1)根据表中所给数据分析推测: 同主族的不同元素的电负性变化的规律是:________; 同周期中,电负性与原子半径的关系为:________。 (2)预测周期表中电负性最大的元素应为________(填元素符号);估计钙元素的电负性的取 值范围:______ (3)预测周期表中,电负性最小的元素位小第________周期________族(放射性元素除外),其基态原子核外电子排布式可表示为______________________。 【定时训练】 一、选择题(个别题最多两个正确答案可选,4分/题,计32分) ()1.下列说法中,正确的是 A.在周期表里,主族元素所在的族序数等于原子核外电子数 B.在周期表里,元素所在的周期数等于原子核外电子层数 C.最外层电子数为8的粒子都是稀有气体元素的原子 D.元素的原子序数越大,其原子半径也越大 ()2.X、Y、Z是3种短周期元素,其中X、Y位于同一族,Y、Z处于同一周期。X 原子的最外层电子数是其电子层数的3倍。Z原子的核外电子数比Y原子少1。下列说法正确的是 A.元素非金属性由弱到强的顺序为Z B.Y元素最高价氧化物对应水化物的化学式可表示为H3YO4 C.3种元素的气态氢化物中,Z的气态氢化物最稳定 D.原子半径由大到小的顺序为Z>Y>X ()3.下列各组元素性质递变情况错误的是 A.Li、Be、B原子最外层电子数依次增多 B.P、S、Cl元素最高正化合价依次升高 C.B、C、N、O、F原子半径依次增大 D.Li、Na、K、Rb原子半径依次增大 ()4.国际无机化学命名委员会将长式元素周期表原先的主、副族及族序序号取消,从 左往右改为第18列,碱金属为第1列,稀有气体为第18列。按这个规定,下列说法不. 正确 ..的是 A.只有第2列元素的原子最外层有2个电子 B.第14列元素形成的化合物种类最多 C.第3列元素种类最多 D.第16、17列元素都是非金属元素 ()5.R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的 是(m、n均为正整数) A.若R(OH)n为强碱,则W(OH)(n+1)也为强碱 B.若H n XO m为强酸,则Y是活泼非金属元素 C.若Y的最低化合价为-2,则Z的最高正化合价为+ 6 D.若X的最高正化合价为+5,则五种元素都是非金属元素 ()6.13C—NMR(核磁共振)、15N—NMR可用于测定蛋白质、核酸等生物大分子的空间 结构,Kurt Wuithrich等人为此获得2002年诺贝尔化学奖。下面有关13C、15N的叙述中 正确的是 A.13C与15N有相同的中子数 B.13C电子排布式为1s22s22p3 C.15N与14N互为同位素 D.15N的电子排布式为1s22s22p4 ()7.已知短周期元素的离子a A2+、b B+、c C3-、d D-都具有相同的电子层结构,则下列 叙述中正确的是 A.原子半径:A>B>D>C B.原子序数:d>c>b>a C.离子半径:C>D>B>A D.元素的第一电离能:A>B>D>C ()8.下列说法中错误的是 A.所有的非金属元素都分布在p区 B.p区元素周期表中ⅢB族到ⅡB族10个纵行的元素都是金属元素 C.除氦以外的稀有气体原子的最外层电子数都是8 D.同一元素的各种同位素的化学性质一定相同 二、填空题(共计68分) 9.(10分)在下列空格中,填上适当的元素符号: (1)在第三周期中,第一电离能最小的元素是__ ___,第一电离能最大的元素是。 (2)在元素周期表中,电负性最大的元素是,电负性最小的元素是_______。(3)最活泼的金属元素是______________。 (4)最活泼的气态非金属原子是_________。 (5)第二、三、四周期原子中p轨道半充满的元素是__________________。 (6)电负性相差最大的两种元素是____________。 10.(9分)今有A、B、C、D四种元素,已知A元素是地壳中含量最多的元素;B元素为金属元素,它的原子核外K、L层电子数之和等于M、N层电子数之和;C元素的单质及其化合物的焰色反应都显黄色;氢气在D元素单质中燃烧呈苍白色。 (1)试推断并写出A、B、C、D四种元素的名称和符号。 A B C D (2)写出上述元素两两化合成的化合物的化学式。(5分) 11.(24分)有A、B、C、D、E五种元素,它们可能是原子或离子,且为短周期元素, A与B可形成BA型化合物,且A元素是非金属性最强的元素,金属B的原子核内质子数比它前一周期同主族元素原子的质子数多8个;C元素有三种同位素C1、C2、C3,自然界里含量最多的是C1,C3原子的质量数是C1的3倍,C2原子的质量数是C1的2倍。D的气态氢化物水溶液显碱性,而其最高价氧化物水化物为强酸,E元素原子的最外层电 子数比次外层电子数多4个。 (1)写出各元素的名称:A_______,B______,C________,D______,E_______。(2)A、B、C、D、E五种元素各基态原子的电子排布式和电子排布图 (3)写出C1、C2、C3粒子的符号:__________、_______________、________。 (4)写出E粒子的结构示意图和电子排布图 ________________________________________________________________________, E的氢化物的分子式______________。 (5)写出A的单质、B的单质分别与水反应的化学方程式 ________________________________________________________________________、 ________________________________________________________________________, 将反应后生成的溶液混合,发生反应的离子方程式为: ___________________________________________________。 12.(8分)X、Y、Z是ⅠA~ⅦA族的三种非金属元素,它们在周 期表中的位置如右图所示。试回答: (1)X元素单质的化学式是__________。 (2)Y元素的原子结构示意图是________________,Y与Na所形成化合物的电子式为 ________________。 (3)Z元素的名称是__________,从元素原子得失电子的角度看,Z元素具有________性;若从Z元素在周期表中所处位置看,它具有这种性质的原因是 ________________________________________________________________________, 其外围电子排布式为__________________。 13.(9分)A、B、C、D为原子序数小于18的四种元素: ①A原子的电子层数等于最外层电子数; ②A与B处于同一周期,B与D可形成离子化合物D2B,该化合物的水溶液显碱性; ③C的离子核内质子数与核外电子数之和为18; ④A、C、D三种元素的离子具有相同的电子层排布。 推断A~D各为何种元素,并填空: (1)A________,B__________,C________,D________。 (2)各原子形成简单离子的电子排布式 _________________、________________、_________________、________________。(3)四种元素离子半径的大小顺序为________________。 14.(8分)在周期表中,同一主族元素化学性质相似。目前也发现有些元素的化学性质 和它在周期表中左上方或右下方的另一主族元素性质相似,这称为对角线规则。据此请 回答: (1)锂在空气中燃烧,除生成_____外,也生成微量的______。 (2)铍的最高价氧化物对应的水化物的化学式是 ________________________________________________________________________, 属两性化合物,证明这一结论的有关离子方程式为 _______________________________________________________________________ ____ ____________ ___________________________________________________。(1)若已知反应Be2C+4H2O===2Be(OH)2+CH4↑,则Al4C3遇强碱溶液反应的离子方程 式为________________________________________________________________________。 (2)科学家证实,BeCl2属共价化合物,设计一个简单实验证明,其方法是 ________________________________________________________________________。 用电子式表示BeCl2的形成过程: ________________________________________________________________________。【学习反思】总结典型题的解题方法和规律;反思自己在课堂上的表现明确改进措施。 北京市第一中级人民法院 民事判决书 (2011)一中民终字第5969号上诉人(原审原告)北京北大方正电子有限公司,住所地北京市海淀区上地五街9号方正大厦。 法定代表人刘晓昆,董事长。 委托代理人陶鑫良,北京市大成律师事务所律师。 委托代理人潘娟娟,北京市大成律师事务所律师。 被上诉人(原审被告)广州宝洁有限公司,住所地广东省广州市经济技术开发区滨河路一号。 法定代表人施文圣(Shannan Stevenson),大中华区总裁。 委托代理人周林,男,1958年9月22日出生,中国社会科学研究院知识产权研究中心研究员,住北京市海淀区阜成路南5号。 委托代理人张玉瑞,北京市科华律师事务所律师。 被上诉人(原审被告)北京家乐福商业有限公司,住所地北京市丰台区方庄芳城园二区15号。 法定代表人孟卫东,董事长。 委托代理人牛琨,北京市天睿律师事务所律师。 委托代理人万迎军,北京市天睿律师事务所律师。 上诉人北京北大方正电子有限公司(简称方正公司)因与被上诉人广州宝洁有限公司(简称宝洁公司)、北京家乐福商业有限公司(简称家乐福公司)侵犯著作权纠纷一案,不服北京市海淀区人民法院(简称原审法院)作出的(2008)海民初字第27047号民事判决(简称原审判决),于法定期限内向本院提起诉讼。本院于2011年3月10日受理后,依法组成合议庭,并于2011年4月1日公开开庭进行了审理。上诉人方 正公司的委托代理人陶鑫良、潘娟娟,被上诉人宝洁公司的委托代理人周林、张玉瑞,被上诉人家乐福公司的委托代理人牛琨到庭参加诉讼。本案现已审理终结。 方正公司原审诉称:我公司是我国最早从事字库开发的专业厂家,长期致力于多种文字字库字体的研究开发,现已成为全球最大的中文字库产品供应商。方正中文字库中的汉字,字体结构优美、造型独特、字形丰富、品质精良。1998年9月,我公司与字体设计师齐立签订协议,约定我公司独家取得齐立创作的倩体字稿的著作权。后依据齐立的设计风格,经过大量的创造性劳动,完成了倩体字体的数字化和字库化转换,命名为方正倩体系列字库字体。该字体具有幽雅、柔美和华丽的特点,如少女婷婷玉立的倩影,故命名为倩体。2000年8月31日,该字库字体首次发表,后申请了著作权登记。倩体字库字体在创造过程中凝聚了我公司技术人员大量的 创造性劳动,其中每个汉字均是基于独特的笔画、构造、顺序而创造,属于著作权法保护的美术作品,我公司对该字库字体和其中的每个单字均享有著作权。后我公司发现宝洁公司未经许可,在其生产的多款产品的包装、标识、商标和广告中使用了我公司多种独创字体。本次诉讼仅针对其使用的倩体“飘柔”二字,涉及24款产品的使用。宝洁公司的行为侵犯了我公司倩体字库和单字的美术作品著作权,具体涉及署名权,复制权,发行权和展览权,其在主观上存在过错。家乐福公司销售使用侵权字体的产品,亦应承担侵权责任。据此,请求判令宝洁公司停止使用并销毁所有带有倩体“飘柔”二字的包装、标识、商标和广告宣传产品,赔偿经济损失50万元,承担诉讼合理支出119 082元(包括鉴定费3万元,律师费8万元,公证费2000元,产品购买费用1982元,翻译费5100元);家乐福公司停止销售上述侵权产品;二被告公开致歉、消除影响。 第二节原子结构与元素的性质 【知识回顾】(必修2) 1. 元素周期表中的周期是指;元素周期表中的族是指 2. ,叫做元素周期律,在化学(必修2)中元素周期律主要体现在、、、等的周期性变化。 【预习导学】 写出锂、钠、钾、铷、銫基态原子的简化电子排布式和氦、氖、氩、氪、氙的电子排布 式。 锂:氦: 钠:氖: 钾:氩: 铷:氪: 銫:氙: 从中你能体会出什么来? 一、原子结构与元素周期表 1、周期系 随着元素原子的核电荷数递增,每到出现,就开始建立一个新的电子层, 随后最外层上的电子逐渐增多,最后达到8个电子,出现。然后又开始由碱金属到稀有气体,如此循环往复——这就是元素周期系中的一个个周期。可见,元素周期 系的形成是 [讨论与探究]请运用构造原理解释为什么周期系中每一周期里元素的数目并不总是一样 多(分别是多少)? 2、元素周期表的结构与原子结构的关系 请认真思考课本14~15页的6个科学探究! (1)元素周期表共有个周期,每周期具有元素的数目分别为 一二三四五六七通式开头元素电子排布式 结尾元素电子排布式 第一周期结尾元素只有一个能级,个电子,所以电子排布跟其他周期不同 (2)元素周期表共有个纵列, ①价电子层: ②价电子:价电子层上的电子。 ③每个纵列的价电子层的电子总数(填“相等”或“不相等”或不知道) (3)s区有个纵列,d区有个纵列,P区有个纵列;从元素的价电子层结构可 以看出,s区、d区、ds区的元素在发生化学反应时容易失去最外层的及的d电子,呈现金属性,所以s区、d区、ds区都是金属。 【归纳】 S区元素价电子特征排布为,价电子数等于序数。 d区元素价电子排布特征为(n-1)d1~10ns1~2;价电子总数等于副族序数; ds区元素特征电子排布为,价电子总数等于所在的序数; p区元素特征电子排布为;价电子总数等于序数。 (4)元素周期表可分为族、族、族和族:从图1—16可知,副族元素(包括区和区。 区的元素)介于s区元素(主要是元素)和区(主要是非金属元素)之间,处于由元素向元素过渡的区域,因此把副族元素又称为过渡元素。 s区p 区 d 区ds 区 f 区分区原则 纵列数 是否都是金属 区全是金属元素,非金属元素主要集中区。主族主要含区, 姓名: _ __ _ 班级: 主备人:刘南审核: 刘晓华学案序号: _____ 课题内容Book 1 Module4 Revision of the language points 学习目标1、通过复习掌握高考中的重点单词,短语及句式结构。 2、实现知识的复现,培养学生归纳总结及独立分析问题的能力。 使用要求1、书写要认真规范;2、教师讲解时,务必用另一颜色的笔修正答案。 复习篇 【学法指导】请同学们根据课文及单词表完成习题。 Fill in the blanks with proper words. 1.___________ adv.很;相当 2.______________ vt.打扰 3._____________ vt.停车 4.___________ vt. 买的起 5.______________ vt.雇佣 6._____________ vi 死里逃生;幸存 7. _______________ 上升8.______________许多;大量9._____________ 摆脱 预习篇 Part1. Keywords and phrases 1._____________ adj.有生气的 2._____________vi.听起来 3.______________ vt.接近 4._____________ adj. 幸运的 5._____________修建 Part2. Sentences 1.自从我们上次见面以来已经6年了。 ______________________________________________________________________ 2.这是我第一次参观你的家乡。 解析篇 【学法指导】请同学们根据课文及笔记翻译句子并完成相应的习题。 ①lively(adj.)_______________ 1.中国是一个生机勃勃的国家.____________________________________________________________________________ 2.我们班主任是一名既美丽又充满活力的女士. _____________________________________________________________ (思考题) What other adjectives ending with –ly can you think of? (其它的以- ly结尾的形容词) _______________________________________________________________________________________________________ ②fortunate (adj.)___________ 反义词(adj.)____________ _____________ (adv.)幸运地反义词(adv.)_____________ ____________ (n. ) 运气, 财富, 1. We are fortunate in living in such a big city. 3. He dreamed of making a fortune. 2. He is/feels very fortunate to have a lovely son. (归纳总结)____________________________________________________________________________________________ ③Sound n._____________; v._____________ 1. We heard strange sounds in the distance. 3. That sounds a good idea. 2. The bell sounded for the end of the class. (归纳总结) ___________________________________________________________________________________________ 宝清二高高三英语导学案 鲁科版高中化学选修3 《物质结构与性质》教案 第一章物质结构与性质教案 第二节原子结构与元素周期表 一、学习目标 1理解能量最低原则、泡利不相容原理和洪特规则,学会原子核外电子排布式写法。知道元素周期表中元素按周期划分的原因,族的划分与原子中价电子数目和价电子排布的密切关系。 2、了解原子半径的周期性变化,能用原子结构的知识解释主族元素,原子半径周期性变化的原因。 3、明确原子结构的量子力学模型的建立使元素周期表的建立有了理论依据。 二、学习重点、难点 能量最低原则、泡利不相容原理和洪特规则、了解核外电子排布与元素周期表的周期,族划分的关系。 三、学习过程: 第一课时 (一)基态原子的核外电子排布 [探索新知](1—18号) 画出1—18号元素的原子结构示意图 a.以H为例 电子排布式轨道表示式 结论: b. 以He为例 电子排布式轨道表示式 结论: c. 以C 为例 电子排布式轨道表示式 结论: [活动探究](1—18号) 书写下列基态原子核外电子排布式和轨道表示式(书写、对照、纠错、探因) N 、 O、 Ne 、 Al、 Mg 、 Si 、 [学无止境](19—36号) a.书写基态原子核外电子排布式(书写、对照、纠错、探因) Sc Fe 结论: b.再书写基态原子核外电子排布式(书写、对照、纠错、探因) Cr Cu 结论: 练习:V、As 第2、3课时 (二)核外电子排布与元素周期表 1.核外电子排布与周期的划分。 [看图·思考] 仔细观察图1-2-7鲍林近似能级图回答下面问题: 鲍林近似能级图中分为几个能级组?每一能级组中共有多少个原子轨道,最多能容纳多少个电子? [交流·研讨] 请根据1-36号元素原子的电子排布,参照鲍林近似能级图,尝试分析原子中电子排布与元素周期表中周期划分的内在联系,回答下题。 (1)周期的划分与什么有关? (2)每一周期(前4周期)各容纳几种元素?这又与什么有关? (3)周期的序数与什么有关?(从原子中电子排布式分析)[同步检测1] 已知某元素原子的核外电子排布式为:1s22s22p63s23p63d34s2,根据这一排布式可知该元素所在的周期是_______________________。 2.核外电子排布与族的划分。 [练习]书写19号钾原子,24号铬原子,30号锌原子和35号溴原子的价电子排布。 [共同分析]主族元素原子的价电子排布与过渡元素原子的价电子排布有什么区别? [观察讨论]仔细观察元素周期表中各族元素价电子排布,从中找出核外电子排布与族划分之间的内在联系,回答下列问题。 目录 上海一中院劳动争议案件中竞业限制纠纷审判情况通报 …………………3-15 上海一中院劳动争议案件中竞业限制纠纷典型案例 …………………15-29 劳动争议案件中竞业限制纠纷审判情况通报 人才是核心竞争优势。上海全面建成具有全球影响力的科技创新中心,成为与我国经济科技实力和综合国力相匹配的全球创新城市,需要把人才作为创新的第一资源。不仅要充分发挥企业家在推进创新和成果产业化中的重要作用,而且要打通人才便捷流动、优化配置的通道。而人才流动,必然涉及企业商业秘密等利益保护,反映到劳动争议案件中,则需要在审理竞业限制纠纷中,在社会、企业和个人三者发展之间做好利益平衡。 上海市第一中级人民法院(以下简称上海一中院)在竞业限制纠纷案件审理中,妥善处理保护商业秘密与自由择业、竞业限制与人才合理流动的关系,促进形成更加公平、有序的市场竞争秩序,助力优化营商环境。为此,上海一中院对2015年1月至2018年3月期间审理的竞业限制纠纷案件进行梳理分析,并选取了五件具有代表性的案件予以发布。 一、近三年竞业限制纠纷案件数据分析 2015年1月至2018年3月,上海一中院共受理劳动争议二审案件8390件,审结劳动争议二审案件8416件。其中,受理竞业限制纠纷案件48件,审结竞业限制纠纷案件47件。从结果上看,维持原判36件,占76.60%;调解6件,撤诉4件,改判1件。 1 、案件数呈上升趋势 2015年审结竞业限制纠纷案件12件,2016年为10件,2017年则上升至19件;2018年1至3月已审结竞业限制纠纷案件6件,明显呈现上升趋势。 2 、集中于高新技术产业和服务业领域 在已审结的竞业限制纠纷案件中,涉软件和信息技术服务业案件 3 元素推断题的主要类型与解题方法 解答原子结构、元素在元素周期表中的位置、元素及其化合物的性质间的推断试题的思路一般可用下面的框线关系表示: 推断题大体有下列三种类型: 1.已知元素原子或离子的核外电子排布推断性质。方法为 要注意一些元素原子电子排布的特殊性(短周期元素)。 (1)族序数等于周期数的元素:H、Be、Al。 (2)族序数等于周期数两倍的元素:C、S。 (3)族序数等于周期数3倍的元素:O。 (4)周期数是族序数两倍的元素:Li。 (5)周期数是族序数3倍的元素:Na。 2.已知元素的特殊性质推断其在周期表中的位置: 以下是元素具有的特殊性质: (1)最高正价与最低负价代数和为零的短周期元素:C、Si。 (2)最高正价是最低负价绝对值3倍的短周期元素:S。 (3)除H外,原子半径最小的元素:F。 (4)最高正化合价不等于族序数的元素:O、F。 (5)第一电离能最大的元素(稀有气体除外):F;第一电离能最小的元素:Cs(放射性元素除外)。 (6)电负性最小的元素:Cs(0.7);电负性最大的元素:F(4.0)。 3.已知元素的单质或化合物的性质、用途、存在的特殊性推断元素的结构。 有些单质或化合物的性质、用途、存在等具有特殊性,可作为推断元素的依据: (1)地壳中含量最多的元素或通常氢化物呈液态的元素:O。 (2)空气中含量最多的元素或气态氢化物水溶液呈碱性的元素:N。 (3)所形成化合物种类最多的元素或有单质是自然界中硬度最大的物质的元素:C。 (4)地壳中含量最多的金属元素或常见氧化物、氢氧化物呈两性的元素:Al。 (5)最活泼的非金属元素或气态氢化物(无氧酸)可腐蚀玻璃或氢化物最稳定的元素:F。 (6)最活泼的金属元素或最高价氧化物对应水化物碱性最强的元素:Cs。 (7)焰色反应呈黄色、紫色的元素:Na、K。 (8)最轻的单质元素:H;最轻的金属元素:Li。 (9)元素的气态氢化物和它的最高价氧化物对应水化物能够化合的元素:N;能起氧化还原反应的元素:S。 (10)单质在常温下能与水反应放出气体的短周期元素:Li、Na、F。 (11)单质易溶于CS2的元素:P、S。 (12)单质常温下呈液态的元素:Br、Hg。 4.核外电子数相同的微粒相互推断 (1)与稀有气体原子电子层结构相同的离子 ①与He原子电子层结构相同的离子有H-、Li+、Be2+; ②与Ne原子电子层结构相同的离子有F-、O2-、N3-、Na+、Mg2+、Al3+; ③与Ar原子电子层结构相同的离子有Cl-、S2-、P3-、K+、Ca2+。 (2)核外电子总数为10的粒子 ①阳离子:Na+、Mg2+、Al3+、NH+4、H3O+;②阴离子:N3-、O2-、F-、NH-2、OH-;③分子:Ne、HF、H2O、NH3、CH4。 (3)核外电子总数为18的粒子 ①阳离子:K+、Ca2+;②阴离子:P3-、S2-、HS-、Cl-; ③分子:Ar、HCl、H2S、F2、H2O2、PH3、SiH4、C2H6、CH3OH、N2H4。 (4)核外电子总数及质子总数均相同的粒子 ①Na+、NH+4、H3O+;②F-、OH-、NH-2;③Cl-、HS-;④N2、CO、C2H2。 【典例6】元素A、B、C都是短周期元素,它们的原子序数大小为A 三河一中2012届高考仿真模拟试卷 英 语本试卷分第选择题和第卷 (非选择题) 两部分: 答第一卷前, 2. 选出每小题答案后,用铅笔把答题卡上对题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。在本试卷上无效。听下面5段对话。每段对话后有一个小题,从题中所给的A、B、C三个选项中选出最佳选项,并标在试卷的相应位置。听完每段对话后,你都有10秒钟的时间来回有关小题和阅读下一小题。每段对话仅读一遍。 A. In a hospital. B. In a restaurant. C. In a classroom. 2. When will the man be able to visit Mr. Black? A. On November 1st. B. On November 2nd C. On November 3rd. 3. What do we know from the man’s answer? A. He doesn’t like either. B. Brown is his favorite color. C. He likes both the two shirts. 4. What does the man plan to do this afternoon? A. Go to a movie. B. Go to his classes. C. Go to buy something. 5. What can we learn about Tom from the conversation? A. He has got a fever. B. He has been practicing running for quite a long time. C. He has no idea where to see a doctor. 第二节 (共15小题;每小题1.5分,满分22.5分) 听下面5段对话或独白。每段对话或独白后有几个小题,从题中所给的A、B、C三个选项中选出最佳选项,并标在试卷的相应位置。听每段对话或独白前,你将有时间阅读各个小题,每小题5秒钟;听完后,各个小题将给出5秒钟的作答时间。每段对话或独白读两遍。 听第6段材料,回答第6至8题。 6. How does the woman feel about waiting? A. It’s fun. B. It’s boring. C. It’s a waste of time. 7. What goes wrong with the man? A. He forgets taking his ID card. B. He can’t remember his social security number. C. He isn’t taking his records with him. 8. What are the two speakers doing? A. Waiting for registration. B. Waiting for a presentation. C. Waiting for a class. 听第7段材料,回答第9至11题。 9. Why does the woman have a sore throat? A. Because she had too many peppers. B. Because she was infected by virus. C. Because she had a bad cold. 10. What will the woman do according to the doctor’s advice? A. Take some medicine. B. Stay in hospital for a couple of days. C. Take an X-ray for her stomach. 11. What doesn’t the doctor suggest to the woman’s sleeplessness? A. Drinking a cup of milk before sleep. B. Washing feet with hot water. C. Taking some sleeping-pills. 听第8段材料,回答第12至14题。 12. Why is the man so upset about his grade? A. Because it took him weeks to finish the project. B. Because the woman doesn’t understand his problem. C. Because Ames got a better grade with less work. 13. What does the woman suggest the man do at first? 正德中学高三英语导学案 M1 U1 reading 一、重点单词二、重点短语 1、_________vt.出席,参加1、______________________________注意 2、_________vt.获得;赚,挣得2、______________________(书的)封底 3、_________n.&vt.尊敬,敬重3、________________________一代又一代 4、_________vt.赢得,取得;实现,成就4、________________________平均 5、_________n.学分;成绩;等级5、_______________________过去常常做 6、_________n.文学6、_______________________逐字地 7、_________adj.一般的,普通的;平均的7、________________________首先 8、_________adj.具有挑战性的8、_____________________介绍……给…… 9、_________adj.额外的,外加的10、_________vt.&vi.准备11、_________vt.放弃12、_________vt.思念,想念13、_________vt.经历,体验14、_________vt.介绍 三、Language points: 1. Going to a British high school for one year was a very enjoyable and exciting experience for me. ●本句是主谓表结构(SVC),句中going to a British high school for one year是动名词短语,作主语。动名词 短语的作用相当于一个名词,在句中常作主语、宾语或表语。例如: Reading French is easier than speaking it. ●句中exciting是现在分词,相当于形容词,作定语,修饰experience. 注意:英语中有一类及物动词,在词尾加-ing或-ed后,相当一个形容词,但意义不同。-ing表示“令人……”,主语通常是物,-ed表示“感到……”,主语通常是人或与人在关的表情、动作。这类动词常见的有:interest; surprise; encourage; inspire; frighten; excite; tire; bore; move; please; satisfy等。 1)He hasn’t got ______________________for the job. 他没有足够的经验做这项工作。 2)Yesterday afternoon Frank Hawkins was telling me about his _________ as a young man. 他年轻时的经历。 2. attend vt. 出席,参加,上(学),到场 attend school/class/ church上学/课/去教堂attend a meeting / lecture / wedding / party 参加仪式/会议 同义词辨析:attend侧重参加或出席会议或学术活动等。join普通用词,指加入党派、团体或游戏活动等。participate正式用词,特指参加团体活动,暗示以一个积极的角色参加。take part in侧重参加某项群众性、集体性的事业、工作或活动,突出参加者在其中发挥一定的作用。 attend to 注意倾听, 专心干,照料,处理attend (on/upon) sb. 伺候/照顾某人 3. The way to do sth. = the way of doing sth. 4. 区别:earn , gain , win 1) He has________ a lot of money by working part-time job.他通过做兼职,已经挣了好多钱。 2) She ______ enough experience while working for the newspaper.她在为那家报社工作期间取得了足够的经验。 5. respect 1尊敬,尊重,敬意 have respect for show respect for/ to尊敬/敬重 respect sb for sth 因……而尊敬某人respect oneself 自重in some/all/few/respects在一些/所有/极少方面 7. challenge 1)He challenged me to play another tennis game. 他向我挑战要我跟他再打一场网球。 2)The present world is full of challenges as well as opportunities. 当今社会充满了机遇与挑战。 I usually went to the Computer Club at lunchtime, so I could e-mail my family and friends back home for free. 8. prepare 9. drop drop in / by顺便拜访drop in on sb.造访某人drop in at a place造访某地drop sb. a line 写封短信 四、阅读理解 Culture shock isn’t a medical condition. It’s only a common way to describe the confusing a nd nervous feelings a person may have after leaving a familiar culture to live in a new and different one. When you move to a new place, you have to face a lot of changes. That can be exciting, but it can also be overwhelming. You may feel sad and want to go home. It’s natural to have difficulty adjusting to a new culture. People from other cultures may have grown up with values and beliefs that differ from yours. Because of these differences,the things they talk about, the ways they express themselves, and the importance of various ideas may be very different from what you are used to. But the good news is that culture shock is temporary. What causes culture shock? To understand culture shock helps to understand what culture is. You may know that genes determine a big part of how you look and act. What you might not know is that your environment has a big effect on your appearance and behavior as well. Your environment is’t just the air you breathe and the food you eat, though; a big part of your environment is culture.Culture is made up of the common things that members of a community learn from family, friends, media, 物质结构与性质 第一章原子结构与性质 第一节原子结构 第二节原子结构与元素的性质 归纳与整理复习题 第二章分子结构与性质 第一节共价键 第二节分子的立体结构 第三节分子的性质 归纳与整理复习题 第三章晶体结构与性质 第一节晶体的常识 第二节分子晶体与原子晶体 第三节金属晶体 第四节离子晶体 归纳与整理复习题 (人教版)高中化学选修3 《物质结构与性质》全部教学案 第一章原子结构与性质 教材分析: 一、本章教学目标 1.了解原子结构的构造原理,知道原子核外电子的能级分布,能用电子排布式表示常见元素(1~36号)原子核外电子的排布。 2.了解能量最低原理,知道基态与激发态,知道原子核外电子在一定条件下会发生跃迁产生原子光谱。 3.了解原子核外电子的运动状态,知道电子云和原子轨道。 4.认识原子结构与元素周期系的关系,了解元素周期系的应用价值。 5.能说出元素电离能、电负性的涵义,能应用元素的电离能说明元素的某些性质。 6.从科学家探索物质构成奥秘的史实中体会科学探究的过程和方法,在抽象思维、理论分析的过程中逐步形成科学的价值观。 本章知识分析: 本章是在学生已有原子结构知识的基础上,进一步深入地研究原子的结构,从构造原理和能量最低原理介绍了原子的核外电子排布以及原子光谱等,并图文并茂地描述了电子云和原子轨道;在原子结构知识的基础上,介绍了元素周期系、元素周期表及元素周期律。总之,本章按照课程标准要求比较系统而深入地介绍了原子结构与元素的性质,为后续章节内容的学习奠定基础。尽管本章内容比较抽象,是学习难点,但作为本书的第一章,教科书从内容和形式上都比较注意激发和保持学生的学习兴趣,重视培养学生的科学素养,有利于增强学生学习化学的兴趣。 通过本章的学习,学生能够比较系统地掌握原子结构的知识,在原子水平上认识物质构成的规律,并能运用原子结构知识解释一些化学现象。 注意本章不能挖得很深,属于略微展开。 《物质结构与性质》说理题归纳 1、氮原子间能形成氮氮叁键,而砷原子间不易形成叁键的原因是砷原子半径较大,原子间形成的σ键较长,p-p轨道肩并肩重叠程度较小或几乎不能重叠,难以形成π键。 AsH3分子为三角锥形,键角为91.80°,小于氨分子键角107°,AsH3分子键角较小的原因是 砷原子电负性小于氮原子,其共用电子对离砷核距离较远,斥力较小,键角较小。 2、乙酸的沸点明显高于乙醛,其主要原因是CH3COOH存在分子间氢键 3、在乙醇中的溶解度H2O大于H2S水分子与乙醇间能形成分子间氢键。 4、硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是:C—C 键和C—H键较强,所形成的烷烃稳定,而硅烷中Si—Si键和Si—H键的键能较低,易断裂,导致长链硅烷难以生成 5、SO3的三聚体环状结构如图1所示,此氧化物的分子式应为________,该结构中S—O键 长有a、b两类,b的键长大于a的键长的原因: 形成b键的氧原子与两个S原子结合,作用力较小(相当于一心两用) 6、碳元素可形成多种结构和性质不同的单质,其中金刚石的熔点为3550 ℃,C60的熔点约为280 ℃,导致这种差异的原因:金刚石是原子晶体,C60是分子晶体,前者原子间是靠强烈的共价键结合的,后者分子间是靠微弱的范德华力结合在一起的 7、Mn2+的稳定性强于Mn3+,其原因是:Mn2+的3d能级为半充满状态而Mn3+不是 8、已知常温下,H2CrO4的K1=4.1、K2=1×10-5,从结构的角度上看,K2< 高三英语导学案 时态专项 第一步:导入 真题试做P236 第二步:概述 动词的时态:谓语动作发生的时间和完成程度或状态 四种时间点和四种状态交错搭配,构成英语的16种时态: 第三步:考点突破 考点一:一般现在时与一般过去时 一般现在时 构成:________________________ 1)表示习惯性、经常性的动作,常与表示频度的时间状语连用,如usually, often, always, sometimes, every day, once a week 等。 On Monday morning, it usually takes me an hour to drive to work. 2)表示客观事实、真理、格言或警句等。 One apple a day keeps the doctor away. 3)表示按照时间表、计划安排好的或者规定发生的动作。go, come, leave, start, stop, arrive, begin, return, open, close 。 The train leaves at nine every day. 4)在时间、条件等状语从句中常用一般现在时代替一般将来时。 Your parents will stand by you even if you don ’t succeed. 5)在here 、there 开头的倒装句中,一般现在时表示正在发生的动作或存在的状态。 Here comes the teacher. 练习 1 If you ________, please give me a phone call.(arrive ) 2 I learned that the earth ________(go) around the sun when I was in Primary School. 3 Here ________ (come) the bus. 一般过去时 构成:________________________ 1)表示过去某个时间发生的动作或存在的状态,常与yesterday, last year, the other day 等连用,也可以表示习惯性动作。 At that time ,he worked as a teacher to support his family. 2)在时间、条件、让步状语从句中,若主句用了过去将来时,从句常用一般过去时表示过去将来的意义。 He said he would tell her about the news as soon as he met her. 3) 有的句子,虽然没有明确的过去的时间状语,但实际上指的是过去发生的动作或状态,也用一般过去时。think ,expect ,know ,want 。 Edward, you play so well. But I didn ’t know you played the piano. 练习 1(2017北京)------_________(do) you call that company to see how they think of our product yesterday? ------Yes, they are happy with it. 2 Last year, I always _______(get) up late, and never __________ (have) enough time for breakfast. 一般现在时与一般过去时练习 1 I jumped out of bed, opened the door and __________(step) outside the room. It was full of thick smoke. 2 The punishment for academic dishonesty in the West ___________ (be)usually very serious. 3 I gave him fifty pence yesterday and advised him to save it. Instead he _______ (buy) himself fifty pence worth of trouble. 4 Everybody knows you shouldn ’t put children ’s beds under a window in case a child ________(try) to climb out. 5 He __________(write) a postcard and sent it to his lovely sister Nell in January, 1916. 考点二: 现在进行时、过去进行时和将来进行时 现在进行时 构成:________________________ 1) 表示说话时正在进行或发生的动作,也可表示当前一段时间内的活动或现阶段正在进行的动 第一部分是1、2段,主要是交代苏武出使的原因、背景和使团的主要成员。第二部分是3-8段,主要写苏武被匈奴扣留胡地十九年的动人事迹。 第三部分是9、10段,苏武返回汉朝的过程。 2、课文主体部分主要写了哪几件事?请简要概括。 主要写了苏武自杀,卫律劝降,苏武北海牧羊,李陵劝降等事件。 三、文言积累 熟读课文1—2段,完成下列题目。 (一)指出下列划线词的古义和今义。 1、稍迁至栘中厩监古义:渐渐;今义:稍微,些许 2、汉亦留之以相当古义:抵押。今义:正在(某时某地) 3、汉天子我丈人行也古义:老人,长辈。今义:岳父。 4、假吏常惠等募士斥候百余人俱古义:临时充任;今义:虚假 5、既至匈奴,置币遗单于币,古义:财物、礼物;今义:货币 遗,古义:送给;今义:丢失、落下 6、张胜许之,以货物与常古义:一般财物。今义:供出售的物品 7、会缑王与长水虞常等谋反匈奴中古义:正当、适逢;今义:聚会 (二)解释下列各句子中的“以”字的意义与用法。 1、少以父任(介词,因为) 3、张胜许之,以货物与常。(介词,把) 2、汉亦留之以相当(连词,来) (三)翻译下列句子。 1、武帝嘉其义,乃遣武以中郎将使持节送匈奴使留在汉者。 汉武帝赞许他这种合乎情理的做法,就派苏武以中郎将的身份,持节旄出使匈奴,送被扣押在汉的匈奴使者回国。 熟读课文4—8段,完成下列题目。 (一)找出下列各句中的通假字并解释之。 1、且单于信女女,通“汝”,你 2、不顾恩义,畔主背亲畔:通“叛”,背叛。 3、与旃毛并咽之旃:通“毡”,毛织品。 4、掘野鼠去草实而食之去:通“弆(jǔ)”,收藏。 5、空自苦亡人之地亡:通“无”,没有。 6、信义安所见乎见:通“现”,显现。 7、因泣下霑衿,与武决去霑:通“沾”,沾湿;衿:通“襟”,衣襟。 决:通“诀”,诀别。 (二)翻译下列划线的字,并指出其活用的类型。 1、单于壮其节壮:形容词的意动用法,以……为壮。 2、诚甘乐之乐:形容词的意动用法,以……为乐。 3、欲因此时降武降:使动用法,使……投降。 4、空以身膏草野膏:使动用法,使……肥沃。 5、反欲斗两主斗:使动用法,使……争斗。 6、何久自苦如此苦:使动用法,使……受苦。 7、天雨雪雨:名词做动词,下。 8、羝乳乃得归乳:名词做动词,生子。 9、杖汉节牧羊杖:名词做动词,拄着。北京一中院方正诉宝洁字体侵权纠纷案二审判决书
三河一中高三物质结构系列导学案(二)《原子结构与元素的性质》
高三英语导学案
鲁科版高中化学选修三《物质结构与性质》全教案
2018年上海一中院竞业限制纠纷案件审判白皮书
高中化学选修3物质结构与性质步步高全套学案课件第一章 重难点专题突破 3
河北省三河一中2012届高三高考仿真模拟试卷英语试题.pdf
正德中学高三英语导学案
(完整word版)人教版高中化学选修3物质结构与性质教案
2019届高考化学一轮复习物质结构与性质说理题归纳学案
高三英语导学案 时态专项正版
广东省江门市第一中学语文人教版必修四导学案:第12课《苏武传》