
流式细胞周期结果图解读(附图详解
流式检测细胞周期操作步骤
1. 细胞培养:
取对数生长期的细胞,按1×106cells/ mL以1mL接种24孔板或2mL接种于6孔板内,进行所需的处理(比如加入药物),特定时间后终止培养,进行下一步的实验。
2. 细胞固定:
800rpm离心5min,收集细胞沉淀,弃上清,用预冷PBS洗涤两次,加入预冷75%乙醇,于4℃固定4h以上。
3. 细胞染色:
1500rpm离心5min,弃上清,以3mL的PBS洗涤一次,加入400uL溴化乙锭(PI,50ug/mL),100ul RNase A(100ug/mL ),4℃避光孵育30min。
4. 流式分析:
以标准程序用流式细胞仪检测,一般计数2~3万个细胞,结果用细胞周期拟和软件ModFit分析。
注:上机前要以50um尼龙网膜或35um细胞过滤器过滤细胞!因为PI具有很强的粘附性,容易使细胞聚团!
流式细胞周期结果图解读
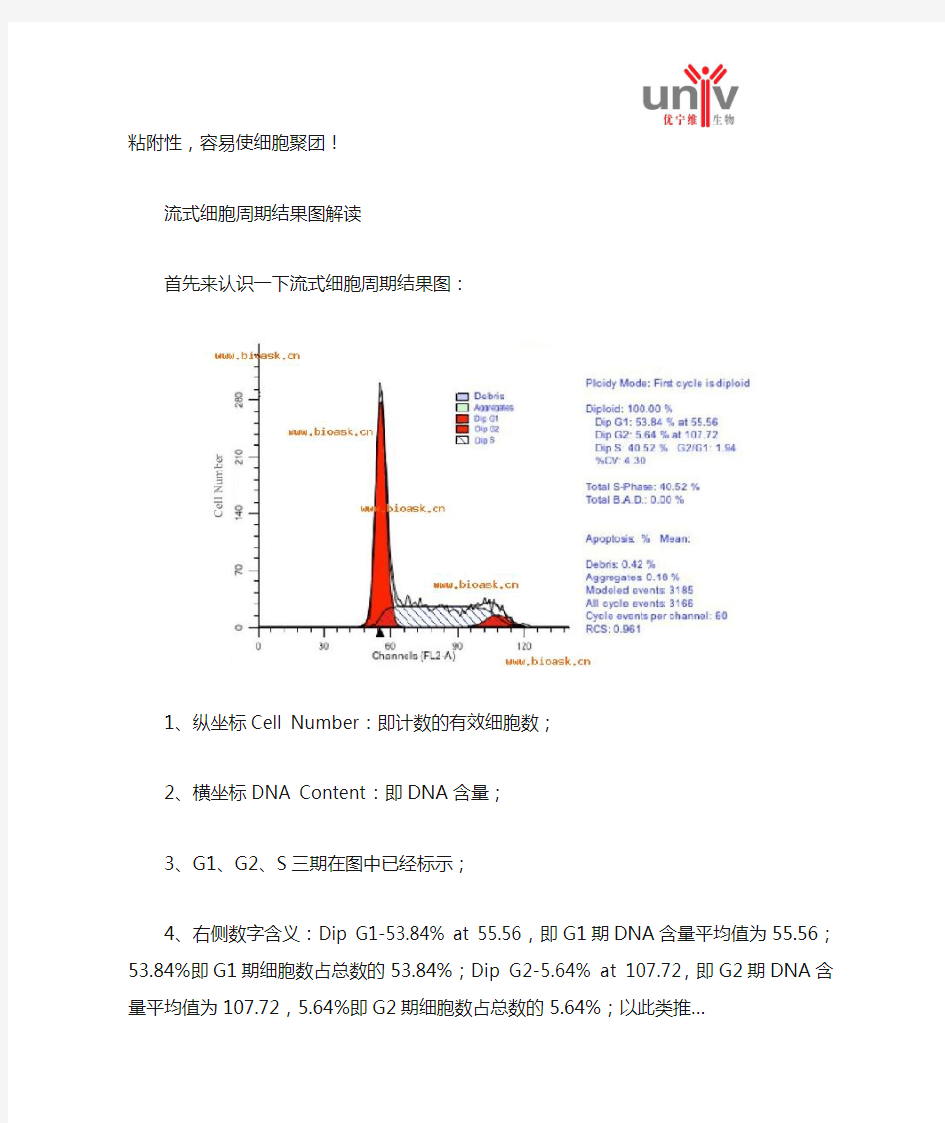
首先来认识一下流式细胞周期结果图:
1、纵坐标Cell Number:即计数的有效细胞数;
2、横坐标DNA Content:即DNA含量;
3、G1、G2、S三期在图中已经标示;
4、右侧数字含义:Dip G1-53.84% at 55.56,即G1期DNA含量平均值为55.56;53.84%即G1期细胞数占总数的53.84%;Dip G2-5.64% at 107.72,即G2期DNA含量平均值为107.72,5.64%即G2期细胞数占总数的5.64%;以此类推…
流式细胞周期结果图的意义,主要从细胞周期的角度看各参数的意义:
1、细胞周期指由细胞分裂结束到下一次细胞分裂结束所经历的过程,所需的时间叫细胞周期时间。
可分为四个阶段:
①G1期(gap1),指从有丝分裂完成到期DNA复制之前的间隙时间;
②S期(synthesis phase),指DNA复制的时期;
③G2期(gap2),指DNA复制完成到有丝分裂开始之前的一段时间;
④M期又称D期(mitosis or division),细胞分裂开始到结束。
2、从增殖的角度来看,可将高等动物的细胞分为三类:
①连续分裂细胞,在细胞周期中连续运转因而又称为周期细胞,如表皮生发层细胞、部分骨髓细胞。
②休眠细胞暂不分裂,但在适当的刺激下可重新进入细胞周期,称G0期细胞,如淋巴细胞、肝、肾细胞等。
③不分裂细胞,指不可逆地脱离细胞周期,不再分裂的细胞,又称终端细胞,如神经、肌肉、多形核细胞等等。
细胞周期的时间长短与物种的细胞类型有关,如:小鼠十二指肠上皮细胞的周期为10小时,人类胃上皮细胞24小时,骨髓细胞18小时,培养的人成纤维细胞18小时,CHO细胞14小时,HeLa细胞21小时。不同类型细胞的G1长短不同,是造成细胞周期差异的主要原因。
3、流式细胞结果图各参数的意义:
常用的流式细胞术分析细胞周期的方法是依据细胞DNA含量(横坐标)来分析的:G1期:DNA复制还没开始,也是DNA含量最少的,即流式检测结果图的第一个峰;
S期:DNA开始复制,到完成复制,是一个一倍DNA到二倍DNA的过程,在流式结果图中显示期跨度特别大(第二个不高但很宽的峰);
G2期:DNA复制完成至分裂的一段时间,此时细胞内含二倍DNA,在流式结果图中的第三个峰;
M期:细胞分裂过程,此时细胞内也是二倍DNA,用DNA含量的方法是无法与G2期分开,所以有第三峰明显升高时报告:G2/M期阻滞。
流式细胞仪检测技术与质量 控制 -标准化文件发布号:(9456-EUATWK-MWUB-WUNN-INNUL-DDQTY-KII
流式细胞仪检测技术与质量控制 【摘要】流式细胞术(FCM)检测HLA等位基因是最近新建立的方法,与原有的分型技术相比,技术上有很大的改进和突破。流式细胞术已广泛用于临床常规检验中,为保证检验结果的可靠性,提高准确度和室间结果的可比性,流式细胞术质量控制越来越受到重视。它在功能水平上对单细胞或其他生物粒子进行定量分析和分选,同传统的荧光镜检查相比,具有速度快、精密度高、准确性好等特点。 【关键词】流式细胞术;检测技术;质量控制 流式细胞仪检验技术(FCM),即流式细胞术,是以流式细胞仪作为检测手段,以免疫荧光技术作为主要标记方法的一门先进的分析技术。该方法用免疫磁珠作为载体,在同一微孔内进行反应,利用流式细胞仪检测杂交信号和区分探针的种类。本技术使用的免疫磁珠具有一定的特性,磁珠可利用颜色进行标识[1]。当免疫磁珠上两种颜色混合的比例不同时,经流式细胞仪检测后即可区分定义为不同种类的免疫磁珠,目前两种颜色的组合在流式细胞仪上最多可区分成为100种不同的免疫磁珠。
1 材料与方法 1.1 标本收集 收集近3年本院治疗的30例患者,对30例患者行流式细胞仪检测,30例受检者中,男性患者16例,女性患者14例,最大年龄60岁,最小年龄17岁,患者平均年龄39岁。 2 检测方法 2.1 采用特定的免疫磁珠作为载体,将已知序列特异性探针(SSO)固定在免疫磁珠上,每一种特异性探针固定在已知颜色比例的免疫磁珠上。由于免疫磁珠上颜色比例的不同,在流式细胞仪红色激光束下可进行区分,根据事先设计的标记情况,通过流式细胞仪检测后可确认特定颜色比例免疫磁珠上携带的特异性探针的种类,从而达到将探针区分的目的。 2.2利用标记的特异性引物对目的DNA进行扩增,将PCR扩增产物与免疫磁珠上的序列特异性探针(SSO)在同一孔内进行特异性杂交,再加入荧光显色剂,然后利用流式细胞仪绿色激光束检测杂交信号,红色激光束区分探针的种类,利用软件分析杂交结果得出样本HLA基因型别。 3 方法学评价该方法与PCR-SSO有相似的地方,但是技术上有重大的突破。本方法灵敏度非常高,在
流式细胞术详解 一. 流式细胞术概述 流式细胞术(Flow Cytometry, FCM)是七十年代发展起来的高科学技术 ,它集计算机技术、激光技术、流体力学、细胞化学、细胞免疫学于一体, 同时具有分析和分选细胞功能。它不仅可测量细胞大小、内部颗粒的性状,还可检测细胞表面和细胞浆抗原、细胞内DNA、RNA含量等,可对群体细胞在单细胞水平上进行分析, 在短时间内检测分析大量细胞,并收集、储存和处理数据,进行多参数定量分析; 能够分类收集(分选)某一亚群细胞,分选纯度>95%。在血液学、免疫学、肿瘤学、药物学、分子生物学等学科广泛应用。 国内使用的流式细胞仪主要由美国的两个厂家生产:BECKMAN- COULTER公司和Becton-Dickinson公司(简称B-D公司)。流式细胞仪主要有两型:临床型(又称小型机、台式机)和综合型(又称大型机、分析型)。BECKMAN-COULTER公司最新产品为EPICS ALTRA和EPICS XL/XL-MCL, B- D公司最新产品为FACS Vantage和FACS Calibur。EPICS XL/XL-MCL和FACS Calibur是临床型;EPICS ALTRA和 FACS Vantage是综合型,除具备检测分析功能外,还具有细胞分选功能 ,多用于科学研究。 二.流式细胞仪主要技术指标 1.流式细胞仪的分析速度: 一般流式细胞仪每秒检测1000~ 5000个细胞,大型机可达每秒上万个细胞。 2.流式细胞仪的荧光检测灵敏度:一般能测出单个细胞上<600个荧光分子,两个细胞间的荧光差>5%即可区分。 3.前向角散射(FSC)光检测灵敏度:前向角散射(FSC)反映被测细胞的大小,一般流式细胞仪能够测量到0.2μm~0.5μm。 4.流式细胞仪的分辨率:通常用变异系数CV值来表示,,一般流式细胞仪能够达到<2.0%,这也是测量标本前用荧光微球调整仪器时要求必须达到的。 5.流式细胞仪的分选速度:一般流式细胞仪分选速度>1000个/秒,分选细胞纯度可达99%以上。 三.流式细胞仪主要构造和工作原理 流动室及液流驱动系统 流式细胞仪主要由以下五部分构成:①流动室及液流驱动系统②激光光源及光束形成系统③光学系统④信 号检测与存储、显示、分析系统⑤细胞分选系统。 流动室(Flow Cell或Flow Chamber)是流式细胞仪的核心部件,流动室由石英玻璃制成,单细胞悬液在细胞流动室里被鞘流液包绕通过流动室内的一定孔径的孔,检测区在该孔的中心,细胞在此与激光垂直相交,在鞘流液约束下细胞成单行排列依次通过激光检测区。流动室里的鞘液流是一种稳定流动,控制鞘液流的装置是在流体力学理论的指导下由一系列压力系统、压力感受器组成,只要调整好鞘液压力和标本管压力, 鞘液流包绕样品流并使样品流保持在液流的轴线方向,能够保证每个细胞通过激光照射区的时间相等,从而使激光激发的荧光信息准确无误。见图12.1流动室示意图。流动室孔径有60μm、100μm、150μm 、250μm等多种,供研究者选择。小型仪器一般固定装置了一定孔径的流动室。 图12.1流动室示意图(采自Coulter Training Guide) 四. 流式细胞仪主要构造和工作原理 激光光源及光束形成系统
流式细胞仪数据分析 5.1 数据采集及显示 光信号转换成电压脉冲后,再通过模数转换器转换成为计算机能够储存处理的数字信号。流式细胞仪的数据以FSC标准格式存储,该标准由“分析细胞学协会”制定。 根据FSC标准,数据存储格式应包括三个文件:样本获取文件,数据设置文件和数据分析结果。4参数(FSC,SSC,FITC和PE)的单细胞分析会生成8位数据。当单个样品累计 收集到10000个细胞时,FCS数据文件为80kB。 数据采集存储完毕后,细胞亚群可以几种不同格式显示。单参数如FSC或FITC(FL1)可使用直方图,横轴表示荧光通道。纵轴表示在该通道内收集到的细胞数量(如图5-1)。 处在同一通道的每一细胞均符合该通道的信号值,而且具有相同的信号密度。通道右侧信号的荧光强度明显高于左侧,越靠右侧荧光亮度越强。图5-1 流式数据分析图双参数可在二维散点图中同时显示,X轴显示通道1(FL1),Y轴显示通道2(FL2)。3维图通过X,Y,Z三个轴分别显示每个通道的细胞量(如图5-1)。 习题:数据采集及显示 1 在直方图中横轴和纵轴分别表示。 2 二维点图用于显示参数。 3 在CellQuest软件中3维图中Z轴代表。
5.2 设门 通过设门的方法可以定义细胞亚群的区域。如:血样本是混合细胞群,如果想单独分析淋巴球细胞,可根据FSC或细胞大小,在FSC,SSC的散点图中设门,其数据结果只反映淋巴细胞亚群的荧光特性。图5-2 全血样本中淋巴细胞亚群的数据分析图 习题:设门 1 设门的方法通常用于分析样本内的指定细胞。(对错) 5.3 细胞亚群的数据分析 数据分析包括从点图中的list-mode文件中显示数据,然后统计点图中的细胞分布情况。如前所述,分别有几种形式的点图用于显示数据,而且可通过设门的方法区分指定的细胞亚群。如图5-3所示,在淋巴细胞亚群周围设门,以单独分析或分选该亚群细胞。
查看文章 流式细胞仪-细胞凋亡检测Ⅰ 2008-11-01 10:20 一PI单染色法 基本原理 其原理主要是根据细胞凋亡时在细胞、亚细胞和分子水平上所发生的特征性改变。这些改变包括细胞核的改变、细胞器的改变、细胞膜成分的改变和细胞形态的改变等,其中细胞核的改变最具特征性,主要包括以下几个方面: 1. 细胞核的改变:由于凋亡细胞核的改变,造成各种染色体荧光染料对凋亡细胞DNA可染性发生改变。研究表明,用各种染色体荧光染料对经固定的凋亡细胞进行染色,其DNA可染性降低。许多学者把这种DNA可染性的降低认为是凋亡细胞的标志之一。 2. 光散射特性:凋亡细胞形态上的改变影响它们的光散射特性。在流式细胞仪上,前散射光与细胞的大小有关,而侧散射光反映的是光在细胞内的折射作用,与细胞内的颗粒多少有关。在细胞凋亡时,细胞固缩,体积变小,故前散射光降低,这一特性往往被认为是凋亡细胞的特点之一。此外细胞凋亡时由于染色体降解,核破裂形成,细胞内颗粒往往增多,故凋亡细胞侧散射光常增加。细胞坏死时,由于细胞肿胀,其前散射光增大;侧散射光在细胞坏死时也增大,因此可根据前散射光和侧散射光区别凋亡细胞和坏死细胞。但需要注意的是,根据前散射光和侧散射光判断凋亡细胞的可靠性受被检测细胞形态上的均一性和核胞浆比率影响很大。因此在某些淋巴细胞凋亡中,用光散射特性检测凋亡的可靠性较好,而在肿瘤细胞凋亡中,其可靠性就较差。根据光散射特性检测凋亡细胞最主要的优点是可以将光散射特性与细胞的表面免疫荧光分析结合起来,用以区别经这些特殊处理发生选择性凋亡的淋巴细胞亚型。也可用于活细胞的分类。 试剂与仪器 l PBS溶液(配制方法见附录); l PI染液:将PI溶于PBS(pH7.4)中,终浓度为100ug/ml。用棕色瓶4℃避光保存。 l 70%乙醇 l 400目筛网 l 流式细胞仪 实验步骤 1. 收集细胞{数目约(1~ 5)×106个/mL},500 ~ 1000 r/min离心5min,弃去
流式细胞仪分析技术及应用 第一节概述 一、工作原理 二、散射光的测定 三、荧光测量 四、细胞分选原理 第二节数据的显示与分析 一、参数 二、数据显示方式 三、设门分析技术 第三节流式细胞仪技术要求 一、检测样品制备 二、常用的荧光染料与标记染色 三、胶乳颗粒的应用 四、流式细胞技术的质量控制第四节流式细胞仪技术的要求 第五节、流式细胞仪的科研应用 第六节流式细胞术在临床检测中的主要应用 一、细胞周期和DNA倍体分析 二、染色体分析 三、细胞表面标志的检测 1、淋巴细胞及其亚群的分析 2、淋巴细胞功能分析 3、淋巴造血系统分化抗原及白血病免疫分型 四、肿瘤耐药相关蛋白分析 五、AIDS病检测中的应用 六、自身免疫性疾病相关HLA抗原分析 七、移植免疫中的应用 流式细胞术(flow cytometry, FCM)亦称荧光激活细胞分选器(fluorescence-activated cell sorting, FACS):是一种集激光技术、电子物理技术、光电测量技术、电子计算机以及细胞荧光化学技术、单克隆抗体技术为一体的新型高科技仪器。 是对于处在快速直线流动状态中的细胞或生物颗粒进行多参数、快速的定量分析和分选的技术。 广泛应用于基础研究和临床实践各个方面,包括细胞生物学、肿瘤学、血液学、免疫学、药理学、遗传学及临床检验学等。 流式细胞术主要包括:1、液流技术2、细胞的分选和计数技术3、数据的采集和分析技术 流式细胞术发展史: ?1930年Caspersson和Thorell开始致力于细胞计数的研究 ?1934年Moldaven最早设想细胞检测自动化,用光电仪记录流过一根毛细管的细胞 ?1940年Coons提出结合荧光素的抗体去标记细胞内的特定蛋白 ?1949年Wallace Coulter申请了在悬液中计数粒子的方法的专利 ?1950年Caspersson用显微UV-VIS检测细胞 ?1953年Croslannd-Taylor应用分层鞘流原理,成功设计红细胞光学自动计数器 ?1969年Van Dilla及其同事在Los Alamos, NM发明第一台荧光检测细胞计 ?1972年Herzenberg研制出细胞分选器 ?1975年Kohler等提出单克隆抗体技术,为细胞研究提供大量的特异免疫试剂 ?大量厂家不断生产流式细胞仪 ?目前国内主要流式细胞仪厂家:Beckton Dickinson(BD)公司、BACKMAN COULTER公司 流式细胞术的特点: 流式细胞术最大的特点是能在保持细胞及细胞器或微粒的结构及功能不被破坏的状态下,通过荧光探针的协助,从分子水平上获取多种信号对细胞进行定量分析或纯化分选 细胞不被破坏,测量快速、大量、准确、灵敏、定量 主要特点:单个细胞水平分析;多参数分析(同时多种荧光素标记)水平分析;高灵敏度、高分辨率、高重复性、高分选纯度;可分析大量细胞;速度快:5000-10000个细胞/秒;统计学意义:提供细
流式细胞仪检测细胞周期操作步骤 欧阳家百(2021.03.07) 取对数生长期的A549细胞,按1×106 cells/mL以1mL接种于100mm培养皿内 ↓ 24h后,进行所需的处理(比如加药,照射) ↓ 特定时间后终止培养,进行下一步的实验 ↓ 收集原培养液,洗后的PBS和消化后的细胞,将三者混匀放入 15ml离心管中 ↓ 1000rpm离心5min(短时低速离心) ↓ 弃上清,用1.5ml预冷PBS,1000rpm离心5min后去除PBS和细 胞悬液内的细胞碎片 ↓ 加入1.5ml预冷PBS,在涡旋状态下加入3.5ml无水乙醇,混匀后,于4℃固定30min,或-20℃长期保存。 ↓ 1000r/min,离心5min ↓ 将乙醇吸除,加PBS清洗混匀 ↓ 1000r/min,5min再离心一遍,将残留在细胞上的乙醇除去 ↓
吸除离心管内PBS,加入200ul PBS和2ul的RNA酶 (0.25mg/ml)(37℃下孵育30min) ↓ 加入0.5ml的50ug/ml的PI溶液室温下避光染色30min ↓ 将离心管内的细胞过滤(300um尼龙网膜)至含有PBS的EP管中(PI具有很强的粘附性,容易使细胞聚团),标记EP管 ↓ 提前一天网上预约 ↓ 开机(先开仪器后开软件) ↓ 流式细胞仪的结构一般分为5部分:①流动室及液流驱动系统; ②激光光源及光束成形系统;③光学系统;④信号检测、存贮、显示、分析系统;⑤细胞分选系统。 ↓ 检测前先涡旋使细胞混匀悬浮呈单个细胞,然后插入流式细胞仪上 ↓ 流动室内充满鞘液,细胞排成单列由喷嘴中心喷出,形成细胞液柱 ↓ 液柱与激光束相交,细胞上的荧光染料被激发产生荧光(488nm 激发光源) ↓ 荧光信号变成电信号输出到计算机,软件分析(荧光染料和细胞
如何看流式细胞术结果中的图 FCM数据的存贮的方式是FCS2.0(flow cytometry standard),采用列表排队(List Mode)方式。易于加工处理分析,但缺乏直观性,数据的显示通常有一维直方图、二维点图、等高线图、密度图等几种;由数据还可以做出标准曲线进行定量分析。 Q1:坐标轴的意义? 1、单参数直方图 每一个细胞单参数的测量数据可以整理成统计分布,以直方图的方式来显示。在图中,横坐标表示荧光信号或散射光信号相对强度的值,其单位是道数(channel),可以是线形(line)或者对数(log)。纵坐标一般是相对细胞/粒子数(count)!
2、二维图 在二维图的中,横坐标/纵坐标都表示荧光信号或散射光信号相对强度的值,可以是线形(line)或者对数(log)。双参数图可以将样品细胞群分开,从而方便对感兴趣的细胞进行分析。
Q2:“Gate”和“Regin”? ?设门是流式细胞分析中一种重要的技术,只有通过最佳的设门方式,才能准确地获取和分析数据,从而得到临床诊断和科研中有价值的信息。 ?On-line gating(threshold gating)监测/获取数据 ?Off-line gating:分析实验数据散射光设门/荧光设 门散射光/荧光联合设门多重逻辑门(组合门) 多重逻辑门G3=R1 and R2 (G3=R1×R2) 其它: G=R1 or R2 G=R1 not R2
Q3:流式图中的颜色与荧光颜色? 流式图中的颜色为区分不同细胞群而人为指定, 与荧光颜色无关!! Q4:流式图中的阴/阳(N/P)如何划分? 如何做M1阴性界限?实际上,这个M1的划分完全是根据阴性(同型)对照来的!如下图:左图为同型对照,即:您所检测的物质在阴性组中的基础表达量,可以理解为背景、静息状态下、基础水平、未受刺激时等。右图即阳性组,也就是接受刺激后,功能状态下、药物作用后等。 Q5: 这么巧,阴性正好在101划分??
1.1电源要求:220V (±10%)、50HZ(±10%) 1.2环境温度:5-35℃ 1.3在相应湿度10-80%的环镜下工作 2. 设备用途: 细胞分析和分选功能 2.1分析功能: 2.1.1细胞周期测定,DNA含量分析,RNA测量与分析 2.1.2细胞凋亡检测, 2.1.3蛋白质总量测定, 2.1.4生物活性的测定, 2.1.5细胞內钙离子流动试验,Ca2+浓度测定,细胞内pH值测量, 2.1.6细胞內Oxidative Burst代谢产物,细胞表面电荷检测。 2.1.7抗原特异性免疫细胞的检测、分选和细胞治疗技术 2.1.8检测细胞因子,可溶性荧光蛋白等 *2.2细胞分选 流式一体化分选功能,采用捕获管技术,分选速度300个细胞/秒,分选纯度98% 3. 技术规格: 3.1主机系统 *3.1.1流式细胞仪主机系统:含15mw 488nm氩离子蓝色激光器,635nm红色激光器,4个荧光探测器和2个散射光探测器 *3.1.2光路: 双激光立体空间激发方式实现四色荧光分析:488nm激光器激发的三色荧光,635nm激光器激发第四色荧光.采用测向光路设计 *3.1.3滤光片:488nm激光的荧光通道包括530/30nm、585/42nm、670nm LP;635nm激光的荧光通道:661nmLP *3.1.4可选用荧光:FITC, PE, PerCP,PI, PE-Cy5, PerCP-Cy5.5, PE-Cy,APC, Rhodamine, Cyanine等 *3.1.5必须配流式一体化分选系统 3.1.6光电倍增管:光谱检测范围300nm-1100nm 电压150V-990V 3.1.7荧光检测灵敏度:<100MESF 3.1.8全峰宽变异系数:CV<2% 3.1.9样本获取速度:>10,000个细胞/秒 3.1.10检测颗粒大小: 0.1um(min)-50um(max) 3.1.11最少样本体积:100μl 3.1.12流动室孔径:430um X 180um 3.1.13自动抽吸系统: 换样时自动吸去管道内剩余样本,避免样本之间的相互干扰 *3.1.14脉冲处理系统:能同时分析脉冲信号峰值、脉冲积分(面积)及脉冲宽度,用脉冲宽度和面积区分双连体细胞(如假四倍体细胞) 3.2 数据处理系统 苹果MAC Pro 工作站 3.2.1 CPU: 双核,主频2.8G 3.2.2 内存:2G 3.2.3 硬盘:容量300G
流式细胞术样品制备技术 流式细胞术对细胞的分析检测必须基于单细胞的基础上,这是流式细胞术的基本要求。因此就必须把实体组织制备成单细胞悬液。在应用FCM技术中,制备出合格的单分散细胞是流式细胞术样本制备技术中重要的一环。它要求这种分散细胞方法既要使细胞成为单个细胞,又能保持细胞的固有生物化学成分及生物学特性。 流式细胞术样品制备大致可分为下面五个步骤:①取材:取手术或活检组织必须具有代表性,如取手术肿瘤组织,必须取瘤细胞生长旺盛部位;组织等标本必须在取材后保持样本的新鲜;一般在室温1个小时之内处理好样本或及时用固定剂或低温对组织进行保存;②对细胞的待测生物化学成分进行荧光染色;③按照厂家提供的软件程序对样本进行获取、检测和存储;④再依照软件提供的程序对检测结果进行定量分析;⑤检测分析结果在生物、医学上的意义进行分析和评价。 第1节样本单细胞悬液的制备方法 一新鲜实体组织样本的制备 FCM对单细胞快速进行各种参数分析必须基于单细胞基础上,根据各种组织成分的特点,可选择不同的分散细胞方法,以期达到单细胞产额高、损伤少的目的。尽管标本制备已形成了标准化的程序,但实际操作中总会出现这样或那样的问题。在实体组织分散为单个细胞过程中,解离的方法可能瞬间地或持久地影响细胞的性质、形态、结构、功能等。所以,在对各种不同组织进行分散选择方法时,应尽量减少对细胞的这种影响。目前常用的分散组织细胞的方法有如下3种。 (一)酶消化法 1 作用原理: 对实体组织分散的作用原理主要有3方面:①可以破坏组织间的胶原纤维、弹性纤维等;②可以水解组织间的粘多糖等物质;③可以水解组织细胞间的紧密联结装置的蛋白质物质。酶消化法是实体瘤、培养细胞分散为单细胞的主要方法之一。常用的酶类试剂有:蛋白酶类——胃蛋白酶、木瓜蛋白酶、链酶蛋白酶和中性蛋白酶等,都能解离组织中的细胞。胰蛋白酶能水解脂键和肽键;胶原酶能降解几种分子类型的胶原;溶菌酶能水解糖蛋白和肽的糖苷键;弹性蛋白酶能消化连接组织的糖蛋白和弹性蛋白的纤维。不同酶对细胞内和细胞间不同组分有特异作用,可根据分散组织类型来确定使用的酶类。 2 注意事项: ①酶需要溶解于适当的溶液中,而这些溶液不致于造成酶效价降低;②要注意酶的使用浓度和消化时间;③要注意酶活性的PH值。如胃蛋白酶在碱性环境中失去活性,胰蛋白酶在中性溶剂中活性不佳等;④要随时注意影响酶活性的其它因素,如酶的生产批号等。 3 方法学程序 (1)将适合于酶消化的组织置于离心管中; (2)将选好的酶溶液1-2ml加入盛有被消化组织的试管中; (3)一般消化20-30分钟(恒温37℃或室温),消化期间要间断振荡或吹打; (4)终止消化,收集细胞悬液,以300目尼龙网过滤,除去细胞团块,以低速成离心除去细胞碎片;
流式细胞术 实验目的 掌握流式细胞仪的工作原理 掌握用流式细胞仪测量细胞群体DNA含量分布的方法 了解流式细胞术在细胞生物学研究中的应用 实验原理 流式细胞仪的工作原理是将待测细胞放入样品管中,在气体的压力下进入充满鞘液的流动室。在鞘液的约束下细胞排成单列由流动室的喷嘴喷出,形成细胞柱。通过对流动液体中排列成单列的细胞进行逐个检测,得到该细胞的光散射和荧光指标,分析出其体积、内部结构、DNA、RNA、蛋白质、抗原等物理及化学特征。 细胞内的DNA含量随细胞周期进程发生周期性变化,如G0/G1期的DNA含量为2C,而G2期的DNA含量是4C。利用PI标记的方法,通过流式细胞仪对细胞内DNA的相对含量进行测定,可分析细胞周期各时相的百分比。 仪器、材料与试剂 仪器:流式细胞仪、离心机。 材料:Hela细胞样品、试管、离心管、封口膜、微量移液器、Tip头、Eppendorf管。 试剂:70%乙醇(保存于4℃),RNase(-20℃保存),PI染液(避光保存于-20℃),PBS(pH 7.4,保存于4℃) 实验步骤 样品细胞由老师于课前收集并置于70%(预冷)乙醇中4℃下固定过夜。 2000rpm 15min收集固定细胞,PBS洗2次。 用100μL PBS重悬细胞并转至试管中轻轻吹打(防止细胞破碎)。 加PI染液50μL和RNase约2μL室温放置15min。 上机检测。 样品测定并使用ModFit LT软件分析结果。 实验结果与讨论: 所测样品中各周期时相的百分比: G1期 68.48% G2/M期 16.63% S期 14.89% G2:G1= 1:1.77 CV 12.16 提示结果可能不可靠或存在多倍体细胞。 流式细胞术是一种对悬液中细胞、微生物或细胞器等进行单个快速识别、分析和分离的技术。用以分析细胞大小、细胞周期、DNA含量、细胞表面分子以及进行细胞分选等。这种技术具有以下特点1.测量速度快;2.可进行多参数测量;3.是一门综合性的高科技方法( FCM综合了光学,电子学,流体力学,细胞化学,免疫学,激光和计算机等多门学科和技术);4.既是细胞分析技术,又是精确的分选技术。本次实验是通过流式细胞仪对细胞内DNA的相对含量进行测定,分析Hela细胞样本中各细胞周期时相所占的百分比。实验中所使用的Hela