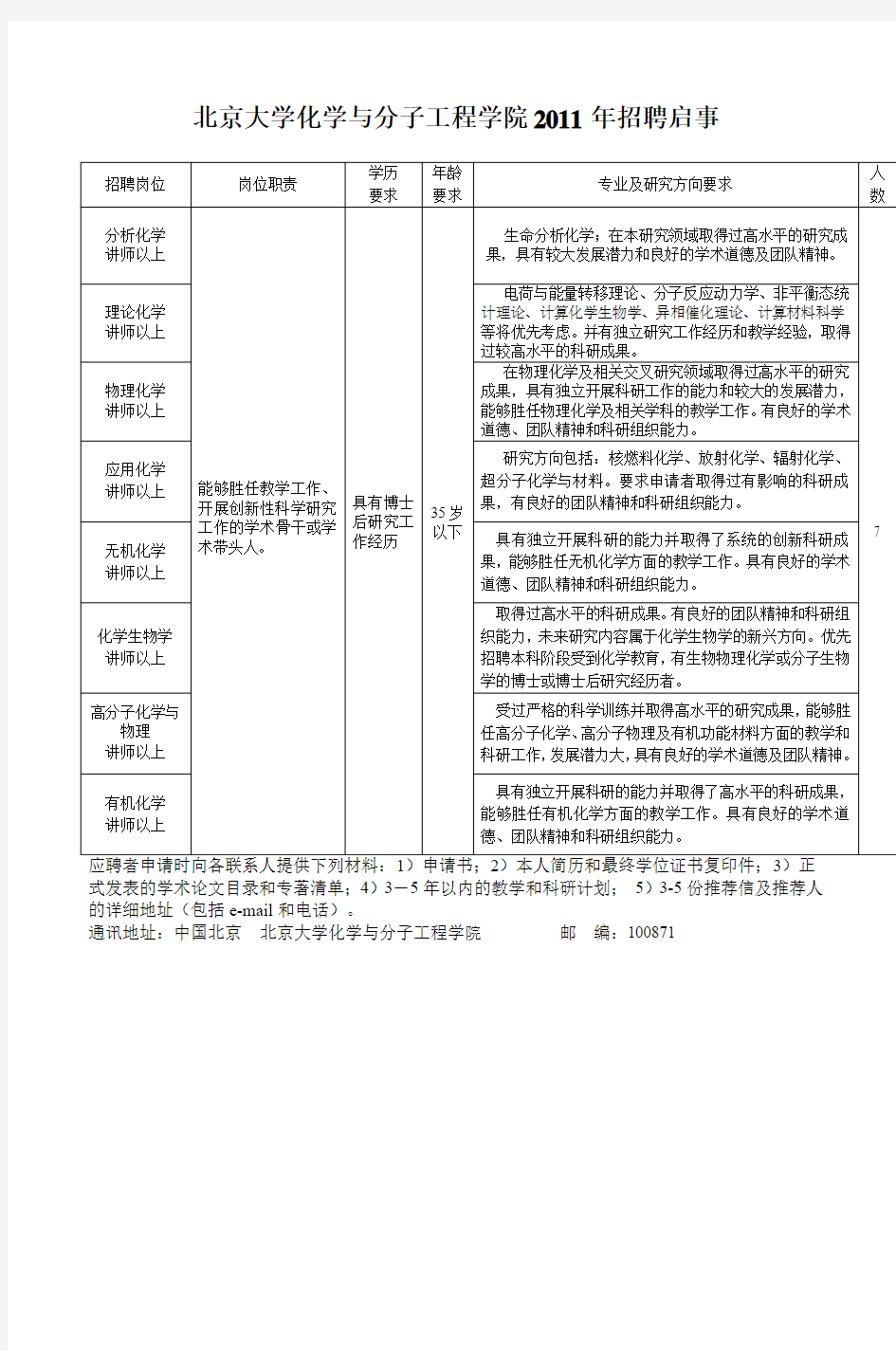
北京大学化学与分子工程学院2011年招聘启事
式发表的学术论文目录和专著清单;4)3-5年以内的教学和科研计划;5)3-5份推荐信及推荐人的详细地址(包括e-mail和电话)。
通讯地址:中国北京北京大学化学与分子工程学院邮编:100871
江南大学化学与材料工程学院研究生招生专业及方向简介 转自:时间:2011-9-19 10:04:20 化学与材料工程学院于2011年成功申请下材料科学与工程一级硕士点及化学工程与技术一级博士点,至此,化工学院已经拥有两个一级硕士点(材料科学与工程、化学工程与技术)、1个二级硕士点(分析化学)以及一个一级博士点(化学工程与技术)和一个二级博士点(皮革化学与工程)。自2012级招生开始,我院实行硕士除分析化学专业外其余的均按一级学科招生,博士亦按一级学科招生。具体一级点及其涵括的二级点分布如下: 博士点 序号学科门类一级学科名称二级学科博士点名称2011年招 生学院 学位点 所在学 院 1 工学0817 化学工程 与技术 081701 化学工程 化工 化工 2 081702 化学工艺化工 3 081703 生物化工 化工(生工) 4 081704 应用化学化工 5 081705 工业催化化工 6 0822 轻工技术 与工程 082204 皮革化学与工程化工化工 硕士点 序号学科 门类 一级学科名 称 二级学科硕士点名称 2011年招 生学院 学位点 所在学 院 1 理学0703 化学070302分析化学化工化工 2 工学0822 轻工技术 与工程 082204 皮革化学与工程化工化工 3 工学0805 材料科学080501 材料物理与化学化工
4 与工程080502 材料学化工化工 5 080503 材料加工工程化工 6 0817化学工程与 技术081701 化学工程化工化工 7 081702 化学工艺化工化工 8 081703 生物化工生工 化工(生工) 9 081704 应用化学化工化工 10 081705 工业催化 一、学科研究方向 (一) 在化学工程与技术一级学科下的二级学科,大致涵括以下具体的研究方 向: 1.表面活性剂与界面化学 2.精细化学品合成与应用 3.天然产物与化妆品 4.绿色化工新技术 5.生物质化学加工技术 6.化学反应工程 7.化工分离工程 (二) 在材料科学与工程一级学科下的二级学科,大致涵括以下具体的研究方 向: 1.高分子材料 2.纳米材料 3.功能材料
说明:仅供参考! 北京大学化学学院考试专用纸 《普通化学》___级期终考试 姓名:学号:院系:班级: 考试时间:2007年1月9日14:00-16:00 命题教师:王颖霞
一、简要回答并填写(可能多选): 1.下列说法中确切的是: (1) 吸热反应都无法自发进行(2) ?Gθ < 0反应能自发进行 (3) 吸热熵增型反应高温有利(4) ?G < 0反应能自发进行 2.下列变化中熵增的过程有: (1) 一定量的气体所受压强增大(2) NaCl溶于水 (3) 水结成冰(4) 氧气变为臭氧 (5) 某一定物质受热温度升高(6) 晶体中产生缺陷 3.根据右图,下列说法正确的有: (2) Na和Ca是很好的还原剂,可以 还原其他金属氯化物 (3) Cu与氯气反应时,温度越高,越 有利于CuCl的生成 (4) 温度高于500K, 金属Al总是可以 还原ZnCl2 (5) 温度在600-1600K区间,Zn既可 以还原CuCl2, 也可以还原CuCl 4.(在括号给出判断)元素的电负性差值越大,所形成的化学键离子性越强();所以,所形成的化学键的强度也越大() 5. 在下列卤化物中,键的共价性最强的是,最弱的是 1) 氟化锂2) 氟化钠3) 氯化锂4) 氯化铍 6. 下列物质中,分子间存在取向力的是 (1) BF3 (2) PF3(3) SiF4(4) PF5 (5) SF6(6) SF4 7.第81号元素是, 其核外价层电子排布为, 它位于第周期第族, 该元素的离子在水中较稳定的氧化态为,原因是 8. 金属中,熔点最高的是,最低的是 9. Fe(H2O)63+显淡紫色,说明它吸收颜色的光,相应的跃迁类型是 10. HBrO4与HBrO3相比,酸性更强的是;HBr与HI相比,酸性更强的是
大学化学期末考试卷 学院:专业:行政班: 姓名:学号:座位号:-------------------------------密封线------------------------------- 一、选择题(每小题分,共24分): 1、某反应的ΔrHmΘ<0 ,当温度升高时,其平衡常数的数值将()。 A、增大 B、不变 C、减小 D、先增大后减小 2、当主量子数n=3时,则角量子数l的取值为()。 A、1、2、 B、0、1、2 C、0、1 D、0、±1、 3、某温度下,反应2NO(g)+O2(g)=2NO2(g)达到平衡,是因为()。 A、反应已停止 B、反应物中的一种已消耗完 C、正逆反应的速率相等 D、反应物均已消耗完毕 4、下列化合物晶体中,既存在离子键又存在共价键的是()。 A、H2O B、NaBr C、CH3OH D、Na2O2 5、蔗糖的凝固点为()。 A、0℃ B、高于0℃ C、低于0℃ D、无法判断 6、已知某元素核外电子排布式为1s22s22p2,该元素在周期表中所属的分区为()。 A、s区 B、d区 C、f区 D、p区 7、质量作用定律只适用于()。 A、实际上能进行的反应 B、一步完成的简单反应 C、化学反应方程式中反应物和产物的化学式系数均为1的反应 D、已进行完的反应 8、对于反应Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O,其ΔrGm= –nFE,式中
n等于()。 A、1 B、6 C、3 D、12 9、下列物质中熔点最高的是()。 A、Si B、CO2 C、ZnS D、Fe3C 10、下列叙述中错误的是( )。 A、原电池的反应是氧化还原反应 B、原电池的能量变化是由化学能变为电能 C、原电池的能量变化是由电能变为化学能 D、原电池的负极发生氧化反应 11、某元素原子的外层电子构型为3s23p3原子中未成对电子数为()。 A、1 B、2 C、3 D、0 12、等温等压下且不做非体积功条件下,反应自发进行的判据是()。 A、ΔHΘ<0 B、ΔSΘ<0 C、ΔG<0 D、ΔfHmΘ<0 13、水具有反常的沸点,是因为分子间存在()。 A、色散力 B、诱导力 C、取向力 D、氢键 14、欲配制pH=的缓冲溶液,则下列哪一种化合物及其盐的混合溶液合适()。 A、HF (pKa= B、CH3COOH (pKa= C、NH3·H2O (pKb= D、HCN(pKa= 15、对于下列基元反应:A + 2B = C,其速率常数为k,若某个时刻(时间以s计),A的浓度为2mol/L,B的浓度为3mol/L,则反应速率v=()。 A、6k mol·L-1 ·s-1 B、12k mol·L-1 ·s-1 C、18k mol·L-1 ·s-1 D、36k mol·L-1 ·s-1 16、在温度T的标准状态下,若已知反应A→2B的标准摩尔反应焓△r HΘm,1,与反应2A→C的标准摩尔反应焓△r HΘm,2,则反应C→4B的标准摩尔反应焓△r HΘm,3与△r HΘm,1及△r HΘm,2的关系为△rHΘm,3=()。 A、2△r HΘm,1+△r HΘm,2 B、△r HΘm,1-2△r HΘm,2 C、△r HΘm,1+△r HΘm,2 D、2△r HΘm,1-△r HΘm,2 二、填空题(21分): 1、原电池(-)Pt |Fe2+(C1),Fe3+(C2)|| Fe2+(C3),Fe3+(C4)| Pt(+)负极上发生的电极反应式:____________________;正极上发生的电 极:______________________________________。该电池属于____________电池。 2、根据热力学第一定律,封闭体系的热力学能变化值反应的ΔU=________________。 3、决定电子运动状态的四个量子数中,____________________反映了原子轨道
4.1 已知铜氨络合物各级不稳定常数为 K 不稳1=7.8×10-3 K 不稳2=1.4×10-3 K 不稳3=3.3×10-4 K 不稳4=7.4×10-5 (1)计算各级稳定常数K 1~K 4和各级累积常数β1~β4; (2)若铜氨络合物水溶液中Cu(NH 3)2+4的浓度为Cu(NH 3)2+ 3的10倍,问溶液中[NH 3]是多少? (3)若铜氨络合物溶液中c (NH 3)=1.0×10-2mol 〃L -1,c (Cu 2+)=1.0×10-4 mol 〃L -1(忽略Cu 2+ ,NH 3的副反应), 计算Cu 2+ 与各级铜氨络合物的浓度。此时溶液中Cu(Ⅱ)的主要存在型体是什么? 答案: (1)K 不1 K 不2 K 不3 K 不4 7.8×10-3 1.4×10-3 3.3×10-3 7.4×10-5 14 1 K K = 不 23 1 K K = 不 32 1 K K = 不 41 1K K = 不 1.4×104 3.0×103 7.1×102 1.3×102 11K β= 212K K β= 3213K K K β= 43214K K K K β= 1.4×104 4.2×107 3.0×1010 3.9×1012 (2) ()[]()[] []10NH NH Cu NH Cu 3 4 23 3243==++ K []12 4 3 L mol 10 7.710NH --??==K (3) ()()14123L mol 100.1Cu L mol 100.1NH ----??=??=c c ()() []4 4 333 322 31302][NH ]NH [NH ]NH [1Cu Cu ]Cu [βββ βc x c ++++= ?=+ 12810674424 109.3100.1100.3100.1102.4100.1104.1100.11100.1???+???+???+???+?= -----194 4L mol 104.110 3.7100.1---??=??= ()[]()[]174 4 13 1 23 L mol 109.110 0.110 3.7 NH Cu NH Cu ---+ ??=???=?=βx c ()[]()[]1644 22 32 223L mol 108.5100.1103.7NH Cu NH Cu ---+??=???=?=βx c ()[]()[]1544 33 33 23 3L mol 101.4100.1103.7NH Cu NH Cu ---+??=???=?=βx c ()[]()[]1544 44 34 24 3L mol 103.5100.1103.7NH Cu NH Cu ---+ ??=???=?=βx c
中南民族大学2016年化学与材料科学学院硕士研究生拟录取名单化学与材料科学学院罗晓旭无机化学 化学与材料科学学院徐俊轩无机化学 化学与材料科学学院蔡君无机化学 化学与材料科学学院张荔分析化学 化学与材料科学学院韦秋曦分析化学 化学与材料科学学院黄月金分析化学 化学与材料科学学院周秀花分析化学 化学与材料科学学院徐梦文分析化学 化学与材料科学学院舒亚玲分析化学 化学与材料科学学院胡丹阳分析化学 化学与材料科学学院王蒙分析化学 化学与材料科学学院周雪分析化学 化学与材料科学学院康艳辉分析化学 化学与材料科学学院李霞分析化学 化学与材料科学学院段有雨有机化学 化学与材料科学学院张洋民有机化学 化学与材料科学学院杜艳婷有机化学 化学与材料科学学院张成江有机化学 化学与材料科学学院李建烨有机化学 化学与材料科学学院张孝焱有机化学 化学与材料科学学院张瑞有机化学 化学与材料科学学院王博有机化学 化学与材料科学学院黄业迎物理化学 化学与材料科学学院何欢物理化学 化学与材料科学学院宁宝贵物理化学 化学与材料科学学院刘思旭物理化学 化学与材料科学学院马彦凯物理化学 化学与材料科学学院胡莎物理化学 化学与材料科学学院程明物理化学 化学与材料科学学院孙布礼物理化学 化学与材料科学学院邹思榕物理化学 化学与材料科学学院马芸高分子化学与物理 化学与材料科学学院班彬入高分子化学与物理 化学与材料科学学院陈雄高分子化学与物理 化学与材料科学学院郭文强高分子化学与物理 化学与材料科学学院丁文强高分子化学与物理 化学与材料科学学院覃爱琼高分子化学与物理 化学与材料科学学院李海高分子化学与物理 化学与材料科学学院曾艺高分子化学与物理
大学化学期末试卷加答案 学院________ 姓名_________ 学号_________ 闭卷考试时间:120分钟 一、选择题<每小题1.5分,共24分) 1、某反应的ΔrHmΘ<0 ,当温度升高时,其平衡常数的数值将<)。 A、增大 B、不变 C、减小 2、当主量子数n=3时,则角量子数l的取值为<)。 A、1、2、 B、 0、1、2 C、0、1 D、0、±1、 3、某温度下,反应2NO(g>+O2(g>=2NO2(g>达到平衡,是因为<)。 A、反应已停止 B、反应物中的一种已消耗完 C、正逆反应的速率相等 4、下列化合物晶体中,既存在离子键又存在共价键的是<)。 A、H2O B、 NaBr C、 CH3OH D、Na2O2 5、蔗糖的凝固点为<)。 A、0℃ B、高于0℃ C、低于0℃ D、无法判断 6、已知某元素核外电子排布式为1s22s22p2,该元素在周期表中所属的分区为<)。 A、 s区 B、d区 C、 f区 D、 p区 7、质量作用定律只适用于<) A、实际上能进行的反应 B、一步完成的简单反应 C、化学反应方程式中反应物和产物的化学式系数均为1的反应 8、对于反应 Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O,其ΔrGm= –nFE,式中n等于<)。b5E2RGbCAP A、1 B、6 C、3 D、12 9、下列物质中熔点最高的是<) A、Si B、CO2 C、ZnS D、Fe3C 10、下列叙述中错误的是( >。 A、原电池的反应是氧化还原反应 B、原电池的能量变化是由化学能变为电能 C、原电池的能量变化是由电能变为化学能 D、原电池的负极发生氧化反应 11、某元素原子的外层电子构型为3s23p3原子中未成对电子数为<)。 A、1 B、2 C、3 D、0 12、等温等压下且不做非体积功条件下,反应自发进行的判据是 A、ΔHΘ<0 B、ΔSΘ<0 C、ΔG<0 D、ΔfHmΘ<0
一、选择题(以下每题均为单选题,多选不得分。每题2分,共30分) 1.根据定义,下列物质中标准摩尔生成吉布斯函数△r G mθ为零的物质是:( D ) (A) 压力为100kPa、温度298.15K下的金刚石;(B)温度为298.15K、200kPa的氢气;(C) 温度为298.15K、压力为100kPa的水蒸气;(D)温度为298.15K、压力为100kPa的氧气2.升高温度可增加反应速率,最主要的原因是因为: ( B ) (A) 增加了反应分子总数; (B) 增大了活化分子的百分数; (C) 降低了反应的活化能; (D) 促进平衡正向移动 3.等温等压条件下任何温度都可自发进行的化学反应,其条件是: ( A ) (A) ΔH< 0、ΔS >0; (B) ΔS< 0、ΔH>0; (C) △r G mθ< 0; (D) ΔS< 0、ΔH< 0 4.下面一组量子数中, 准确描述原子轨道的是: ( A ) (A) (3, 2, -2); (B) (3, 3, 1); (C) (3, 2, -3); (D) (3, 2, 0, 1); (E) (3, 2, 1, -1/2); (F) (3, 2, -1, 0); (G) (3, 3, 2, +1/2) 5.上述量子数中, 准确描述电子运动状态的是: ( E ) 6.根据“酸碱质子理论”,属于HPO42-的共轭酸是: ( B ) (A) PO43-; (B) H2PO4-; (C) H3PO4; (D) H4PO4+ 7.已知Kθsp(Ag2CrO4)=1.2?10-12,0.1mol·dm-3CrO42-溶液中滴加AgNO3,开始产生沉淀时Ag+的浓度为 ( D ) (A) 1.2?10-11mol·dm-3; (B) 6.5?10-5mol·dm-3; (C) 0.1mol·dm-3; (D) 3.46?10-6mol·dm-3 8.室温下,0.20mol.dm-3HCOOH溶液电离度为3.2%,HCOOH的电离常数为: ( A ) (A) 2.0×10-4; (B) 1.3×10-3; (C) 6.4×10-3; (D) 6.4×10-4 9.可以用作缓冲溶液的系统是: ( C ) (A) 0.10 mol·dm-3NaAc+0.10 mol·dm-3HCl溶液;(B) 0.10 mol·dm-3HAc+0.20 mol·dm-3NaOH 溶液;(C) 0.20 mol·dm-3HAc+0.10 mol·dm-3NaOH溶液; (D) 0.20 mol·dm-3醋酸+0.10 mol·dm-3HCl溶液 10.原电池 (-) Pt?SO32-,SO42-??H+,Mn2+,MnO4-?Pt (+) 的电池反应: ( A ) (A) 2 MnO4- + 5 SO32- + 6H+ =2 Mn2+ + 5SO42- +3H2O; (B) 2 MnO4- + 8H+ + 5e=2 Mn2+ + 4H2O; (C) SO32- + H2O = SO42- +2H+ + 2e; (D) MnO4- + SO32- + 6H+ + 3e = Mn2+ + SO42- +3H2O 11.22T原子核外电子分布式正确的是: ( B ) (A) 1s22s22p63s23p64s24p2 (B) 1s22s22p63s23p63d24s2 (c) 1s22s22p63s23p64s23d2 (C) 1s22s22p63s23p63d4 12.已知反应 A(g) = 2B(g) + C(g),T、V一定,开始时P(A) = 20kPa,达到平衡时总压为40kPa,该反应的转化率为 ( B ) (A) 30%; (B) 50%; (C) 10%; (D) 100%; 13.根据酸碱质子理论,下列各组物质中都可以作为酸的有 ( B ) (A) HCl, S2-, CO32-; (B) NH4+, HSO4-, H2O; (C) HS-, HPO4-, CO32-; (D) NH3, H2S, H2O 14.在21.8℃时,反应NH4HS(s) = NH3(g) + H2S(g)的标准平衡常Kθ = 0.070,4molNH4HS 分解达到平衡是混合气体的总压力是: ( C ) (A) 7.0 kPa; (B) 26 kPa; (C) 53 kPa; (D) 0.26 kPa 15.一个化学反应达到平衡时,下列说法正确的是: ( A ) (A) 各物质的浓度或分压不随时间变化;(B) △r G mθ = 0; (C) 正、逆反应的速率常数相等; (D) △r H mθ = 0 二、填空题 (25分,每空1分)
1、用H3PO4(pKa1= 2.16,pKa2= 7.21,pKa3= 12.32)和NaOH所配成的pH = 7.35的缓冲溶液中,抗碱成分是()(4 分)A.H3PO4 B.H2PO4- C.HPO42- D.PO43- 我的答案:B 得分:4分 2、对于一个化学反应,下列说法中正确的是()(4 分)
A.越负,反应速率越大 B.越负,反应速率越大 C.活化能越大,反应速率越大 D.活化能越小,反应速率越大 我的答案:D 得分:4分 3、蛋白质发生盐析的主要原因是()(4 分)A.电解质离子强烈的水化作用使大分子去水化 B.蛋白质所带的电荷发生了变化
C.由于电解质的加入,使大分子溶液处于等电点 D.蛋白质上基团的解离情况发生了变化我的答案:A 得分:4分 4、已知某蛋白的pI = 5.6,欲使该蛋白移向正极,则电泳液的pH应()(4 分)A.<5.6 B.=5.6 C.>5.6 D.无法确定
我的答案:C 得分:4分 5、聚沉As2S3负溶胶,下列电解质中聚沉能力最强的是()(4 分) A.Ca(NO3)2 B.K2SO4 C.Na3PO4 D.AlCl3 我的答案:D 得分:4分
6、溶胶在一定时间内能稳定存在而不聚沉,主要原因是()(4 分) A.溶胶的分散相粒子很小 B.溶胶的分散相粒子很大,扩散速度慢C.溶胶的胶粒呈均匀分布,是均相系统D.胶粒带电,相互排斥;胶粒带有水化膜保护,阻止彼此碰撞时聚结沉淀 我的答案:D 得分:4分 7、溶胶的丁铎尔(Tyndall)现象的本质是胶粒对光的()(4 分) A.透射作用
一、判断题(每题0.5分,共5分)(在题后括号内正确的打√,错误的打×) 1. 内能、焓和热都是状态函数。( f ) 2. 缓冲比固定,缓冲对浓度越大,缓冲溶液的pH值越大( f ) 3. 固体硝酸盐在高温下均是强氧化剂。(t ) 4.对于Fe原子,其轨道的能量只与主量子数有关。( f ) 5.非极性分子与极性分子间不可能存在氢键。( t ) 6.在冰晶石Na3[AlF6]配合物中,配体为F原子。( f ) 7.由非极性共价键形成的分子一定具有非极性。( t ) 8. 全由共价键结合的物质均形成分子晶体。( f ) 9. 极性分子与极性分子间只存在诱导力和取向力。( f ) 10. 同一金属元素高价态的氯化物比低价态的溶沸点低。( t ) 二、选择题(每题1分,共15分,请将答案填在表格中) 1、决定镁原子轨道能级的量子数是 b 。 A、n B、n, l C、n, l, m D、n, l, m, m S 2、下列各组量子数中合理的是 d 。 A、n=1 l=1 m=0 B、n=2 l=0 m=1 C、n=2 l=2 m=2 D、n=4 l=3 m= -2 3、在密闭容器中,盛有二氧化氮气体,在等温下建立下列平衡: 2NO2(红棕色)=N2O4(无色);ΔH < 0。若降低温度,则颜色将 b 。 A、变深 B、变浅 C、不变 D、不一定 4、下列分子中分子偶极矩为零的是 a 。 A、BeCl2 B、SiHCl3 C、PH3 D、H2O 5、下列含氢化合物中存在氢键的是 d 。 A、HCl B、N2 C、CH4 D、硝酸 6、下列各组作用力中都不具有方向性的是a 。 A.离子键、金属键 B.氢键、金属键 C.共价键、氢键 D.共价键、离子键 7、下列硝酸盐中热分解产物有金属单质的是 c 。
材料化学专业硕士研究生课程 教学大纲 课程名称:材料化学导论课程编号:0703212X01 学分:3 总学时:54 开课学期:1-2 学期考核方式:笔试+课程论文课程说明: 本课程是材料化学专业硕士研究生学位课。要求同学以固体结构、用为主线,掌握二元离子晶体和三元典型离子晶体的结构描 述和各类点缺陷,握主要类型电、光和磁功能材料 的结构和性能, 纳米技术。教学内容、要求及学时分配: 01 绪论(4 学时)定义和分类材料科 学中基本化学问题 02 理想晶体的结构(10学时)宏观 特征等径球主要堆积方式 03 缺陷晶体的结构(10学时)两类热 缺陷非化学整比化合物不等价元 素置换固溶体能带理论的概念 04 固体的电学性质与电功能材料(固 体电导率定义Frenkel 导体和 Schottky 导体超导概念和特征参 数压电效应和压电材料 材料与新技术革命 点阵概念 间隙杂质和替代杂质缺陷点缺 陷F- 心双重价态控制半导体 各类 缺陷 的拟化学平衡 10 学时)固体中的离子扩散快离子导 体两类超导体和库柏电子对模 型铁电效应和铁电材料 性能和应掌 了解固体材料的基本制备方法和
05 固体的光性质和光功能材料(8 学时) 光导电和光电转化材料发光材料组固体光吸收的本质发光材料的发光特性 成和发光原理 激光原理和激光材料 06 固体的磁性和磁功能材料(6 学时) 固体的磁性磁化率与温度的关系 磁性材料的分类过渡金属、合金和铁氧体的磁结构 分子磁体及其磁化学 07 纳米材料化学简介(6 学时) 纳米材料的概念、特性及应用主要纳米技术 纳米粉材料、孔材料和纳米碳管材料制备原理和典型示例 教材或主要参考书目: [1]张逢星、李珺编著,《材料化学导论》,西北大学本科讲义,2004 年 [2]张逢星、李珺编译,《无机材料化学》,牛津双语读物,2005 年 [3]苏勉曾,固体化学导论,北京大学出版社,1996 年 [4]唐小真主编,材料化学导论,高等教育出版社,1997 年 (大纲起草人:张逢星大纲审定人:史启祯) 课程名称:功能高分子材料导论 课程编号:0703212X02 学分:3 总学时数:54 开课学期:第1-2 学期 考核方式:笔试 课程说明: 本课程是材料化学专业硕士研究生学位课。功能高分子材料在生态环境保护、信息功能化、生物医用器材、物质分离膜、能量转换和储能技术等工业领域有着极为广泛的应用。本课程的目的是使学生了解和掌握功能高分子材料的基本内容、研究方法、主要研究领域、国内外发展现状及发展趋势。要求学生全面了解和掌握功能高分子材料类型、结构和功能的关系、制备原理及方法,提高研究、开发特种功能高分子材料的能力。
《无机化学》试题 学号: 姓名: 座号: : 复核人: 一、单项选择题 (在每小题列出的四个选项中只有一个选项就是符合题目要求的,请选出正确选项并在“答题卡”的相应位置上涂黑。多涂、少涂、错误均无分。每小题1分,共40分) 1、对于Zn 2+ /Zn 电对,增大Zn 2+ 的浓度,则其标准电极电势将 ( ) A 增大 B 减小 C 不变 D 无法判断 2 、 Cu 2 +离子的外层电子构型为 ( ) A 8e B 18e 型 C 18+2e D 9~17e 型 3、设氨水的解离平衡常数为θb K 。浓度为m mol·L -1 的氨水溶液, 若将其用水稀释一倍,则溶液中OH - 的浓度(mol·L - 1 )为 ( ) A m 21 B θ b K m ?2 1 C 2/m K b ?θ D 2m 4、已知θsp K (Ag 3PO 4) = 1、4× 10-16,其溶解度为
( ) A 1、1×10-4mol?L-1; B 4、8×10-5mol?L-1; C 1、2×10-8mol?L-1; D 8、3×10-5mol?L-1 5、下列各组物质,能自发发生反应的就是( ) A Cu、Cu2+; B Cr2O72-、Cr3+; C MnO2、Mn2+; D SnCl4、Sn 6、3d轨道的磁量子数可能就是( ) A 1,2,3 B 0,1,2 C 0,±1 D 0, ±1, ±2 7、下列各分子中,以sp3不等性杂化轨道成键的就是( ) A BeCl2 B PCl3 C BF3 D SiH4 8、熔化下列晶体时,只需克服色散力的就是( ) A HF B Ag C KF D CO2 9、已知V E A/ :Cr2O72- +1、36 Cr3+ -0、41 Cr2+ -0、86 Cr,则判断发生歧化反应的就是( ) A 都不能 B Cr2O72- C Cr3+ D Cr2+ 10、下列各物质中,熔点最高的就是( ) A K2O B MgO C CaO D
3.1 从手册中查出下列各酸的酸度常数p K a ,分别计算它们的K a 及与其相应的共轭碱的K b 值。 34224+43+ 3.2 (1)计算pH=5.0时,H 3PO 4的摩尔分数3210。(2)假定H 3PO 4各种形式总浓度是0.050 mol 〃L -1 , 问此时H 3PO 4、H 2PO 4-、HPO 42-、PO 43-的浓度各为多少? 答案:(1)123 112122 a a a 03 2 a a a a a a [H ][H ][H ]K K K x K K K K K K +++ = +++ 10 69.2137.1416.1200.1531.1221.716.2100.31010101010--------?=+++= 3 16 .1200 .15337.1416.1216.1223 16 .1237 .141104.110 10 )994.0(0.1)1010(10102.610 10 ---------?===+= ?==x x x (2)c =0.050mol 〃L -1 1 53431 24 2141241 11034L mol 102.7]PO H [L mol )0497.0(050.0]PO H [L mol 101.3]HPO [L mol 105.1]PO [---- ------??=?=?=?=??=?=??=?=x c x c x c x c 3.3 某溶液中含有HAc 、NaAc 和Na 2C 2O 4,其浓度分别为0.80、0.29和1.0×10-4 mol 〃L -1 。计算此溶液 中C 2O 42-的平衡浓度。 答案:溶液的酸度由HAc-Ac -所决定 ()() 4.76 4.32a HAc 0.80 [H ]10100.29 Ac c K c +---= = ?= 22 a 224 0a 4 4.2951 4.32 4.29 [C O ][H ]1.01010 5.210mol L 1010cK cx K -+------== +??==??+ 写出下列物质水溶液的质子条件: (1)NH 3;(2)NH 4Cl ;(3)Na 2CO 3;(4)KH 2PO 4;(5)NaAc+H 3BO 3。 答案:(1)NH 3 [NH 4+]+[H +]=[OH -] (2)NH 4Cl [H +]=[NH 3]+[OH -] (3)Na 2CO 3 [H +]+[HCO -3]+2[H 2CO 3]=[OH -]
南京师范大学化学与材料科学学院 教学团队设置方案与教研活动开展细则 1.本方案拟按照二级学科为基础设置教学团队。 2.教学团队是学院直接从事教学活动的基本单位,直属系领导。 3.教学团队负责人由学科带头人召集团队成员讨论后指定,报各系和学院备案。 4.教学团队主要工作内容:执行教学计划;拟定教学大纲;选编教材、编写教学参考资料;实 施各个环节的教学工作;开展教学研究与青年教师培养;组织考试命题及阅卷;落实听课制度,检查教学质量;对教师定期考核;搞好教学改革和课程建设。 5.教学团队负责人除主持常规的教学活动外,有责任带领团队在教学团队建设、师资队伍建设、 人才培养模式改革、课程与教学资源建设、教学方式方法改革、实践教学环节、教学管理改革、课程整合与建设等开展工作。 6.教研活动安排在每周三下午,每个教学团队至少安排教研活动6次/学期,每次教研活动必 须有教学督导或教学委员参加。以下三次活动为必开时间:开学第一周的教研活动安排在教学活动正常开展前一天或二天,讨论学期教学活动计划;期中教研活动集中讨论上半学期教学中存在问题与改进措施,开展教学检查活动;在学院制定下学期教学计划前,组织一次教研活动,制定教材,安排教师(A角和B角,A角为主讲教师、B角为备讲教师)。另外三次教研活动针对第五条开展。 7.参与教研活动的教师的工作量按3课时/次计算;每次教研活动须填写教研活动总结报告, 由教学负责人和教学督导或教学委员签字认定,交教学秘书保存。 8.学院将对教学团队的教研活动进行适当资助。
南京师范大学化学与材料科学学院 2013-08-20 附录一: 教学团队设置如下: 无机学科教学团队:刘红科、包建春、黄晓华、陈晓峰、蒋晓青、唐亚文、方敏、戴志晖、兰亚乾、韩敏、吴勇、赵文波、李顺利、吴萍、周小四 分析化学教学团队:杨小弟、杜江燕、周耀明、张继双、李卉卉、屠闻文、毕文韬、陈维 物理化学教学团队:蔡称心、周益明、赵波、杨春、卫海燕、李淑萍、周泊、李晓东、朱银燕、张卉、陈煜、孙冬梅、吴平、沙兆林、李亚飞 有机化学教学团队:孙培培、魏少华、王炳祥、杨锦飞、肖亚平、顾玮瑾、韩巧荣、林云、职慧珍、周林、韩维、邵科峰、马振毛 化工教学团队:顾正桂、王玉萍、杨维本、林军、马振叶、崔世海、刘俊华、李明海、张英华、王春梅、苏复 高分子及材料教学团队:李利、周宁琳、毛春、章峻、朱丹、肖迎红、莫宏、袁江 附录二: 南京师范大学化学与材料科学学院本科专业课程概况
模拟试题(十) 一、 答下列问题: 1. 试比较下面三种化合物与CH 3ONa 发生S N 反应的相对活性。 A. NO 2CH 2Cl B. NO 2 CH 3 Br C. NO 2 CH 3 F 2. 比较下面三种化合物发生碱性水解反应的相对活性。 A. B. C. CH 3CH =CHCH 2Br CH 3CH 2CH 2Br CH 3CCH 2Br = O 3. 下面三种化合物一硝化时,所得间位产物的多少次序如何 A. B. C. C 6H 5CH 3 C 6H 5CHCl 2 C 6H 5CCl 3 4. 下面三种化合物分子的偶极矩大小的次序如何 A. B. CH 3 C. CH 3 2 3 5. 下面三种化合物与一分子HBr 加成的反应活泼性大小次序如何 A. B. C.PhCH =CH 2 p - O 2NC 6H 4CH =CH 2 p - CH 3C 6H 4CH =CH 2 6. 甲基环戊烷的一氯代产物中哪个有对映异构体 7. 下面三种化合物发生消除HBr 的反应活化能大小次序如何 A. 3 B. C. Br 8. 下列各化合物发生亲核取代反应是按S N 1机理还是S N 2机理进行的 A. C 6H 5CH 2Br B. (C 6H 5)2CHBr C. C 6H 5COCH 2Br D. 二、 写出下面反应的反应机理:
CH=CH2 += CH CH 3 3 H+ 3 3 3 3 3 三、用化学方法鉴别下列化合物: A. B. Cl C. 2 D. E. F. 四、合成下列化合物: 1.由苯合成Ph2C=CH2(其它试剂任选)。 2.由甲苯合成2-硝基-6-溴苯甲酸。 五、完成下列反应: 1. 25 。 O2 [ A ] PhCH3 3 H3O+ [ B ][ C ] 2. HCHO , HCl 2 [ D ][ E ] H2O 2+ + [ F ] 3.PhC+CH3CH2MgBr[ G ] PhCH2Cl [ H ] Na , NH3 [ I ] HBr [ J ][ K ] (1) CO2 3 + [ M ] 六、化合物A、B、C、D的分子式都是C10H14,它们都有芳香性。A不能氧化为苯甲 酸;B可被氧化为苯甲酸,且B有手性;C也可氧化成苯甲酸,但C无手性,C 的一氯代产物中有两个具有手性,分别为E和F;D可氧化为对苯二甲酸,D 的一氯代产物中也有两个具有手性,分别是G和H。试写出A、B、C、D、E、F、 G、H的构造式。 七、某学生由苯为起始原料按下面的路线合成化合物A(C9H10): +ClCH2CH2CH3 AlCl3 2 CH2CH3 Br2 hv 2 CH3 Br3 = (A) 当他将制得的最终产物进行O3氧化、还原水解后却得到了四个羰基化合物;经 波谱分析得知它们分别是苯甲醛、乙醛、甲醛和苯乙酮。问:(1)该学生是否得到 了A(2)该学生所设计的合成路线是否合理为什么(3)你认为较好的合成路线是什
北京中医药大学《无机化学》考试辅导试题及答案 用离子-电子法配平并完成下列反应 答:+ + 2I-= 2Fe2+ + I2 -+ 3SO32-+H2O = 2MnO2 + 3SO42-+ 2OH— + + Zn = Cu+ Zn2+ -+3S2-+14H+ =2Cr3++3S +7 H2O -+ 5SO32-+ 6H+= 2Mn2+ + 5SO42-+3 H2O — + SO32-+ 2OH—= 2MnO42—+ SO42-+ H2O 简答题 1. 一种钠盐A,在A的水溶液中加入稀盐酸产生刺激性气体B。A的水溶液在酸性中能使KMnO4溶液腿色,得到无色溶液C。若在A的水溶液中通入Cl2得溶液D,在D中加入AgNO3溶液产生白色沉淀E,若在E中加入NH3水,震荡后得到无色溶液F。指出A、B、C、D、E、F各为何物。 答:A、Na2SO3B、SO2C、Mn2+ D、Cl- E、AgCl F、[Ag(NH)2]+ 2.根据配合物的价键理论,指出下列配离子中,中心离子和配体的配位情况(即画出中心离子杂化后价电子排布、指出杂化轨道类型及空间构型)。 (1)[FeF6]3-μ= . (2)[Fe(CN)6]3-μ= . 答:(1)Fe3+ 3d53d轨道有5个单电子sp3d2杂化八面体 (2)Fe3+ 3d53d轨道有1个单电子d2sp3杂化八面体 3.有四种试剂:Na2SO4、Na2SO3、Na2S2O3、Na2S,它们的标签已脱落,请设计只加一种试剂的简便方法鉴别它们,并写出有关配平的离子反应方程式。 答:加稀HCl (略) 4.根据配合物的价键理论,确定下列配离子是内轨型还是外轨型,说明理由。 (1) [Fe(H2O)6]3-(Fe3+3d 5)μ= . (2) [Mn(CN)6] 4-(Mn2+3d 5)μ= . 答:(1)μ= 则n=5 Fe3+ 3d53d轨道有5个单电子sp3d2杂化八面体 (2)μ= 则n=1 Fe3+ 3d53d轨道有1个单电子d2sp3杂化八面体 5.现有一种含结晶水的淡绿色晶体A,将其配成溶液,若加入BaCl2溶液,则产生不溶于酸的白色沉淀B,若加入NaOH溶液,则生成白色胶状沉淀C并很快变成红棕色沉淀D,再加入盐酸,此红棕色沉淀又溶解,滴入硫氰化钾溶液显深红色溶液E。指出A、B、C、D、E各为何物。 答:A、Na2SO3B、SO2C、Mn2+ D、Cl- E、AgCl F、[Ag(NH)2]+
2017 研究前沿 中国科学院科技战略咨询研究院 中国科学院文献情报中心 科睿唯安 七、化学与材料科学 1. 热点前沿及重点热点前沿解读 1.1 化学与材料科学 Top 10 热点前沿发展态势 化学与材料科学领域Top10热点前沿主要分布在太阳能电池、有机合成、纳米技术、超级电容器、自由基聚合、上转换发光等领域。与2013-2016 年相比,2017年 Top10热点前沿既有延续又有发展。在太阳能电池领域,关于钙钛矿太阳能电池和聚合物太阳能电池的研究连年入选热点前沿或新兴前沿。在今年的Top10热点前沿中,聚合物太阳能电池延续了去年对非富勒烯受体(小分子和聚合物)的关注,钙钛矿太阳能电池则侧重空穴传输材料研究。在有机合成领域,碳氢键的活化反应也是连年入选,往年侧重在钌、铑等贵金属的催化转化,今年是非贵金属钴的催化转化,另外今年还突出了间位碳氢键的活化。在纳米技术领域,不仅继续有具体的前沿研究入选,而且首次出现宏观的研究概念――纳米组装学。在超级电容器领域,基于纳米孔碳电极(2014年)、纳米二氧化锰电极材料(2016年)的超级电容器曾经入选热点前沿或新兴前沿,今年入选的是基于NiCo2S4电极材料的超级电容器。在自由基聚合领域,继2014年入选新兴前沿后,光引发的聚合反应今年成为热点前沿。在上转换发光领域,“三重态-三重态湮灭上转换”入选热点前沿。
1.2 重点热点前沿——三价钴催化的碳氢键活化反应 传统的合成化学基于活性官能团的相互转化,通常需要繁琐的预官能团化步骤。而碳氢键的直接化学转化可以避免这一过程,大大提高反应的原子经济性和步骤经济性,因而受到广泛关注并取得蓬勃发展。近十年来,过渡金属催化的碳氢键直接官能团化反应已成为重要的合成工具,特别是贵金属(铑、钌、铱、铂、金、银等)催化成果显著。然而,高昂的成本以及对环境可能造成的不利影响限制了贵金属催化的大规模应用。因此,越来越多的研究人员将目光转向储量丰富、成本低廉的第一行过渡金属(锰、铁、钴、镍、铜等)。这点在《研究前沿》系列报告中也得以体现:在2013年和2014年的报告中,“钌、铑催化的碳氢键活化反应”进入化学领域Top10热点前沿,本年度则是“钴催化的碳氢键活化反应”入选。钴催化的碳氢键活化反应可分为低价钴(CoⅡ)催化和高价钴(CoⅢ)催化两类。本研究前沿是高价钴催化的碳氢键活化反应。2013年,日本东京大学金井求(Motomu Kanai)教授和川岛茂裕(Shigehiro Kawashima)博士报道了Cp*CoⅢ(Cp*= 五甲基环戊二烯)络合物催化的2-苯基吡啶碳氢键活化直接加成到亚胺、烯酮上的反应。此后,研究人员不断扩大Cp*Co Ⅲ催化剂的应用围并研究其催化机理。与其替代对象Cp*RhⅢ相比,Cp*CoⅢ不仅可用于前者催化的反应,而且由于反应活性差异,导致可能采取不同的反应路线从而生成不同的产物。 如表31所示,在本研究前沿中,德国、日本、美国、国以及中国等国家或地区发表了多篇核心论文。日本东京大学、德国哥廷根大学、明斯特大学、美国耶鲁大学、国基础科学研究院等研究机构在该领域做出了突出贡献。大学、大学、中科院化物所等研究机构的工作也比较突出。
《大学化学》期末考试试卷附答案 一、选择题(共15小题,每小题3分,共45分) 1、某反应的ΔrHmΘ<0 ,当温度升高时,其平衡常数的数值将()。 A、增大 B、不变 C、减小 D、先增大后减小 2、当主量子数n=3时,则角量子数l的取值为()。 A、1、2、 B、 0、1、2 C、0、1 D、0、±1、 3、某温度下,反应2NO(g)+O2(g)=2NO2(g)达到平衡,是因为()。 A、反应已停止 B、反应物中的一种已消耗完 C、正逆反应的速率相等 D、反应物均已消耗完毕 4、下列化合物晶体中,既存在离子键又存在共价键的是()。 A、H2O B、 NaBr C、 CH3OH D、Na2O2 5、蔗糖的凝固点为()。 A、0℃ B、高于0℃ C、低于0℃ D、无法判断 6、已知某元素核外电子排布式为1s22s22p2,该元素在周期表中所属的分区为()。 A、 s区 B、d区 C、 f区 D、 p区 7、质量作用定律只适用于()。 A、实际上能进行的反应 B、一步完成的简单反应 C、化学反应方程式中反应物和产物的化学式系数均为1的反应 D、已进行完的反应 8、对于反应 Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O,其ΔrGm= –nFE,式中n等于()。 A、1 B、6 C、3 D、12 9、下列物质中熔点最高的是()。 A、Si B、CO2 C、ZnS D、Fe3C 10、下列叙述中错误的是( )。 A、原电池的反应是氧化还原反应 B、原电池的能量变化是由化学能变为电能 C、原电池的能量变化是由电能变为化学能 D、原电池的负极发生氧化反应 11、某元素原子的外层电子构型为3s23p3原子中未成对电子数为()。 A、1 B、2 C、3 D、0 12、等温等压下且不做非体积功条件下,反应自发进行的判据是()。 A、ΔHΘ<0 B、ΔSΘ<0 C、ΔG<0 D、ΔfHmΘ<0