
河南鹤壁2018届高三毕业班调研试题
化学
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 K 39 Fe 56 Sr 88 I 127
第I卷选择题
一、选择题:本大题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.《物理小识》中有如下叙述:“青矾厂气熏人,衣服当之易烂,栽木不茂”。“青矾厂气”指的是A.CO和CO2B.SO2和SO3
C.NH3和NO D.NO2和H2S
2.古“丝绸之路”我国商人运出的货物有:①丝绸、②茶叶、③白糖、④瓷器、⑤纸张、⑥植物油、⑦明矾、⑧金银铜器等。下列说法正确的是
A.④、⑦、⑧都属于盐类
B.①、③、⑤、⑥都属于高分子化合物
C.①、②、⑤、⑥都属于蛋白质
D.①、②、③、⑤、⑥的主要成分都属于有机物
3.四元轴烯t、苯乙烯b及立方烷c的分子式均为C8H8。下列说法正确的是
A.b的同分异构体只有t和c两种
B.t、b、c的二氯代物均只有三种
C.t、b、c中只有t的所有原子处于同一平面
D.t、b、c中只有t和b能使酸性KMnO4溶液褪色
4.设N A为阿伏加德罗常数的值。下列说法正确的是
A.常温常压下,5.6L甲烷和乙烯的混合气体中含氢原子数为N A
B.1L 0.2mol·L-1NaHCO3溶液中含Na+数为0.2N A
C.4.6g钠用铝箔包裹并刺小孔,与足量水充分反应生成氢气分子数为0.1N A
D.反应NH4Cl+NANO2微热
N2↑+NaCl+2H2O,每生成0.1mol N2,转移电子数为0.6N A
5.化学在生活中有着广泛的应用,下列对应关系错误的是
6.下列指定反应的离子方程式书写正确的是
A.氯气通入水中:Cl2+H2O====2H++Cl-+ClO-
B.浓氨水中通入少量二氧化硫:SO2+NH3·H2O===NH4++HSO3-
C.铜丝插入稀硝酸中:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
D.明矾溶液与足量Ba(OH)2溶液反应:Al3++4OH-=AlO2- +2H2O
7.下列有关实验的操作正确的是
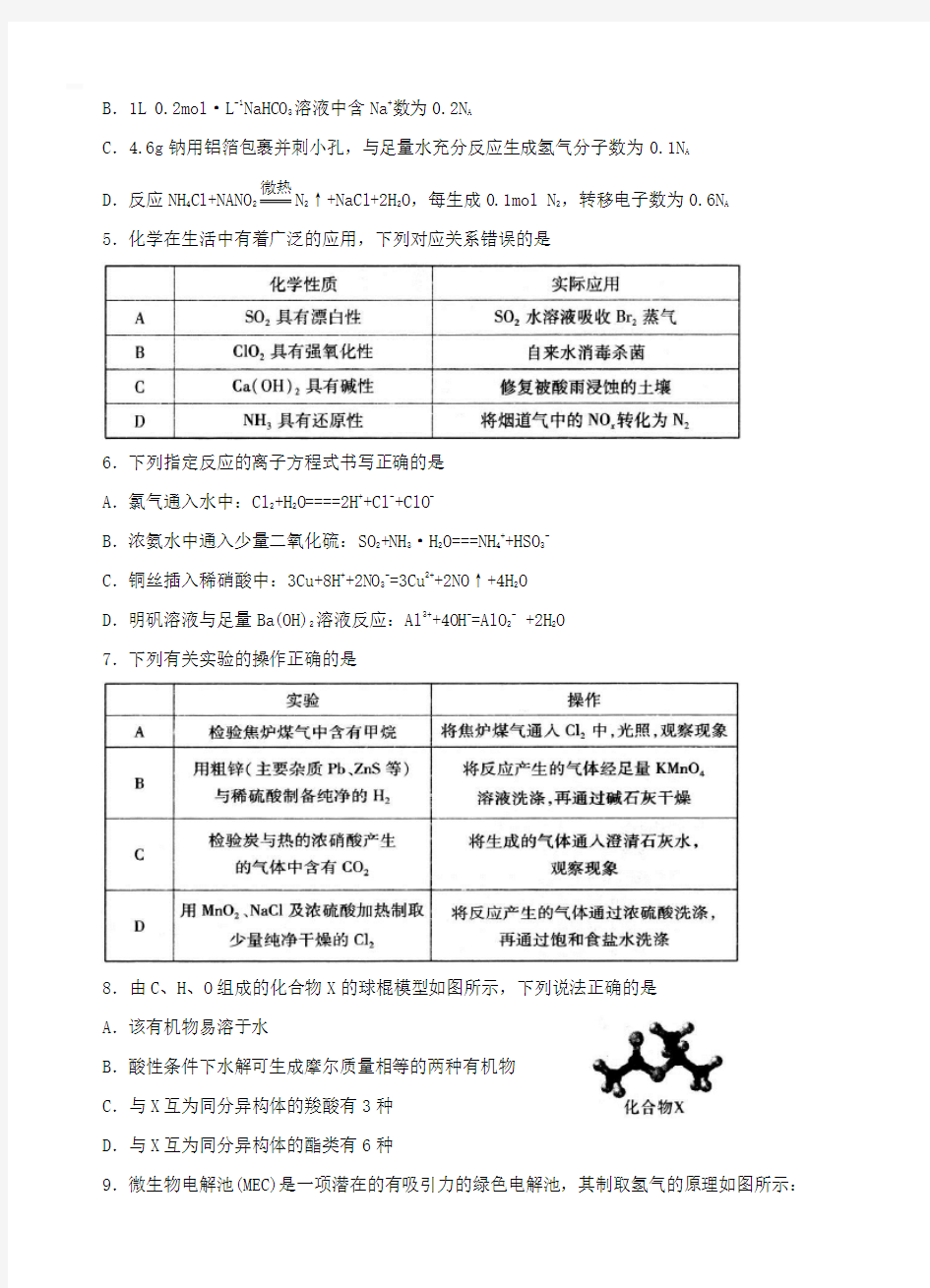
8.由C、H、O组成的化合物X的球棍模型如图所示,下列说法正确的是
A.该有机物易溶于水
B.酸性条件下水解可生成摩尔质量相等的两种有机物
C.与X互为同分异构体的羧酸有3种
D.与X互为同分异构体的酯类有6种
9.微生物电解池(MEC)是一项潜在的有吸引力的绿色电解池,其制取氢气的原理如图所示:
下列说法正确的是
A.MEC可在高温下工作
B.电解池工作时,化学能转变为电能
C.活性微生物抑制反应中电子的转移
D.阳极的电极反应式为CH3COO-+4H2O-8e-====2HCO3-+9H+
10.叔丁基氯与碱溶液经两步反应得到叔丁基醇,反应(CH3)3CCl+OH-→ (CH3)3COH+Cl-的能量与反应进程如图所示:
下列说法正确的是
A.该反应为吸热反应
B.(CH3)3C+比(CH3)3 CCl稳定
C.第一步反应一定比第二步反应快
D.增大碱的浓度和升高温度均可加快反应速率
11.某白色粉末由两种物质组成,取少量样品加入适量水中有少量气泡并有少量不溶物,再向其中加入足量盐酸,固体不溶解;将上述悬浊液过滤,滤渣中加入浓硝酸并加热,固体全部溶解。则可推得该白色粉末可能为
A.Na2S2O3、NaHSO4 B.NaHCO3、KA1(SO4)2·12H2O
C.Na2SiO3、NH4Cl D.(NH4)2SO4、Ba(OH)2
12.短周期元素W、X、Y、Z的原子序数依次增加。W、X、Y简单离子的电子层结构相同,X元素在短周期主族元素中原子半径最大;W的简单氢化物常温下呈液态,Y的氧化物和氯化物熔融时都能导电,X、Y 和Z原子的最外层电子数之和为10。下列说法正确的是
A.单质沸点:W B.原子半径:W C.工业上采用电解Y的氧化物冶炼单质Y D.W、X、Z三种元素组成的化合物水溶液一定显碱性 13.下列实验操作、现象及得出的结论均正确的是 14.将体积均为V0的三种溶液分别加水稀释至体积为V时,pH与V0/V的关系如下图所示: 下列说法正确的是 A.酸性:HX>HY B.HX溶液滴定NaOH溶液时指示剂用甲基橙比用酚酞误差小 C.“HX+NaX-混合溶液中,V0/V=10-1时,c(HX) D.V0/V在10-1~10-3,“HX+NaX”混合溶液随V0/V的减小,X-的水解与HX的电离程度始终保持不变 第Ⅱ卷非选择题 二、非选择题:本大题包括必考题和选考题两部分。第15~18题为必考题。每个试题考生都必须作答。第19~20题为选考题,考生根据要求作答。 (一)必考题:共43分。 15.(8分)砷及其化合物广泛用于制造半导体材料以及用于医疗、农药等。回答下列问题: (1)砷与氮同主族,原子序数比氮大26,则砷在元素周期表中的位置是;砷化氢的电子式为。 (2)H3AsO3又叫路易斯酸,是一种弱酸,发生酸式电离是通过和水中的氢氧根离子结合实现的,则第一步电离方程式为;若常温时H3AsO3的第一步电离常数 K a1=1.0×10-9,则常温下,0.1mol·L-1的H3AsO3溶液的pH为。 (3)利用可逆的氧化还原反应AsO-3 4+2I-+2H+AsO-3 3 +I2+H2O可以设计为原电池,起始时在甲、乙两池中分 别加入图示药品并连接装置。 ①起始时,甲池石墨棒C1上发生的电极反应为。 ②一段时间后指针不发生偏转。欲使指针偏转方向与起始时相反,应采取的可行措施是 (举一例)。 16.(12分)三氯化磷是一种无色液体,熔点-93.6℃,沸点76.1℃,PCl3遇到水蒸气剧烈反应。实验室利用下列装置制备三氯化磷。 (1)仪器W的名称是,其作用是。 (2)盛P2O5的长玻璃管的作用是, 浓硫酸的作用是。 (3)实验室用KMnO4与浓盐酸制取氯气的离子方程式为。 (4)氯气通入烧瓶中会发生燃烧,说明P4与Cl2反应的△H 0(填“>”或“<”)。 (5)烧瓶中得到的产物除PCl3外还可能含有 (填化学式),进一步精制的方法 是。 (6)PCl3与H2O反应的化学方程式为。 17.(11分)一种可利用含碘废水制取KI的实验流程如下: 回答下列问题: (1)含碘废水中碘的存在形式一般有I2、I-。检验是否含I2及I-的方法是用CCl4萃取后观察萃取液为紫色,证明含有I2,反复萃取后取水层少许于试管中, 。 (2)“制CuI”时,I2被还原为CuI,同时有S4O 2 生成。 6 ①该反应的离子方程式为。 ②已知上述反应的平衡常数为1.78×1026,实验中需控制CuSO4过量2%,其目的 是。 (3)“制FeI2溶液”的化学方程式为;“滤渣3”的成分是(填化学式)。 (4)用HI调节溶液pH约为6,其目的是。 (5)准确称取产品0.1000g溶于50mL水,加入适量乙酸并加入曙红钠指示剂,然后用0.025mol·L-1AgNO3溶液滴定,至终点时消耗AgNO3溶液22.00mL,则产品中KI的质量分数为 (保留三位有效数字)。 18.(12分)利用铜—氯热化学循环可制取氢气,主要流程如下: 回答下列问题: (1)图中属于氧化还原反应的是 (填序号)。 (2)已知25℃时,K sp(CuOH)=2.0×10-15,K sp(CuC1)=1.0×10-6,则反应CuC1(s)+H2O(1) CuOH(s)+Cl-(aq)+H+(aq)的平衡常数K= (填数值)。 (3)已知: Cl2(g)+H2O(g)==2HCl(g)+1/2O2(g) △H1 2CuCl(s)+2HCl(g)==2CuCl2(s)+H2(g) △H2 Cl2(g)+2CuCl(l)==2CuCl2(s) △H3 CuC1(l)==CuC1(s) △H4 则反应H2O(g)==H2(g)+1/2O2(g) △H= (用△H1、△H2、△H3、△H4表示)。 (4)反应Ⅱ若在水溶液中进行可用惰性电极电解实现,其装置如下图所示。阳极的电极反应式为;电解过程中阳极周围溶液的pH (填“升高”或“降低”)。 (5)反应I是可逆反应,工业上也常用该反应生成的HC1制取氯气,反应为4HCl(g)+O2(g) 2Cl2(g)+2H2O(g),在不同起始投料比m下,HC1平衡转化率随温度的变化关系如下图所示: ①该反应的正反应为热反应(填“放”或“吸”)。 ②图中m2 m1(填“>”或“<”)。 ③p kPa下,A点对应温度下反应的平衡常数K p= kPa-1(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,列出计算式即可)。 (二)选考题:共15分。请考生从给出的两道题中任选一题作答。如果多做。则按所做的第一题计分。 19.化学·选修3:物质结构与性质(15分) 铁及其化合物用途非常广泛,如二茂铁可用作火箭燃料添加剂,铁酸锶用于直流电机永久陶瓷磁铁。用环戊二烯钠法制备二茂铁(如图)的原理为 C5H6+NaOH→C5H5Na+H2O;2C5H5Na+FeCl2→(C5H5)2Fe+2NaCl。 (1)铁元素的基态价电子排布式为。 (2)基态Na原子中,核外电子占据的最高能级的符号是,占据该能层电子的电子云轮廓图形状为。Na和K属于同一主族,但金属Na的熔点比金属K高,原因 是。 表示,其中m代表 (3)(C5H5)2Fe中阴离子中的σ键总数为个。分子中的大π键可用符号II n m ),则 参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Ⅱ6 6 中的大π键应表示为。 (4)用二乙胺法合成二茂铁的原料有(C2H5)2NH、FeCl2·4H2O及C5H6。(C2H5)2NH分子中采用sp3杂化的原子是;FeCl2·4H2O是一种配合物,其结构如图所示,Fe2+与配体之间形成的化学键称为。 (5)铁酸锶的晶胞结构如下图所示: ①晶胞中距离最近的两个氧原子的距离为 cm(列出计算表达式即可)。 ②该晶体的密度为 g·cm-3(列出计算表达式即可)。 20.化学·选修5:有机化学基础(15分) 化合物H是一种香料,其合成路线如下: 回答下列问题: (1)A的化学名称为,H中含氧官能团名称是。 (2)A生成B的反应类型是,C生成D的反应类型是。 (3)B的结构简式为,E的结构简式为。 (4)F与足量NaOH溶液反应的化学方程式为。 (5)芳香化合物X是G的同分异构体,X与金属钠不反应,其核磁共振氢谱显示有4种不同化学环境的氢,写出1种符合要求的X的结构简式:。 (6)写出以1,2-二氯环戊烷和丙烯酸甲酯为原料制备的合成路线: (其他试剂任选)。