
高考化学专题:物质的量浓度计算
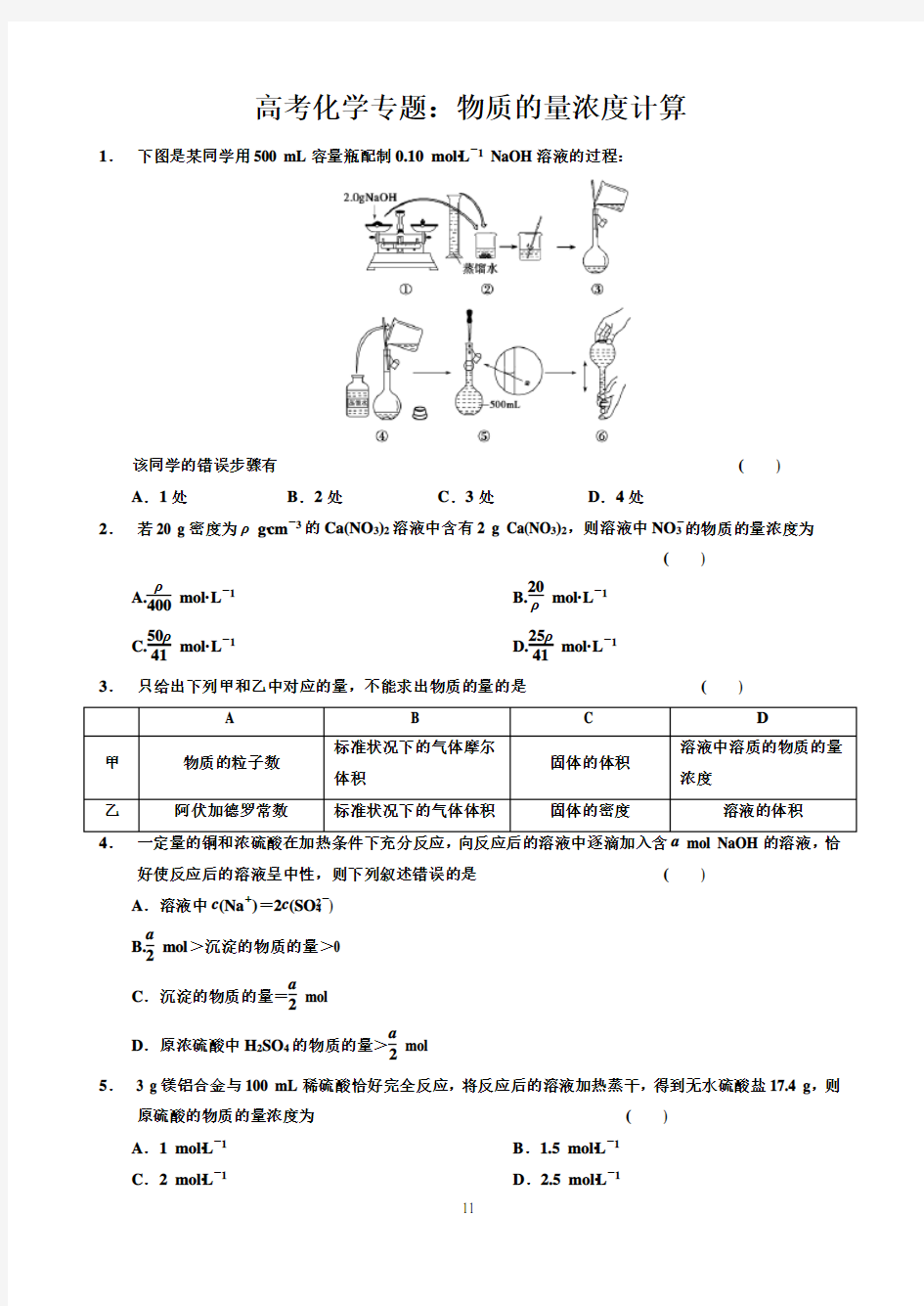
1. 下图是某同学用500 mL 容量瓶配制0.10 mol·L -
1 NaOH 溶液的过程:
该同学的错误步骤有
( )
A .1处
B .2处
C .3处
D .4处
2. 若20 g 密度为ρ g·cm -
3的Ca(NO 3)2溶液中含有2 g Ca(NO 3)2,则溶液中NO -
3的物质的量浓度为
( )
A.ρ400
mol·L -
1 B.20ρ mol·L -1 C.
50ρ41
mol·L -
1
D.
25ρ41 mol·L -
1 3. 只给出下列甲和乙中对应的量,不能求出物质的量的是
( )
A B
C D
甲 物质的粒子数 标准状况下的气体摩尔体积
固体的体积 溶液中溶质的物质的量浓度
乙
阿伏加德罗常数
标准状况下的气体体积
固体的密度
溶液的体积
好使反应后的溶液呈中性,则下列叙述错误的是 ( )
A .溶液中c (Na +
)=2c (SO 2-
4) B.a
2
mol >沉淀的物质的量>0 C .沉淀的物质的量=a
2
mol
D .原浓硫酸中H 2SO 4的物质的量>a
2
mol
5. 3 g 镁铝合金与100 mL 稀硫酸恰好完全反应,将反应后的溶液加热蒸干,得到无水硫酸盐17.4 g ,则
原硫酸的物质的量浓度为
( )
A .1 mol·L -
1 B .1.5 mol·L -
1 C .
2 mol·L -1
D .2.5 mol·L -
1
6.等质量的CuO和MgO粉末分别溶于相同体积的硝酸中完全溶解,得到的Cu(NO3)2和Mg(NO3)2溶液的浓度分别为a mol·L-1和b mol·L-1,则a与b的关系为()
A.a=b B.a=2b
C.2a=b D.a=5b
7.300 mL Al2(SO4)3溶液中,含Al3+为1.62 g,在该溶液中加入0.1 mol·L-1 Ba(OH)2溶液300 mL,反应后溶液中SO2-4的物质的量浓度为()
A.0.4 mol·L-1B.0.3 mol·L-1
C.0.2 mol·L-1D.0.1 mol·L-1
8.在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g·cm-3,溶质的质量分数为w,溶质的物质的量浓度为c mol·L-1。下列叙述中正确的是()
①w=
35a
22.4Vρ×100%②c=
1 000a
22.4V③若上述溶液中再加入V mL水后,所得溶液的质量分数大于
0.5w④若上述溶液中再加入0.5V mL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为
c(NH+4)>c(Cl-)>c(OH-)>c(H+)
A.①④B.②③C.①③D.②④
9.右图是NaCl、MgSO4的溶解度曲线。下列说法正确的是()
A.只有在t1℃时,NaCl和MgSO4的溶解度才相等
B.t1~t2℃,MgSO4的溶解度随温度升高而减小
C.在t2℃时,MgSO4饱和溶液的溶质质量分数最大
D.把MgSO4饱和溶液的温度从t3℃降至t2℃时,有晶体析
出
10.36.5 g HCl溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为W,物质的量浓度为c mol·L-1,N A表示阿伏加德罗常数,则下列叙述中正确的是
()
A.所得溶液的物质的量浓度:c=1 mol·L-1
B.所得溶液中含有N A个HCl分子
C.36.5 g HCl气体占有的体积为22.4 L
D.所得溶液的质量分数:W=36.5 c/(1 000ρ)
11.试回答下列问题。
(1)已知24 g A和40 g B恰好完全反应生成0.4 mol C和32 g D,则C的摩尔质量为________。
(2)把1 mol Na和1 mol Mg分别投入到等量且过量的盐酸中,分别得到溶液a和b,则溶液a和b的
质量关系为m a________m b。
(3)如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试根据标签上的有关数据回答下列问题:
盐酸
分子式:HCl
相对分子质量:36.5
密度:1.19 g·cm -
3 HCl 的质量分数:36.5%
①该浓盐酸中HCl 的物质的量浓度为______ mol·L -
1。
②标准状况下,1.00 L 水(密度为1.00 g·cm -
3)吸收________ L 的HCl 可制得上述浓盐酸。
12.奶粉中蛋白质含量的测定往往采用“凯氏定氮法”,其原理是食品与硫酸和催化剂一同加热,使蛋白
质分解,分解的氨与硫酸结合生成硫酸铵。然后碱化蒸馏使氨游离,用硼酸吸收后再以硫酸或盐酸标准溶液滴定,根据酸的消耗量乘以换算系数,即为蛋白质含量。 操作步骤:
①样品处理:准确称取一定量的固体样品奶粉,移入干燥的烧杯中,经过一系列的处理,待冷却后移入一定体积的容量瓶中。
②NH 3的蒸馏和吸收:把制得的溶液(取一定量),通过定氮装置,经过一系列的反应,使氨变成硫酸铵,再经过碱化蒸馏后,氨即成为游离态,游离氨经硼酸吸收。
③氨的滴定:用标准盐酸溶液滴定所生成的硼酸铵,由消耗的盐酸标准液计算出总氮量,再折算为粗蛋白含量。 试回答下列问题:
(1)在样品的处理过程中使用到了容量瓶,怎样检查容量瓶是否漏水?
________________________________________________________________________ ________________________________________________________________________。 (2)在配制过程中,下列哪项操作可能使配制的溶液的浓度偏大( ) A .烧杯中溶液转移到容量瓶中时,未洗涤烧杯 B .定容时,俯视刻度线 C .定容时,仰视刻度线 D .移液时,有少量液体溅出
(3)若称取样品的质量为1.5 g ,共配制100 mL 的溶液,取其中的20 mL ,经过一系列处理后,使N 转变为硼酸铵然后用0.1 mol·L -1
盐酸滴定,其用去盐酸的体积为23.0 mL ,则该样品中N 的含量为
________。
[已知:滴定过程中涉及到的反应方程式:(NH 4)2B 4O 7+2HCl +5H 2O===2NH 4Cl +4H 3BO 3] 13.盐泥是氯碱工业中的废渣,主要成分是镁的硅酸盐和碳酸盐(含少量铁、铝、钙的盐)。实验室以盐泥
为原料制取MgSO 4·7H 2O 的实验过程如下: 29.0 g 盐泥
――→①水,调成泥浆②稀硫酸调pH 为1~2――→③煮沸
④过滤
滤液Ⅰ―→滤液Ⅱ―→产品
已知:①室温下K sp [Mg(OH)2]=6.0×10
-12
。②在溶液中,Fe 2+、Fe 3+、Al 3+
从开始沉淀到沉淀完全
的pH 范围依次为7.1~9.6、2.0~3.7、3.1~4.7。③三种化合物的溶解度(S )随温度变化的曲线如图所示。
(1)在盐泥中加入稀硫酸调pH 为1~2以及煮沸的目的是_____________________。
(2)若室温下的溶液中Mg 2+
的浓度为6.0 mol·L -
1,则溶液pH ≥________才可能产生Mg(OH)2沉淀。 (3)由滤液Ⅰ到滤液Ⅱ需先加入NaClO 调溶液pH 约为5,再趁热过滤,则趁热过滤的目的是__________________,滤渣的主要成分是______________________。
(4)从滤液Ⅱ中获得MgSO 4·7H 2O 晶体的实验步骤依次为①向滤液Ⅱ中加入______________;②过滤,得沉淀;③________________;④蒸发浓缩,降温结晶;⑤过滤、洗涤得产品。
(5)若获得的MgSO 4·7H 2O 的质量为24.6 g ,则该盐泥中镁[以Mg(OH)2计]的百分含量约为________(MgSO 4·7H 2O 的相对分子质量为246)。
14.已知硫酸、氨水的密度与所加水的量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回
答下列问题:
溶质的物质的量 浓度/mol·L -
1
溶液的密度/g·cm -
3
硫酸 c 1 ρ1 氨水
c 2
ρ2
(1)表中硫酸的质量分数为________(不写单位,用含c 1、ρ1的代数式表示)。 (2)物质的量浓度为c 1 mol·L
-1
的硫酸与水等体积混合(混合后溶液的体积变化忽略不计),所得溶液的
物质的量浓度为________ mol·L -
1。 (3)将物质的量浓度分别为c 2 mol·L
-1
和15
c 2 mol·L -
1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm -3,所得溶液的物质的量浓度________35c 2 mol·L -
1(设
混合后溶液的体积变化忽略不计)。
专题突破答案
1. 答案 C
解析 第①步不能把NaOH 放在称量纸上称量;第④步玻璃棒应接触容量瓶内壁刻度
线以下的部分;第⑤步定容时应平视刻度线。 2. 答案 C 3. 答案 C 4. 答案 C
解析 铜和浓硫酸反应后的溶液中含有CuSO 4和H 2SO 4,加入含a mol NaOH 的溶液后显中性,此时溶液中的溶质为Na 2SO 4,Cu 2+
完全沉淀,A 项正确;n (CuSO 4)<a 2 mol ,
故B 项正确,C 项错;由于有一部分浓硫酸被还原为SO 2,故n (H 2SO 4)>a
2 mol ,D
项正确。 5. 答案 B
解析 由镁铝合金到无水硫酸盐,固体增重的质量为SO 2-
4的质量,则n (H 2SO 4)=n (SO 2-4)=(17.4-3) g 96 g·mol -1=0.15 mol ,故c (H 2SO 4)=0.15 mol 0.1 L =1.5 mol·L -1,B 对。 6. 答案 C
解析 该溶液中,n (CuO)∶n (MgO)=
m M (CuO )∶m M (MgO )=m 80∶m
40
=1∶2,体积相同
时,物质的量的比等于物质的量浓度的比,所以a b =n (CuO )n (MgO )=1
2,即2a =b ,故选C 。
7. 答案 D
解析 n (Al 3+)= 1.62 g 27 g·mol -1=0.06 mol ,则n (SO 2-4)=0.09 mol ,加入的Ba(OH)2溶液中含Ba 2+
0.03 mol ,反应后剩余SO 2-
4 0.06 mol ,此时溶液的体积为600 mL ,因此c (SO 2-
4)=0.1 mol·L -
1。 8. 答案 D
解析 ①w =a 22.4×17Vρ×100%=17a
22.4Vρ×100%;②c =a 22.4V 1 000=1 000a 22.4V
;③因为V mL
水的质量大于V mL 氨水的质量,所以溶液的质量分数小于0.5w ;④所得溶液为NH 4Cl 和NH 3·H 2O 等物质的量的混合液,所以c (NH +
4)>c (Cl -
)>c (OH -
)>c (H +
)。 9. 答案 C
解析 A 项,t 1 ℃、t 3 ℃时,NaCl 、MgSO 4的溶解度相等;B 项,t 2之前,MgSO 4
的溶解度随温度的升高而增大,t2之后,随温度的升高而降低;C项,w=S
100+S
×100%,S越大,w越大;D项,把MgSO4饱和溶液的温度从t3℃降至t2℃时,由饱和溶液变成不饱和溶液,不会有晶体析出。
10. 答案 D
解析A错误,36.5 g HCl的物质的量是1 mol,但溶液的体积不是1 L,所以所得溶液的物质的量浓度不是1 mol·L-1;B错误,36.5 g HCl的物质的量是1 mol,但在溶液中HCl完全电离,溶液中不存在HCl分子;C错误,因为题中没有给定温度和压强,所以不能确定气体所占有的体积;D选项正确,这是物质的量浓度与溶液的质量分数之间换算的重要公式,要求学生能够掌握并能运用。
11. 答案(1)80 g·mol-1(2)=(3)①11.9②353
解析(1)由质量守恒定律可知生成m(C)=24 g+40 g-32 g=32 g,故M(C)=
32 g/0.4 mol=80 g·mol-1。(2)把1 mol Na和1 mol Mg分别投入到等量且过量的盐酸中,充分反应后均引起溶液增重22 g,故反应后两溶液质量仍相等。(3)①假设取该盐酸1 L,则溶液中含有n(HCl)=[(1 000 mL×1.19 g·mL-1)×36.5%]/36.5 g·mol-1=
11.9 mol,故其物质的量浓度为11.9 mol·L-1。②设需吸收x L HCl,则
x L 22.4 L·mol-1
÷[(36.5 g·mol-1×
x L
22.4 L·mol-1
+1 000 g)÷1.19 g·mL-1]×1 000 mL·L-1=11.9 mol·L-1,解得x=353。12.
答案(1)往容量瓶中注入一定量的水,塞紧瓶塞,倒转过来,观察是否漏水,然后再正放,旋转瓶塞180°,再倒转过来,观察是否漏水,若都不漏水,则说明该容量瓶不漏水
(2)B(3)10.73%
解析(1)容量瓶的检漏方法是往容量瓶中注入一定量的水,塞紧瓶塞,倒转过来,观察是否漏水,然后再正放,旋转瓶塞180°,再倒转过来,观察是否漏水,若都不漏水,则说明该容量瓶不漏水。
(2)由c=n/V判断:A、D选项中使n偏小,浓度偏小;B选项中俯视刻度线,使V偏小,浓度偏大;C选项中仰视刻度线,使V偏大,浓度偏小。
(3)n(N)=5n(HCl)=0.011 5 mol,该样品中N的含量
w =0.011 5 mol ×14 g·mol -
11.5 g ×100%≈10.73%。
13. 答案 (1)提高Mg 2+
的浸取率(其他合理答案均可) (2)8
(3)温度较高时钙盐与镁盐分离得更彻底(或高温下CaSO 4·2H 2O 溶解度小等合理答案均可) Al(OH)3、Fe(OH)3、CaSO 4·2H 2O
(4)NaOH 溶液 向沉淀中加足量稀硫酸(合理答案均可) (5)20.0%
解析 (1)加入H 2SO 4可以使Mg 的硅酸盐或碳酸盐充分转化成Mg 2+
。(2)c (OH -
)=6.0×10
-12
6.0
mol·L -1=10-6 mol·L -1,所以pH =8。(3)加入NaClO ,可以把Fe 2+
氧
化成Fe 3+
,当pH 大约为5时,Fe 3+
、Al 3+
转化成沉淀;根据溶解度曲线,温度高时,CaSO 4·2H 2O 的溶解度更小,所以滤渣的主要成分为Al(OH)3、Fe(OH)3和CaSO 4·2H 2O 。(4)使Mg 2+
转化成MgSO 4·7H 2O 的步骤为①加入NaOH 溶液。②过滤得Mg(OH)2沉淀。③加入稀H 2SO 4。④蒸发浓缩、降温结晶、过滤得产品。(5)根据镁元素守恒得24.6 g 246 g·mol
-1×58 g·
mol -
129.0 g ×100%=20%。
14. 答案 (1)9.8c 1
ρ1
% (2)c 1/2 (3)大于 大于
解析 (1)设硫酸的体积为1 L ,则w (H 2SO 4)=1×c 1×981×103×ρ1×100%=9.8c 1
ρ1%。(2)硫酸与水等体积混合(混合后溶液的体积变化忽略不计),溶液的体积变为原来的2倍,则浓度为
c 12
mol·L -1。(3)根据图像可知,氨水的浓度越大,密度越小,则c 2 mol·L -1氨水的密度小于15c 2 mol·L -1氨水的密度,等质量时,15c 2 mol·L -1氨水的体积小于c 2 mol·L -
1氨
水的体积。两者混合后,所得溶液的密度一定比ρ2大,所得溶液的物质的量浓度趋近于体积大者,故大于35c 2 mol·L -
1。