臭氧催化氧化计算书电子教案
- 格式:docx
- 大小:163.66 KB
- 文档页数:8

臭氧均相催化氧化的工艺以臭氧均相催化氧化的工艺为标题,下面将介绍臭氧均相催化氧化的原理、应用和优缺点。
一、臭氧均相催化氧化的原理臭氧均相催化氧化是一种利用臭氧分子作为氧化剂,在均相条件下进行氧化反应的工艺。
臭氧是一种具有强氧化性能的分子,能够与有机物发生氧化反应,将其分解为较低分子量的无机物。
臭氧均相催化氧化的原理主要包括两个步骤:生成臭氧和催化氧化反应。
首先,通过臭氧发生器产生臭氧,一般采用电晕放电法或紫外线法。
其次,在反应器中,将产生的臭氧与待处理的有机物混合,加入催化剂进行反应。
催化剂可以提高反应速率和效率,常用的催化剂有金属氧化物、金属络合物等。
二、臭氧均相催化氧化的应用1. 废水处理:臭氧均相催化氧化广泛应用于废水处理领域。
臭氧能够高效地氧化有机废水中的有害物质,如苯、酚、酮类化合物等。
通过臭氧均相催化氧化,有机废水中的有害物质可以被分解为无害的无机物,提高废水的处理效果。
2. 大气污染治理:臭氧均相催化氧化也可以用于大气污染治理。
臭氧可以氧化大气中的有机物和有害气体,如挥发性有机物、二氧化硫等。
臭氧均相催化氧化可以将这些有害物质转化为无害的无机物或降解为较低的分子量,减少大气污染物的排放。
3. 化学合成:臭氧均相催化氧化还可以应用于化学合成领域。
臭氧可以作为一种强氧化剂,用于有机合成反应中的氧化步骤。
通过臭氧均相催化氧化,可以高效地将有机物氧化为目标产物,提高合成反应的收率和选择性。
三、臭氧均相催化氧化的优缺点1. 优点:(1)高效性:臭氧作为氧化剂具有高氧化能力,能够快速分解有机物,提高反应速率和效率。
(2)无二次污染:臭氧均相催化氧化能够将有机物氧化为无害的无机物,不会产生二次污染物。
(3)广泛适用性:臭氧均相催化氧化适用于各种有机物的氧化反应,具有广泛的应用前景。
2. 缺点:(1)成本较高:臭氧的制备和催化剂的使用都需要一定的成本投入,增加了工艺的经济性。
(2)操作复杂:臭氧均相催化氧化需要控制反应条件和催化剂的投加量,操作较为复杂。

光催化臭氧氧化法(臭氧紫外线法)此法是在投加臭氧的同时辅以紫外光照射,其效率大大高于单一紫外法和单一臭氧法。
这一方法不是利用臭氧直接与有机物反应,而是利用臭氧在紫外线的照射下分解的活泼的次生氧化剂来氧化有机物。
03/UV工艺机理的解释有目前有两种:Okabe认为,当03被紫外光照射时,首先产生游离氧自由基((O),然后,.O 与水反应产生.-OH.03一=hv(310nm)一 ,O。
十OZO,+H2口-> 20H,而Glaze等人则认为,031UV过程首先产生H202,然后H202在紫外光的照射下分解生成〃OH.1目前这一工艺真实可靠的机理还有待进一步深入研究。
Prengle等人在实验中首先发现了03/UV系统可显著地加快有机物的降解速率。
之后Glaze等人提出了03与UV之间的协同作用机理。
臭氧在紫外光辐射下会分解产生活泼的轻基自由基,再由轻基自由基氧化有机物。
因而它能氧化臭氧难以降解的有机物,如乙醛酸、丙二酸、乙酸等。
其中紫外线起着促进污染物的分解,加快臭氧氧化的速度,缩短反应的时间的作用。
此外,紫外线的辐射还能使有机物的键发生断裂而直接分解。
研究证明03/UV比单独臭氧处理更有效,只有在酸性时,臭氧才是主要的氧化剂,中性及碱性时氧化是按自由基反应模式进行的,在03/UV , 03情形下,酚及TOC的去除率随pH值升高而升高,在一定的pH时,三种方法的处理效果为q/UV>03>UV o施银桃等以300 W高压汞灯为光源,研究了紫外光联合臭氧化、单纯臭氧氧化及单纯紫外光照处理400 mg/L 的活性艳红K-2BP废水的可行性。
结果表明:光催化臭氧化可加速有机物的矿化。
在同样时间条件下,三者氧化能力由大至小为:UV/O3>单独O3>单独UV。
光催化臭氧化染料过程中,TOC随反应时间的增大而逐渐减小,表明反应过程中有部分有机物逐渐矿化为无机物。
TOC虽降低了,但最终TOC去除率仍大大低于脱色率,它表明反应只是把染料氧化为小分子有机物,并未完全矿化为CO2和水。

《氧化还原反应方程式的配平及计算》教案一、氧化还原反应方程式的配平1.氧化还原反应方程式配平的基本原则(1)得失电子守恒:氧化剂和还原剂得失电子总数相等,化合价升高总数=化合价降低总数。
(2)质量守恒:反应前后原子的种类和个数不变。
(3)电荷守恒:离子反应前后,阴、阳离子所带电荷总数相等。
2.氧化还原反应方程式配平的一般步骤(1)标价态:写出反应物和生成物的化学式,标出发生氧化反应和还原反应的元素的化合价。
C 0+HN +5O 3(浓)——N +4O 2↑+C +4O 2↑+H 2O(2)列变化:标出反应前后元素化合价的变化。
(3)求总数:依据电子得失守恒,使化合价升高和降低的总数相等。
(4)配化学计量数:用观察法配平其他物质的化学计量数。
C +4HNO 3(浓)——4NO 2↑+CO 2↑+2H 2O(5)查守恒:检查电荷是否守恒,原子个数是否守恒,配平后,把单线改成等号,标注反应条件。
C +4HNO 3(浓)=====△4NO 2↑+CO 2↑+2H 2O1.配平下列氧化还原反应方程式(1)正向配平类①__HCl(浓)+__MnO 2=====△__Cl 2↑+__MnCl 2+__H 2O②__KMnO 4+__FeSO 4+__H 2SO 4===__K 2SO 4+__MnSO 4+__Fe 2(SO 4)3+__H 2O 答案 ①4 1 1 1 2 ②2 10 8 1 2 5 8(2)逆向配平类①__S +__KOH=====△__K 2S +__K 2SO 3+__H 2O②__Cl 2+__NaOH=====△__NaCl +__NaClO 3+__H 2O答案①36213②3651 3(3)缺项配平类[一般缺的为酸(H+)、碱(OH-)、水]①__MnO-4+__H2O2+____===__Mn2++__O2↑+__H2O②__Fe3++__SO2+__H2O===__Fe2++__SO2-4+____答案①256H+258②212214H+配平的基本方法(1)全变从左边配:氧化剂、还原剂中某元素化合价全变的,一般从左边反应物着手配平。


光催化氧化设计计算书
为满足全球日益增长的能源需求,将太阳能转化为化学能/热能具有很好的前景。
光媒介催化包括光催化(有机转化、水分解、CO2还原等)和光热催化,在光能与光物质相互作用的太阳能到化学/热能转化中起着关键作用。
传统的半导体光催化剂面临的主要挑战包括阳光利用不足、载流子的重组、活性位点暴露有限,特别是难以理解结构-活性关系。
通过理论计算研究光催化剂的电子结构及性质,光催化过程的反应机理、电子转移等可帮助我们更好的理解材料的结构-性能关系,可在原子/分子层面上,通过调控电子结构改善和预测材料的性能。
光催化氧化设计计算书包括以下内容:
1)态密度/能带结构:研究材料的电子结构。
2)吸附能:研究材料对反应物的俘获能力。
3)差分电荷分析:研究材料与吸附物间的电子转移。
4)化学反应路径:研究光催化过程的反应机理。


实验七臭氧.紫外指导书doc5篇第一篇:实验七臭氧.紫外指导书doc实验七臭氧、紫外光化学氧化实验一、实验目的(1)通过实验了解臭氧紫外杀菌的原理及处理方法。
(2)掌握实验操作的方法。
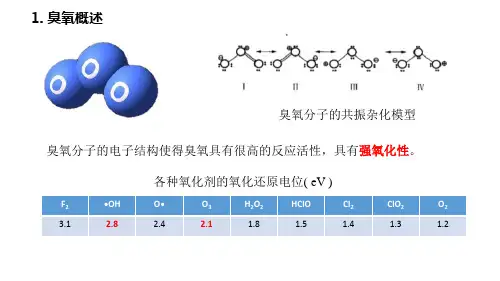
二、实验原理臭氧灭菌机理臭氧是氧的同素异性体,常温下是一种不稳定的淡紫色气体,有刺激腥味,微量时具有一种“清新”气味。
臭氧具有极强的氧化能力,在水中的氧化还原电位2.07V,仅次于氟电位2.87V,居第二位,它的氧化能力高于氯(1.36V)、二氧化氯(1.5V)。
正因为臭氧具有强烈的氧化性,所以它对细菌、霉菌、病毒具有强烈的杀灭性,这种作用通常是物理、化学、生物学方面的综合效果。
其机理可以是以下几个方面:⑴臭氧很容易同细菌的细胞壁中的脂蛋白或细胞膜中的磷脂质、蛋白质发生化学反应,从而使细菌的细胞壁和细胞受到破坏(即所谓的溶菌作用),细胞膜的通透性增加,细胞内物质外流,使其失去活性。
⑵臭氧破坏或分解细胞壁,迅速扩散进入细胞里,氧化了细胞内酶或 RNA、DNA,从而致死菌原体。
在高压强电场作用下,气体在电介质表面产生脉冲电晕放电,产生高浓度等离子体,电子和离子被强大电场力作用加速与气体分子碰撞,在10S内使氧分子分解成单原子氧,在数10S内原子氧和分子氧结合成臭氧:O2 +e →2O+2O2 → 2O3臭氧在水中是不稳定的,时刻发生还原反应,产生十分活泼的、具有强烈氧化作用的单元子氧(O),在产生瞬时,对水中细菌、微生物有机物质进行分解作用。
O3 → O2+(O);(O)+H2O → 2HO臭氧在水中的“半衰期”为20min(pH7.6时41min,p H10.4时为0.5min)。
人们把含有臭氧的水叫做臭氧水。
臭氧水对各种致病微生物均有极强的灭菌作用,臭氧在水中不稳定,发生强烈氧化还原反应,产生极活泼、具有强烈的氧化作用的单元子氧(O)、羟基(OH)。
羟基氧化还原电位为2.8V,相当于氟的氧化能力。
臭氧杀菌的影响因素臭氧杀菌的效果主要受其浓度、微生物种类、作用时间、温度、PH值、水的理化性质、杂质等因素影响。


催化臭氧氧化之均相催化氧化技术以催化臭氧氧化之均相催化氧化技术为标题的文章一、引言均相催化氧化技术是一种重要的氧化反应方法,能够在常温常压下将有机物氧化为有机酸、酮、醛等化合物。
其中,催化臭氧氧化技术作为一种高效的均相催化氧化技术,在环境保护和有机合成领域具有广泛应用前景。
二、催化臭氧氧化的原理催化臭氧氧化是利用催化剂促进臭氧分子与有机物发生氧化反应的过程。
催化剂通常为金属离子或过渡金属化合物,其作用是提供活性位点,吸附臭氧分子并激活臭氧分子中的氧原子。
臭氧分子激活后,与有机物发生反应,将有机物中的碳氢键氧化为羟基、羰基等功能团。
三、催化臭氧氧化的应用领域1. 环境保护领域:催化臭氧氧化技术可以将有机废水中的有害有机物进行有效降解,达到环境排放标准。
同时,催化臭氧氧化还可以有效去除大气中的有机污染物,提高空气质量。
2. 有机合成领域:催化臭氧氧化技术能够在有机合成中实现高效、高选择性的氧化反应。
通过调节催化剂的种类和反应条件,可以实现对不同官能团的选择性氧化,从而合成目标化合物。
四、催化臭氧氧化的优势和挑战1. 优势:(1)高效性:催化臭氧氧化技术在常温常压下能够高效完成氧化反应,提高反应速率和产率。
(2)环保性:催化臭氧氧化技术无需加热或高压条件,减少能源消耗和环境污染。
(3)选择性:通过选择合适的催化剂和反应条件,可以实现对特定官能团的选择性氧化。
2. 挑战:(1)催化剂的选择:不同的有机物需要不同的催化剂来实现有效氧化,催化剂的选择对反应效果至关重要。
(2)副反应的控制:催化臭氧氧化过程中,可能会产生一些副反应,如酸解、脱羧等,需要进一步研究和优化反应条件,以提高产率和选择性。
(3)催化剂的稳定性:催化剂的稳定性对反应的持续进行具有重要影响,需要开发更稳定的催化剂。
五、结论催化臭氧氧化技术作为一种高效的均相催化氧化技术,在环境保护和有机合成领域具有广泛应用前景。
通过调节催化剂的种类和反应条件,可以实现对不同官能团的选择性氧化,从而合成目标化合物。

催化燃烧课程设计计算一、教学目标通过本章节的学习,学生将掌握催化燃烧的基本原理、反应机理和计算方法。
知识目标包括:了解催化燃烧的定义、特点和应用领域;掌握催化燃烧的反应机理和动力学方程;学会使用催化燃烧的计算方法。
技能目标包括:能够运用催化燃烧的基本原理分析和解决实际问题;能够运用催化燃烧的计算方法进行简单的工程计算。
情感态度价值观目标包括:培养学生的环保意识,使学生认识到催化燃烧技术在环境保护中的重要作用;培养学生的创新精神,激发学生对催化燃烧技术研究的兴趣。
二、教学内容本章节的教学内容主要包括催化燃烧的基本原理、反应机理和计算方法。
首先,介绍催化燃烧的定义、特点和应用领域,使学生对催化燃烧有一个整体的认识。
其次,讲解催化燃烧的反应机理,包括催化剂的作用原理、反应路径和动力学方程。
然后,教授催化燃烧的计算方法,包括反应速率常数的确定、反应器的设计和优化等。
最后,通过实例分析,使学生能够将催化燃烧的基本原理和计算方法应用于实际问题的解决。
三、教学方法为了提高教学效果,本章节将采用多种教学方法相结合的方式进行教学。
首先,运用讲授法,系统地讲解催化燃烧的基本原理、反应机理和计算方法。
其次,采用讨论法,引导学生对催化燃烧的实际应用和未来发展进行思考和讨论。
同时,利用案例分析法,分析催化燃烧技术在环境保护和工业生产中的应用案例,使学生能够将理论知识与实际问题相结合。
最后,通过实验法,让学生亲自动手进行催化燃烧实验,加深对催化燃烧原理的理解和掌握。
四、教学资源为了支持本章节的教学内容和教学方法的实施,将选择和准备以下教学资源:教材《催化燃烧原理与应用》、参考书《化学反应工程》、多媒体资料(包括催化燃烧的原理动画、实验视频等)、实验设备(包括催化燃烧实验装置、分析仪器等)。
这些教学资源将有助于丰富学生的学习体验,提高学生的学习效果。
五、教学评估本章节的教学评估将采用多元化的评估方式,全面客观地评价学生的学习成果。
高中化学备课教案氧化还原反应的氧化数计算与电子转移方程高中化学备课教案:氧化还原反应的氧化数计算与电子转移方程一、引言在化学领域中,氧化还原反应是一类重要的化学反应。
它通过电子的转移来实现物质的氧化与还原过程。
本教案将介绍氧化还原反应中的氧化数计算和电子转移方程的相关知识。
二、氧化数的计算1. 氧化数的定义氧化数是指原子在化合物或离子中的电荷数。
它用来描述原子在化学反应中的电子转移情况。
在纯元素中,氧化数通常为零。
2. 氧化数的计算规则(1)单质元素的氧化数为零。
例如,氧的氧化数为零(O2)。
(2)单原子离子的氧化数等于电荷数。
例如,Na+的氧化数为+1。
(3)一些常见元素的氧化数有固定的值。
例如,氧的氧化数通常为-2,氢的氧化数通常为+1。
(4)化合物的总氧化数为零,离子的总氧化数为离子的电荷数。
利用这一规则可以推算出其他元素的氧化数。
3. 氧化数计算的例子(1)在H2SO4中,氧的氧化数为-2,氢的氧化数为+1,硫的氧化数如何计算呢?由于化合物H2SO4的总氧化数为零,根据计算规则可得:2 × (+1) + x + 4 × (-2) = 0化简得:2 + x - 8 = 0解方程可得:x = +6因此,硫的氧化数为+6。
(2)在KMnO4中,氧的氧化数为-2,钾的氧化数为+1,那么锰的氧化数如何计算呢?由于化合物KMnO4的总氧化数为零,可得:1 × (+1) + x + 4 × (-2) = 0化简得:1 + x - 8 = 0解方程可得:x = +7因此,锰的氧化数为+7。
三、电子转移方程的编写1. 电子转移的概念氧化还原反应中,电子的转移是实现物质氧化与还原的关键步骤。
编写电子转移方程可以明确指示反应中电子的流动方向与数量。
2. 编写电子转移方程的步骤(1)确定氧化和还原的物质,并标记其氧化数。
(2)计算物质氧化数的变化量,确定电子的输送方向。
(3)根据氧化数变化量以及电子的输送方向,编写电子转移方程。
内蒙古易高煤化科技有限公司膜系统浓水处理项目技术方案一非均相臭氧催化氧化技术山西晶凯科技有限责任公司2015年9月目录一、技术方案部分1. 项目概况 (3)2. 工艺简介 (3)二、投资及运行成本部分1. 运行成本 (12)2. 投资估算 (12)一、技术方案部分1.项目概况内蒙古易高煤化科技有限公司煤制甲醇生化废水反渗透浓水回用的同时,产生了一部分纳滤及反渗透浓水,这部分浓排水具有有机物含量高,含盐量高的特点,若要外排,其中CODcr、氨氮等主要指标要达到排放标准。
2.工艺简介2.1.处理水量膜浓缩水处理系统总体设计处理规模Q=40m3/h。
2.2.进水水质本系统进水为污水三膜法回用的浓排水,水质具体指标见下表:2.3. 产水要求产水CODcr ≤100mg/L ,氨氮≤15mg/L ,其它指标暂不做要求。
2.4. 工艺流程2.4.1 工艺的选择与评价图2-1 膜系统浓水处理工艺流程图2.4.2 工艺流程说明40m 3/h 纳滤、反渗透膜系统浓水分别进入混凝沉淀池,混凝沉淀池为新建处理设施,在混凝处理单元中采用中国科学院过程工程研究所研发的混凝专用药剂(KL-107),该药剂为高分子物质,通过网捕卷扫、架桥吸附、络合沉降等作用,脱除废水中相当一部分长链、环状极性有机物(主要为苯系衍生物等),进而确保经混凝处理后,废水中的相当一部分CODcr 、色度、悬浮物等得到去除。
废水经40m 3/h 清水池过泵提升进入多介质过滤器,悬浮物进一步降低,同时对后续催化氧化系统进行保护。
然后进入催化反应器中,在两级催化剂作用下,废水中无法生物降解的有机物被臭氧产生的羟基自由基氧化成容易生物降解的小分子有机物或部分矿化,处理出水进入后续氨氮脱除处理。
经过处理的废水进入加药单元,通过动态定量投加氯化镁和磷酸氢二钠,去除水中的氨氮。
出水CODcr、氨氮等达标后,进入清水池,定期外排。
2.4.3工艺特点1)混凝沉淀池来水进入混凝处理系统,混凝处理系统为新建处理设施,在混凝处理单元中投加转为煤化工废水而研发的特殊混凝药剂,有效去除水中的由极性物质提供的CODcr、色度等物质。
臭氧催化氧化计算书
一、进水条件
当用于处理废水时,除要求布水布气均匀外,还要注意调查分析进水来源状况,特别注意是否含有对催化剂产生危害的物质。
以下为部分重要的原水进水条件。
1.1pH
催化剂适宜的酸碱运行条件为pH=3~12,最佳的酸碱运行条件为pH=6-9,pH过低会影响催化剂寿命,并导致出水质量下降,pH过高会影响臭氧催化氧化的使用效果。
1.2温度
进水温度过高或者过低会影响臭氧的使用效果,也会对催化剂的催化效果产生影响,建议温度范围为10-30℃,最佳运行温度为25℃。
1.3氯化物
氯化物过高会对催化剂的使用效果产生影响,建议氯化物的浓度在5000mg/L以下,氯化物最佳浓度为500mg/L以下。
1.4臭氧投加方式
臭氧分子在水中的扩散速度与污染物的反应速度是影响去除效果的主要因素。
二、相关简图
1.1催化氧化填料
催化剂主要特点如下:
(1) 选用碘值高、吸附能力强、耐磨强度好、质量稳定可靠的优质活性炭为载体,制备的催化剂具有很大的比表面积和合适的孔结构;
(2) 在活性炭载体表面选择性的负载Fe、Mn等过渡金属活性组分及K、Na 等碱金属催化助剂,原位促进臭氧分解成羟基自由基并降解有机物;
(3) 催化剂的制备采用机械混合、成型、炭化和活化的生产工艺,活性组分在载体表面分散性良好。
催化剂填料图片如下:
臭氧催化氧化填料
规格参数如下:
1.2进水方式
臭氧催化高级氧化进水工艺流程
上游出水进入臭氧催化高级氧化池,首先进入臭氧催化高级氧化池第一段,从原水取一定比例的水进行循环,在离心泵管道上设置射流溶气装置,通过溶气装置投加臭氧,达到提高臭氧气体的溶解效率,并有效减少臭氧投加量。
溶解臭氧的污水,通过池底设置的二次混合设备,将含臭氧污水与原污水充分混合。
含臭氧的污水,混合后的污水流经固定填充的固相催化剂表面,催化剂表面具有不平衡电位差,在催化剂的作用下,激发产生羟基自由基,羟基自有基的氧化还原电位为E0=2.8ev,在如此高的氧化电位的作用下大部分难降解的有机物发生断链反应形成短链的有机物或直接被氧化至CO2和H2O。
第二段、第三段取水位置分别是第一段出水和第二段出水,同样采用高效臭氧溶气装置投加臭氧,原理与第一段相同。
通过三段投加,污水中难降解有机物被充分降解,使污水达到设计标准。
接触池内未溶解的臭氧需重新还原变为氧气,避免对大气环境造成污染。
在臭氧接触池池顶上设置有臭氧尾气分解处理设施,设计采用热触媒式臭氧尾气处理装置进行处理,将空气中残留臭氧还原为氧气,使尾气处理装置出口处臭氧浓度低于0.1ppm。
相关工程案例平面简图如下:
内部构造简图如下:
三、主要构筑物计算
1)设计总水量Q设计=K Z*Q实际
K Z为变化系数,通常取1.3;Q设计单位为m3/h。
2)总有效池容V有效=HRT*Q设计
HRT市政水取值1h,工业污水根据水质增加停留时间。
3)单座设计流量Q1=Q设计/n1
n1为座数,根据现场占地面积确定。
4)单座臭氧催化氧化反应池格数n2
反应池格数n2根据进水浓度、去除效果等因素确定,考
虑是否需要多格数串联,若多格串联,每格体积不变则臭
氧投加量逐步降低。
5)单格有效池容V单格=V有效/(n1* n2)
6)单位小时内COD消减量∆m COD=(C进水-C出水)*Q设计*1h
C进水为进水COD浓度;C出水为出水COD浓度,设计去除
率为30-75%。
7)单位小时内臭氧投加量m臭氧=k1*∆m COD
k1为臭氧用量与COD消减量质量比例关系,取值范围为
1:1-2:1,设计取值参考市政污水 1.2:1-1.5:1、工业污水
1.5:1-2:1。
8)臭氧发生器输出流量Q臭氧=m臭氧*k2/1h
1为单位时间,1h;k2为变化系数,通常取1.2。
9)单位时间臭氧气量Q气量= m臭氧/(1h*C臭氧浓度)
臭氧浓度根据设备效率确定; Q气量单位为m3/h。
10)臭氧催化氧化缓冲配水区高度h1=1.35-1.5m
11)总停留时间T=1h
有效池容V数值与单位小时设计进水量相同。
12)进水区高度h2=1.2-1.5m
13)滤板厚度h滤板=0.16m
工程案例套用0.16m钢筋混凝土。
14)鹅卵石厚度h鹅卵石= A1+A2+A3=0.15+0.15+0.15=0.45m
A1表示粒径200mm左右鹅卵石;A2表示粒径150mm左右鹅卵石;A3表示粒径100mm左右鹅卵石。
15)滤层停留时间t滤层=0.15-0.5h
16)滤层池容V滤层= V催化剂=Q进水*t滤层
V催化剂指改性活性炭催化剂添加量,单位m3。
17)滤料装填高度h3=V滤层/S或根据中试确定填料高度h3,则
S =V滤层/ h3
S表示构筑物底面积;h3高度要求市政水不低于1m,工业污水不低于2m。
18)滤料接触时间t接触时间= h3/ v滤速
v滤速取值范围为4-6m/h。
19)清水区高度h4
20)总有效水深H有效=V单格/S =h2+h滤板+h鹅卵石+ h3+ h4
h4高度根据此数值调整,多数取值2.5-3.5m,不固定。
21)总水深H=H有效+H超高
22)反洗风机强度Q反洗风机=S*k3
S,单位为m2,指构筑物底面积;k3指反洗强度,取值15L/(m2.s)。
23)反洗水强度Q反洗流量=S*k4
S,单位为m2,指构筑物底面积;k4指反洗强度,取值12L/(m2.s)。
24)催化剂费用15000元/m3。