有机化学(必修二)
- 格式:doc
- 大小:332.50 KB
- 文档页数:15


有机化合物(必修二)
第1节甲烷、乙烯、苯煤、石油、天然气的综合利用
考点1 常见烃的结构与性质
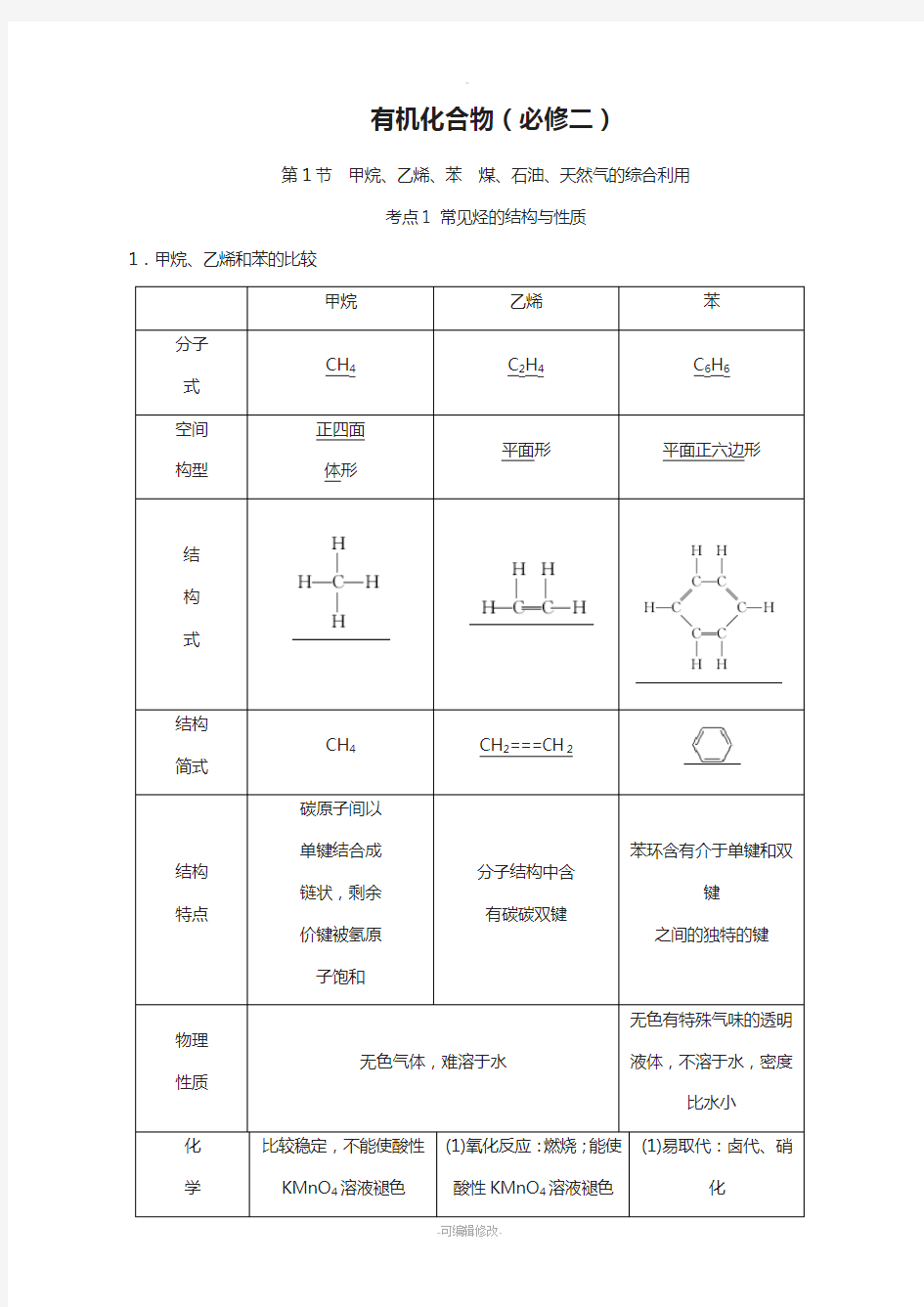
1.甲烷、乙烯和苯的比较
性 质
(1)氧化反应 (2)光照卤化 (取代反应)
(2)加成反应:使溴水褪色、与H 2O 加成生成乙
醇
(3)加聚反应:加聚生成聚
乙烯
(2)能加成:与H 2加成
生成环己烷 (3)难氧化:燃烧,但不能使酸性KMnO 4溶
液褪色
(1)氧化反应:写出甲烷、乙烯、苯燃烧反应的化学方程式 ①甲烷:CH 4+
2O 2――→点燃
CO 2+2H 2O
②乙烯:CH 2===CH 2+3O 2――→点燃2CO 2+2H 2O
③苯:
+15O 2――→点燃
12CO 2+6H 2O
(2)取代反应:有机物分子里的某些原子或原子团被其他原子或原子团所替代的反应。 ①完成甲烷与Cl 2发生取代反应的化学方程式:
②完成下列关于苯的取代反应的化学方程式:
(3)加成反应:
①定义:有机物分子中的不饱和碳原子与其他原子或原子团直接结合生成新的化合物的反应。 ②乙烯与溴水、H 2、HCl 、H 2O 反应的化学方程式如下:
③苯和H 2发生加成反应的化学方程式:
(4)加聚反应:合成聚乙烯塑料的化学方程式:
n CH 2===CH 2――→催化剂
加热、加压
CH 2—CH 2。
3.烷烃
(1)烷烃的结构与性质
通式
C n H 2n +2(n ≥1)
结构
链状(可带支链)分子中碳原子呈锯齿状排列;碳原子间以单键相连,其余价键
均被氢原子饱和
特点
一个碳原子与相邻四个原子构成四面体结构;1 mol C n H 2n +2含共价键的数目
是(3n +1)N A
物理性质 密度:随分子中碳原子数的增加而增大,但都小于水的密度
熔沸点:随分子中碳原子数的增加而升高
状态:气态→液态→固态,碳原子数小于5的烷烃常温下呈气态
化学性质 取代反应;氧化反应(燃烧);分解反应(高温裂解)
①当碳原子数n ≤10时,用甲、乙、丙、丁、戊、己、庚、辛、壬、癸表示;当n >10时,用汉字数字表示。
②当碳原子数n 相同时,用正、异、新来区别。
如:CH3CH2CH2CH2CH3称为正戊烷,(CH3)2CHCH2CH3称为异戊烷,C(CH3)4称为新戊烷。
问题2 有机反应类型的判断方法
(1)依据概念及所含官能团判断
①取代反应:
取代反应的特点是“有上有下”,反应中一般有副产物生成;卤代、水解、硝化、酯化均属于取代反应。
②加成反应:
加成反应的特点是“只上不下”,反应物中一般含碳碳双键、碳碳三键、苯环等。
③氧化反应:
主要包括有机物的燃烧,碳碳不饱和键被酸性KMnO4溶液氧化,葡萄糖(含醛基)与新制Cu(OH)2悬浊液、银氨溶液的反应,醇的催化氧化等。
(2)依据反应条件判断
①当反应条件是稀酸并加热时,通常为酯或糖类的水解反应。
②当反应条件为Cu或Ag作催化剂、加热,并有O2参加反应时,通常为醇的催化氧化。
③当反应条件为催化剂并有H2参加反应时,通常为碳碳双键、碳碳三键、苯环的加成反应。
④当反应条件为光照且与卤素单质(Cl2或溴蒸气)反应时,通常为烷烃或苯环侧链烷烃基上的氢原子发生的取代反应。
⑤当反应条件为铁或FeX3作催化剂且与X2反应时,通常为苯环上的氢原子被取代,发生取代反应。
考点2 碳的成键特征、同系物与同分异构体
1.有机物中碳原子的成键特征
(1)碳原子的最外层有4个电子,可与其他原子形成4条共价键,而且碳原子之间也能相互形成共价键。
(2)碳原子不仅可以形成单键,还可以形成双键和三键。
(3)多个碳原子可以相互结合形成碳链,也可以形成碳环,碳链或碳环上还可以连有支链。
2.同系物
(1)定义:结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物。
(2)烷烃同系物:分子式都符合C n H2n+2,如CH4、CH3CH3、互为同系物。
(3)同系物的化学性质相似,物理性质呈现一定的递变规律。
3.同分异构体
(1)概念:化合物具有相同的分子式,但具有不同结构的现象,叫同分异构现象。具有同分异构现象的化合物互称为同分异构体。
(2)常见的同分异构体(写结构简式):
甲烷、乙烷、丙烷无同分异构现象;
丁烷的同分异构有2种,分别为:
戊烷的同分异构体有3种,分别为:
4.有机物结构的表示方法
(1)球棍模型:用来表现化学分子的三维空间分布。棍代表共价键,球表示构成有机物分子的原子。如
图所示分别为丙烷、乙烯的球棍模型。
(2)比例(填充)模型:是一种与球棍模型类似,用来表现分子三维空间分布的分子模型。球代表原子,大和小代表原子直径的大小,球和球紧靠在一起。比例模型表示的是原子的相对大小及连接形式,更接近分子的真实结构。
如图分别是甲烷和乙酸的比例模型。
(3)结构式:用元素符号和短线表示有机物分子中原子的排列和结合方式的式子。
例如:乙烷、乙烯的结构式分别为
(4)结构简式:结构简式是结构式的简单表达,应能表现该物质的官能团。
例如:丙烷、乙烯、乙醇的结构简式分别为CH3CH2CH3、CH2===CH2、CH3CH2OH。
(5)键线式:碳碳键用线段来体现。拐点或端点表示碳原子,碳原子上的氢原子不必标出,其他原子或其他原子上的氢原子都要指明。例如:丙烯、正丙醇的键线式分别为、OH。
问题同分异构体数目的判断
(1)记忆法:记住常见异构体的数目。
①凡只含有一个碳原子的分子均无同分异构体。
②甲烷、乙烷、新戊烷、苯的一卤代物只有一种。
③丁烷、丙基(—C3H7)有2种,如丙烷的一氯代物有2种。
④戊烷有3种。
⑤丁基(—C4H9)有4种,如丁烷的一氯代物有4种。
(2)换元法:
例如:二氯苯C6H4Cl2的同分异构体有3种,四氯苯的同分异构体也有3种。
(3)等效氢法:分子中有多少种“等效”氢原子,其一元取代物就有多少种。
①同一个碳原子上的氢原子属于“等效”氢原子。如中—CH3上的3个氢原子是“等效”氢原子。
②同一分子中处于轴对称位置或镜面对称位置上的氢原子属于“等效”氢原子。如分子中有两种“等效”氢原子,即甲基上的氢原子和苯环上的氢原子。
③同一个碳原子上相同取代基上的氢原子属于“等效”氢原子。如分子中有两种“等效”氢原子。