软件测试文档集模板(医疗器械)
- 格式:doc
- 大小:72.00 KB
- 文档页数:6


***软件描述一、基本信息1、产品标识***使用的软件作为医疗器械组成部分的软件,为控制型软件。
2、安全性级别软件功能:本软件通过*******进行一种体外诊断分析,配合仪器硬件系统完成实验检测和生成报告。
预期用途:*****等方面的检测。
适用环境:环境温度5 c 25 C;相对湿度:<70%室内使用。
本软件在温度,湿度安全的室内环境中使用,分析的对象是体外特定核酸的电信号数据,并且在其预期用途中,无待检核酸和人体接触的情况,无论是对待检人或软件操作者的健康都不会有损害,故安全级别为A级。
3、结构功能本软件是基于windows平台研发的应用软件, 测和配合仪器硬件系统完成实验检报告生成。
分为四大模块:***********软件体系关系图如下:4、 硬 件关系软件系统通过路由器连接PC 机和测试塔,将测试数据返回PC 机器,并通过路由 器进行实时通讯,通过PC 机控制测试塔进行相应操作。
5、 运 行环境Windows Xp sp3(32 位) Visual studio 2008 .Net framework 2.0 无 无 网络环境:以太6、 适 用范围本软件需与 *** 系统配套使用,主要用于分析设备仪器返回的数据并产生报 告。
7、 禁 忌症无。
8、 上 市历史经查询,目前市面上暂无同类产品(包含本软件组件)批准上市。
二、 实现过程1、 开 发综述开发语言: C#.net开发工具: 1)支持软件 Visual Studio 2008 ; 2)应用软件:无 开发方法: 面向对象生存周期模型: 瀑布模型开发人员数量: 1开发时间: 7 个月工作量: 7 月 / 人代码行总数: 40497控制文档总数:软件环境:1) 、系统软2、风险管理详见资料4《安全风险分析管理报告》。
3、需求规格详情见”D** 系统需求规格书.doc”。
4、生存周期本软件开发采用瀑布模型方式进行开发。
首先进行项目立项,经过调研分析,确认方案后,再进行开发设计,设计完成后进行配置测试和缺陷管理。

XXXX医学科技有限公司产品名称:xxxx系统产品型号:XTM300软件版本:V1.0.0.0文档版本:A/0软件测试文档集文档制订:xxx文档审核:xxx测试执行:xxx文档签发:xxx发布日期:2016.3.1目录1. 测试过程概述1.1 测试任务 (3)1.2 参加测试人员 (3)1.3 测试时间 (3)1.4 测试环境 (3)1.4.1 硬件环境 (3)1.4.2 软件环境 (4)2.测试内容&测试计划2.1 测试内容 (4)2.2 通过-失败准则 (4)2.3 测试方案····································4-52.3 测试用例·····································5-83.测试异常情况报告 (8)4. 测试结论 (8)5.术语表····································8-91. 测试过程概述1.1 测试任务和目的本次测试主要是遵循GB/T25000.51-2010的要求,测试xxxxxxxx 系统与该标准的符合性。

软件确认报告
编制/日期:_____________
审核/日期:_____________
批准/日期:_____________
一、引言
1.1 目的:
通过测试报告反馈及时解决由程序中的错误引发的问题。
适用于XX治疗仪,型号XX
1.2 背景:
软件系统的名称:
任务提出者:
开发者:
本系统包括XX治疗仪嵌入式软件系统。
1.3 参考资料:
1)软件需求说明书
2)软件详细设计说明
3)产品使用说明书
4)技术要求
5)软件验证报告
二、测试方法
参考《系统测试报告》
三、测试机构和人员
测试机构:
测试人员:
四、测试记录、分析统计
五、测试结果
六、评价
6.1 软件能力:
软件能力达到《软件需求说明书》规定的能力要求;
软件相关的产品性能符合技术要求。
6.2 缺陷和限制:
无明显缺陷
6.3 建议:
无
6.4 测试结论:
经测试,软件功能符合产品设计要求,判定合格。
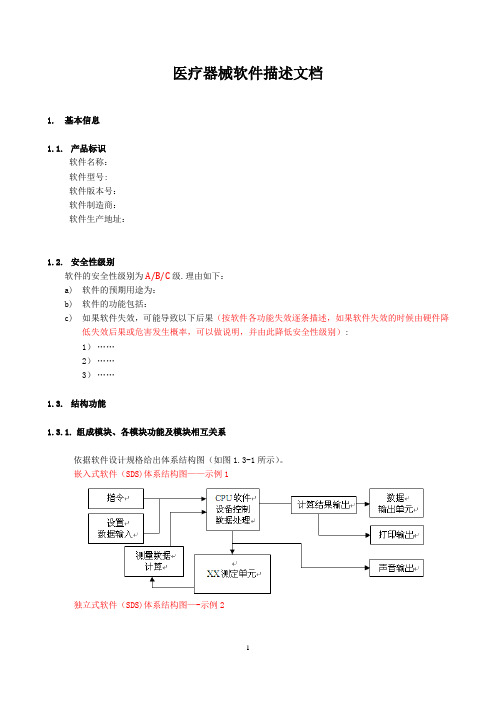
医疗器械软件描述文档1.基本信息1.1.产品标识软件名称:软件型号:软件版本号:软件制造商:软件生产地址:1.2.安全性级别软件的安全性级别为A/B/C级.理由如下:a)软件的预期用途为:b)软件的功能包括:c)如果软件失效,可能导致以下后果(按软件各功能失效逐条描述,如果软件失效的时候由硬件降低失效后果或危害发生概率,可以做说明,并由此降低安全性级别):1)……2)……3)……1.3.结构功能1.3.1.组成模块、各模块功能及模块相互关系依据软件设计规格给出体系结构图(如图1.3-1所示)。
嵌入式软件(SDS)体系结构图——示例1独立式软件(SDS)体系结构图—-示例2图1。
3-1 XXX体系结构图1.3.2各模块功能说明注:1、每个软件模块一份表单。
2、软件功能项目列表需列出与测试相关的所有功能(包括各级子功能).3、功能说明栏目应填写:功能项目概述、边界值规定(数据有效性)、安全说明等信息。
4、功能列表上所列出来的功能必须是可以实现或演示的。
5、功能名称与软件、文档保持一致。
6、软件功能项目列表根据需要列出(可增加或删减子功能列)。
1.3.2.用户界面设计采用广泛应用的图形用户界面(GUI),即诸如窗口、菜单、对话框、滚动条等。
用户主界面见图1。
3—2.图1.3—2 XXX用户主界面1.3.3.外部接口XXX可使用VISUAL C++ 提供的对SQL SERVER 的接口,进行对数据库的所有访问。
XXX可使用SQL SERVER 的对数据库的备分命令,以做到对数据的保存。
在网络软件接口方面,使用一种无差错的传输协议,采用滑动窗口方式对数据进行网络传输及接收.1.4.硬件关系1.4.1.物理拓扑图嵌入式软件物理拓扑关系表格形式——示例1硬件软件分类零件种类功能显示部分血压显示7工具LED 血压值显示最高血压・最低血压、脈拍を表示时刻显示7工具LED 時刻显示显示现在时刻压力单位显示LED mmHg / kPa 显示显示血压值以及压力值的单位开关部分开始/关闭开关开始/关闭开关读取控制开始测量血压测量时停止测量背面功能设定开关背面功能设定开关读取控制时刻的设定等、主机功能设定的更改打印部分打印切纸打印控制测量结果的打印、打印后切纸血压测量部分泵、电磁阀、压力传感器血压测定控制测量时加压、减压控制、脉搏信号处理以及测量值的确定安全监视用压力传感器压力安全检测控制压力监测、急排控制袖带驱动部分袖带驱动用马达袖带控制袖带的卷曲、固定、开放语音部分扬声器语音控制测量通知外部进出力部串行通信串行进出力测量结果出力、指令输入记忆存储U盘设定值记忆存储控制功能设定内容的保持嵌入式软件物理拓扑关系表格形式——示例2独立式软件物理拓扑关系表格形式--示例3图1。

医疗器械软件标准测试本文作者任海萍女士,博士、国家食品药品监督管理局中检所医疗器械质量监督检验中心;奚廷斐先生,主任、研究员、博士生导师,中国生物医学工程学会常务理事、生物材料分会主任委员,人工器官分会副主任委员,全国医疗器械生物学评价标准化技术委员会主任委员;汤京龙先生,助理研究员;王硕先生、王建宇先生,实习研究员;陆颂芳女士,主任技师。
关键词: 医疗器械软件标准测试一概述随着计算机技术的发展,越来越多的医用电气设备中使用了计算机软件技术,其安全性是非常重要的,而它的复杂性超过了那些单纯的治疗和/或诊断医用电气设备。
同时,越来越多的软件被用于在医疗监视下对患者进行诊断、治疗或监护。
医疗器械的许多重要功能,越来越多地依靠软件进行控制,因此,医疗器械中软件错误导致的后果可能非常严重。
而软件产品可能在六个月内就已经过时了。
从而,在医疗器械生产企业和管理部门之间存在着矛盾:生产企业必须尽快使新的含软件器械上市,但同时,管理部门必须保护公众免受与软件相关的器械故障造成的危害。
2003年开始,我国国家食品药品监督管理局将相关软件纳入了医疗器械管理。
软件质量已成为大家共同关注的焦点。
由于我国目前医疗器械管理的技术基础主要是产品的第三方测试,因此,软件测试是否充分、有效,直接影响到软件产品的质量,也影响着是否能够对医疗器械软件进行有效管理。
但是,由于软件产品的特殊性,我国至今尚未形成医疗器械软件产品测试的国家标准和行业标准。
本文通过对美国FDA的医疗器械软件管理、软件工程以及软件测试情况的介绍,希望能为我国加强医疗器械软件的管理、尽快制定技术标准提供参考。
二软件的特殊性美国FDA对于作为医疗器械组件、部件或附件的软件、本身就是医疗器械的软件(例如模拟重建血管系统软件)、加工制造医疗器械时使用的软件(例如加工器械时使用的逻辑控制程序)以及器械制造商在质控系统中所使用的软件(例如记录和保存器械历史记录的软件)都根据其特定的使用要求进行验证。
医疗器械用软件设计模板1. 引言本文档旨在提供医疗器械用软件设计的模板和指导,以确保设计的合规性和可靠性。
医疗器械软件的设计过程应参照相关法规和标准,以确保产品的安全性和有效性。
2. 软件需求分析在软件设计之前,需要进行充分的需求分析,确定软件的功能和性能要求。
需求分析应包括以下步骤:- 定义软件的用途和目标;- 确定用户需求和期望;- 确定适用的法规和标准;- 定义软件的功能和界面要求;- 确定性能和可靠性要求。
3. 系统架构设计系统架构设计是将软件分解为不同模块和组件的过程。
在医疗器械软件设计中,需考虑以下因素:- 系统的可扩展性和可维护性;- 分层架构设计,确保模块的独立性;- 实时性和响应性的要求。
4. 数据流图设计数据流图是描述系统流程和数据传输的图形工具。
在医疗器械软件设计中,数据流图需要考虑以下因素:- 合规性和隐私保护;- 数据的准确性和一致性;- 数据传输的安全性。
5. 界面设计用户界面是用户与软件进行交互的平台,设计良好的用户界面能提高用户体验。
在医疗器械软件设计中,界面设计应注重以下方面:- 易用性和易读性;- 考虑用户的特殊需求和能力;- 考虑界面的安全性。
6. 数据库设计数据库设计是为了存储和管理软件中的数据。
在医疗器械软件设计中,数据库设计需要考虑以下因素:- 数据的安全性和保密性;- 数据的完整性和可靠性;- 合规性要求。
7. 软件测试和验证软件测试和验证是确保软件的正确性和合规性的过程。
在医疗器械软件设计中,需要进行以下测试和验证:- 单元测试和集成测试;- 功能测试和性能测试;- 需求追踪和验证。
8. 结论本文档提供了一份医疗器械用软件设计的模板和指导,从需求分析到测试验证,完整了解了医疗器械软件设计的过程和关键要点。
在实际设计中,应参照相关法规和标准,并根据具体需求进行适当的调整和优化。
只有合规和可靠的软件设计才能确保医疗器械的安全和有效使用。
---Please let me know if you need any further assistance.。
医疗器械计算机软件验证方案模板依据 :《医疗器械生产质量管理规范》MDD/93/42EEC 医疗器械指令GB/T 19001-2016 IDT ISO9001:2015 《质量管理体系要求》YY/T 0287-2017 IDT ISO13485:2016 《医疗器械质量管理体系用于法规的要求》编制 :审核 :批准 :0修改历史/History版本 /Version变更号/Change原因/ReasonNo01NA第一次发行/First Edition*******有限公司目录1.确认目的 (4)2.确认范围 (4)3.确认职责 (4)4.确认指导文件 (5)5.术语缩写 (5)6.概述 (5)7.确认实施前提条件 (4)8.人员确认 (6)9.风险评估 (6)10. 确认时间安排 (11)11. 确认内容 (11)12. 偏差处理 (29)13. 风险的接收与评审 (29)14. 方案修改记录 (29)15. 确认计划 (30)16. 附件 ..................................................................................................错误 !未定义书签。
1.验证目的检查并确认控制气相、液相色谱仪的计算机系统符合《医疗器械生产质量管理规范》及仪器计算机使用说明书要求,满足使用需求,特根据制定本确认方案,作为对气相、液相色谱仪计算机系统验证系统进行确认的依据。
2.验证范围本次验证主要对用于我公司由**** 气相、液相色谱仪软件、台式电脑及打印机所组成的气相、液相色谱仪验证系统的安装、运行以及性能进行确认。
3.确认职责。
3.1 确认职责部姓职责签名门名****负责验证方案的起草、实施,组织验证的相关培训;负责对验证方案修订或补充提出申请。
**负责验证资料的汇总及整理,验证结果的分析讨论和起草验证报告;责对验证系统的变更按照《变更管理规程》提出变更申请。
医疗器械软件描述文档1医疗器材软件描绘文档基本信息1.1.产品表记系统名称:远程抢救医疗信息系统制造商:珠海德瑞斯科技有限企业生产地点:广东省珠海市香洲区人民东路245号名都大厦10071.2.安全性级别专业加密狗加锁;采纳不行逆加密算法登录账号;支持分级用户权限管理,采纳数据流加密技术,保证网络通讯安全。
1.3.构造功能21.4.硬件关系3医疗器械软件描述文档41.5.运转环境服务器:硬件:IBMX3400M3服务器以上配置塔式服务器。
四核英特尔至强办理器E5606(8MB可扩展至2个办理器。
1x4GBDDR3RDIMM内存1TB以上硬盘三级缓存,最高支持1066MHz内存频次,GT/sQPI),软件:Windows2003Server 以上操作系统,SqlServer2005 以上数据库,.NetFramework。
网络:视安装车辆多少而调整,介绍10M光纤速度,客户端:硬件:介绍配置:1440*900。
P4 双核办理器,2G内存,独立显卡显示分辨率能达到1280*1024 以上,最正确分辨率:软件:WindowsXp 以上操作系统,.NetFramework 。
3.网络:4M以上互联网速度。
4. 1.6.合用范围5. 1.7.禁忌症6. 1.8.上市历史7.实现过程8.开发综述9.该系统鉴于平台开发,使用微软件主流开发技术,分别采纳了C#语言、C++语言以及java语言Android手持10.终端开发。
C/S模式设计散布式布署。
11.开发工具:Visualstudio2005、eclipse9、SqlServer200512. 2.2.风险管理13. 2.3.需求规格14. 2.4.生计周期15. 2.5.考证与确认16. 2.6.缺点管理17. 2.7.订正历史18. 2.8.临床评论19.中默算法医疗器械软件描述文档5附表:医疗器材软件描绘文档申报要求描绘文档A 级(稍微)B 级(中等)C 级(严重)产品表记 描绘软件名称、型号、版本号、制造商和生产地点 安全性级别 描绘软件安全性级别,并详述安全性级别确立原因构造功能 依照系统构造图,描绘软件的构成模块、模块功能、模块关系、外面接口和用户界面 基 硬件关系依照物理拓扑图,描绘软件、通用计算机和医疗器材硬件的连结关系本信 运转环境 描绘软件运转所需的硬件配置、软件环境和网络条件 息适应范围 描绘软件的合用范围和合用人群禁忌症 描绘软件的禁忌症和不合用人群上市历史 描绘软件在中国、原产国等主要国家地域的上市时间、版本号和管理类型 开发综述 描绘开发语言、工具、方法、模型、人员、时间、工作量、代码行数和控制文档数 风险管理 供给风险管理资料需求规格需求规格的功能、性能要求 需求规格全文,包括硬件、功能、性能、输入输出、接口界面、警告信息、保密安全、数据和数据库、文档和法例的要求。
医疗器械计算机软件验证方案模板一、引言(介绍验证方案重要性、目的和背景信息)二、系统描述(描述待验证的计算机软件系统,包括其功能、使用场景、操作流程等)三、验证目标(明确本次验证的具体目标和范围)四、验证策略1.验证方法(列出将使用的验证方法,如黑盒测试、白盒测试、冒烟测试等)2.验证环境(明确验证所需的硬件设备、软件工具、测试数据等)3.验证时间计划(制定详细的验证时间安排)五、验证过程1.验证准备a.设计验证用例(根据功能需求和预期效果,设计合适的验证用例)b.环境准备(准备好验证所需的硬件设备、软件工具、测试数据等)c.文档准备(准备验证所需的文档,如验证计划、测试用例等)2.验证执行a.执行验证用例(根据验证计划,逐个执行验证用例)b.记录测试结果(记录每个验证用例的执行结果、问题和改进建议)3.验证总结和报告a.验证总结(总结本次验证的结果,评估达到的目标和未达到的目标)b.编写验证报告(编写详细的验证报告,包括验证目标、执行情况、测试结果等)c.提出改进建议(根据验证结果,提出改进软件系统的建议)六、风险控制(列出可能的风险和应对措施,如备份数据、设备故障处理等)七、验证的限制和局限性(明确验证过程中的限制和局限性,如可用测试数据的有限性、验证时间的限制等)八、验证结果的评估(对验证结果进行评估,判断计算机软件系统是否符合预期要求)九、验证结果的验证(可根据需要,邀请相关专家对验证结果进行评审和验证)十、验证计划执行的控制(制定计划执行的控制措施,如定期评估进展、及时调整计划等)十一、验证方案的维护和更新(说明如何对验证方案进行维护和更新,以保证验证过程的准确性和实效性)(列出所参考的相关文件和资料的详细信息)以上是医疗器械计算机软件验证方案的一个模板,具体内容可以根据实际情况进行调整和补充。
请注意,验证方案的编写应遵循相关的法规和标准要求,并确保验证过程的安全性和可靠性。
XXXX医学科技有限公司
产品名称:xxxx系统
产品型号:XTM300
软件版本:V1.0.0.0
文档版本:A/0
软件测试文档集
文档制订:xxx
文档审核:xxx
测试执行:xxx
文档签发:xxx
发布日期:2016.3.1
目录
1. 测试过程概述
1.1 测试任务 (3)
1.2 参加测试人员 (3)
1.3 测试时间 (3)
1.4 测试环境 (3)
1.4.1 硬件环境 (3)
1.4.2 软件环境 (4)
2.测试内容&测试计划
2.1 测试内容 (4)
2.2 通过-失败准则 (4)
2.3 测试方案····································4-5
2.3 测试用例·····································5-8
3.测试异常情况报告 (8)
4. 测试结论 (8)
5.术语表····································8-9
1. 测试过程概述
1.1 测试任务和目的
本次测试主要是遵循GB/T25000.51-2010的要求,测试xxxxxxxx 系统与该标准的符合性。
1.2 参加测试人员
1.3 测试时间
2016年3月1日
1.4 测试环境
1.4.1 硬件环境
CPU:四核2.0 GH以上内存:8G以上
显卡:独立显卡1G以上
显示器:支持 1280*1024以上,32 位真彩显示
硬盘:500G以上光驱:CD-ROM(24X)
1.4.2 软件环境
操作系统:Window 7 以上 64Bit 或更新版本
2.测试说明&测试计划
2.1 测试内容
对于xxxxxxxx系统的以下全部功能的测试:
1)GB25000.52-2010中5.3的要求
2)xxxx 功能 3)xxxx功能
4)xxxx功能 5)xxxx功能
2.2 通过-失败准则
如果软件的测试按照2.4测试用例的执行步骤进行测试未出现异常则即测试通过,否则测试失败。
2.3 测试计划
2.4 测试用例
3. 测试异常情况报告
按照2.2的测试计划对xxxxxxxx系统对软件进行测试,暂未发现异常。
4. 测试结论
通过以上2.4测试用例测试全部项目合格,软件测试通过。
5. 术语表。