)
C.向0.10 mol·L-1 Na2SO3溶液中通SO2:c(Na+)=2[c(SO32- )+c(HSO3- )+c(H2SO3)]
D.向0.10 mol·L-1 CH3COONa溶液中通HCl:c(Na+)>c(CH3COOH)=c(Cl-)
解题导引 (1)在比较溶液中离子浓度大小或判断关系式是否正确时,一般 需借助电荷守恒和物料守恒。 (2)①写电荷守恒式时,必须找全阴、阳离子并注意阴、阳离子所带的电荷 数。②写物料守恒式时,有时不需要找全阴、阳离子。如B项中“NaHSO3 溶液中通NH3”,不论通入NH3的量为多少,溶液中始终存在关系式:c(Na+)= c(HSO3- )+c(SO32- )+c(H2SO3)(此式由化学式NaHSO3即可得出)。
HCO3- +OH-,加热使溶液中
二、酸式盐溶液酸碱性的判断
酸式盐的水溶液显什么性,要看该盐的组成微粒的实际表现。
1.强酸的酸式盐只电离,不水解,其溶液一定显酸性。如NaHSO4溶液:
NaHSO4
Na++H++S O24-。
2.弱酸的酸式盐溶液的酸碱性,取决于酸式酸根离子的电离程度和水解程
度的相对大小。
考点清单
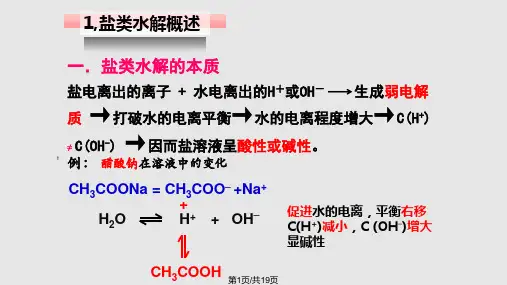
考点一 盐类水解
基础知识 一、盐类水解的定义和实质 1.盐类水解的定义 强碱弱酸盐和强酸弱碱盐溶于水时,电离产生的阴离子或阳离子可分别与 水电离出来的① H+ 或② OH- 生成③ 弱电解质 ——弱酸或弱 碱,盐与水发生的这种作用叫作盐类的水解。 2.盐类水解的实质 盐类的水解是盐跟水之间的化学反应,水解(反应)的实质是生成弱电解质, 使水的④ 电离平衡 被破坏而建立起新的平衡。盐的水解促进了水的 电离。