乙烯、乙炔的实验室制法
- 格式:ppt
- 大小:364.50 KB
- 文档页数:2
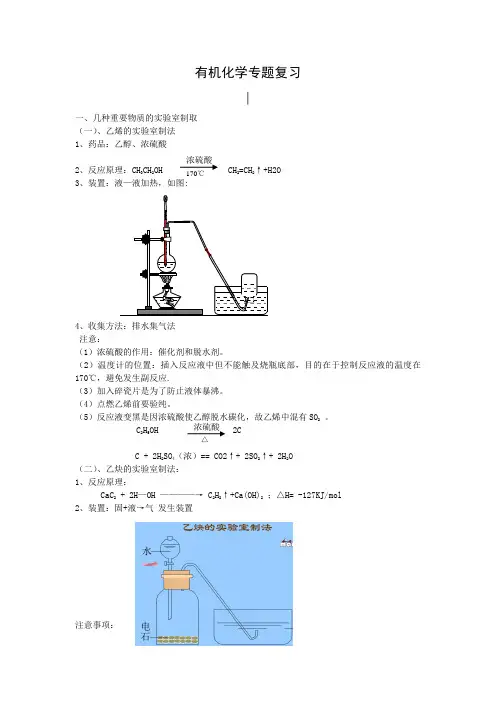
有机化学专题复习∣一、几种重要物质的实验室制取(一)、乙烯的实验室制法1、药品:乙醇、浓硫酸2、反应原理:CH 3CH 2OH CH 2=CH 2↑+H2O3、装置:液—液加热,如图:4、收集方法:排水集气法注意:(1)浓硫酸的作用:催化剂和脱水剂。
(2)温度计的位置:插入反应液中但不能触及烧瓶底部,目的在于控制反应液的温度在170℃,避免发生副反应.(3)加入碎瓷片是为了防止液体暴沸。
(4)点燃乙烯前要验纯。
(5)反应液变黑是因浓硫酸使乙醇脱水碳化,故乙烯中混有SO 2 。
C 2H 5OH 2CC + 2H 2SO 4(浓)== CO2↑+ 2SO 2↑+ 2H 2O(二)、乙炔的实验室制法:1、反应原理:CaC 2 + 2H —OH ————→ C 2H 2↑+Ca(OH)2 ;△H= -127KJ/mol2、装置:固+液→气 发生装置注意事项:浓硫酸170℃浓硫酸 △(1)反应装置不能用启普发生器,改用广口瓶和分液漏斗。
(2)实验中常用饱和食盐水代替水,目的:降低水的含量,得到平稳的乙炔气流。
(3)制取时在导气管口附近塞入少量棉花目的:为防止产生的泡沫涌入导管。
(4)纯净的乙炔气体是无色无味的气体。
用电石和水反应制取的乙炔,常闻到有恶臭气味。
(三)、苯的取代反应1、反应装置2、反应现象3、反应原理4、注意事项(1)、试剂的加入顺序怎样?各试剂在反应中所起到的作用?A 、首先加入铁粉,然后加苯,为防止溴的挥发,最后加溴。
B 、溴应是纯溴,而不是溴水。
加入铁粉起催化作用,实际上起催化作用的是FeBr3。
(2)、导管为什么要这么长?其末端为何不插入液面?C 、伸出烧瓶外的导管要有足够长度,其作用是导气、冷凝。
D 、导管未端不可插入锥形瓶内水面以下,因为HBr 气体易溶于水,以免倒吸。
(3)、反应后的产物是什么?如何分离?E 、导管口附近出现的白雾,是溴化氢遇空气中的水蒸气形成的氢溴酸小液滴。
F 、纯净的溴苯是无色的液体,而烧瓶中液体倒入盛有水的烧杯中,烧杯底部是油状的褐色液体,这是因为溴苯溶有溴的缘故。


实验室制甲烷内部编号:(YUUT-TBBY-MMUT-URRUY-UOOY-DBUYI-0128)实验室制甲烷CH3COONa+NaOH→Na2CO3+CH4(条件是CaO加热)实验室制乙烯CH3CH2OH→CH2=CH2↑+H2O(条件为加热,浓H2SO4)实验室制乙炔CaC2+2H2O→Ca(OH)2+C2H2↑工业制取乙醇:C2H4+H20→CH3CH2OH(条件为催化剂)乙醛的制取乙炔水化法:C2H2+H2O→C2H4O(条件为催化剂,加热加压)乙烯氧化法:2CH2=CH2+O2→2CH3CHO(条件为催化剂,加热)乙醇氧化法:2CH3CH2OH+O2→2CH3CHO+2H2O(条件为催化剂,加热)乙酸的制取乙醛氧化为乙酸:2CH3CHO+O2→2CH3COOH(条件为催化剂和加温)加聚反应:乙烯聚合nCH2=CH2→-[-CH2-CH2-]n-(条件为催化剂)氯乙烯聚合nCH2=CHCl→-[-CH2-CHCl-]n-(条件为催化剂)氧化反应:甲烷燃烧CH4+2O2→CO2+2H2O(条件为点燃)乙烯燃烧CH2=CH2+3O2→2CO2+2H2O(条件为点燃)乙炔燃烧C2H2+3O2→2CO2+H2O(条件为点燃)苯燃烧2C6H6+15O2→12CO2+6H2O(条件为点燃)乙醇完全燃烧的方程式C2H5OH+3O2→2CO2+3H2O(条件为点燃)乙醇的催化氧化的方程式2CH3CH2OH+O2→2CH3CHO+2H2O(条件为催化剂)乙醛的催化氧化:CH3CHO+O2→2CH3COOH(条件为催化剂加热)取代反应:有机物分子中的某些原子或原子团被其他原子或原子团所代替的反应叫做取代反应。
甲烷和氯气发生取代反应CH4+Cl2→CH3Cl+HClCH3Cl+Cl2→CH2Cl2+HClCH2Cl2+Cl2→CHCl3+HClCHCl3+Cl2→CCl4+HCl(条件都为光照。
)苯和浓硫酸浓硝酸C6H6+HNO3→C6H5NO2+H2O(条件为浓硫酸)苯与苯的同系物与卤素单质、浓硝酸等的取代。

乙炔的制备及性质实验报告实验目的本实验旨在通过实验方法制备乙炔,并对其性质进行初步观察和分析。
实验原理乙炔,化学式为C2H2,是一种无色、有刺激性气味的气体。
其制备方法主要有以下两种: 1. 乙炔的制备可以通过乙烯的部分氧化反应得到。
在适当的催化剂存在下,乙烯与空气中的氧气发生反应,生成乙炔。
2. 另一种方法是通过碳酸钙与酸的反应制备乙炔。
碳酸钙与酸反应生成二氧化碳和水,而二氧化碳与过量的碳酸钙反应生成乙炔。
实验步骤实验材料•乙烯气体•空气•碳酸钙(CaCO3)•酸(如盐酸)•试管•导管实验步骤1.实验室准备工作:–预先准备好所需实验材料。
–建议在通风良好的环境下进行实验,以确保安全。
2.方法一:乙烯的部分氧化制备乙炔–将乙烯气体导入试管中。
–在试管中加入适量的催化剂(如氯化铜等)。
–用导管将空气导入试管中,与乙烯反应。
–观察试管内是否产生气体,并判断其性质。
3.方法二:碳酸钙与酸反应制备乙炔–在试管中加入适量的碳酸钙。
–加入适量的酸(如盐酸)。
–观察试管内是否产生气体,并判断其性质。
4.性质观察:–观察乙炔气体的颜色、气味等性质。
–观察乙炔气体是否燃烧,并记录燃烧现象。
–注意安全,避免过量使用乙炔和火源。
实验结果与讨论经过实验操作,我们成功制备了乙炔气体。
根据观察和记录,我们可以得出以下结论: - 乙炔气体是无色的,并具有刺激性气味。
- 乙炔气体在火源的作用下可以燃烧,产生明亮的火焰。
- 乙炔燃烧时产生的火焰温度较高,可应用于某些高温实验或工业中。
然而,本实验中使用的方法只是制备乙炔的两种常见方法之一。
乙炔的制备过程还有其他更复杂的方法和工艺,如通过炼油厂的乙烯制备和工业生产中的炼焦炉等。
实验总结通过本实验,我们了解了乙炔的制备方法和初步观察了其性质。
乙炔作为一种重要的化学原料,在化学实验和工业生产中具有广泛的应用。
在实验操作中,我们要注意安全,避免过量使用乙炔和火源,并在通风良好的环境下进行实验。

一、实验目的1. 掌握乙烯和乙炔的实验室制取方法。
2. 了解乙烯和乙炔的物理性质和化学性质。
3. 培养学生的实验操作技能和科学思维。
二、实验原理1. 乙烯的制取:利用乙醇在浓硫酸催化下,加热至170℃发生消去反应生成乙烯。
2. 乙炔的制取:利用碳化钙与水反应生成乙炔。
三、实验仪器与药品1. 仪器:圆底烧瓶、酒精灯、石棉网、温度计、铁架台、集气瓶、导管、水槽等。
2. 药品:无水乙醇、浓硫酸、碳化钙、饱和食盐水、酸性高锰酸钾溶液、溴水、NaOH溶液等。
四、实验步骤1. 乙烯的制取(1)取一个圆底烧瓶,加入无水乙醇,加入浓硫酸,比例为13:1。
(2)在烧瓶中加入少量碎瓷片,防止暴沸。
(3)将烧瓶固定在铁架台上,插入温度计,水银球位于液面下。
(4)加热烧瓶,迅速升温至170℃,保持该温度。
(5)收集乙烯气体,用排水集气法。
2. 乙炔的制取(1)取一个集气瓶,加入少量碳化钙。
(2)向集气瓶中加入饱和食盐水,使其与碳化钙反应。
(3)用导管将生成的乙炔气体导入集气瓶中,收集乙炔气体。
五、实验现象1. 乙烯的制取:烧瓶内产生大量气泡,气体收集满集气瓶,无水乙醇和浓硫酸反应剧烈,溶液颜色变深。
2. 乙炔的制取:碳化钙与水反应产生大量气泡,乙炔气体收集满集气瓶。
六、实验结果与讨论1. 乙烯的制取:实验成功制得乙烯气体,无水乙醇和浓硫酸反应剧烈,溶液颜色变深,符合实验原理。
2. 乙炔的制取:实验成功制得乙炔气体,碳化钙与水反应剧烈,产生大量气泡,符合实验原理。
七、实验注意事项1. 乙烯的制取:注意加热速度,防止溶液暴沸;温度计水银球位于液面下,准确测量反应液温度。
2. 乙炔的制取:注意反应速度,避免碳化钙与水反应过于剧烈;收集乙炔气体时,注意安全,避免气体泄漏。
八、实验总结本次实验成功制取了乙烯和乙炔,通过观察实验现象,验证了实验原理。
在实验过程中,培养了学生的实验操作技能和科学思维,提高了学生的综合素质。

实验室制乙烯的原理
乙烯是一种重要的有机化合物,广泛应用于化工、塑料和橡胶工业中。
制备乙烯的常用方法是从石油化工过程中的烃类中裂解得到。
原理上,乙烯的制备通常通过裂解长链烃类分子得到较小分子量的烃类。
具体的步骤如下:
1. 原料准备:选取适当的烃类作为原料,常见的原料包括石油馏分、天然气等。
这些原料中含有较长的碳链,需要通过裂解来得到乙烯。
2. 加热:原料需要加热到一定温度,通常在500-900摄氏度之间。
加热的目的是使得分子内部的键能量增加,以便于分子的裂解。
3. 裂解:在高温下,原料中的长链烃类分子发生裂解反应,分解为较小的烃类分子。
这个过程中产生了乙烯以及其他一些烃类。
4. 分离:裂解产物中含有多种不同的烃类,需要进行分离和纯化,以提取出纯度较高的乙烯。
总结起来,实验室制备乙烯的原理是通过烃类的裂解反应得到较小分子量的烃类,其中包括乙烯。
这个过程需要一定的温度条件和分离纯化步骤,最终得到纯度较高的乙烯产物。

乙炔电石法制聚乙烯方程式
乙炔电石法是一种工业上用来制备乙炔的方法,而乙炔可以通过氢化反应制得乙烯。
乙炔电石法的化学方程式可以描述为,CaC2 + 2H2O → C2H2 + Ca(OH)2。
这个方程式表示了电石(化学式为CaC2)与水(化学式为H2O)发生反应生成乙炔(化学式为C2H2)和氢氧化钙(化学式为Ca(OH)2)。
而乙烯的制备则可以通过乙炔的氢化反应来实现,其化学方程式为,C2H2 + 2H2 → C2H4。
这个方程式表示了乙炔与氢气(化学式为H2)在适当的催化剂存在下发生反应生成乙烯(化学式为C2H4)。
这两个反应方程式是乙炔电石法制备乙烯的基础。
通过这些化学方程式,我们可以了解到乙炔电石法是如何制备乙烯的。



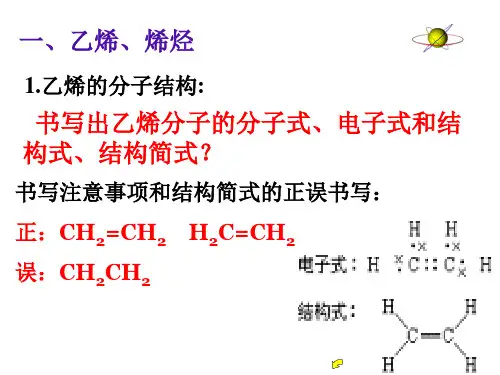
有机化学实验一、烃的重要实验1、乙烯的实验室制法(1)反应原料:乙醇、浓硫酸(2)反应原理:CH3CH2OH CH2=CH2↑ + H2O副反应:2CH3CH2OH CH3CH2OCH2CH3 + H2OC2H5OH + 6H2SO4(浓)6SO2↑+ 2CO2↑+ 9H2O(3)发生装置和收集装置:发生装置:l + l g (圆底烧瓶、酒精灯、温度计等)收集装置:排水法(4)尾气处理:点燃法(5)注意事项:①配制乙醇和浓硫酸体积比为1:3的混合液应注意:应将浓硫酸缓缓注入乙醇并不断摇匀。
②温度计水银球(或液泡)应插入反应混和液,液面以下,但不能接触瓶底,以便控制反应温度为170℃。
③反应时应迅速升温到170℃。
④为防止加热过程中液体爆沸,应在反应液中加少许碎瓷片。
⑤如控温不当,会发生副反应,是制得的乙烯中混有CO2、SO2、乙醚等杂质,必须通过浓NaOH溶液(或碱石灰)后,才能收集到比较纯净的乙烯。
⑥若实验时,已开始给浓硫酸跟乙醇的混合物加热一段时间,忽然记起要加碎瓷片,应先停止加热,冷却到室温后,在补加碎瓷片。
3、乙炔的实验室制法(1)反应原料:电石(主要成分为CaC2)、水(用饱和食盐水代替)(2)反应原理:CaC2 + 2H2O Ca(OH)2 + CH≡CH↑副反应:CaS + 2H2O Ca(OH)2 + H2S↑Ca3P2 + 6H2O 3Ca(OH)2 + 2PH3↑Ca3As2 + 6H2O 3Ca(OH)2 + 2AsH3↑(3)发生装置和收集装置:发生装置:S + l g(广口瓶(或锥形瓶、烧瓶、大试管等)、分液漏斗等)收集装置:排水法(4)尾气处理:点燃法(5)注意事项:①不能用启普发生器制乙炔:a、反应产物Ca(OH)2微溶于水,呈糊状堵塞反应容器,使水面难以升降;b、反应速率快且放出大量的热,会损坏启普发生器。
②电石与水反应很剧烈,应选用分液漏斗,通过控制水流的速度,来控制产生乙炔的速度。
乙烯的实验室制法1。
药品:乙醇浓硫酸2. 装置:圆底烧瓶、温度计、铁架台、水槽、集气瓶、双孔橡皮塞、酒精灯、导管3.步骤:(1)检验气密性。
在烧瓶里注入乙醇和浓硫酸(体积比1:3)的混合液约20mL(配置此混合液应在冷却和搅拌下将15mL浓硫酸满满倒入5mL酒精中),并放入几片碎瓷片。
(温度计的水银球要伸入液面以下)(2)加热,使温度迅速升到170℃,酒精便脱水变成乙烯。
(3)用排水集气法收集乙烯。
(4)再将气体分别通入溴水及酸性高锰酸钾溶液,观察现象。
(5)先撤导管,后熄灯.4.反应原理:(分子内的脱水反应)5。
收集气体方法:排水集气法(密度与空气相近)6.现象:溶液变黑;气体使溴水及酸性高锰酸钾溶液褪色。
7.注意点:(1)乙醇和浓硫酸体积比为什么是1:3?答:浓硫酸是强氧化剂,在此反应中氧化乙醇,如果浓硫酸的量少就会很快变为稀硫酸而达不到实验效果.(2)浓硫酸在反应中的作用?答:①催化剂②脱水剂(③吸水剂)(3)为什么要迅速升温到170℃?答:如果低于170℃会有很多的副反应发生。
如:分子之间的脱水反应(4)为什么要加入碎瓷片?答:防止溶液暴沸。
(5)为什么反应过程中溶液逐渐变黑?答:①(乙醇+浓硫酸)②(c+浓硫酸)(6)怎样证明生成气体乙烯中混有二氧化硫气体?怎样除去二氧化硫气体?答:①证明用品红溶液②除去用NaOH溶液+品红溶液(二氧化硫使溴水及酸性高锰酸钾溶液方程式)实验室制取乙烯的几个为什么河北省宣化县第一中学栾春武一、为什么温度计必须插入液面下?实验室制取乙烯的反应原理:CH3-CH2-OH CH2=CH2↑+H2O,温度要迅速上升到170℃,防止140℃时生成副产物乙醚,因为:CH3-CH2-OH+HO-CH2-CH3CH3-CH2-O-CH2-CH3+H2O。
该反应属于“液体+液体生成气体型”反应,两种液体混合后,装于圆底烧瓶中,加热要用到酒精灯,只有当温度计插入液面下,但不能接触瓶底,才能准确测出反应时反应液的温度,避免副反应的发生,确保产物的纯度。
实验室制乙烯的方程式引言乙烯(C2H4)是一种重要的有机化合物,广泛用于化学工业、聚合物产业和农业。
在实验室中,制备乙烯的方法有很多种,本文将介绍一种简单而常见的实验室制乙烯的方法,包括实验步骤和反应方程式。
实验材料•乙醇(C2H5OH)•浓硫酸(H2SO4)•磨口烧瓶(250 mL)•橡皮塞•连通装置•饱和NaCl溶液•水浴器•水准器•烧杯(50 mL)•秒表•反应管实验步骤1.在磨口烧瓶中加入适量的乙醇(C2H5OH)。
2.加入浓硫酸(H2SO4),控制加入的速度和温度,防止剧烈反应。
3.将磨口烧瓶与连通装置连接,连接好的装置需保持密封状态。
4.在反应管中倒入适量的饱和NaCl溶液,用烧杯装入热水中,使反应管中的水位与实验室外的水位相等。
5.在一定时间间隔内测量反应管中的水位的变化。
6.完成实验后,废弃废液和废气。
反应方程式乙醇经由脱水反应转化为乙烯的反应方程式如下:C2H5OH → C2H4 + H2O根据这个反应方程式,乙醇中的氢原子与氧原子结合,形成了水分子。
乙醇的一个碳原子和相邻的一个碳原子之间形成碳碳双键,生成了乙烯分子。
反应机理当乙醇与浓硫酸反应时,硫酸会从乙醇中提取出水分子。
磁性硫酸根会与乙醇中的羟基(OH)作用,形成含硫特殊结构的中间体,进而发生脱水反应。
结果分析根据实验步骤中测量的反应管水位的变化,可以通过体积差计算出水分子的生成量。
进一步得到乙烯生成的量,并通过质量守恒计算出乙醇转化为乙烯的百分比。
实验安全提示1.实验过程中,硫酸具有腐蚀性,请佩戴实验手套和护目镜,并避免接触皮肤和眼睛。
2.硫酸具有强烈的脱水性,请注意控制反应条件,防止剧烈反应产生危险。
3.在室内操作时请保持良好的通风条件。
结论实验室制乙烯的方法中,利用乙醇与浓硫酸进行脱水反应,生成乙烯分子。
乙醇中的一个碳原子和相邻的一个碳原子之间形成碳碳双键,生成乙烯分子。
实验的目的是通过体积差计算出水分子的生成量,进而得到乙烯生成的量,并计算出乙醇转化为乙烯的百分比。
第1篇一、实验目的1. 了解乙烯的实验室制法及其原理。
2. 掌握实验操作步骤,学习使用实验仪器。
3. 通过实验,加深对化学反应过程的理解。
二、实验原理乙烯是一种无色、具有刺激性气味的气体,化学式为C2H4。
实验室制取乙烯的方法是将乙醇在浓硫酸催化下进行消去反应,生成乙烯和水。
反应方程式如下:CH3CH2OH → CH2=CH2 + H2O三、实验仪器与试剂1. 仪器:圆底烧瓶、温度计、铁架台、水槽、集气瓶、双孔橡皮塞、酒精灯、导管。
2. 试剂:乙醇、浓硫酸。
四、实验步骤1. 准备实验装置:将圆底烧瓶固定在铁架台上,插入温度计,并用双孔橡皮塞密封。
2. 加入试剂:在圆底烧瓶中加入20毫升乙醇和60毫升浓硫酸的混合液。
3. 预热:用酒精灯加热圆底烧瓶,使温度迅速升高至170℃。
4. 收集乙烯:将集气瓶倒置于水槽中,用导管将生成的乙烯导入集气瓶中。
5. 检验乙烯:将集气瓶中的气体分别通入溴水和酸性高锰酸钾溶液中,观察现象。
6. 清理实验装置:关闭酒精灯,撤除导管,待圆底烧瓶冷却后,清理实验仪器。
五、实验现象1. 加热过程中,圆底烧瓶内液体沸腾,产生大量气泡。
2. 集气瓶中的气体通入溴水中,溴水颜色逐渐褪去。
3. 集气瓶中的气体通入酸性高锰酸钾溶液中,溶液颜色逐渐褪去。
六、实验结果分析1. 乙醇在浓硫酸催化下,加热至170℃时发生消去反应,生成乙烯和水。
2. 乙烯具有不饱和键,能与溴水发生加成反应,使溴水褪色。
3. 乙烯具有还原性,能与酸性高锰酸钾溶液发生氧化还原反应,使溶液褪色。
七、实验讨论1. 实验过程中,温度对乙烯的生成有较大影响。
温度过高或过低都会影响乙烯的产量。
2. 实验过程中,浓硫酸的用量对乙烯的产量也有一定影响。
使用过量的浓硫酸可以提高乙醇的利用率,增加乙烯的产量。
3. 实验过程中,应确保实验装置的气密性,防止气体泄漏。
八、实验结论通过本次实验,我们成功制取了乙烯,并验证了其化学性质。
实验过程中,我们掌握了实验室制取乙烯的操作步骤,加深了对化学反应过程的理解。