琼脂糖凝胶电泳
- 格式:docx
- 大小:342.12 KB
- 文档页数:3

高中生物琼脂糖凝胶电泳高中生物学是非常重要的一门学科,它涉及到人类的生命、健康和环境保护等方面。
在学习生物学过程中,琼脂糖凝胶电泳是一个重要而又基础的实验课程。
在这个实验中,我们利用琼脂糖凝胶电泳技术来分离和检测DNA 条带,以便于准确鉴定生物特征。
简单介绍琼脂糖凝胶电泳琼脂糖凝胶电泳是一种分子生物学的实验方法,它利用琼脂糖凝胶的特性将DNA 条带分离。
琼脂糖是一种胶体物质,通过加热和冷却过程,将其转变成凝胶状。
凝胶的孔隙大小和密度是可调的,可以根据需要进行操作。
琼脂糖凝胶电泳是利用电场的力学作用,将DNA 条带分离为不同的迁移带,大小和迁移速度的差异可以对不同的DNA 条带进行鉴定和分析。
实验步骤琼脂糖凝胶电泳是一项基础性的实验,下面我们来简单介绍一下实验步骤。
准备琼脂糖凝胶首先,我们需要准备琼脂糖凝胶。
将琼脂糖粉末加入缓冲溶液中,在加热的过程中充分混合,然后冷却成凝胶状态。
准备DNA 样本接下来,我们需要提取DNA 样本。
可以通过DNA 提取试剂盒快速提取DNA 样本,或者手动分离DNA 样本。
电泳操作将准备好的琼脂糖凝胶放置于电泳槽中,加入适量缓冲溶液。
然后在琼脂糖凝胶中插入电极片,加入电泳缓冲液。
在电泳桥的一侧加入DNA 样本,另一侧加入DNA 分子量标准品。
运行电泳在电泳过程中,DNA 样本会在电场力的作用下迁移至阳极端,较小的分子将更远地迁移。
DNA 分离后,通过染色技术来识别各段片段。
注意事项在实验过程中,需要注意电压和时间的控制,以保证良好的分离效果。
同时,对琼脂糖凝胶的制备和保存也需要注意。
结语总结一下,琼脂糖凝胶电泳是一项基础性的实验操作,需要掌握一定的实验技能和知识。
通过这项实验,我们能够更加深入地了解生命的分子基础,并加深对遗传学、基因工程等方面的理解。

琼脂糖电泳是一种常用的核酸和蛋白质分离和纯化方法。
通过利用琼脂糖的凝胶特性,将待测样品分子按照大小和电荷进行分离。
在琼脂糖电泳实验中,电压和电流的设置对实验结果有着重要的影响。
下面我将详细介绍琼脂糖电泳电压和电流的设置方法和注意事项。
一、电压的设置1. 琼脂糖电泳实验中,电压的设置应根据待测分子的大小来确定。
较小的DNA片段通常需要较高的电压,而较大的DNA片段则需要较低的电压。
2. 选择合适的电压可以提高分离速度和分辨率。
但是过高的电压会导致琼脂糖凝胶发热、溶胶蒸发和样品失去活性等问题,因此需要谨慎设置。
3. 一般情况下,琼脂糖电泳实验的电压范围为50-150V。
如果待测分子较小,可以选择较高的电压,最大不超过150V。
大片段DNA则应选择较低的电压,最小不低于50V。
二、电流的设置1. 电流是根据电压和电阻来计算得到的,它与琼脂糖凝胶中的离子浓度和凝胶孔隙大小有关。
凝胶浓度越高,孔隙越小,电流就越小。
2. 电流的设置应根据实验室所使用的琼脂糖凝胶和电泳槽的尺寸来确定。
一般情况下,电流范围为10-30mA。
3. 在设置电流时,需要根据具体实验条件进行调整。
如果电流过高,可能会导致凝胶加热、样品失活等问题;而电流过低,则可能导致分离速度缓慢、分辨率下降等。
三、注意事项1. 在进行琼脂糖电泳实验前,要仔细检查电泳槽、电极和电源等设备是否正常工作,以确保实验的顺利进行。
2. 在设置电压和电流之前,需要根据待测样品的大小、琼脂糖凝胶的浓度和孔隙大小等因素进行综合考虑,并进行初步的试验和优化。
3. 在实验过程中,要定期检查电泳槽内的温度和电压情况,确保实验的稳定性和可靠性。
4. 对于不同的琼脂糖电泳实验,根据实际需要可以进行不同的电压和电流设置,以获得最佳的分离效果。
总结起来,琼脂糖电泳电压和电流的设置应根据待测分子的大小、琼脂糖凝胶的浓度和孔隙大小等因素进行综合考虑。
合理的电压和电流设置可以提高实验的分离速度和分辨率,同时还需要注意避免电泳槽发热、溶胶蒸发和样品失活等问题。

琼脂糖凝胶电泳原理琼脂糖凝胶电泳是一种常用的蛋白质分离和分析技术,它利用琼脂糖凝胶作为分离介质,根据蛋白质的分子大小和电荷来进行分离。
在琼脂糖凝胶电泳中,蛋白质样品被加载到琼脂糖凝胶中,然后通过电场进行电泳分离,最终形成不同的蛋白质条带,从而实现蛋白质的分离和分析。
琼脂糖凝胶电泳的原理主要包括琼脂糖凝胶的特性和电泳过程中蛋白质的迁移。
首先,琼脂糖凝胶是一种多孔性凝胶,其孔隙大小可以根据需要进行调整,通常用于分离大分子量的蛋白质。
其次,电泳过程中,蛋白质样品在电场的作用下向电极迁移,根据蛋白质的分子大小和电荷不同,迁移速度也不同,从而实现蛋白质的分离。
在进行琼脂糖凝胶电泳实验时,首先需要准备琼脂糖凝胶板和蛋白质样品。
将琼脂糖凝胶板放置在电泳槽中,然后将蛋白质样品加载到琼脂糖凝胶板上。
接下来,将电泳槽中注满电泳缓冲液,然后连接电源进行电泳。
在电泳过程中,蛋白质样品将会在琼脂糖凝胶板上形成条带,根据其分子大小和电荷特性进行分离。
琼脂糖凝胶电泳的原理简单清晰,操作也相对容易,因此被广泛应用于生物化学和分子生物学领域。
通过琼脂糖凝胶电泳,可以对蛋白质进行分离和纯化,也可以用于分析蛋白质的相对分子质量和电荷性质。
此外,琼脂糖凝胶电泳还可以与其他技术相结合,如Western blotting等,用于进一步的蛋白质分析。
总之,琼脂糖凝胶电泳作为一种重要的蛋白质分离和分析技术,具有简单易操作、分辨率高、分离效果好等优点,被广泛应用于生命科学领域。
通过对琼脂糖凝胶电泳原理的深入理解,可以更好地应用该技术进行蛋白质研究,为生命科学研究提供更多有益信息。

琼脂糖凝胶电泳的实验器材列表全文共四篇示例,供读者参考第一篇示例:琼脂糖凝胶电泳是一种常用的蛋白质分离和分析技术,它通过将待检样品加入琼脂糖凝胶中,然后施加电场进行电泳,根据蛋白质的大小和电荷来实现分离。
在进行琼脂糖凝胶电泳实验时,需要准备一系列的实验器材来保证实验顺利进行。
下面就为大家介绍一份关于琼脂糖凝胶电泳的实验器材清单。
1. 琼脂糖凝胶板:用于制备琼脂糖凝胶电泳所需的琼脂糖凝胶板。
琼脂糖凝胶板有不同厚度和孔径的选择,可以根据实验需要选择合适的琼脂糖凝胶板。
2. 电泳槽:用于放置琼脂糖凝胶板和提供电场进行电泳的设备。
电泳槽有不同尺寸和型号,可以根据实验需要选择合适的电泳槽。
3. 电源和电源线:用于提供电流进行电泳实验,电源的输出电流和电压应根据实验要求进行调节。
电源线连接电源和电泳槽,确保实验可以正常进行。
4. 琼脂糖:用于制备琼脂糖凝胶板的主要原料,琼脂糖的纯度和质量对实验结果有重要影响,应选择优质的琼脂糖。
5. 蛋白质样品:待检样品,用于进行琼脂糖凝胶电泳分析。
样品预处理和加载方法会对实验结果产生影响,应根据实验目的选择合适的样品处理方法。
6. 样品缓冲液:用于稀释样品和维持合适的pH值,以及提供电泳所需的离子条件。
不同类型的琼脂糖凝胶电泳需要不同种类的样品缓冲液。
7. 饱和盐溶液:用于制备电泳缓冲液和维持电泳过程的离子条件,常用的饱和盐溶液包括氯化钠和磷酸钾。
8. 蛋白质标记剂:用于标记蛋白质样品,通过标记蛋白质使其在电泳过程中可见,以便后续的分析和检测。
9. 蛋白质分子量标准品:用于校准琼脂糖凝胶电泳的分子量刻度,帮助确定待检样品的分子量。
10. 染色剂:用于染色琼脂糖凝胶板上的样品,使样品可见并方便后续的分析和检测。
以上就是一份关于琼脂糖凝胶电泳实验器材清单,这些器材是进行琼脂糖凝胶电泳实验时必备的。
在选择和使用这些器材时,需要注意其质量和操作规范,以确保实验结果的准确性和可靠性。

琼脂糖凝胶电泳实验报告琼脂糖凝胶电泳实验报告引言:琼脂糖凝胶电泳是一种常用的分离和分析生物大分子的方法。
它基于琼脂糖凝胶的孔隙大小,通过电场作用下分离样品中的不同分子。
本实验旨在通过琼脂糖凝胶电泳技术,分离并分析DNA样品中的不同片段。
实验材料与方法:1. 实验材料:-琼脂糖凝胶:用于制备凝胶基质,提供分离分子的孔隙。
-缓冲液:用于维持凝胶的pH值和离子浓度稳定。
-DNA样品:包含待分离的DNA片段,可通过PCR扩增获得。
2. 实验步骤:(1)制备琼脂糖凝胶:将适量琼脂糖加入缓冲液中,加热搅拌至溶解,待冷却至大约60℃时,倒入凝胶模具中,插入梳子,待凝胶完全固化后,取出梳子。
(2)样品处理:将待分离的DNA样品与DNA加载缓冲液混合,加热至95℃,使DNA变性,然后迅速冷却至室温。
(3)电泳分离:将凝胶模具放入电泳槽中,加入足够的缓冲液,将DNA样品加入凝胶孔中,连接电源,施加适当电压,进行电泳分离。
结果与讨论:经过电泳分离后,我们观察到琼脂糖凝胶上出现了一系列DNA条带。
这些条带的迁移距离与DNA片段的大小成反比,即较小的片段迁移距离较远,较大的片段迁移距离较短。
实验结果的解释可以通过琼脂糖凝胶电泳的原理来理解。
琼脂糖凝胶的孔隙大小决定了不同大小的DNA片段在凝胶中的迁移速度。
较小的DNA片段能够更容易通过凝胶孔隙,因此迁移距离较远;而较大的DNA片段则受到凝胶孔隙的限制,迁移距离较短。
通过对DNA条带的大小和形状进行分析,我们可以获得关于DNA样品的重要信息。
例如,我们可以确定样品中是否存在特定的DNA片段,或者在PCR扩增中是否成功地放大了目标片段。
总结:琼脂糖凝胶电泳是一种简单而有效的生物大分子分离和分析方法。
通过电泳分离DNA样品,我们可以快速获得关于样品中DNA片段的信息。
这种技术在分子生物学、遗传学等领域有着广泛的应用,对于研究和诊断基因相关的疾病具有重要意义。
在今后的研究中,我们可以进一步探索琼脂糖凝胶电泳的应用,并结合其他分析技术,提高实验的准确性和灵敏度。
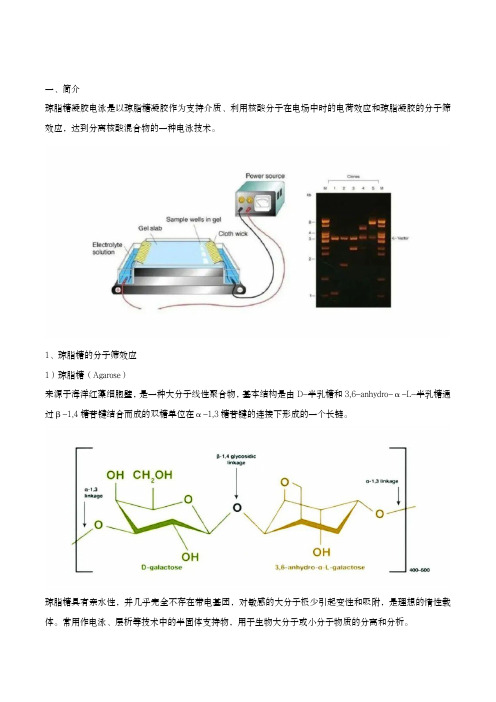
一、简介琼脂糖凝胶电泳是以琼脂糖凝胶作为支持介质、利用核酸分子在电场中时的电荷效应和琼脂凝胶的分子筛效应,达到分离核酸混合物的一种电泳技术。
1、琼脂糖的分子筛效应1)琼脂糖(Agarose)来源于海洋红藻细胞壁,是一种大分子线性聚合物,基本结构是由D-半乳糖和3,6-anhydro-α-L-半乳糖通过β-1,4糖苷键结合而成的双糖单位在α-1,3糖苷键的连接下形成的一个长链。
琼脂糖具有亲水性,并几乎完全不存在带电基团,对敏感的大分子极少引起变性和吸附,是理想的惰性载体。
常用作电泳、层析等技术中的半固体支持物,用于生物大分子或小分子物质的分离和分析。
琼脂糖在水中一般加热到90℃以上溶解,温度下降到40℃左右形成良好的半固体状凝胶。
琼脂糖加热溶解后分子呈随机线团状分布,当温度降低时链间糖分子上的羟基通过氢键作用相连接,形成直径从50nm-200nm不等的孔径结构,孔径的大小由凝胶浓度控制。
琼脂糖凝胶中孔径的大小,影响了通过的核酸分子的大小以及通过的速度。
通常来说,琼脂糖凝胶的浓度越高,孔径越小,能够通过的核酸分子越小,迁移速度也越慢。
DNA片段越小,所需的胶浓度越大;而DNA 片段越长,所需的胶浓度则越小。
选择合适的胶浓度才能更好的分离片段。
2)琼脂的质量评价琼脂糖通常通过其凝胶强度和电内渗情况判断质量好坏。
强度越高,凝胶性能越好。
质量较好的琼脂糖强度通常在1200g/cm2以上,硫酸根含量在0.2%以下,电内渗在0.13以下。
琼脂糖是从琼脂中分离而来的。
琼脂由琼脂糖和琼脂果胶组成的,琼脂果胶是由许多更小的分子组成的异质混合物,和琼脂糖结构相似,但带硫酸根和羧基组分,凝胶能力差。
在琼脂糖制备过程中需要把琼脂果胶尽量去除,否则琼脂糖有可能存在极微量硫酸根和丙酮酸取代电离基团,附着到琼脂糖的多糖基质上,造成电内渗(EEO)。
电内渗会导致缓冲液中产生正电荷反向离子,它们向负极移动,从而造成与DNA反方向迁移的液流,使DNA的分离效果变差。
琼脂糖凝胶电泳一、琼脂糖凝胶的特点天然琼脂是一种多糖,主要由琼脂糖(约80%)和琼脂凝集素组成。
琼脂糖是一种中性物质,由半乳糖及其衍生物组成,不带电荷,而琼脂凝胶是一种含有硫酸盐和羧基的强酸性多糖。
因为这些基团是带电的,所以它们在电场的作用下能产生强烈的电渗作用。
此外,硫酸盐能与一些蛋清物质相互作用,影响电泳速度和分离效果。
因此,目前平板电泳常用琼脂糖作为电泳载体,其优点如下。
1.琼脂糖凝胶电泳操作简单,电泳速度快,样品无需预先处理即可电泳。
2.琼脂糖凝胶结构均匀,含水量大(约占98%~99%),近似自由电泳,样品扩散较自由电流,对样品吸附极微,因此电泳图谱清晰,分辨率高,重复性好。
3.琼脂糖透明,无紫外线吸收。
电泳过程和结果可直接用紫外灯检测和定量测定。
4.电泳后区带易染色,样品极易洗脱,便于定量测定。
制成干膜可长期保存。
目前,琼脂糖常用作分离蛋白质和同工酶的电泳载体。
琼脂糖电泳和免疫化学的结合已经发展成为免疫电泳技术,它可以识别其他方法无法识别的复杂系统。
由于超微技术的建立,可以检测到0.1ug蛋白质。
琼脂糖凝胶电泳也常用于分离、鉴定核酸,如dna鉴定,dna限制性内切核酸酶图谱制作等。
由于这种方法操作方便,设备简单,需样品量少,分辨能力高,已成为基因工程研究中常用实验方法之一。
二、dna的琼脂糖凝胶电泳琼脂糖凝胶电泳分离核酸主要基于它们的相对分子质量和分子构型,并且与凝胶浓度密切相关。
1.核酸分子大小与琼脂糖浓度的关系①dna分子的大小在凝胶中,dna片段迁移距离(迁移率)与碱基对的对数成反比,因此通过已知大小的标准物移动的距离与未知片段的移动距离时行比较,便可测出未知片段的大小。
但是当dna分子大小超过20kb时,普通琼脂糖凝胶就很难将它们分开。
此时电泳的迁移率不再依赖于分子大小,因此,就用琼脂糖凝胶电泳分离dna时,分子大小不宜超过此值。
2.琼脂糖浓度如下表所示。
不同大小的DNA需要用不同浓度的琼脂糖凝胶分离。
一、实验原理琼脂糖凝胶电泳是分离和纯化DNA 片段的常用技术。
把DNA样品加入到一块包含电解质的多孔支持介质(琼脂糖凝胶)的样品孔中,并置于静电场上。
由于DNA分子的双螺旋骨架两侧带有含负电荷的磷酸根残基,因此在电场中向正极移动。
在一定的电场强度下,DNA分子的迁移速度取决于分子筛效应。
具有不同的相对分子质量的DNA片段泳动速度不一样,因而可依据DNA分子的大小来使其分离。
凝胶电泳不仅可分离不同分子质量的DNA,也可以分离相对分子质量相同,而构型不同的DNA分子。
在电泳过程中可以通过示踪染料或相对分子质量标准参照物和样品一起进行电泳而得到检测。
相对分子质量标准参照物相对可以提供一个用于确定DNA片段大小的标准。
在凝胶中加入少量溴化乙锭(ethidium bromide, EB),其分子可插入DNA的碱基之间,形成一种络合物,在254~365nm 波长紫外光照射下,呈桔红色荧光,因此也可对分离的DNA进行检测。
一般琼脂糖凝胶电泳适用于大小在0.2kb~50kb范围内的DNA片段。
本实验介绍琼脂糖凝胶的制备以及琼脂糖凝胶电泳在DNA片段分离中的应用方法。
二、仪器及试剂1.仪器及耗材:水平电泳槽、电泳仪、凝胶成像分析系统、微波炉、微量移液器、透明胶带、点样板或parafilm、100 ml或250 ml锥形瓶、量筒、吸头等。
2.试剂及配制:50×TAE缓冲液的配制:2 mol/L Tris-乙酸,0.05 mol/L EDTA(pH 8.0)配制1000 mlTris 242 g冰乙酸 57.1 ml0.5 mol/L EDTA 100 ml加入600 ml去离子水后搅拌溶解,将溶液定容至1 L后。
高温高压灭菌,室温保存。
1×TAE缓冲液的配制:称量20 ml的50×TAE缓冲液,再加入980 ml的去离子水。
溴化乙啶贮存液:10 mg/ml 溴化乙啶配制:100 ml称取1 g溴化乙啶,置于100 ml烧杯中,加入80 ml去离子水后搅拌溶解。
琼脂糖凝胶电泳
实验材料:
实验器材:核酸电泳设备,琼脂糖凝胶制备槽,微量移液器,10微升枪头实验试剂:核酸染液(Biotium 10000ΧGelred),10ΧLoading buffer,TAE 电泳缓冲液,DNA Marker(天根),琼脂糖
实验步骤:
1.制胶:
a)准备干净的配胶板和电泳槽,根据样品量选择合适的制胶板及梳子并组
装好;
b)根据目的条带大小选择琼脂糖凝胶浓度,琼脂糖凝胶浓度选择参照如下:
凝胶浓度(%质量/体积)线性DNA长度(bp)
0.5 1000~30000
0.7 800~12000
1.0 500~10000
1.2 400~7000
1.5 200~3000
2.0 50~2000
注意:对于需要DNA凝胶回收样品,不管分子量大小,都建议用0.8%
琼脂糖凝胶以提高胶回收产率。
c)称取琼脂糖粉,放入锥形烧瓶中,加入相应体积的1ΧTAE溶液,用称
量纸将瓶口覆盖严实,轻轻摇匀。
放入微波炉中,加热2分钟,小心取
出,透过光看液体中是否有透明折光颗粒,若有说明琼脂糖融化不充分,
需要继续加热片刻,直至充分溶解;
d)根据体积按照1/10000加入核酸染料,摇匀,小心倾倒入制胶板中,待
其自然冷却凝固后小心取出梳子连板一起放入电泳槽中(注意正反,样
品向红色正极泳动),加入1ΧTAE溶液完全淹没凝胶。
2.上样、电泳:
根据样品分子量大小选择合适的DNA Marker,每孔加入6-10ul。
将对照及样品与10Χ Loading Buffer混匀,依次加入凝胶上样孔中(动作轻柔快捷,防止样品逸散飘出)。
盖上盖子,120V恒压电泳25分钟,至样品指示带泳动至距胶另一端0.5-1cm以上结束电泳。
3.拍照(以Image Lab软件为例):
启动软件后,首先根据所用选择正确的核酸染料曝光程序
放置,点击软件左下角“放置凝胶(Position Gel)”,在视野下摆正凝胶位置,然后点击“运行(Run Protocol)”
4.结果导出:
点击左上角”文件(file)”-“将结果导出以便发布”,一般导出图像为Tif格式,分辨率不小于300dpi。
图像可以选择用Image Lab或者Photo shop处理。
注意事项:
1.若选用EB核酸染料进行实验,应严格注意生物安全防护;因核酸染料作用
的特异性,即使选用其他核酸染料也应注重个人安全防护;
2.TAE电泳液可以重复使用,但若发现电泳过程中产热严重,应及时更换电泳
液,防止因溶液离子浓度过高,产热过多导致胶融化;
3.制胶过程中确保琼脂糖充分溶解,若未充分溶解会导致电泳结果异常;
4.加样过程中确保没有样品溢出加样孔;
5.为确保DNA胶回收质量,在进行DNA胶回收电泳时尽量更换新的TAE缓
冲液;。