普通锌锰干电池
- 格式:doc
- 大小:128.00 KB
- 文档页数:6

原电池电极反应的书写班级:___________,姓名:________________。
1.伏打电池:负极-Zn,正极-Cu,电解液-H2SO4。
负极反应为_____________________________;负极反应为_____________________________。
总反应为_______________________________。
2.普通锌锰干电池:总反应为Zn+2NH4Cl+2MnO2=ZnCl2+Mn2O3+2NH3↑+H2O,电解液-NH4Cl、MnO2的糊状物。
负极反应为_____________________________;负极反应为_____________________________。
3.碱性锌锰干电池:总反应为Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH,电解液-KOH、MnO2的糊状物。
负极反应为_____________________________;负极反应为_____________________________。
4.银锌电池:总反应为Zn+Ag2O+H2O=Zn(OH)2+2Ag,电解液-NaOH。
负极反应为_____________________________;负极反应为_____________________________。
5.铝-空气-海水电池:总反应式为4Al+3O2+6H2O=4Al(OH)3,电解液-海水。
负极反应为_____________________________;负极反应为_____________________________。
6.镁-铝电池:电极材料分别为镁和铝,电解液-KOH。
负极反应为_____________________________;负极反应为_____________________________。
总反应为_______________________________。
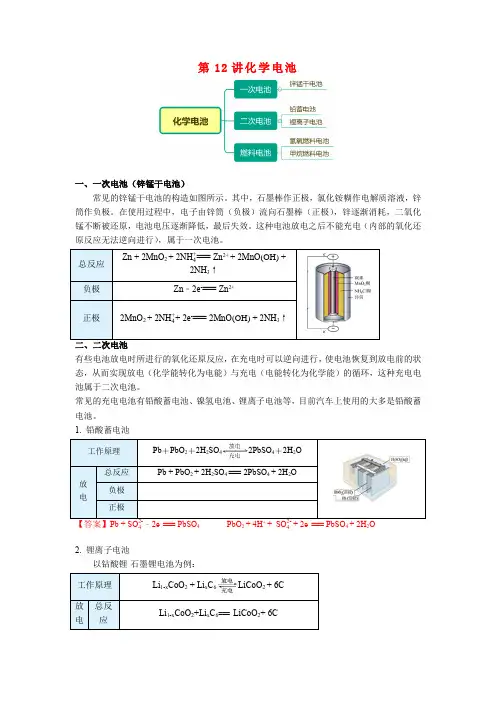
第12讲化学电池一、一次电池(锌锰干电池)常见的锌锰干电池的构造如图所示。
其中,石墨棒作正极,氯化铵糊作电解质溶液,锌筒作负极。
在使用过程中,电子由锌筒(负极)流向石墨棒(正极),锌逐渐消耗,二氧化锰不断被还原,电池电压逐渐降低,最后失效。
这种电池放电之后不能充电(内部的氧化还原反应无法逆向进行),属于一次电池。
有些电池放电时所进行的氧化还原反应,在充电时可以逆向进行,使电池恢复到放电前的状态,从而实现放电(化学能转化为电能)与充电(电能转化为化学能)的循环,这种充电电池属于二次电池。
常见的充电电池有铅酸蓄电池、镍氢电池、锂离子电池等,目前汽车上使用的大多是铅酸蓄电池。
1. 铅酸蓄电池Pb+PbO2+2H2SO42PbSO4+2H2OPb + PbO+ 2H SO === 2PbSO+ 2H O=== PbSO4 + 2H2O4 4 2 42. 锂离子电池以钻酸锂-石墨锂电池为例:Li1-x CoO2 + Li x C6LiCoO2 + 6C61-x22三、燃料电池燃料电池是一种将燃料(如氢气、甲烷、乙醇)和氧化剂(如氧气)的化学能直接转化为电能的电化学反应装置,具有清洁、安全、高效等特点。
燃料电池的能量转化率可以达到80%以上。
1.氢氧燃料电池2 2 2O2 + 4H+ +4e-=== 2H2OO2 +2H2O + 4e-=== 4OH-2.甲烷燃料电池4224322O2 +8H+ +8e-=== 4H2O2O2 + 8e-+4H2O=== 8OH-CH4 + 2O2 === CO2 + 2H2OCH4 + 2O2 + 2OH-===CO32-+ 3H2O题型一:化学电池的分类及特点【变1】下列化学电池属于高效、环境友好电池的是A.镍镉电池B.锌锰电池C.铅蓄电池D.氢氧燃料电池【答案】D【详解】A.镍镉电池中含有镍镉重金属,对环境有污染,故A错误;B.锌锰电池中含有锌、锰元素,对环境有污染,故B错误;C.铅蓄电池中含有铅重金属,对环境有污染,故C错误;D.氢氧燃料电池最终生成水,水对环境无污染,故D正确;故选:D。


化学电池的种类化学电池:借助于化学能直接转变为电能的装置。
化学电池的主要部分是电解质溶液,和浸在溶液中的正极和负极,使用时将两极用导线接通,就有电流产生,因而获得电能。
化学电池放电到一定程度,电能减弱,有的经充电复原又可使用,这样的电池叫蓄电池,如铅蓄电池、银锌电池等;有的不能充电复原,称为原电池,如干电池、燃料电池等。
下面介绍化学电池的种类:,淀粉糊的作用是提高阴、阳离子在两个电极的迁移速率。
)吸收正极放出的H2,防止产生极化现象,即作去极剂( 1.干电池:普通锌锰干电池的简称,在一般手电筒中使用锌锰干电池,是用锌皮制成的锌筒作负极兼做容器,中央插一根碳棒作正极,碳棒顶端加一铜帽。
在石墨碳棒周围填满二氧化锰和炭黑的混合物,并用离子可以通过的长纤维纸包裹作隔膜,隔膜外是用氯化锌、氯化铵和淀粉等调成糊状作电解质溶液;电池顶端用蜡和火漆封口。
在石墨周围填充ZnCl2、NH 4Cl和淀粉糊作电解质,还填有MnO2作去极化剂电极反应为:负极=Zn2+-Zn-2 e=2NH3+H2-正极 2 +2 eH2+2MnO2=Mn2O3+H2O4]2+)NH3(正极产生的NH3又和ZnCl2作用:Zn2++4NH3=[Zn2Cl2+Mn2O3+H2O)NH3(干电池的总反应式:Zn+2NH4Cl+2MnO2=Zn或2]Cl2+ZnCl2+Mn2O3+H2O)NH3(2Zn+4NH4Cl+2MnO2=[Zn5.正极生成的氨被电解质溶液吸收,生成的氢气被二氧化锰氧化成水。
干电池的电压16.V—1 V。
在使用中锌皮腐蚀,电压逐渐下降,不能重新充电复原,因而不宜长时间连续使用。
这种电池的电量小,在放电过程中容易发生气涨或漏液。
而今体积小,性能好的碱性锌—锰干电池是电解液由原来的中性变为离子导电性能更好的碱性,负极也由锌片改为锌粉,反应面积成倍增加,使放电电流大加幅度提高。
碱性干电池的容量和放电时间比普通干电池增加几倍。
28.25—1.密度为1(2.铅蓄电池:铅蓄电池可放电亦可充电,具有双重功能。

碱性锌锰干电池原理
碱性锌锰干电池是一种常见的干电池,其原理是基于电化学反应。
它由一个锌阳极和一个二氧化锰阴极组成,这两个电极之间通过电解质(一般为碱性溶液)隔离。
在工作过程中,锌阳极发生氧化反应,即锌原子失去两个电子转变为锌离子:
Zn(s) → Zn2+(aq) + 2e-
这些电子从锌电极经过外部电路流向阴极。
同时,阴极上的二氧化锰得到电子转变为MnOOH,然后进一步发生水的电离反应:
MnO2(s) + H2O(l) + e- → MnOOH(s) + OH-(aq)
这个反应中产生的氢氧根离子再结合锌离子生成氢氧化锌:Zn2+(aq) + 2OH-(aq) → Zn(OH)2(s)
整个反应过程如下:
Zn(s) + 2MnO2(s) + 2H2O(l) → Zn(OH)2(s) + 2MnOOH(s)
在这个电池中,产生的氢氧根离子会在电池中逐渐消耗,导致电池反应速率降低,从而限制了电池的使用寿命。
当电池用完时,锌阳极将被完全消耗,电池无法再产生电流。
总的来说,碱性锌锰干电池的原理是通过锌和二氧化锰之间的氧化还原反应,在电解质的作用下,将化学能转化为电能,从而产生电流。

十大原电池与电极反应式的书写一、十大原电池1、普通锌锰干电池:Zn +2MnO 2+2NH 4Cl ZnCl 2+Mn 2O 3+2NH 3↑+H 2O负极(Zn ):Zn -2e-Zn 2+正极(C ):2MnO 2+2e -+2NH 4+Mn 2O 3+2NH 3↑+H 2O 碱性锌锰干电池:Zn +2MnO 2+H 2O Zn(OH)2+Mn 2O 3负极(Zn ):Zn -2e -+2OH-Zn(OH)2 正极(C ):2MnO 2+2e -+H 2O Mn 2O 3+2OH -2、铅蓄电池:2PbSO 4+2H 2O充电 放电Pb +PbO 2+2H 2SO 4 负极(Pb ):Pb -2e -+SO 42-PbSO 4正极(PbO 2):PbO 2+2e -+4H ++SO 42-PbSO 4+2H 2O3、钮扣电池:Ag 2O +Zn2Ag +ZnO负极(Zn ):Zn -2e -+2OH-ZnO +H 2O正极(Ag 2O ):Ag 2O +2e -+H 2O 2Ag +2OH -4、镍镉电池:Cd(OH)2+2Ni(OH)2充电 放电Cd +2NiO(OH)+2H 2O负极(Cd ):Cd -2e -+2OH-Cd(OH)2正极[NiO(OH)]:2NiO(OH)+2e -+2H 2O 2Ni(OH)2 +2OH -5、银锌电池:Zn +Ag 2O +H 2O 2Ag +Zn(OH)2负极(Zn ):Zn -2e -+2OH-Zn(OH)2正极(Ag 2O ):Ag 2O +2e -+H 2O 2Ag +2OH -6、氢镍电池:H 2+2NiO (OH ) 2Ni(OH)2负极(通入H 2):H 2-2e -+2OH-2H 2O正极[NiO(OH)]:2NiO(OH)+2e -+2H 2O2Ni(OH)2 +2OH -放电充电7、心脏起搏器:2Zn +O 2+4HCl 2ZnCl 2+2H 2O负极(Zn ):Zn -2e-Zn 2+正极(通入氧气):O 2+4e -+4H+2H 2O8、海水标志灯:4Al +O 2+6H 2O 4Al(OH)3负极(Al ):Al -3e-Al 3+正极(通入O 2):O 2+4e -+2H 2O4OH -9、氢氧燃料电池:2H 2+O 22H 2O酸电解质 负极(通入H 2):H 2-2e -2H +正极(通入氧气):O 2+4e -+4H+2H 2O 碱电解质:负极(通入H 2):H 2-2e -+2OH-2H 2O 正极(通入氧气):O 2+4e -+2H 2O4OH -碳酸钠电解质:负极(通入H 2):H 2-2e -+CO 32-CO 2↑+H 2O正极(通入氧气和二氧化碳):O 2+4e -+2CO 22CO 32-NiO 电解质:负极(通入H 2):H 2-2e -+O 2-H 2O 正极(通入氧气):O 2+4e-2O 2-10、锂电池:Li +FePO 4 LiFePO 4负极(Li ):Li -e-Li +正极(FePO 4):FePO 4+e -+Li +LiFePO 4二、电极反应式的书写以氢气与氧气在碱性环境中的燃料电池为例。


锌锰电池亦称为碱性干电池
锌锰电池主要由锌、锰、汞、铜、铁、塑料、碳及酸、碱等电解质溶液等约十几种原料制成
锌锰干电池的危害,主要是其中所含的汞和酸、碱等电解质溶液在废弃后可能进入环境中所造成的危害。
废旧电池的危害主要集中在其中所含的少量的重金属上,如铅、汞、镉等。
这些有毒物质通过各种途径进入人体内,长期积蓄难以排除,损害神经系统、造血功能和骨骼,甚至可以致癌。
铅:神经系统(神经衰弱、手足麻木)、消化系统(消化不良、腹部绞痛)、血液中毒和其他的病变。
汞:精神状态改变是汞中毒的一大症状。
脉搏加快,肌肉颤动,口腔和消化系统病变。
镉、锰:主要危害神经系统。
重金属对人体的危害
锌腹痛,昏睡,高血压,冠心病等
镉、锰主要危害神经系统
镍使细胞恶变,有致癌作用
铅神经系统、消化系统、血液中毒和其他的病变。

水系锌锰电池综述一、电池概述水系锌锰电池,也称为糊式锌锰电池,是一种自放电率较低的一次干电池。
其正极为二氧化锰,负极为锌,电解液多为氯化铵、氯化锌和水。
这种电池的标称电压为1.5V,容量较低,通常为0.5\~1Ah。
水系锌锰电池的结构紧凑,使用方便,成本较低,适用于电流较小的用电设备,如闹钟、计算器、遥控器等。
二、工作原理水系锌锰电池的工作原理主要基于化学反应。
当电池放电时,锌失去电子成为锌离子,电子从外电路通过,电流从负极流向正极。
同时,电解液中的氯离子在正极上得到电子,还原成氢气和氯气。
这个化学反应过程伴随着电子的转移和电流的产生。
三、构造与材料水系锌锰电池主要由正极、负极、隔离层和外壳等部分组成。
正极为二氧化锰和石墨的混合物,负极为锌粉和电解液的混合物,隔离层用于隔离正负极,避免短路。
外壳通常由金属或塑料制成,用于容纳电解液和隔绝外部环境。
四、性能特点水系锌锰电池具有以下性能特点:1.电压稳定:水系锌锰电池的标称电压为1.5V,放电过程中电压变化较小。
2.容量适中:水系锌锰电池的容量适中,适合电流较小的用电设备。
3.安全性高:水系锌锰电池没有泄漏和爆炸的风险,安全性较高。
4.环保:水系锌锰电池无汞无铅,对环境友好。
5.使用寿命短:由于自放电率较高,水系锌锰电池的使用寿命较短,通常只有几年。
五、生产工艺水系锌锰电池的生产工艺主要包括装填、注液、封口、检测等步骤。
装填是将正负极材料装入外壳中;注液是将电解液注入外壳中;封口是用封口机将注液后的电池封口;检测是对成品电池进行性能检测,包括电压、容量、内阻等方面的检测。
六、应用领域水系锌锰电池广泛应用于以下领域:1.民用市场:水系锌锰电池适用于家用电器、遥控器、计算器、电子玩具等小型电器设备。
2.工业市场:在工业领域,水系锌锰电池可用于仪表、计时器、测试仪器等设备的电源。
3.军事领域:由于水系锌锰电池具有较高的安全性,因此在军事领域也有一定的应用。

znmno2干电池反应式ZnMnO2干电池反应式一、引言干电池是一种常见的便携式电源,被广泛应用于各个领域。
其中,ZnMnO2干电池作为一种重要的碱性锌锰电池,具有体积小、重量轻、使用方便等优点,被广泛用于电子产品、家用电器、玩具等领域。
本文将从反应式的角度,探讨ZnMnO2干电池的原理与特点。
二、ZnMnO2干电池的反应式ZnMnO2干电池的反应式可简化为以下两个半反应:1. 阳极反应:Zn(s) → Zn2+(aq) + 2e-2. 阴极反应:2MnO2(s) + H2O(l) + 2e- → Mn2O3(s) + 2OH-(aq)三、反应机理ZnMnO2干电池的工作原理基于两个半反应的相互作用。
在阳极,锌(Zn)通过放电反应氧化成锌离子(Zn2+),同时释放出电子。
而在阴极,二氧化锰(MnO2)与水(H2O)以及电子发生还原反应,生成三氧化二锰(Mn2O3)和氢氧根离子(OH-)。
两个半反应通过电解质(通常为碱性电解质)中的离子传导实现电子的流动,从而产生电能。
四、特点与优势1. 高能量密度:ZnMnO2干电池具有较高的能量密度,能够在小体积的情况下提供持久的电力供应,适用于需要长时间使用的电子设备。
2. 长寿命:由于ZnMnO2干电池采用碱性电解质,相对于其他类型的干电池而言,其寿命更长,能够提供更持久的电能。
3. 耐高温性能好:ZnMnO2干电池具有较高的工作温度范围,可在-20℃至60℃的环境下正常工作,适用于各种气候条件下的使用。
4. 低自放电率:ZnMnO2干电池的自放电率较低,即在长时间不使用的情况下,电池内部的电能损失较小,能够更好地保存电能。
5. 环保节能:与一次性碱性电池相比,ZnMnO2干电池可重复使用,减少了电池废弃物的产生,对环境更加友好。
五、应用领域1. 电子产品:ZnMnO2干电池广泛应用于电子产品,如遥控器、手持游戏机、计算器等,为这些设备提供可靠的电力支持。
普通锌锰干电池11.普通干电池中装有MnO2和其它物质,MnO2的作用是()。
A.和正极作用把碳氧化为CO2B.把正极附近生成的H2氧化成水C.电池中发生化学反应的催化剂D.和负极作用,将锌变成锌离子12.干电池的负极反应为:Zn-2e-=Zn2+,现以它为电源电解32.4g34%的KNO3溶液,一段时间后测得溶液的质量分数为36%,问这段时间内,干电池中消耗的Zn 的物质的量为()。
A.0.05mol B.0.1mol C.0.2mol D.0.3mol49.锌锰干电池在放电时,电池总反应方程式可以表示为:Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3+H2O在此电池放电时,正极(碳棒)上发生反应的物质是()。
A.Zn B.碳棒C.MnO2和NH4+D.Zn2+和NH4+49.解析:干电池放电时,正极得到电子发生还原反应。
答案:C13.某干电池的电极分别为碳棒(上面由铜帽)和锌(皮),以糊状NH4Cl和ZnCl2做为电解质(其中加入MnO2吸收H2,ZnCl2吸收NH3),电极反应可简化为:Zn-2e-=Zn2+,2NH4++2e-=2NH3+H2。
根据以上所述判断下列结论正确的是()。
A.Zn为正极,碳为负极B.工作时电子由碳极经外电路流向Zn极C.Zn为负极,碳为正极D.长时间使用内装糊状物可能流出,腐蚀用电器14.常用的锌锰干电池在放电时总反应可表为:Zn(s)+2MnO2(s)+2NH4+=Zn2++Mn2O3+2NH3+H2O,放电时正极区发生反应的物质或微粒是()。
A.Zn B.MnO2和NH4+C.MnO2D.Zn2+和NH323.(6分)手电筒中使用的干电池一般是普通锌锰干电池,其结构如右图所示。
在放电时的总反应可表示为:Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3+H2O试回答下列问题:(1)该电池的正极是____________。
(2)写出该电池的极反应式:负极反应式:______________________________;正极反应式:______________________________。
23.(1)碳棒(2)Zn-2e-=Zn2+2MnO2+2NH4++2e-=Mn2O3+2NH3+H2O(每空2分,共6分)20.小刚为了解生活中常见的锌锰干电池,做了以下探究.他打开一节废电池,观察到如下现象:○1黑色碳棒完好无损;○2电极周围充满黑色粉末;○3里面有少量无色晶体;○4金属外壳明显破损.小刚查阅了资料:锌锰干电池的结果如图14所示,它以中心的碳棒(石墨)做正极,外围的锌筒做负极,锌筒与碳棒之间填满用氯化铵溶液(做电解质)拌湿的二氧化锰和石墨,石墨不参加化学反应,仅起导电作用,在电池的使用中,锌逐渐变成了氯化锌.……请你根据初中学习的知识和小刚的探究活动,填写以下空白.(1)用碳棒做电极主要利用了石墨的________________性.(2)干电池在使用过程中的能量转化是__________________________.(3)以氯化锌为例,写出证明废电池中含有氯化物的化学方程式:____________________________________________________________.(4)用简单的方法证明黑色粉末中含有石墨,写处操作步骤和实验现象.(5)通过回收废旧锌锰电池可得到的物质有________________(至少答2种).13.某干电池的电极分别为碳棒(上面由铜帽)和锌(皮),以糊状NH4Cl和ZnCl2做为电解质(其中加入MnO2吸收H2,ZnCl2吸收NH3),电极反应可简化为:Zn-2e-=Zn2+,2NH4++2e-=2NH3+H2。
根据以上所述判断下列结论正确的是()。
A.Zn为正极,碳为负极B.工作时电子由碳极经外电路流向Zn极C.Zn为负极,碳为正极D.长时间使用内装糊状物可能流出,腐蚀用电器21.锌-锰干电池是普遍使用的化学电池,其中含有MnO2.NH4Cl.ZnCl2等糊状物。
以锌筒为负极材料,石墨为正极材料。
工作时反应方程式是:Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3+H2O(1)试写出干电池放电时的正.负电极反应式:正极:_________________________负极:________________________________干电池用久了就会变软,其原因是_________________________________________。
(2)正极反应中,前后经历下列反应:2NH4++2e-=2NH3+H2;2MnO2+H2=Mn2O3+H2O,如果没有MnO2参与,干电池将难于持续稳定工作。
试说明理由:_________________________________________________________________。
21.(1)2NH4++2MnO2+2e-=2NH3+Mn2O3+H2O Zn-2e-=Zn2+ 电池放电过程中有水产生.锌筒变薄造成干电池变软(2)正极反应的中间产物H2附着于石墨,增加电池内阻。
2.碱性电池具有容量大.放电电流大的特点,因而得到广泛应用。
锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn (OH)2(s)+Mn2O3(s)下列说法错误..的是A.电池工作时,锌失去电子B.电池工作时,电子由正极通过外电路流向负极C.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq)D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g16.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。
锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s),下列说法错误的是()。
A.电池工作时,锌失去电子B.电池负极的电极反应式为:Zn(s)+2H2O(1)-2e-=Zn(OH)2(s)+2H+(aq)C.电池工作时,电子由正极通过外电路流向负极D.电池工作时,MnO2得到电子,发生了还原反应15.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。
锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s),下列说法错误..的是()。
A.电池工作时,锌失去电子B.电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH -(aq)C.电池工作时,电子由正极通过外电路流向负极D.外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g16.(18分)某学校设计了一节实验活动课,让学生从废旧干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质。
整个实验过程如下,请回答有关问题:(1)干电池的基本构造和工作原理。
上图为干电池的基本构造图。
干电池工作时负极的电极反应式是___________。
正极上的电极反应式是______________________________(已知NH4+的得电子能力大于Zn2+)。
MnO2的作用是除去正极上产物,本身生成Mn2O3,反应的化学方程式为________________________________________________。
而淀粉糊的作用是提高阴、阳离子在两个电极的迁移速率。
(2)锌皮和碳棒的回收。
用钳子和剪刀剪开回收的干电池的锌铜,将锌皮和碳棒取出,并用毛刷刷干净,将电池内的黑色粉末移入小烧杯中。
(3)氯化铵、氯化锌的提取、检验和分离。
①如何从黑色粉末中提取NH4Cl和ZnCl2等晶体的混合物?写出简要的实验步骤________________________________。
②设计简单的实验证明所得晶体中含有NH4+。
实验步骤:__________________________________________________。
实验现象:__________________________________________________。
有关的离子方程式:________________________________。
③用________方法可将NH4Cl和ZnCl2的晶体混合物分离开,实验原理用方程式表示为________________________________________。
④最后剩余的黑色残渣的主要成分是MnO2,还有炭黑和有机物等。
可用灼烧的方法除去杂质,该实验中需要用到的两种主要仪器有__________________。
16.(18分)(1)Zn-2e-=Zn2+,2NH4++2e-=2NH3↑+H2↑,H2+2MnO2=Mn2O3+H2O(3)①向小烧杯中加入一定量的蒸馏水,充分搅拌,然后过滤,将滤液移入蒸发皿中,加热蒸发结晶。
②实验步骤:取少量晶体溶于蒸馏水配成溶液。
取少许溶液,加入少量NaOH溶液后加热,将湿润的红石蕊试纸放在试管口实验现象:试纸变蓝有关的离子方程式:NH4++OH-NH3↑+H2O③加热NH4Cl NH3↑+HCl↑NH3↑+HCl↑NH4Cl④坩埚酒精灯8.(2007·深圳宝安区高三检测,13分)某学校设计了一节实验活动课,让学生从废旧电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质,整个实验过程如下。
试回答有关问题:(1)干电池的构造和工作原理:下图为干电池的基本构造图,该电池的工作原理是Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3↑,则干电池工作时负极上的电极反应为:_____________________,正极反应中前后经历了下列两个反应,即2NH4++2e-=H2+2NH3↑,MnO2.的作用是了除去正极上的产物氢气,该反应的化学方程式为2MnO2+H2=H2O+Mn2O3,由以上两个反应式可知,正极上发生的电极反应为___________________________________。
(2)锌皮和碳棒的回收:用钳子和剪刀剪开回收的干电池的锌筒,将锌皮和碳棒取出,并用毛刷刷干净,将电池内的黑色粉末移入烧杯中。
(3)NH4Cl、ZnCl2的提取、检验和分离:①如何从黑色粉末中提取NH4Cl、ZnCl2的等晶体的混合物?写出简要的实验步骤:____________________________________________________________________ __。
②设计简单的实验证明所得晶体中含有NH4+。