人教版化学选修三第三章第四节离子晶体
- 格式:ppt
- 大小:1.76 MB
- 文档页数:37






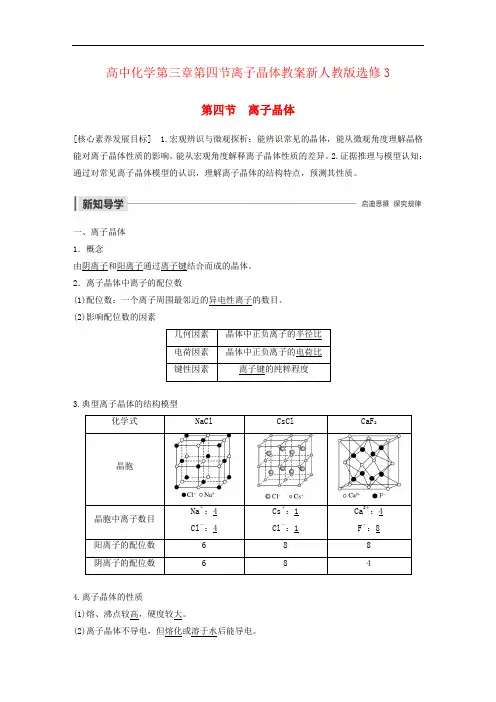
高中化学第三章第四节离子晶体教案新人教版选修3第四节离子晶体[核心素养发展目标] 1.宏观辨识与微观探析:能辨识常见的晶体,能从微观角度理解晶格能对离子晶体性质的影响,能从宏观角度解释离子晶体性质的差异。
2.证据推理与模型认知:通过对常见离子晶体模型的认识,理解离子晶体的结构特点,预测其性质。
一、离子晶体1.概念由阴离子和阳离子通过离子键结合而成的晶体。
2.离子晶体中离子的配位数(1)配位数:一个离子周围最邻近的异电性离子的数目。
(2)影响配位数的因素几何因素晶体中正负离子的半径比电荷因素晶体中正负离子的电荷比键性因素离子键的纯粹程度3.典型离子晶体的结构模型化学式NaCl CsCl CaF2晶胞晶胞中离子数目Na+:4Cl-:4Cs+:1Cl-:1Ca2+:4F-:8 阳离子的配位数 6 8 8阴离子的配位数 6 8 44.离子晶体的性质(1)熔、沸点较高,硬度较大。
(2)离子晶体不导电,但熔化或溶于水后能导电。
(3)大多数离子晶体能溶于水,难溶于有机溶剂。
(1)离子晶体中无分子,物质的化学式只表示物质的阴、阳离子个数比,不是分子式。
(2)离子晶体中一定含有离子键,也可能含有共价键。
(3)离子晶体中离子键没有方向性和饱和性,但每个阴(阳)离子周围排列的带相反电荷的离子数目都是固定的。
(4)常见的离子晶体包括强碱、活泼金属的氧化物、大部分盐。
例1自然界中的CaF 2又称萤石,是一种难溶于水的固体,属于典型的离子晶体。
下列一定能说明CaF2是离子晶体的实验是( )A.CaF2难溶于水,其水溶液的导电性极弱B.CaF2的熔、沸点较高,硬度较大C.CaF2固体不导电,但在熔融状态下可以导电D.CaF2在有机溶剂(如苯)中的溶解度极小【考点】离子晶体的组成与性质【题点】离子晶体的性质及应用答案 C解析离子晶体中含有离子键,离子键在熔融状态下被破坏,电离出自由移动的阴、阳离子,所以离子晶体在熔融状态下能够导电,这是判断某晶体是否为离子晶体的依据。


《离子晶体》第一课时导学案【课标要求】1.理解离子晶体的结构模型及其性质的一般特点。
2.了解离子晶体中离子晶体配位数及其影响因素。
【课前复习】1.什么是离子键?什么是离子化合物?2.指出下列物质中所含的化学键类型?属于离子化合物的有_____________; ①Na 2O ②SiO 2 ③NaCl ④CsCl ⑤H 2O ⑥Na ⑦Si ⑧O 2 ⑨Na 2SO 4 ⑩CaF 2 晶体类型 分子晶体原子晶体金属晶体结构微粒粒子间相互作用 物理性质特点【新课导学】 离子晶体 1.概念由_________和__________通过________结合而成的晶体。
(1)构成离子晶体的微粒:_________和_________。
(2)微粒间的作用力:______________。
(3)种类繁多:离子晶体有:______________。
2.常见离子晶体的空间结构AB 型离子晶体的空间结构:氯化钠,氯化铯。
Ⅰ、NaCl 晶体:(1)钠离子和氯离子的位置:(2)在一个NaCl 晶胞中,有 个Na +,有 个Cl -。
在NaCl 晶体中,与每个Na +最近且等距离的Cl -个,它们构成 形 ;(3)与每个Cl -最近且等距离的Na + 个,它们构成 形。
(4)与每个Na +等距紧邻的Na +共有 个,与每个Cl -等距紧邻Cl -共有 个Ⅱ、CsCl 晶体:(1)铯离子和氯离子的位置: (2)在一个CsCl 晶胞中,有 个Cs +,有 个Cl - (3)在CsCl 晶体中,每个Cs +同时强烈吸引 个Cl -, 即Cs +的配位数为 ;每个Cl - 同时强烈吸引 个Cs +,即Cl -的配位数为 。
(4)在CsCl 晶体中,每个Cs +等距紧邻的Cs +共有 个,形成 形。
同理:在CsCl 晶体中,每个Cl -周围与它最接近且距离相等的Cl -共有 个。
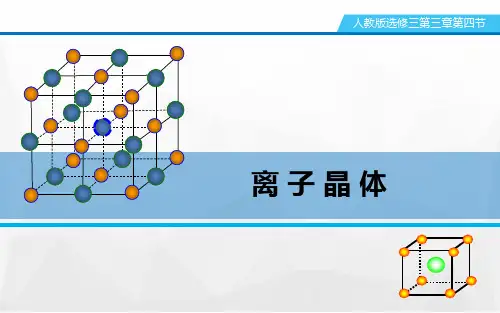
AB 2型离子晶体的空间结构: Ⅲ、氟化钙晶体:(1)Ca 2+的位置: F -的位置: (2)一个CaF 2的晶胞中,有 个Ca 2+, 有 个F -。